Твердые фармацевтические композиции, содержащие ингибитор интегразы
Иллюстрации
Показать всеОписаны прессованные таблетки для перорального введения, содержащие ралтегравир в форме фармацевтически приемлемой соли. Таблетки содержат: (A) внутригранулярный компонент, содержащий (i) эффективное количество калиевой соли ралтегравира, (ii) первый суперразрыхлитель и (iii) связывающий агент; и (B) внегранулярный компонент, содержащий (i) второй суперразрыхлитель, (ii) наполнитель и (iii) смазывающий агент. Суперразрыхлитель представляет собой кроскармеллозу натрия, наполнитель представляет собой микрокристаллическую целлюлозу или комбинацию микрокристаллической целлюлозы и двухосновного фосфата кальция, смазывающий агент представляет собой стеарат магния. В состав таблетки не входит атазанавир или его фармацевтически приемлемая соль. Прессованные таблетки по изобретению характеризуются высокой нагрузкой по лекарственному веществу при приемлемом размере таблетки. 3 н. и 8 з.п. ф-лы, 1 ил., 3 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет временной заявки на патент США № 61/254869, поданной 26 октября 2009 г, полное описание которой включено в описание путем ссылки.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение направлено на твердые фармацевтические композиции для перорального введения, в частности таблетки, которые содержат ралтегравир в форме фармацевтически приемлемой соли.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
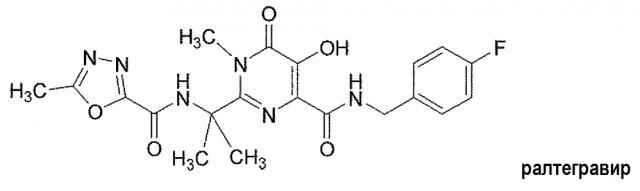
Соединение N-(4-фторбензил)-5-гидрокси-1-метил-2-(1-метил-1-{[(5-метил-1,3,4-оксадиазол-2-ил)карбонил]амино}этил)-6-оксо-1,6-дигидропиримидин-4-карбоксамид (далее именуемое «ралтегравиром») представляет собой мощный ингибитор интегразы ВИЧ. Ралтегравир имеет следующую структуру:
Ралтегравир, раскрытый в патенте США № 7169780, представляет собой активный фармацевтический ингредиент (API) в таблетках Изентресс®. Эти таблетки содержат 400 мг ралтегравира в форме калиевой соли и утверждены FDA (Управлением по контролю за качеством пищевых продуктов и лекарственных средств США) в комбинации с другими антиретровирусными средствами для лечения инфекции вирусом иммунодефицита человека (ВИЧ-1) у взрослых пациентов. Изентресс® является первым лекарственным продуктом в данном классе и важным средством в арсенале лекарственных препаратов, имеющихся для лечения ВИЧ-инфекции. Полезным дополнением к Изентресс® была бы содержащая ралтегравир таблетка, которая меньше по массе и объему и характеризуется обеспечением улучшенного фармакокинетического профиля.
Следующие ссылки представляют интерес в качестве документов предшествующего уровня техники:
В документе US 2006/0122205 A1 раскрыта кристаллическая калиевая соль ралтегравира.
В документе US 2007/0292504 A1 раскрыты фармацевтические препаративные формы для перорального введения в твердых лекарственных формах, которые содержат основную соль ралтегравира и композицию, регулирующую скорость высвобождения. В примере 3 описано получение посредством способа сухого гранулирования прессованных таблеток, содержащих калиевую соль ралтегравира (400 мг свободного фенола), микрокристаллическую целлюлозу, высушенную распылением водную лактозу, безводный двухосновный фосфат кальция, HPMC (гидроксипропилметилцеллюлозу) K4M, полоксамер 407, стеарилфумарат натрия и стеарат магния.
В документе US 2008/0118559 A1 раскрыты фармацевтические препаративные формы для перорального введения в твердых лекарственных формах, которые содержат соль щелочного металла ралтегравира и антинуклеирующий агент. В примере 3 описано получение посредством способа сухого гранулирования прессованных таблеток, содержащих калиевую соль ралтегравира (100 мг и 25 масс.% на основании свободного фенола), микрокристаллическую целлюлозу, моногидрат лактозы, кроскармеллозу натрия, HPMC 2910 (6 сП) и стеарат магния. В примере 6 описано получение посредством сухого гранулирования прессованных таблеток с пленочным покрытием красителем опадрай белым, содержащих калиевую соль ралтегравира (400 мг и 50% масс. на основании свободного фенола), микрокристаллическую целлюлозу, моногидрат лактозы, кроскармеллозу натрия, HPMC 2910 (6 сП) и стеарат магния.
В документе WO 2009/002823 A2 раскрыты прессованные таблетки, включающие ралтегравир и гранулы, содержащие атазанавира сульфат и внутригранулярный смазывающий агент, где гранулы имеют внутреннюю секцию и наружную поверхность, и по меньшей мере часть внутригранулярного смазывающего агента присутствует во внутренней секции гранул. Прессованные таблетки пригодны для лечения ВИЧ-инфекции.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на прессованные таблетки для перорального введения, которые содержат ралтегравир в качестве активного фармацевтического ингредиента в форме фармацевтически приемлемой соли. Более конкретно, настоящее изобретение включает прессованную таблетку, которая содержит:
(A) внутригранулярный компонент, содержащий:
(i) эффективное количество соли щелочного металла ралтегравира,
(ii) необязательно, первый суперразрыхлитель и
(iii) связывающий агент; и
(B) внегранулярный компонент, содержащий:
(i) второй суперразрыхлитель,
(ii) наполнитель и
(iii) смазывающий агент,
при условии, что в состав таблетки не входит атазанавир или его фармацевтически приемлемая соль.
Понятно, что прессованные таблетки могут включать один или более ингредиентов в дополнение к тем, которые конкретно указаны выше в пунктах (A) и (B), за исключением того, что в состав таблетки не входит атазанавир или фармацевтически приемлемая соль атазанавира. Используемый в настоящем описании термин «в состав таблетки не входит» в отношении определенного вещества (например, атазанавира или его фармацевтически приемлемой соли) означает, что прессованная таблетка по изобретению не содержит данное вещество. Прессованная таблетка может включать один или более дополнительных ингредиентов в Компоненте A или в Компоненте B или в каждом из Компонентов A и B. Прессованная таблетка может включать один или более ингредиентов в одном или более дополнительных компонентах. Дополнительные ингредиенты могут быть выбраны из API (кроме атазанавира и его фармацевтически приемлемых солей), эксципиентов, носителей и тому подобное.
Один вариант осуществления настоящего изобретения (альтернативно именуемый в настоящем описании Вариантом осуществления E1) представляет собой прессованную таблетку, как определено выше, где первый суперразрыхлитель присутствует во внутригранулярном компоненте A, т.е. присутствие первого суперразрыхлителя является обязательным. Соответственно, Вариант осуществления E1 представляет собой прессованную таблетку, которая содержит:
(A) внутригранулярный компонент, содержащий (i) эффективное количество соли щелочного металла ралтегравира, (ii) первый суперразрыхлитель и (iii) связывающий агент; и
(B) внегранулярный компонент, содержащий (i) второй суперразрыхлитель, (ii) наполнитель и (iii) смазывающий агент,
при условии, что таблетка не содержит атазанавир или его фармацевтически приемлемую соль.
Прессованные таблетки по настоящему изобретению могут обеспечить улучшенный фармакокинетический профиль по сравнению с содержащими полоксамер таблетками ралтегравира, такими как таблетки, описанные в заявке на патент США US 2007/0292504, который охватывает таблетки Изентресс®. Более конкретно, было обнаружено, что содержащие ралтегравир прессованные таблетки по настоящему изобретению обеспечивают значительное увеличение абсорбции лекарственного препарата (т.е. значительно более высокую AUC (площадь под кривой «концентрация-время»)) при значимо сниженной вариабельности абсорбции в отношении таблеток Изентресс® (см. пример 3 ниже). Состав, используемый в таблетках по настоящему изобретению, может обеспечить возможность получения таблеток с большей лекарственной загрузкой и меньшим размером, чем возможно для таблеток Изентресс®, что, таким образом, делает состав более привлекательным для использования в комбинациях с фиксированной дозой с другими API.
Настоящее изобретение также включает способы получения прессованных таблеток. Настоящее изобретение дополнительно включает применение прессованных таблеток для ингибирования интегразы ВИЧ, для лечения или профилактики ВИЧ-инфекции или для лечения, задержки начала или профилактики СПИДа.
Различные варианты осуществления, аспекты и признаки настоящего изобретения или описаны ниже, или будут очевидны из последующего описания, примеров и прилагаемой формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой график, показывающий отдельные и средние величины AUC ралтегравира для групп лечения дозой A и дозой B фармакокинетического исследования, описанного в примере 3.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Прессованные таблетки по настоящему изобретению включают внутригранулярный компонент и внегранулярный компонент, где внутригранулярный компонент содержит эффективное количество ралтегравира в форме фармацевтически приемлемой соли.
Как описано ниже, прессованные таблетки получают, используя способ, который включает гранулирование так, чтобы определенные ингредиенты комбинировать перед образованием гранул, а другие ингредиенты добавлять после гранулирования. Термин «внутригранулярный компонент» относится к ингредиентам прессованной таблетки, которые включают перед стадией гранулирования, а «внегранулярный компонент» относится к ингредиентам, которые включают после гранулирования.
Термин «фармацевтически приемлемая соль» относится к соли, которая обладает эффективностью материнского соединения и которая не является биологически или иным образом нежелательной (например, является ни токсичной, ни иным образом вредной для ее реципиента). Подходящие соли ралтегравира включают основные соли, т.е. соли, образованные в результате реакции лекарственного соединения с основанием. Соль ралтегравира представляет собой соль щелочного металла, такую как натриевая или калиевая соль, а обычнее калиевую соль. Соли щелочных металлов соединений могут быть образованы путем обработки соединения, растворенного в подходящем растворителе, водным раствором гидроксида щелочного металла (например, NaOH или KOH).
Термин «эффективное количество», используемый в настоящем описании, означает то количество API (например, ралтегравира), которое в ткани, системе, у животного или человека вызывает биологическую или лекарственную реакцию, искомую исследователем, ветеринаром, врачом или другим клиницистом. Эффективное количество может представлять собой «терапевтически эффективное количество» для облегчения симптомов подвергаемого лечению заболевания или состояния. Эффективное количество может также представлять собой «профилактически эффективное количество» для профилактики симптомов предотвращаемого заболевания или состояния. Когда лекарственное соединение ингибирует действие фермента (например, интегразы ВИЧ), данный термин также относится к количеству активного соединения, достаточному для того, чтобы ингибировать фермент и, тем самым, вызвать искомую реакцию (т.е. «эффективное ингибирующее количество»).
Внутригранулярный компонент включает, в дополнение к соли ралтегравира, связывающий агент и, необязательно, суперразрыхлитель. Термин «суперразрыхлитель» относится к веществу или смеси веществ, которые используются в таблетке для содействия ее разрушению или разрыхлению после введения. Внутригранулярный суперразрыхлитель может представлять собой кроскармеллозу натрия, кросповидон или натриевый гликолят крахмала и обычно представляет собой кроскармеллозу натрия или натриевый гликолят крахмала, а обычнее кроскармеллозу натрия. Суперразрыхлитель, используемый во внутригранулярном компоненте прессованной таблетки, может необязательно представлять собой комбинацию двух или более суперразрыхлителей, такую как комбинация кроскармеллозы натрия и натриевого гликолята крахмала. Суперразрыхлитель в комбинации может быть добавлен отдельно или в виде смеси для смешивания с другими ингредиентами внутригранулярного компонента.
Термин «связывающий агент» относится к веществу или смеси веществ, которые обеспечивают или улучшают когезионную способность гранул и могут также содействовать когезионной способности прессованных таблеток. Связывающий агент, например, обеспечивает то, что таблетка остается интактной после прессования. Подходящие связывающие агенты включают такие вещества, как желатин, гуаровая камедь, гидрированное растительное масло и различные целлюлозы. В одном аспекте изобретения связывающие агенты представляют собой связывающие агенты с низкой вязкостью. Термин «низкая вязкость» относится к связывающему агенту, который обеспечивает получение водного раствора 2 масс.% (т.е. масса полимера/масса воды), имеющего вязкость в диапазоне от примерно 2 до примерно 100 сантипуаз (сП) при 20°C (1 сП = 1 мПа·с). Связывающие агенты с низкой вязкостью, подходящие для использования в прессованных таблетках по изобретению, обычно обеспечивают получение раствора 2 масс.%, имеющего вязкость в диапазоне от примерно 2 до примерно 50 сП (например, от примерно 3 до примерно 20 сП) при 20°C. Подходящие связывающие агенты включают имеющие низкую вязкость растворимые в воде полимеры, такие как гидроксиалкилцеллюлозы, алкилцеллюлозы и поливинилпирролидоны. Имеющий низкую вязкость связывающий агент представляет собой обычно гидроксипропилметилцеллюлозу (HPMC), гидроксиэтилцеллюлозу (HEC), гидроксипропилцеллюлозу (HPC), поливинилпирролидон (PVP) или метилцеллюлозу. Имеющий низкую вязкость связывающий агент обычнее представляет собой HPMC, HPC или PVP. В одном аспекте изобретения имеющий низкую вязкость связывающий агент представляет собой HPMC, имеющую содержание гидроксипропила от примерно 7 до примерно 12 масс.%, содержание метокси от примерно 28 до примерно 30 масс.% и вязкость для 2% масс./масс. водных растворов от примерно 3 до примерно 20 сП. В другом аспекте связывающий агент представляет собой HPMC, которая представляет собой заместитель типа 2208, 2906 или 2910 стандарта Фармакопеи США, такой как HPMC 2910 (6 сП), который выпускается компанией Shin-Etsu Chemical Co в виде продукта с названием PHARMACOAT.
Связывающий агент может представлять собой комбинацию двух или более связывающих агентов. Например, связывающий агент может представлять собой комбинацию имеющих низкую вязкость растворимых в воде полимеров (например, двух или более полимеров HPMC), где полимерная смесь образует 2 масс.% раствор со средней вязкостью в диапазоне низкой вязкости. Средняя вязкость полимерной смеси обычно отличается от вязкости каждого компонентного полимера. Связывающие агенты в комбинации могут быть добавлены отдельно или в виде смеси для смешивания с другими ингредиентами во внутригранулярном компоненте.
Внегранулярный компонент включает суперразрыхлитель, наполнитель и смазывающий агент. Внегранулярный суперразрыхлитель (альтернативно именуемый в настоящем описании «второй суперразрыхлитель») может быть таким же или отличным от внутригранулярного суперразрыхлителя (альтернативно именуемого в настоящем описании «первым суперразрыхлителем»). Внегранулярный суперразрыхлитель может представлять собой кроскармеллозу натрия, кросповидон или натриевый гликолят крахмала, и обычно представляет собой кроскармеллозу натрия или натриевый гликолят крахмала, а обычнее представляет собой кроскармеллозу натрия. В одном аспекте изобретения внутригранулярный компонент прессованной таблетки не содержит суперразрыхлитель, а внегранулярный компонент включает суперразрыхлитель, такой как кроскармеллоза натрия. Прессованная таблетка предпочтительно содержит как внутригранулярный, так и внегранулярный суперразрыхлитель. Считается, что прессованные таблетки, содержащие как внутригранулярные, так и внегранулярные суперразрыхлители, являются более надежными, т.е. таблетки имеют лучшую воспроизводимость с точки зрения их характеристик уплотнения и растворения, чем аналогичные таблетки, содержащие только внегранулярный суперразрыхлитель. Таким образом, в одном аспекте изобретения таблетка содержит как внутригранулярный, так и внегранулярный суперразрыхлитель, и оба суперразрыхлителя представляют собой кроскармеллозу натрия или они оба представляют собой комбинацию кроскармеллозы натрия и натриевого гликолята крахмала. В другом аспекте таблетка содержит внутригранулярный и внегранулярный суперразрыхлители, и они оба представляют собой кроскармеллозу натрия.
Наполнитель (также именуемый в данной области «разбавителем») представляет собой вещество, используемое для придания объема таблетке. Подходящие наполнители включают безводный двухосновный фосфат кальция, двухосновный дигидрофосфат кальция, трехосновный фосфат кальция, сульфат кальция, карбоксиметилцеллюлозу кальция, микрокристаллическую целлюлозу, порошковую целлюлозу, глюкозу, фруктозу, лактозу, манит, декстрин, декстрозу, декстраты, каолин, лактит, карбонат магния, оксид магния, мальтит, мальтодекстрин, мальтозу, крахмал, сахарозу, трегалозу, тальк и их комбинации. В одном аспекте изобретения наполнитель представляет собой лактозу, микрокристаллическую целлюлозу, манит, безводный двухосновный фосфат кальция или двухосновный дигидрофосфат кальция. В другом аспекте изобретения наполнителем не является восстанавливающий сахар, т.е. в данном аспекте связывающий агент не представляет собой глюкозу, фруктозу, лактозу, мальтозу, декстрозу или тому подобное. В одном признаке данного аспекта наполнитель представляет собой микрокристаллическую целлюлозу, манит, безводный двухосновный фосфат кальция, двухосновный дигидрофосфат кальция или их комбинацию. В другом признаке данного аспекта наполнитель представляет собой микрокристаллическую целлюлозу, безводный двухосновный фосфат кальция, двухосновный дигидрофосфат кальция или их комбинацию.
В еще одном аспекте изобретения наполнитель представляет собой микрокристаллическую целлюлозу. Примером подходящей микрокристаллической целлюлозы является та, которая может характеризоваться как имеющая номинальный размер частиц примерно 100 мкм, содержание влаги от примерно 3% до примерно 5% и свободную насыпную плотность от примерно 0,28 до примерно 0,33 г/см3. Микрокристаллическая целлюлоза, имеющая указанные выше характеристики, представляет собой, например, AVICEL PH-102. Другие подходящие микрокристаллические целлюлозы представляют собой те, которые имеют следующие характеристики:
| Номинальный размер частиц в мкм | Содержание влаги (%) | Свободная насыпная плотность (г/см3) | Пример |
| 50 | от 3,0 до 5,0 | 0,26-0,31 | AVICEL PH-101 |
| 50 | ≤3 | 0,26-0,31 | AVICEL PH-103 |
| 20 | ≤5,0 | 0,20-0,30 | AVICEL PH-105 |
Соответственно, подходящие формы микрокристаллической целлюлозы для использования в прессованных таблетках по изобретению включают, но не ограничиваются ими, материалы, продаваемые под торговыми названиями AVICEL PH-101, AVICEL PH-102, AVICEL PH-103 и AVICEL PH-105 (все выпускаемые компанией FMC Corporation), и их комбинации. Так, например, микрокристаллическая целлюлоза, используемая в таблетке, может представлять собой AVICEL PH-102 или AVICEL PH-105 или их комбинацию.
В еще одном аспекте изобретения наполнитель представляет собой комбинацию микрокристаллической целлюлозы и безводного двухосновного фосфата кальция. Примером подходящей комбинации является порошок, содержащий примерно 75% микрокристаллической целлюлозы и примерно 25% безводного двухосновного фосфата кальция, где порошок получают диспергированием во влажном состоянии и распылительной сушкой целлюлозы и фосфата. Такой продукт выпускается компанией FMC Corporation под торговым названием AVICEL DG.
Роль смазывающего агента заключается в улучшении потока гранул, полученных на стадии гранулирования, перед их прессованием и/или в предотвращении адгезии прессованной таблетки к прессовочному оборудованию. Подходящие смазывающие агенты включают стеарат кальция, глицерилмоностеарат, глицерилпальмитостеарат, гидрированное касторовое масло, гидрированное растительное масло, легкое минеральное масло, стеарат магния, минеральное масло, полиэтиленгликоль, стеариновую кислоту, тальк, стеарат цинка и стеарилфумарат натрия. В одном аспекте изобретения смазывающий агент представляет собой стеарат магния, стеариновую кислоту, стеарилфумарат натрия или комбинацию двух или более из них. В другом аспекте смазывающий агент представляет собой стеарат магния. Если используют комбинацию смазывающих агентов, то смазывающие агенты могут быть добавлены отдельно или в виде смеси гранул.
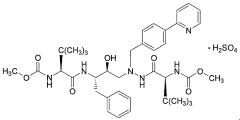
Прессованная таблетка по изобретению не содержит атазанавир или его фармацевтически приемлемую соль, такую как атазанавир сульфат. Атазанавира сульфат имеет структуру:
Дополнительное описание атазанавира, атазанавира сульфата и способов их получения и применения можно найти, например, в патенте США № 6087383, заявке на патент США US 2005/0256202 A1 и заявке на Международный патент WO 2009/002823 A2. Атазанавир коммерчески доступен в виде прописываемого лекарственного средства от Bristol-Myers Squibb Company под торговым названием Reyataz® (атазанавир сульфат) в форме капсул по 100, 150, 200 и 300 мг.
Если из контекста ясно или прямо указано иное, то массовый процент ралтегравира в прессованной таблетке выражен в пересчете на свободный фенол, даже если он используется в форме соли. Величины массовых процентов ингредиентов таблетки (например, первого и второго суперразрыхлителей, связывающего агента, наполнителя, смазывающего агента и т.д.) основаны на общей массе таблетки.
Второй вариант осуществления настоящего изобретения (Вариант осуществления E2) представляет собой прессованную таблетку, как первоначально определено выше (т.е., как определено в Кратком изложении сущности изобретения), где:
(A)(i) соль щелочного металла ралтегравира используется на основе свободного фенола в количестве по меньшей мере примерно 30 масс.%;
(A)(ii) первый суперразрыхлитель используется в количестве в диапазоне от нуля до примерно 12 масс.%;
(A)(iii) связывающий агент используется в количестве в диапазоне от примерно 0,5 масс.% до примерно 7 масс.%;
(B)(i) второй суперразрыхлитель используется в количестве в диапазоне от примерно 3 масс.% до примерно 20 масс.%;
(B)(ii) наполнитель используется в количестве в диапазоне от примерно 10 масс.% до примерно 40 масс.%; и
(B)(iii) смазывающий агент используется в количестве в диапазоне от примерно 0,5 масс.% до примерно 2,5 масс.%;
где общее количество суперразрыхлителя находится в диапазоне от примерно 6 масс.% до примерно 20 масс.%; и
где массовый процент каждого ингредиента в прессованной таблетке основан на общей массе прессованной таблетки.
Третий вариант осуществления настоящего изобретения (Вариант осуществления E3) представляет собой прессованную таблетку, как определено в Варианте осуществления E1, где:
(A)(i) соль щелочного металла ралтегравира используется на основе свободного фенола в количестве по меньшей мере примерно 30 масс.%;
(A)(ii) первый суперразрыхлитель используется в количестве в диапазоне от примерно 3 масс.% до примерно 12 масс.%;
(A)(iii) связывающий агент (например, связывающий агент с низкой вязкостью) используется в количестве в диапазоне от примерно 0,5 масс.% до примерно 7 масс.%;
(B)(i) второй суперразрыхлитель используется в количестве в диапазоне от примерно 3 масс.% до примерно 15 масс.%;
(B)(ii) наполнитель используется в количестве в диапазоне от примерно 10 масс.% до примерно 40 масс.%; и
(B)(iii) смазывающий агент используется в количестве в диапазоне от примерно 0,5 масс.% до примерно 2,5 масс.%;
где общее количество суперразрыхлителя находится в диапазоне от примерно 6 масс.% до примерно 20 масс.%; и
где массовый процент каждого ингредиента в прессованной таблетке основан на общей массе прессованной таблетки.
Четвертый вариант осуществления настоящего изобретения (Вариант осуществления E4) представляет собой прессованную таблетку, как определено выше или как определено в Вариантах осуществления E1-E3, где:
(A)(ii) первый суперразрыхлитель выбран из группы, состоящей из кроскармеллозы натрия, натриевого гликолята крахмала, кросповидона и их комбинаций;
(A)(iii) связывающий агент имеет вязкость в диапазоне от примерно 2 до примерно 100 сантипуаз (сП) при 20°C и выбран из группы, состоящей из HPMC, HPC, PVP и их комбинаций;
(B)(i) второй суперразрыхлитель выбран из группы, состоящей из кроскармеллозы натрия, натриевого гликолята крахмала, кросповидона и их комбинаций;
(B)(ii) наполнитель выбран из группы, состоящей из микрокристаллической целлюлозы, маннита, лактозы, фосфата Ca и их комбинаций; и
(B)(iii) смазывающий агент выбран из группы, состоящей из стеарата Mg, стеариновой кислоты, стеарилфумарата натрия и их комбинаций.
В первом аспекте Варианта осуществления E4
(A)(ii) первый суперразрыхлитель выбран из группы, состоящей из кроскармеллозы натрия, натриевого гликолята крахмала и кросповидона;
(A)(iii) связывающий агент имеет вязкость в диапазоне от примерно 2 до примерно 100 сантипуаз (сП) при 20°C и выбран из группы, состоящей из HPMC, HPC и PVP;
(B)(i) второй суперразрыхлитель выбран из группы, состоящей из кроскармеллозы натрия, натриевого гликолята крахмала и кросповидона;
(B)(ii) наполнитель выбран из группы, состоящей из микрокристаллической целлюлозы, маннита, лактозы, фосфата Ca и их комбинаций; и
(B)(iii) смазывающий агент выбран из группы, состоящей из стеарата Mg, стеариновой кислоты, стеарилфумарата натрия и их комбинаций. В одном признаке первого аспекта наполнитель выбран из группы, состоящей из микрокристаллической целлюлозы, фосфата Ca и их комбинаций. В другом признаке первого аспекта Варианта осуществления E4 наполнитель представляет собой микрокристаллическую целлюлозу. В еще одном признаке первого аспекта Варианта осуществления E4 наполнитель представляет собой комбинацию микрокристаллической целлюлозы и двухосновного фосфата Ca (например, безводного двухосновного фосфата Ca).
Во втором аспекте Варианта осуществления E4 наполнитель выбран из группы, состоящей из микрокристаллической целлюлозы, фосфата Ca и их комбинаций. В третьем аспекте Варианта осуществления E4 наполнитель представляет собой микрокристаллическую целлюлозу. В четвертом аспекте Варианта осуществления E4 наполнитель представляет собой комбинацию микрокристаллической целлюлозы и двухосновного фосфата Ca (например, безводного двухосновного фосфата Ca).
Другой вариант осуществления настоящего изобретения (Вариант осуществления E5) представляет собой прессованную таблетку, как первоначально определено выше или определено в любом из предыдущих вариантов осуществления, где:
(A)(i) соль щелочного металла ралтегравира представляет собой соль Na или K, используемую в количестве в диапазоне от примерно 50 масс.% до примерно 65 масс.%;
(A)(ii) первый суперразрыхлитель используется в количестве в диапазоне от примерно 5 масс.% до примерно 10 масс.%;
(A)(iii) связывающий агент используется в количестве в диапазоне от примерно 2 масс.% до примерно 6 масс.%;
(B)(i) второй суперразрыхлитель используется в количестве в диапазоне от примерно 6 масс.% до примерно 12 масс.%;
(B)(ii) наполнитель используется в количестве в диапазоне от примерно 6 масс.% до примерно 25 масс.%; и
(B)(iii) смазывающий агент используется в количестве в диапазоне от примерно 1 масс.% до примерно 2,5 масс.%;
где общее количество суперразрыхлителя находится в диапазоне от примерно 10 масс.% до примерно 18 масс.%.
Другой вариант осуществления настоящего изобретения (Вариант осуществления E6) идентичен Варианту осуществления E5, за исключением того, что наполнитель - (B)(ii) - используется в количестве в диапазоне от примерно 10 масс.% до примерно 25 масс.%.
В одном аспекте Варианта осуществления E5 и Варианта осуществления E6 первый суперразрыхлитель и второй суперразрыхлитель представляют собой одинаковое вещество или одинаковую комбинацию веществ.
Другой вариант осуществления настоящего изобретения (Вариант осуществления E7) представляет собой прессованную таблетку, как первоначально определено выше или как определено в любом из Вариантов осуществления E1-E6, где:
(A)(ii) первый суперразрыхлитель представляет собой внутригранулярную кроскармеллозу Na;
(A)(iii) связывающий агент представляет собой HPMC;
(B)(i) второй суперразлыхлитель представляет собой внегранулярную кроскармеллозу Na;
(B)(ii) наполнитель представляет собой микрокристаллическую целлюлозу или комбинацию микрокристаллической целлюлозы и двухосновного фосфата Ca (например, безводный двухосновный фосфат Ca); и
(B)(iii) смазывающий агент представляет собой стеарат Mg.
Другой вариант осуществления настоящего изобретения (Вариант осуществления E8) идентичен Варианту осуществления E7, за исключением того, что наполнитель представляет собой микрокристаллическую целлюлозу (т.е. наполнитель не представляет собой комбинацию микрокристаллической целлюлозы и двухосновного фосфата Ca).
Другой вариант осуществления настоящего изобретения (Вариант осуществления E9) представляет собой прессованную таблетку, как определено в Варианте осуществления E8, где:
(A)(i) соль щелочного металла ралтегравира представляет собой соль Na или K, используемую в количестве в диапазоне от примерно 55 масс.% до примерно 60 масс.%;
(Α)(ii) внутригранулярная кроскармеллоза Na используется в количестве в диапазоне от примерно 5 масс.% до примерно 7 масс.%;
(A)(iii) HPMC используется в количестве в диапазоне от примерно 3 масс.% до примерно 5 масс.%;
(B)(i) внегранулярная кроскармеллоза Na используется в количестве в диапазоне от примерно 8 масс.% до примерно 10 масс.%;
(B)(ii) микрокристаллическая целлюлоза используется в количестве в диапазоне от примерно 16 масс.% до примерно 18 масс.%; и
(B)(iii) стеарат магния используется в количестве в диапазоне от примерно 1 масс.% до примерно 2 масс.%;
где общее количество кроскармеллозы натрия находится в диапазоне от примерно 13 масс.% до примерно 17 масс.%.
Другой вариант осуществления настоящего изобретения (Вариант осуществления E10) представляет собой прессованную таблетку, как определено в Варианте осуществления E7, где:
(A)(i) натриевая или калиевая соль ралтегравира используется в количестве в диапазоне от примерно 55 масс.% до примерно 65 масс.% на основании свободного фенола;
(A)(ii) внутригранулярная кроскармеллоза Na используется в количестве в диапазоне от примерно 5 масс.% до примерно 8 масс.%;
(A)(iii) HPMC используется в количестве в диапазоне от примерно 3 масс.% до примерно 5 масс.%;
(B)(i) внегранулярная кроскармеллоза Na используется в количестве в диапазоне от примерно 8 масс.% до примерно 10 масс.%;
(B)(ii) наполнитель представляет собой комбинацию микрокристаллической целлюлозы и двухосновного фосфата Ca и используется в количестве в диапазоне от примерно 7 масс.% до примерно 10 масс.%; и
(B)(iii) стеарат магния используется в количестве в диапазоне от примерно 1 масс.% до примерно 2 масс.%;
где общее количество кроскармеллозы натрия находится в диапазоне от примерно 13 масс.% до примерно 17 масс.%.
Другой вариант осуществления настоящего изобретения (Вариант осуществления E11) представляет собой прессованную таблетку, как первоначально определено выше или как определено в любом из Вариантов осуществления E1-E10, где соль щелочного металла ралтегравира используется на основании свободного фенола в количестве в диапазоне от примерно 200 мг до примерно 600 мг на стандартную дозу.
Другой вариант осуществления настоящего изобретения (Вариант осуществления E12) представляет собой прессованную таблетку, как первоначально определено выше или как определено в любом из Вариантов осуществления E1-E11, где соль щелочного металла представляет собой калиевую соль ралтегравира.
Другой вариант осуществления настоящего изобретения (Вариант осуществления E13) представляет собой прессованную таблетку, как определено в Варианте осуществления E7, где таблетка имеет следующий состав:
| Ингредиент | Относительное количество (масс.%) |
| Калиевая соль ралтегравира | 62,1 (57,1 на основании свободного фенола) |
| Кроскармеллоза Na (внутригранулярная) | 6,2 |
| HPMC2910 (6 сП) | 4,1 |
| Микрокристаллическая целлюлоза, имеющая номинальный размер частиц 100 мкм, содержание влаги от 3,0 до 5,0% и свободную насыпную плотность от 0,26 до 0,31 г/см3 1 | 17,1 |
| Кроскармеллоза Na (внегранулярная) | 9,0 |
| Стеарат Mg | 1,5 |
| Всего | 100 |
| 1. Подходящая микрокристаллическая целлюлоза представляет собой AVICEL PH-102 |
В одном аспекте настоящего варианта осуществления количество ралтегравира калия в стандартной лекарственной форме в виде таблетки составляет 434,4 мг (400 мг в пересчете на свободный фенол).
Другой вариант осуществления настоящего изобретения (Вариант осуществления E14) представляет собой прессованную таблетку, как определено в Варианте осуществления E7, где таблетка имеет следующий состав:
| Ингредиент | Относительное количество (масс.%) |
| Калиевая соль ралтегравира | 70,0 (64,5 на основании свободного фенола) |
| Кроскармеллоза Na (внутригранулярная) | 7,0 |
| HPMC2910 (6 сП) | 4,7 |
| Комбинация микрокристаллической целлюлозы и двухосновного фосфата Ca, которая состоит примерно из 75% микрокристаллической целлюлозы и примерно 25% безводного двухосновного фосфата Ca в форме порошка, полученного диспергированием во влажном состоянии и распылительной сушкой целлюлозы и фосфата1 | 7,8 |
| Кроскармеллоза Na (внегранулярная) | 9,0 |
| Стеарат Mg | 1,5 |
| Всего | 100 |
| 1. Подходящий наполнитель представляет собой AVICEL DG. |
В одном аспекте настоящего варианта осуществления количество ралтегравира калия в стандартной лекарственной форме в виде таблетки составляет 434,4 мг (400 мг в пересчете на свободный фенол).
Другой вариант осуществления настоящего изобретения (Вариант осуществления E15) представляет собой прессованную таблетку, как первоначально определено выше или как определено в любом из Вариантов осуществления E1-E14, где соль щелочного металла ралтегравира представляет собой калиевую соль ралтегравира, которая представляет собой Форму 1 кристаллической калиевой соли ралтегравира. Форма 1 кристаллической соли представляет собой кристаллическую соль, описанную и охарактеризованную в примере 2 в заявке на патент США US 2006/0122205 A1. Форма 1 соли ралтегравира характеризуется типом рентгеновской порошковой дифракции, полученной с использованием Kα излучения меди (т.е. источник излучения представляет собой комбинацию излучения Cu Kα1 и Kα2), который включает 2Θ величины (т.е. отражения при 2Θ величинах) при градусах 5,9, 20,0 и 20,6. В одном аспекте данного варианта осуществления Форма 1 кристаллической калиевой соли ралтегравира характеризуется типом рентгеновской порошковой дифракции, полученной при использовании Kα излучения меди, которая включает 2Θ величины при градусах 5,9, 12,5, 20,0, 20,6 и 25,6. Репрезентативный тип XRPD для Формы 1 представлен на фиг. 1 заявки на патент США US 2006/0122205 A1.
Другой вариант осуществления настоящего изобретения (Вариант осуществления E16) представляет собой прессованную таблетку, как первоначально определено выше или как определено в любом из Вариантов осуществления E1-E15, где в состав таблетки не входят восстанавливающие сахара, т.е. восстанавливающий сахар не содержится в таблетке. Восстанавливающие сахара представляют собой сахара, которые действуют в качестве восстанавливающих агентов и легко восстанавливают щелочные растворы солей меди. Сахар, который вызывает появление кирпично-красного цвета при тестировании реактивом Бенедикта или раствором Фелинга, является восстанавливающим сахаром. Цвет в тестирующем растворе появляется вследствие восстановления ионов Cu(II) в оксид меди(I) сахаром. Восстанавливающие сахара включают глюкозу, фруктозу, лактозу, арабинозу и мальтозу.
Композиции, содержащие восстанавливающий сахар и амин, восприимчивы к реакции конденсации Мэйларда, которая может привести к образованию продуктов распада коричневого цвета. Таблетки по изобретению, в состав которых не входят восстанавливающие сахара, поэтому более совместимы с аминосодержащими веществами, которые могут присутствовать в таблетке. Применение таблеток, не содержащих восстанавливающие сахара, особенно привлекательно, когда таблетка включает второй активный фармацевтический ингредиент, имеющий одну или более аминогрупп (например, монолитная таблетка, содержащая комбинацию фиксированной дозы ралтегравира и аминосодержащего противовирусного средства против ВИЧ).
Другой вариант осуществления настоящего изобретения (Вариант осуществления E17) представляет собой прессованную таблетку, как первоначально определено выше или как определено в любом из Вариантов