Способ идентификации рнк вирусов гриппа а и в с одновременным определением вариантов гемагглютинина и нейраминидазы вируса гриппа а, идентификацией генетических маркеров патогенности и устойчивости к противогриппозным препаратам на биологических микрочипах, биочип, набор олигонуклеотидных зондов, используемые в способе
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии, вирусологии, ветеринарии и медицине и касается способа идентификации РНК вирусов гриппа А и В с одновременным определением вариантов гемагглютинина и нейраминидазы вируса гриппа А, а также генетических маркеров патогенности и устойчивости к противогриппозным препаратам, на биологических микрочипах. Способ основан на проведении реакции обратной транскрипции для получения кДНК с использованием вирусной РНК в качестве матрицы, полимеразной цепной реакции (ПЦР) и последующей гибридизации полученного одноцепочечного флуоресцентно-меченного ПЦР-продукта на биологическом микрочипе. Биологический микрочип представляет собой подложку с упорядоченно расположенными гидрогелевыми элементами, содержащими ковалентно иммобилизованные олигонуклеотидные зонды, которые обеспечивают гибридизацию со специфическими участками генома вируса гриппа, определяющими его тип, субтип и генетические маркеры, включая детерминанты устойчивости к противовирусным препаратам. 3 н. и 2 з.п. ф-лы, 27 ил., 4 табл., 3 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области молекулярной биологии, вирусологии, медицине и ветеринарии и может быть использовано для идентификации вирусов гриппа А и В, типирования и субтипирования вирусов гриппа А с одновременным определением генетических маркеров патогенности и устойчивости к противогриппозным препаратам. Изобретение также включает биологический микрочип (биочип) для осуществления способа и набор олигонуклеотидных зондов для иммобилизации в элементах биочипа.
Уровень техники
Вирусы гриппа (типы А, В и С) относятся к семейству Ortomyxoviridae. Они циркулируют в природных резервуарах, вызывая инфекцию у человека, птиц, многих видов млекопитающих; и являются причиной сезонных эпидемий и периодических пандемий, которые уносят миллионы жизней. Наибольшую эпидемиологическую опасность представляет вирус гриппа типа А (далее по тексту - ВГА). Различные генетические варианты вирусов гриппа (штаммы) различаются так называемыми сайтами патогенности - нуклеотидными последовательностями в составе РНК, кодирующими синтез факторов, обуславливающих тяжесть заболевания, контагиозность, восприимчивость к лекарственным противовирусным средствам. Высокая изменчивость вируса приводит к появлению с периодичностью в 2-3 года новых патогенных для человека генетических вариантов и мутаций, изменяющих устойчивость к противогриппозным препаратам.
Для борьбы с гриппом существуют две стратегии: вакцинация и лекарственная терапия. Эффективность вакцинации ограничена изменениями, происходящими в геноме вируса от сезона к сезону, а действие лекарственных средств - возникновением устойчивых штаммов. Основные препараты, применяемые для терапии вируса, действуют на разные мишени: белок М2, образующий ионный канал (препараты группы адамантанов, например, амантадин, ремантадин) (Jefferson T., Demicheli V., et al., Amantadine and rimantadine for influenza A in adults. Cochrane Database of Syst. Rev., 2006. 2, CD001169); нейраминидазу, отщепляющую остаток N-ацетилнейраминовой кислоты (препараты группы ингибиторов нейраминидазы, например, ланинамивир, озельтамивир, перамивир, занамивир) (Ikematsu H., Kawai N. Laninamivir octanoate: a new long-acting neuraminidase inhibitor for the treatment of influenza. Expert Review of Anti-infective Therapy, 2011. v. 9 (10), p. 851-857).
Появление штаммов, обладающих выраженным пандемическим потенциалом, а также не снижающийся уровень заболеваемости гриппом обусловливают необходимость поиска новых высокочувствительных и надежных способов определения вирусного подтипа для прогнозирования эпидемий, осуществления эпидемиологического контроля, своевременного создания противогриппозных вакцин, учитывающих генетические особенности возбудителя грядущей эпидемии.
Известен ряд методов для определения подтипов вируса гриппа, дифференциации подтипов гемагглютинина и нейраминидазы, определения чувствительности к противогриппозным препаратам.
(1) Выделение вируса гриппа на развивающихся куриных эмбрионах или клеточных линиях с последующим анализом. Наиболее распространенными методами идентификации подтипов ВГА являются реакция торможения гемагглютинации (РТГА) с антисыворотками к эталонным штаммам вируса гриппа для определения подтипа гемагглютинина и реакция ингибирования нейраминидазной активности (РИНА) - для определения подтипа нейраминидазы (WHO Manual on animal influenza diagnosis and surveillance. WHO, Geneva, 2002, document WHO/CDS/CSR/NCS/2002.5 Rev.1, http://www.who.int). Метод явдяется "золотым стандартом" при определении вирусного подтипа (Stamboulian D., Bonvehi Р. Ε., Nacinovich F. M., Сох N. Influenza Infect. Dis. Clin. North. Am., 2000, v. 14., p. 141-166), и также используется для определения патогенности и устойчивости вирусов гриппа к противовирусным препаратам (Bouvier N.M., Lowen А.С. Animal models for influenza virus pathogenesis and transmission. Viruses, 2010, v. 2 (8), p. 1530-1563).
Преимуществом культивирования вируса является то, что вирус может быть использован для дальнейших исследований, молекулярно-генетической характеризации и др. Недостатком является повышенная биологическая опасность, трудоемкость и длительное время, требуемое для культивирования (от 3 до 7 дней).
(2) Методы, основанные на использовании поли- или моноклональных антител, иммуноферментный и иммунофлуоресцентный анализ (Belshe R.B., Smith M.H., Hall C.B., Betts R. Hay A.J. Genetic basis of resistance to rimantadine emerging during treatment of influenza virus infection. J. Virol., 1988, v. 62, p. 1508-1512; Tkaceova M., Varenckova E., Baker I.C., Love J.M., Ziegler T. Evaluation of monoclonal antibodies for subtyping of currently circulating human type A Influenza viruses. J. Clin. Microbiol, 1997, p. 1196-1198). Методы с использованием антител требуют наличия набора специфичных антител для каждого подтипа ВГА, которые дорогостоящи и трудны в получении, и применяются для ограниченного количества подтипов.
(3) Методы определения чувствительности вирусов к различным лекарственным препаратам, включающие:
- метод подавления бляшкообразования (Matrosovich M., Matrosovich Т., Garten W., Klenk H.-D. New low-viscosity overlay medium for viral plaque assays. Virology Journal, 2006, v. 3, p.63). Применяется преимущественно для определения устойчивости вирусов гриппа к препаратам группы адамантанов и не подходит для определения устойчивости к ингибиторам нейраминидазы;
- МТТ колориметрический тест: оценка клеточной и лекарственной цитотоксичности, основанная на способности митохондриальных дегидрогеназ конвертировать водорастворимый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромид (МТТ) в формазан, который кристаллизуется внутри клетки (Watanabea W., Konnoa K., Ijichi K., Inouea H., et al. МТТ colorimetric assay system for the screening of anti- orthomyxo-and anti-paramyxoviral agents. J. Virol. Methods, 1994, v. 48, p. 257-265). Метод требует наличия специальной аппаратуры и не обладает достаточной чувствительностью;
- анализ активности нейраминидазы хемилюминесцентным (Buxton R.C., Edwards В., Juo R. R., et al. Development of a sensitive chemiluminescent neuraminidase assay for the determination of influenza virus susceptibility to zanamivir. Anal. Biochem., 2000, v. 280, p. 291-300) и флюорометрическим методом (Potier M., Mameli L., Belisle M., Dallaire L., Melançon S.B. Fluorometric assay of neuraminidase with a sodium (4-methylumbelliferyl-α-D-N-acetylneruaminate) substrate. Anal. Biochem., 1979, v. 94, p. 287-296). Методы не применимы для анализа резистентности к препаратам группы адамантанов;
- проточная цитометрия инфицированных клеток (McSharry, J.J. McDonough А.С, Olson B.A., Drusano G.L. Phenotypic drug susceptibility assay for influenza virus neuraminidase inhibitors. Clin. Diagn. Lab. Immunol., 2004, v. 11, p. 21-28). Требуется дорогостоящее специальное оборудование (проточный цитофлюориметр).
В последнее время все более широкое распространение получают молекулярно-генетические методы анализа, основанных на анализе последовательностей вирусного генома, включая последовательности генов НА и NA и сайты патогенности (Wang R., Taubenberger J.K. Methods for molecular surveillance of influenza. Expert. Rev. Anti Infect. Ther., 2010, v. 8(5), p. 517-527). Проводится амплификация соответствующих участков генома с последующим анализом результатов различными методами.
(4) Полное или частичное секвенирование вирусных генов. Описана амплификация любых возможных подтипов ВГА с помощью универсальной праймерной системы с последующим секвенированием (Hoffmann Ε., Stech J., Guan Y., Webster R.G., Perez D.R. Universal primer set for the full-length amplification of all influenza A viruses. Arch. Virol., 2001, v. 146, p. 2275-2289). Для исследования резистентности вируса к препаратам группы адамантанов использовали метод прямого секвенирования сегментов MP и NA (Laplante J.M., Marshall S.A., Shudt M., Van T.T., et al. Influenza antiviral resistance testing in New York and Wisconsin, 2006-2008: methodology and surveillance data. J. Clin. Microbiol., 2009, v. 47, p.1372-1378; Bright R.A., Shay D.K., Shu В., Cox N.J., Klimov A.I. Adamantane resistance among influenza A viruses isolated early during the 2005-2006 influenza season in the United States. JAMA, 2006, v. 295, p. 891-894, а также метод пиросеквенирования этих же сегментов (Deyde V.M., Tung Ν., Bright R.A., et al. Detection of molecular markers of antiviral resistance in influenza A (H5N1) viruses using a pyrosequencing method. Antimicrob. Agents Chemother., 2009, v. 53 (3), p. 1039-1047).
К недостаткам методов, основанных на секвенировании, относится их трудоемкость, дороговизна, необходимость дорогостоящего оборудования (например, автоматический секвенатор), а также значительные затраты времени и реагентов на дополнительную очистку продуктов амплификации перед проведением секвенирования.
(5) Проведение полимеразной цепной реакции (ПЦР) и последующий электрофоретический анализ продуктов (Poddar S.K. Influenza virus types and subtypes detection by single step single tube multiplex reverse transcription-polymerase chain reaction (RT-PCR) and agarose gel electrophoresis, J. Virol. Methods, 2002 v. 99 (1-2), p. 63-70).
(6) Проведение ПЦР и рестрикции с последующим анализом полиморфизма длин рестрикционных фрагментов (L.A. Cooper, K. Subbarao. A simple restriction fragment length polymorphism-based strategy that can distinguish the internal genes of human H1N1, H3N2, and H5N1 influenza A viruses. J. Clin. Microbiol., 2000, p. 2579-2583), Suzuki H., Saito R., Masuda H., Oshitani H., Sato M., Sato I. Emergence of amantadine-resistant influenza A viruses: epidemiological study. J. Infect. Chemother., 2003, v. 9, p.195-200).
(7) Изотермическая амплификация (Poon L.L., Leung C.S., Chan K.H. et al. Detection of human influenza A viruses by loop-mediated isothermal amplification. J. Clin. Microbiol., 2005, v. 43, p. 427-430).
(8) ПЦР-гетеродуплексный анализ (Ellis J.S., Zambon M.C. Combined PCR-heteroduplex mobility assay for detection and differentiation of influenza A viruses from different animal species. J. Clin. Microbiol, 2001, p. 4097-4102).
(9) Методы ПЦР с детекцией в режиме реального времени. Используются как для типирования ВГА (Stone В., Burrows J., Schepetiuk S., et al. Rapid detection and simultaneous subtype differentiation of influenza A viruses by real time PCR. J. Virol. Methods, 2004, v. 117, p. 103-112), так и для определения мутаций, приводящих к лекарственной устойчивости ВГА (Hindiyeh M., Ram D., Mandelboim M., Meningher T., et al. Rapid detection of influenza A pandemic (H1N1) 2009 virus neuraminidase resistance mutation H275Y by real-time reverse transcriptase PCR. J Clin. Microbiol., 2010; v. 48 (5), p. 1884-1887; Carr M.J., Sayre N., Duffy M., Connell J., Hall W.W. Rapid molecular detection of the H275Y oseltamivir resistance gene mutation in circulating influenza A (H1N1) viruses. J. Virol. Methods, 2008, v. 153 (2), p. 257-262).
Для ПЦР в реальном времени описаны также методики с количественным определением вируса (Lee C.W., Suarez D.L. Application of real-time RT-PCR for the quantitation and competitive replication study of H5 and H7 subtype avian influenza virus. J. Virol. Methods, 2004, v. 119, p. 151-158).
К недостаткам вышеуказанных ПЦР-методов (5)-(9) относится их трудоемкость, а также ограниченность в числе определяемых подтипов вируса. Метод изучения полиморфизма и ПЦР-гетеродуплексный анализ чрезвычайно усложняются при увеличении количества дифференцируемых подтипов. Метод ПЦР в реальном времени требует постановки отдельных реакций для определения каждой мутации и при этом весьма дорог для рутинного анализа.
(10) Многопараметрический анализ генетического материала с использованием ДНК-микроматриц (микрочипов), представляющих собой массив иммобилизованных на твердой фазе олигонуклеотидов, способных специфично связываться с детектируемыми последовательностями. Для идентификации и типирования вируса гриппа описаны микрочипы двух типов: ДНК-микроматрицы высокой плотности и специализированные олигонуклеотидные микрочипы.
Описано несколько вариантов секвенирующего микрочипа высокой плотности для анализа вируса гриппа и других респираторных патогенов (Lin В., Malanoski А.Р., Wang Ζ., Blaney K.M., et al. Universal detection and identification of avian influenza virus by use of resequencing microarrays. J. Clin. Microbiol., 2009, v. 47 (4), p.988-993; Leclercq I., Berthet N., Batéjat С, Rousseaux С. Use of consensus sequences for the design of high density resequencing microarrays: the influenza virus paradigm, BMC Genomics, 2010, v. 11, p. 586-590). Известны микроматрицы на основе технологии Agilent для общего скрининга вирусов «Virochip», разрабатываемые компанией Agilent technologies, США, содержащие ~36000 зондов, полученные на основе базы данных 1500 вирусов GenBank (Chen Е.С., Miller S.A., DeRisi J.L., Chiu C.Y. Using a pan-viral microarray assay (Virochip) to screen clinical samples for viral pathogens, J. Vis. Exp., 2011 Apr 27; (50), 2536).
Компанией CombiMatrix Corp., США запатентован микрочип для идентификации ряда патогенов, включающих аденовирусы, энтеровирусы, вирус герпеса, SARS, вирус Эпштейна-Барр, вирусы гриппа А и В и др., а также субтипирования ВГА (Microarray for pathogen identification, заявка на патент США №20070092871). Этой же компанией представлен полупроводниковый микрочип высокой плотности для идентификации 15 вариантов гемагглютинина и 9 вариантов нейраминидазы (Lodes M.J., Suciu D., Elliott M., Stover A.G., et al. Use of semiconductor-based oligonucleotide microarrays for influenza a virus subtype identification and sequencing. J. Clin. Microbiol., 2006, v. 44, p. 1209-1218). Около 9000 олигонуклеотидных зондов синтезировались непосредственно на микрочипе, результаты регистрировали с помощью специализированного оптического сканера.
Описаны проточные микрочипы для анализа ВГА на основе микроканалов (Kessler Ν., Ferraris О., Palmer K., Marsh W., Steel A. Use of the DNA flowthruchip, a three-dimensional biochip, for typing and subtyping of influenza viruses. J. Clin. Microbiol., 2004, v. 42, p. 2173-2185). Олигонуклеотидные зонды выбирали на основе анализа консервативных участков геномов 7 вирусов.
Гибридизация на микроматрицах высокой плотности требует сложного компьютерного обсчета полученных результатов и дорогостоящих расходных материалов. Чрезвычайно высокая стоимость микрочипов не позволяет использовать их для рутинной медицинской практики.
В работах различных авторов описаны гибридизационные микрочипы низкой плотности, которые отличаются методами получения, типом используемых олигонуклеотидных зондов, типом детекции. Большинство микрочипов изготавливаются путем нанесения растворов олигонуклеотидов на стеклянную или пластиковую подложку, т.е. олигонуклеотидные зонды находятся на поверхности подложки, однако имеются примеры и микрочипов других типов.
Микрочипы, представляющие собой подложки с иммобилизованными фрагментами ДНК, описаны, например, в работах Li J., Chen S., and Evans D. H. Typing and subtyping influenza virus using DNA microarrays and multiplex reverse transcriptase PCR. J. Clin. Microbiol., 2001, v. 39, p. 696-704; Sengupta S., Onodera K., Lai Α., Melcher U. Molecular detection and identification of influenza viruses by oligonucleotide microarray hybridization. J. Clin. Microbiol., 2003, v. 41, p. 4542-4550. Имеется патентная заявка США по методам и реагентам для детекции, типирования и субтипирования вируса гриппа на основе микрочипов (DNA array analysis as a diagnostic for current and emerging strains of influenza, патентная заявка WO 2008/054830, заявка на патент США №20090124512), а также заявка по детекции устойчивости вируса гриппа к различным антивирусным агентам (Detection of antiviral resistance in influenza a using DNA microarray, заявка WO/2008/079450).
Описан микрочип для идентификации подтипов вируса гриппа по последовательности M гена вируса (Dawson E.D., Moore C.L., Smagala J.A. MChip: a tool for influenza surveillance. Anal. Chem, 2006, v. 78, p. 7610-7615), a также микрочип для анализа мутаций сегмента MP, ведущих к устойчивости к адамантанам (Townsend M., Smagala J., Dawson Ε., Deyde V., et al. Detection of adamantane-resistant influenza on a microarray. J. Clin. Virol, 2008, v. 42, p. 117-123).
Имеется несколько работ российских авторов, в которых описаны микрочипы для анализа вируса гриппа, представляющие собой подложки с нанесенными на них олигонуклеотидными зондами («двумерные микрочипы»). Микрочипы для субтипирования ВГА, разработанные в Институте химической биологии и фундаментальной медицины СО РАН, получают путем нанесения растворов на стеклянный слайд (Рябинин В.А., Костина Е.В., Неверов А.А., Максакова Г.А., Синяков А.Н. Типирование гемагглютинина вируса гриппа А с использованием гибридизационного микрочипа. Биоорг. хим., 2010, т. 36 (6), с. 688-699; Ryabinin V.A., Kostina Ε.V., Maksakova G.A., Neverov A.A., Chumakov K.M., Sinyakov A.N. Universal oligonucleotide microarray for sub-typing of Influenza A virus. PLoS One, 2011, v. 6 (4), e17529). Микрочип содержит зонды для определения H1-, Н2-, Н3-, Н5-, Н7-, Н9-субтипов гемагглютинина и N1-, N2-, N7-субтипов нейраминидазы и, а также зонды, выявляющие ген матриксного белка ВГА для выявления субтипов, патогенных для человека. Получен патент РФ №2470076, дата публикации 20.12.2012, касающийся способа выбора ДНК-зондов для микрочиповой диагностики, биочипа и способа типирования гена нейраминидазы и гемагглютинина ВГА. Способ включает проведение двухэтапной ПЦР кДНК вируса с последующей гибридизацией полученных флуоресцентно меченных ампликонов с ДНК-микрочипом. Теми же авторами опубликована работа по определению субтипов ВГА H1N1, H5N1, H2N2, H3N2, H9N2, H7N9 методом ПЦР на микрочипе: Костина Е.В., Рябинин В.А., Терновой В.А., Синяков А.Н., ПЦР на микрочипе для определения субтипов вируса гриппа А, циркулирующих в человеческой популяции, Биорг. хим., 2015, т. 41 (1). с. 124-128. Микрочипы позволяют анализировать лишь ограниченное число субтипов ВГА. Кроме того, не описано использование данных микрочипов для анализа клинических образцов.
Описан диагностический олигонуклеотидный микрочип для субтипирования вирусов гриппа А (Васин А.В., Сандыбаев Н.Т., Плотникова М.А, et al. Универсальный диагностический олигонуклеотидный микрочип для определения и субтипирования вирусов гриппа А человека и животных. Вопр. вирусол., 2013, т. 58 (5), с. 32-37). Микрочип также получен методом нанесения олигонуклеотидные зондов, содержащих амино-линкер, на подложку с последующей ковалентной пришивкой под действием УФ-излучения.
Получен патент РФ №2538168, дата публикации 10.01.2015 (ЗАО «ИмДи»), касающийся наборов праймеров и зондов для идентификации и типирования вирусов гриппа А и В, биологического микрочипа и тест-системы на основе биочипов. Микрочип и тест-система предназначены только для идентификации и типирования вируса. Субтипирования и анализ мутаций не проводится.
Микрочипы, полученные нанесением на альдегидные стекла описаны в работе китайских авторов Tian M., Tian Y., Li Y., Lu H., Li X., et al., Microarray multiplex assay for the simultaneous detection and discrimination of influenza A and influenza В viruses, Indian J. Microbiol., 2014, v. 54 (2), p. 211-217 (детекция вирусов гриппа А и В, субтипирование субтипов H1 и Н3).
Имеется несколько заявок на получение патентов Китая: Flu/human avian influenza virus detection gene chip and production method and use», заявка CN 101392302; Detection of influenza A virus epidemic isolates, typing gene chip and using method», заявка CN 101487061; Gene chip for detecting influenza A virus and preparation method and application thereof», заявка CN 101701266.
К недостаткам вышеописанных микрочипов низкой плотности относится их неуниверсальность: описаны микрочипы либо только для идентификации и типирования вируса гриппа, либо субтипирования вируса гриппа А, либо для анализа устойчивости к ограниченному числу антивирусных препаратов. Как правило, микрочипы позволяют идентифицировать лишь небольшое количество типов и субтипов вируса.
Микрочипы для молекулярного типирования ВГА на основе трехмерных гидрогелевых элементов разработаны в ИМБ РАН (Москва) (Fesenko Е.Е., Kireyev D.E., Gryadunov D.A., Mikhailovich V.M., et al. Oligonucleotide microchip for subtyping of influenza A virus. Influenza Other Resp. Viruses, 2007, v. 1 (3), p. 121-129; Гейдаров P.H., Фесенко E.E., Шаскольский Б.Л., et al. Определение генетических детерминант устойчивости вируса гриппа А к адамантанам и ингибиторам нейраминидазы на биологическом микрочипе. Докл. Акад. Наук, 2015, т. 460, №1, с. 102-106). Процедура анализа включает двухстадийную амплификацию фрагментов генов НА и NA с последующей гибридизацией на биочипе и флуоресцентной детекцией. Сконструирован микрочип для идентификации 15 подтипов НА и подтипов N1 и N2 нейраминидазы, а также микрочип для выявления мутаций в генах белков М2 (S31N, V27A, L26F и А30Т) и NA (H274Y), приводящих к возникновению устойчивости вируса к адамантанам и ингибиторам нейраминидазы. К недостаткам данных микрочипов относится ограниченное число анализируемых субтипов ВГА, что не позволяет определять все возможные варианты вируса, циркулирующие в данном эпидемиологическом сезоне.
Компанией GENOMICA S.A.U., Испания выпускается тест-система CLART® PneumoVir для детекции и генотипирования наиболее распространенных вирусов, вызывающих респираторные инфекции у человека (аденовирусы, некоторые субтипы ВГА, VSR-A, VSR-B и др., всего 19 вирусов) на основе микроматриц низкой плотности, элементы которых располагают на дне пробирки объемом 1,5 мл (Array-Tube-AT) или колодца стандартного иммунологического стрипа (CL ART Strips-CS). Детекция осуществляется после проведения ОТ-ПЦР с образованием продуктов, меченных биотином, и основана на образовании нерастворимого осадка: Kouni S., Karakitsos P., Chranioti Α., et al. Evaluation of viral co-infections in hospitalized and non-hospitalized children with respiratory infections using microarrays, Clin. Microbiol. Infect., 2013, v. 19 (8), p. 772-777).
Другим примером коммерчески доступных микроматриц для анализа вируса гриппа являются микрочипы FluType производства Alere Technologies GmbH, Германия. Чипы представляют собой микротитровальные стрипы, содержащие иммобилизованные ДНК-зонды для генотипирования ВГА. Возможен одновременный анализ 96 образцов. Тест-система, помимо стрипов (чипов), включает специфические ПЦР-праймеры для типирования, реагенты для детекции на основе фермента пероксидазы: Gall Α., Hoffmann В., Harder T., Grund С, et al. Design and validation of a microarray for detection, hemagglutinin subtyping, and pathotyping of avian influenza viruses. J. Clin. Microbiol, 2009, v. 47, p. 327-334; Bandt D., Monecke S., Scott C, Gall Α., Hoffmann В., Ehricht R. Economic high-throughput-identification of influenza A subtypes from clinical specimens with a DNA-oligonucleotide microarray in an outbreak situation, Mol. Cell. Probes, 2012, v. 26 (1), p. 6-10. Недостатком данных систем также является ограниченное число анализируемых типов вируса.
Многопараметрический анализ достигается также при использовании микрочипов, представляющих собой суспензию флуоресцентно маркированных микросфер (мультиплексная технология хМАР, детекция с использованием технологии Luminex). Окрашивание микросфер смешанными в различных соотношениях флуорофорами позволяет получить множество типов микросфер с различными спектральными характеристиками. Олигонуклеотидные зонды расположены на поверхности микросфер. Описано применение микросфер для субтипирования ВГА и детекции ряда респираторных патогенов (Multiplex detection of respiratory pathogens, заявка WO/2008/143450, заявка на патент США №20090088331; Munro S.B., Kuypers J., Jerome K.R. Comparison of a Multiplex Real-Time PCR Assay with a Multiplex Luminex Assay for Influenza Virus Detection, J. Clin. Microbiol., 2013, v. 51(4), p, 1124-1129).
Имеется также несколько заявок на получение патентов Китая, касающихся метода детекции и типирования вирусов гриппа с использованием технологии хМАР (в данных заявках они называются «жидкими» чипами ("liquid chips")): Method for detecting flu and H5N1 avian influenza virus by using liquid chip, заявка CN 101392298; Method for detecting influenza virus by liquid phase chip, заявка CN 101717830). Предложенные варианты чипа позволяют идентифицировать лишь ограниченное число подтипов ВГА.
Таким образом, многопараметрический анализ образца достигается при использовании микрочипов высокой и низкой плотности. Микроматрицы высокой плотности чрезвычайно дорогостоящи и сложны в изготовлении; в настоящее время они не получили широкого применения и используются только в научных лабораториях. Основным недостатком всех описанных вариантов гибридизационных микрочипов низкой плотности для анализа вируса гриппа является их неуниверсальность: микрочипы позволяют проводить либо только идентификацию вируса, либо только типирование и/или субтипирование ВГА, причем число определяемых подтипов ограничено, либо только анализ чувствительности к некоторым противовирусным препаратам. Все эти недостатки преодолены настоящим изобретением.
Раскрытие изобретения
Предлагаемое изобретение обеспечивает способ идентификации РНК вирусов гриппа А и В с одновременным определением вариантов гемагглютинина и нейраминидазы вируса гриппа А, идентификацией генетических маркеров патогенности и устойчивости к противогриппозным препаратам на биологических микрочипах (биочипах), представляющих собой подложку с гелевыми элементами, содержащими иммобилизованные специфичные олигонуклеотидные зонды. Изобретением также обеспечиваются биочип, используемый в способе идентификации РНК вирусов гриппа, и набор олигонуклеотидных зондов, используемый для получения биочипа. Способ выгодно отличается от способов, известных из уровня техники, тем, что предоставляет возможность одновременно (в одном эксперименте) осуществить идентификацию РНК вируса гриппа и определить его типовую принадлежность (тип А либо тип В), выполнить субтипирование вируса гриппа А с определением молекулярных вариантов генов гемагглютинина и нейраминидазы, молекулярного анализа генетических маркеров, характеризующих степень патогенности вируса гриппа А и его устойчивость к основным противовирусным препаратам. Способ не требует дорогостоящего оборудования и высококвалифицированного персонала.
Анализ наличия в геноме вируса гриппа генетических маркеров патогенности важен для оценки степени патогенности возбудителя для человека и его восприимчивости к основным противовирусным препаратам. Способ может использоваться для эпидемиологического мониторинга заболевания гриппом и разработки стратегии вакцинации и лечения в каждый конкретный эпидемический сезон.
Процедура определения в предлагаемом способе основана на проведении реакции обратной транскрипции для получения кДНК с использованием вирусной РНК в качестве матрицы, далее проведение полимеразной цепной реакции (ПНР) с последующей гибридизацией полученного одноцепочечного флуоресцентно-меченного ПЦР-продукта на биологическом микрочипе. Биологический микрочип представляет собой подложку с упорядоченно расположенными гидрогелевыми элементами, содержащими ковалентно иммобилизованные олигонуклеотидные зонды, которые обеспечивают гибридизацию со специфическими участками генома вируса гриппа, определяющими его тип, субтип и генетические маркеры, включая детерминанты устойчивости к противовирусным препаратам.
Визуализация результатов гибридизации проводится флуоресцентным методом с помощью возбуждения флуоресценции после реакции меченого ПЦР-продукта с иммобилизованными на микрочипе зондами. Интерпретация результатов осуществляется в зависимости от того, с какими из иммобилизованных зондов прошла реакция гибридизации.
Предлагаемый способ включает:
а) обеспечение биочипа, представляющего собой подложку с гелевыми элементами, в каждом из которых иммобилизован набор олигонуклеотидных зондов, относящийся к следующим группам:
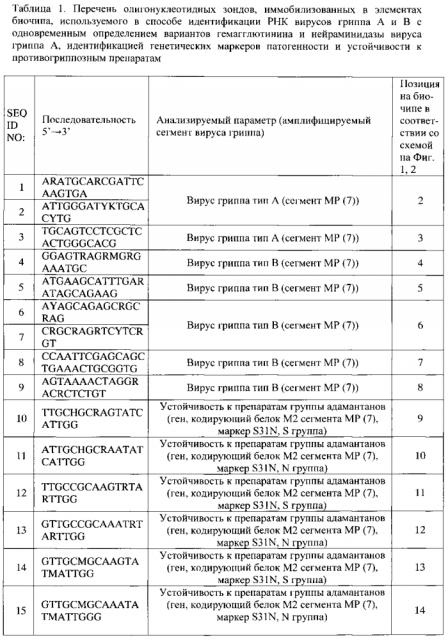
- группа зондов, последовательности которых представлены SEQ ID NO: 1-9 (Таблица 1), соответствующая фрагментам вирусных сегментов MP (7), для определения наличия РНК вируса гриппа и определения типа вируса (тип А или тип В);
- группа зондов, последовательности которых представлены SEQ ID NO: 112-178 (Таблица 1), соответствующая фрагментам вируса гриппа А, для определения молекулярного варианта гемагглютинина (Н1-Н16);
- группа зондов, последовательности которых представлены SEQ ID NO: 73-111 (Таблица 1), соответствующая фрагментам вируса гриппа А, для определения молекулярного варианта нейраминидазы (N1-N9);
- группа зондов, последовательности которых представлены SEQ ID NO: 9-25 (Таблица 1), для идентификации генетических маркеров S31N, V27A, А30Т, L26F в гене М2 вирусного сегмента MP вируса гриппа А, ассоциированных с устойчивостью вируса к лекарственным препаратам группы адамантанов;
- группа зондов, последовательности которых представлены SEQ ID NO: 26-37 (Таблица 1), для идентификации генетического маркера H274Y в гене нейраминидазы вируса гриппа А субтипа N1, ассоциированных с устойчивостью вируса к лекарственным препаратам группы ингибиторов нейраминидазы;
- группа зондов, последовательности которых представлены SEQ ID NO: 66-72 (Таблица 1), для определения состояния сайта протеолитического расщепления гемагглютинина вируса гриппа А, ассоциированного с повышенной патогенностью вируса (для субтипов Н5 и Н7);
- группа зондов, последовательности которых представлены SEQ ID NO: 38-51 (Таблица 1), для анализа генетических маркеров в рамке считывания вирусного белка PB1-F2, который является одним из ключевых факторов подавления вирусом гриппа иммунного ответа хозяина, включающих последовательности для идентификации мутации N66S и стоп-кодонов в 12 и 58 положении;
- группа зондов, последовательности которых представлены SEQ ID NO: 52-65 (Таблица 1), для анализа генетических маркеров в структуре PDZ-связывающего домена в гене NS1, детерминирующего активацию сигнальных систем клетки, обеспечивающих контроль над противовирусным ответом при гриппозной инфекции, включающих последовательности для анализа длины белка NS1 (LVT-0, LVT-11, LVT-13), последовательности аминокислот RSKV (низкопатогенный вариант вируса), RSEV (низкопатогенный вариант вируса), KSEV (высокопатогенный вариант вируса), ESEV (высокопатогенный вариант), ESKV (высокопатогенный вариант вируса), EPEV (высокопатогенный вариант вируса);
б) проведение реакции обратной транскрипции для получения кДНК с использованием вирусной РНК в качестве матрицы и далее ПЦР с использованием олигонуклеотидных праймеров, комплементарных фрагментам генома вируса гриппа, в буферном растворе, включающем смесь четырех дезоксинуклеозидтрифосфатов, один из которых содержит флуоресцентную метку, с получением продуктов амплификации в виде преимущественно одноцепочечных флуоресцентно-меченных фрагментов ДНК;
в) гибридизацию амплифицированных флуоресцентно-меченных продуктов, полученных на стадии (б), на биочипе, полученном на стадии (а);
г) регистрацию и интерпретацию результатов гибридизации на биочипе, проведенной на стадии (в), путем сравнения интенсивности флуоресценции сигналов в пределах каждой из групп ячеек, в которых образовались совершенные и несовершенные гибридизационные дуплексы.
Для анализа по данному способу используется РНК, выделенная из биологического материала, полученного от человека (мазки из полости носа и ротоглотки, бронхоальвеолярный лаваж, промывные воды бронхов, секционный материал) и от птиц (клоакальные мазки, фрагменты внутренних органов) или культуры вирусов. ПЦР на стадии (б), в результате которой осуществляется получение одноцепочечных фрагментов вирусного генома и их флуоресцентное маркирование за счет встраивания флуоресцентного красителя в продукт.
Регистрацию результатов на стадии (г) проводят с помощью прибора-анализатора флуоресценции, оснащенного специализированным программным обеспечением, что позволяет использовать программную автоматическую обработку интенсивностей сигналов с последующей интерпретацией результатов.
Изобретение также обеспечивает биочип, используемый в способе идентификации РНК вирусов гриппа А и В с одновременным определением вариантов гемагглютинина и нейраминидазы вируса гриппа А, идентификацией генетических маркеров патогенности и устойчивости к противогриппозным препаратам, представляющий собой подложку с гелевыми элементами, в каждом из которых иммобилизован набор зондов, причем последовательности зондов представлены SEQ ID NO: 1-178 (Таблица 1).
Изобретением также предлагается набор олигонуклеотидных зондов, используемый для получения биочипа, используемого в способе идентификации РНК вирусов гриппа А и В с одновременным определением вариантов гемагглютинина и нейраминидазы вируса гриппа А, идентификацией генетических маркеров патогенности и устойчивости к противогриппозным препаратам, причем зонды имеют последовательности SEQ ID NO: 1-178 (Таблица 1).
Далее изобретение будет раскрыто подробнее со ссылками на фигуры и примеры, которые приводятся исключительно с целью иллюстрации и пояснения сущности заявленного изобретения, но которые не предназначены для ограничения объема притязаний.
Краткое описание фигур
Фиг. 1 представляет схему размещения олигонуклеотидов на биочипе для идентификации РНК вирусов гриппа А и В с одновременным определением вариантов гемагглютинина и нейраминидазы вируса гриппа А, идентификацией генетических маркеров патогенности и устойчивости к противогриппозным препаратам.
Позиция 0 - элементы, не содержащие иммобилизованные соединения (фоновые ячейки);
позиция 1 - элементы, содержащие флуоресцентный маркер;
позиции 2-177 - элементы, содержащие иммобилизованные олигонуклеотидные зонды (последовательности зондов приведены в Таблице 1).
Фиг. 2 представляет структуру биочипа в соответствии со схемой на Фиг. 1 с указанием элементов для определения анализируемых параметров/мутаций.
А, В - ячейки для определения типа вируса гриппа: тип А или тип В;
N1-N9 - ячейки для определение субтипа нейраминидазы вируса гриппа А;
H1-Н16 - ячейки для определение субтипа гемагглютинина вируса гриппа А;
S31, А30, V27, L26, Н274, N66 - ячейки для определения генетических маркеров вируса гриппа А, связанных с патогенностью и устойчивостью к противовирусным препаратам;
Блок PB1-F2 - ячейки для определения стоп-кодонов в рамке считывания вирусного белка PB1-F2;
Блок NS1 - ячейки для определения стоп-кодонов и структуры вирусного белка NS1;
Блок HPAI - ячейки для анализа структуры сайта протеолитического расщепления гемагглютинина вируса гриппа A (HPAI).
Фиг. 3 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа биологического образца (мазок из полости носа и ротоглотки): обнаружен вирус гриппа, тип А, субтип H1N1; имеется мутация в белке М2 сегмента MP (7) S31N, приводящая к устойчивости к препаратам группы адамантанов; функциональный вирусный белок PB1-F2 не синтезируется, имеется стоп кодон по положению 12; обнаружен вариант белка NS1, характерный для низкопатогенных штаммов, С-концевое укорачивание на 11 аминокислот.
Фиг. 4 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа биологического образца (мазок из полости носа и ротоглотки): обнаружен вирус гриппа, тип В.
Фиг. 5 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа биологического образца (мазок из полости носа и ротоглотки) здорового донора: вирус гриппа не обнаружен.
Фиг. 6 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа образца культуры вируса, штамм вируса гриппа A/Coot/Chany/204/2005, субтип H2N2, детерминанты патогенности: умеренно патогенный функциональный вирусный белок PB1-F2, вариант белка NS 1, характерный для высокопатогенных штаммов (ESEV).
Фиг. 7 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа биологического образца (промывные воды бронхов): обнаружен вирус гриппа, тип А, субтип H3N2, имеется мутация S31N в белке М2 сегмента MP (7), приводящая к устойчивости к адамантанам, обнаружен умеренно патогенный функциональный вирусный белок PB1-F2.
Фиг. 8 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа образца культуры вируса, штамм вируса гриппа A/Mallard/Altai/846/2011, субтип H4N6, детерминанты патогенности: высокопатогенный функциональный вирусный белок PB1-F2 (мутация N66S), вариант белка NS1, характерный для высокопатогенных штаммов (ESEV).
Фиг. 9 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа биологического образца (секционный материал, суспензия внутренних органов домашних птиц): обнаружен вирус гриппа, тип А, субтип H5N1 ("птичий грипп"), имеется мутация N66S в белке PB1-F2, приводящая к повышенной патогенности вируса, а также вариант белка NS1, характерный для высокопатогенных штаммов (ESEV).
Фиг. 10 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа образца культуры вируса, штамм вируса гриппа A/Teal/Amurskaya oblast/928/2009, субтип H6N6, обнаружен умеренно патогенный функциональный вирусный белок PB1-F2.
Фиг. 11 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа образца культуры вируса, штамм вируса гриппа A/Mallard/NT/00, субтип H7N3, имеется вариант белка NS1, характерный для высокопатогенных штаммов (ESEV).
Фиг. 12 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа образца культуры вируса, штамм вируса гриппа A/Shoveler/Novosibirsk/246/2011, субтип H8N4, имеется высокопатогенный функциональный вирусный белок PB1-F2 (мутация N66S) и вариант белка NS1, характерный для высокопатогенных штаммов (ESEV).
Фиг. 13 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа препарата плазмидной ДНК, содержащей синтетический фрагмент последовательности гена НА 9 субтипа и гена NA 9 субтипа.
Фиг. 14 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа образца культуры вируса, штамм вируса гриппа A/Pochard/Siberia/249/2008, субтип H10N7, имеется умеренно патогенный функциональный вирусный белок PB1-F2, и вариант белка NS1, характерный для высокопатогенных штаммов (ESEV).
Фиг. 15 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа образца культуры вируса, штамм вируса гриппа A/Mew Gull/Kamchatka/131/2008, субтип H11N8, имеется умеренно патогенный функциональный вирусный белок PB1-F2, и вариант белка NS1, характерный для высокопатогенных штаммов (ESEV).
Фиг. 16 представляет флуоресцентное изображение (гибридизационную картину) биочипа и отчет программы после проведения анализа образца культу