Рекомбинантный микроорганизм, обладающий повышенной способностью продуцировать путресцин, и способ получения путресцина с использованием этого микроорганизма
Иллюстрации
Показать всеГруппа изобретений относится к рекомбинантному микроорганизму рода Corynebacterium, обладающему способностью продуцировать путресцин, и способу получения путресцина. В указанном рекомбинантном микроорганизме гидролазная активность белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO: 17 или SEQ ID NO: 19, удалена. Способ получения путресцина включает культивирование указанного рекомбинантного микроорганизма и выделение путресцина из полученной клеточной культуральной жидкости. Группа изобретений позволяет получить путресцин с высоким выходом. 2 н. и 8 з.п. ф-лы, 2 ил., 5 табл., 4 пр.
Реферат
Область изобретения
Настоящее изобретение относится к рекомбинантным микроорганизмам, обладающим повышенной способностью продуцировать путресцин, и к способу получения путресцина с использованием этих микроорганизмов.
Предшествующий уровень техники
Путресцин (или 1,4-бутандиамин) является представителем полиаминов, таких как спермидин и спермин, и обнаружен в грамотрицательных бактериях и грибах. Поскольку путресцин присутствует в различных видах в широком диапазоне концентраций, предполагается, что он играет важную роль в метаболизме микроорганизмов. Путресцин обычно получают посредством химического синтеза из пропилена через акрилонитрил и сукцинонитрил. В химическом синтезе в качестве исходных материалов используют вещества, полученные из нефтехимических продуктов, и используют токсичные химические реагенты, и, таким образом, синтез не является экологически безопасным и связан с проблемой истощения нефтяных ресурсов.
Для решения этих проблем проводилось много исследований по разработке способа биосинтеза путресцина с использованием микроорганизмов, являющегося более экологически безопасным и имеющим пониженное потребление энергии. Согласно современным представлениям, путресцин можно биологически синтезировать двумя путями. В первом случае из глутамата получают орнитин, и этот орнитин декарбоксилируется с синтезом путресцина. В другом случае из орнитина синтезируют аргинин, из аргинина получают агматин и затем из агматина синтезируют путресцин. Кроме того, имеются другие способы синтеза путресцина с использованием целевого микроорганизма, который трансформирован с помощью ферментов, вовлеченных в известные пути синтеза путресцина. Например, в WO 09/125924 описан способ получения путресцина с высоким выходом, путем инактивации пути, вовлеченного в разложение и утилизацию путресцина у Е. coli, путем инактивации пути, в котором орнитин, предшественник путресцина, превращается в аргинин, и путем улучшения биосинтетического способа получения орнитина. В статье, опубликованной в 2010, описан способ получения путресцина высокой концентрации путем введения и увеличения количества белка, который превращает орнитин в путресцин в штаммах Corynebacterium, которые не способны продуцировать путресцин. Кроме того, описан способ получения путресцина из аргинина посредством введения в штаммы аргинин-декарбоксилазы и агматиназы, полученной от E. coli. При этом в орнитиновом пути продуцируется примерно в 50 раз большее количество путресцина, чем в аргининовом пути (Schneider et al., Appl. Microbiol. Biotechnol. 88:4, 859-868, 2010).
Технические проблемы
В этом контексте авторы настоящего изобретения обнаружили, что путресцин можно продуцировать с высоким выходом в микроорганизме рода Corynebacterium путем ослабления или удаления активности белка NCgl0101, тем самым осуществляя настоящее изобретение.
Техническое решение
Одна цель настоящего изобретения заключается в предложении рекомбинантного микроорганизма рода Corynebacterium, способного продуцировать путресцин с высоким выходом, который модифицирован так, чтобы иметь ослабленную активность NCgl0101 по сравнению с его эндогенной активностью.
Еще одной целью настоящее изобретение является предложение способа получения путресцина с использованием этого микроорганизма.
Полезный эффект
Когда микроорганизм рода Corynebacterium по настоящему изобретению, имеющий улучшенную способность продуцировать путресцин, используют для получения путрецина, его модифицируют для ослабления активности NCgl0101 по сравнению с его эндогенной активностью, что позволяет получать путресцин с высоким выходом. Следовательно, этот микроорганизм можно широко использовать для более эффективного продуцирования путресцина.
Описание графических материалов
На Фиг. 1 представлена схематическая диаграмма, показывающая относительные положения генов, кодирующих NCgl0100, NCgl0101, NCgl0102, NCgl0103 и NCgl0104, которые находятся в хромосоме штамма Corynebacterium glutamicum АТСС13032 дикого типа; и
На Фиг. 2 представлен результат теста по сравнению роста рекомбинантных штаммов, полученных в настоящем изобретении, где 1, 2, 3, 4, 5 и 6 представляют собой штаммы, полученные посредством введения рНС139Т, pHC139T-P(CJ7)-NCgl0100, pHC139T-P(CJ7)-tNCgl0100, рНС139Т-P(CJ7)-NCgl0101, pHC139T-P(CJ7)-NCgl0102-NCgl0103 и pHC139T-P(CJ7)-NCgl0104 в KCCM11138P соответственно.
Лучший вариант осуществления изобретения
В одном аспекте для достижения вышеуказанных целей в настоящем изобретении предложен рекомбинантный микроорганизм рода Corynebacterium, обладающий повышенной способностью продуцировать путресцин, который модифицирован путем ослабления или удаления активности белка NCgl0101, имеющего аминокислотную последовательность, представленную в SEQ ID NO: 17 или SEQ ID NO: 19, по сравнению с его эндогенной активностью.
При использовании в данном описании изобретения термин "NCgl0101" означает белок, демонстрирующий активность металлозависимого фермента, который экспрессируется в Corynebacterium glutamicum и функция которого еще полностью не известна. Он включает металл-связывающий домен пептидазного семейства М20 или аминобензоил-глутамат утилизирующего белка (AbgB). AbgB из E. coli представляет собой аминобензоил-глутамат-гидролазу с AbgA для гидролиза аминобензоил-глутамата в аминобензоат и глутамат. Аминобензоат, как известно, используют в качестве предшественника в фолатном синтезе, но его связь с эффективностью продуцирования путресцина не была известна.
Белок NCgl0101 по настоящему изобретению может содержать аминокислотную последовательность, представленную в SEQ ID NO: 17 или SEQ ID NO: 19. Однако он не ограничен ими, так как аминокислотная последовательность белка может различаться в зависимости от видов или штаммов микроорганизмов. Другими словами, это может быть мутантный белок или искусственный вариант с аминокислотной последовательностью, включающей замещение, делецию, вставку или добавление одной или нескольких аминокислот в одном или более положениях аминокислотной последовательности, представленной в SEQ ID NO: 17 или SEQ ID NO: 19, до тех пор, пока это может помочь в повышении способности продуцировать путресцин путем ослабления активности этого белка. В данном описании "несколько" может варьироваться в зависимости от локализации или типа в трехмерной структуре аминокислотных остатков белка, но конкретно означает от 2 до 20, более конкретно от 2 до 10 и еще более определенно от 2 до 5. Кроме того, замена, делеция, вставка, добавление или инверсия аминокислоты включает искусственные варианты или природную мутацию, основанную на различии между отдельными организмами или видами микроорганизмов.
Полинуклеотид, кодирующий аминокислотную последовательность по настоящему изобретению, может содержать полинуклеотидную последовательность, кодирующую белок, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 17 или SEQ ID NO: 19 или аминокислотную последовательность с 80% или более, предпочтительно с 90% или более, более предпочтительно с 95% или более, и особенно с 97% или более, гомологией этой аминокислотной последовательности, при условии сохранения той же самой активности, что и у белка NCgl0101. Наиболее предпочтительно это может быть полинуклеотидная последовательность, представленная SEQ ID NO: 16 или SEQ ID NO: 18.
Термин "гомология" относится к идентичности двух аминокислотных последовательностей и может быть определена с помощью хорошо известного специалистам в данной области метода, с использованием BLAST 2.0 для вычисления такого параметра, как счет выравнивания, идентичность и подобие.
Кроме того, полинуклеотидная последовательность, кодирующая NCgl0101 по настоящему изобретению, может быть гибридизована с полинуклеотидом SEQ ID NO: 16 или с пробой, полученной из него в "жестких условиях", и может быть модифицированной полинуклеотидной последовательностью, кодирующей белок NCgl0101, который нормально функционирует. При использовании в данном описании изобретения "жесткие условия" относятся к условиям, обеспечивающим возможность специфической гибридизации полинуклеотидов, и конкретно описанным, например, в Molecular Cloning (A Laboratory Manual, J. Sambrook et al., Editors, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989) или Current Protocols in Molecular Biology (F.M. Ausubel et al., Editors, John Wiley & Sons, Inc., New York). Например, гибридизацию выполняют в гибридизационном буфере при 65°C (3.5× SSC, 0,02% фиколла, 0,02% поливинилпирролидона, 0,02% бычьего сывороточного альбумина, 2,5 мМ NaH2PO4 (pH 7), 0,5% SDS (додецилсульфат натрия), 2 мМ EDTA (этилендиаминтетрауксусная кислота). SSC представляет собой 0,15 M хлорид натрия/0,15 M цитрат натрия, имеющий pH 7. После гибридизации мембрану, на которую перенесена ДНК, промывают с помощью 2 X SSC при комнатной температуре и затем промывают еще раз с помощью 0,1-0,5 X SSC/0,1 X SDS при температуре 68°С.
Активность белка NCgl0101 по настоящему изобретению может быть понижена посредством 1) частичного или полного удаления полинуклеотида, кодирующего этот белок, 2) модификации экспрессии регуляторной последовательности для снижения экспрессии полинуклеотида, 3) модификации полинуклеотидной последовательности в хромосоме или 4) их комбинации.
В приведенном выше частичное или полное удаление полинуклеотида, кодирующего белок, может быть выполнено путем замены полинуклеотида, кодирующего эндогенный целевой белок, в хромосоме на маркерный ген или полинуклеотид с частично удаленной нуклеотидной последовательностью, с вектором для хромосомной вставки гена. Длина такого "частичного" удаления зависит от типа полинуклеотида, но конкретно составляет от 2 п.о. до 300 п.о., более предпочтительно от 2 п.о. до 100 п.о. и наиболее предпочтительно от 1 п.о. до 5 п.о.
Кроме того, для уменьшения экспрессии полинуклеотида может быть модифицирована последовательность, регулирующая экспрессию, посредством индукции мутаций в последовательности, регулирующей экспрессию, путем удаления, вставки, консервативной или неконсервативной замены нуклеотидной последовательности или их комбинации для дальнейшего ослабления активности последовательности, регулирующей экспрессию, или путем замены последовательности, регулирующей экспрессию, последовательностью с более низкой активностью. Последовательность, регулирующая экспрессию, может включать последовательность, кодирующую промотор, последовательность оператора, сайт связывания рибосом и последовательность, контролирующую окончание транскрипции и трансляции.
Кроме того, полинуклеотидная последовательность в хромосоме может быть модифицирована для снижения активности белка путем индукции мутаций в последовательности посредством удаления, вставки, консервативной или неконсервативной замены нуклеотидной последовательности или их комбинации для дополнительного ослабления активности последовательности или путем замены полинуклеотидной последовательности на модифицированную последовательность для снижения активности белка.
При этом микроорганизм рода Corynebacterium, обладающий повышенной способностью продуцировать путресцин, по настоящему изобретению, может быть дополнительно модифицирован для снижения активности орнитин-карбамоилтрансферазы (ArgF), вовлеченной в синтез аргинина из орнитина, и активности белка (NCgl1221), вовлеченного в экспорт глутамата, по сравнению с его эндогенной активностью. Кроме того, микроорганизм рода Corynebacterium может быть модифицирован путем дополнительного введения активности орнитиндекарбоксилазы (ODC). Также микроорганизм рода Corynebacterium может быть дополнительно модифицирован для повышения активности ацетилглутамат-синтазы для превращения глутамата в ацетилглутамат, или орнитин-ацетилтрансферазы (ArgJ) для превращения ацетилорнитина в орнитин, активности ацетилглутамат-киназы (ArgB) для превращения ацетилглутамата в ацетилглутамилфосфат, активности ацетил-гамма-глутамилфосфат-редуктазы (ArgC) для превращения ацетилглутамилфосфата в полуальдегид ацетилглутамата, и активности ацетилорнитин-амино-трансферазы (ArgD) для превращения полуальдегида ацетилглутамата в ацетилорнитин, по сравнению с их эндогенными активностями, тем самым усиливая путь биосинтеза орнитина, предшественника путресцина (Sakanyan V et al., Microbiology. 142:1, 99-108, 1996).
В этом случае ArgF, NCgl1221, ODC, ArgC, ArgJ, ArgB и ArgD могут иметь, без конкретного ограничения ими, аминокислотные последовательности, представленные в SEQ ID NO: 20, 21, 22, 23, 24, 25, 26, соответственно, или аминокислотные последовательности с 80% или более, предпочтительно 90% или более, более предпочтительно 95% или более, и наиболее предпочтительно 97% или более гомологией с ними.
При использовании в данном описании изобретения термин "орнитиндекарбоксилаза (ODC)" относится к ферменту, который синтезирует путресцин, используя орнитин, и ODC нуждается в пиридоксальфосфате (пиридоксаль-5′-фосфат, PLP) в качестве кофермента. ODC обнаружен у большинства грамотрицательных бактерий и может быть обнаружен у некоторых кишечных бактерий, таких как Lactobacillus, относящихся к грамположительным бактериям. Е. coli имеет два типа генов, кодирующих ODC, один из которых, speC, экспрессируется непрерывно в определенной концентрации, а другой, speF, экспрессируется в определенных условиях (в присутствии орнитина в концентрации больше определенной и при низком pH). В зависимости от видов, некоторые виды, такие как Е. coli, имеют два типа ODC, а другие имеют только один тип. Такие виды, как Escherichia sp., Shigella sp., Citrobacter sp., Salmonella sp., и Enterobacter sp. имеют два типа ODC (speC, speF), и штаммы Yersinia sp., Klebsiella sp., Erwinia sp., имеют один тип ODC (speC). В случае Lactobacillus, ODC экспрессируется в одном типе гена (speF), и, как известно, индуцируется для экспрессии в условиях низкого pH или избыточного орнитина и гистидина.
ODC-активность может быть введена рекомбинантному микроорганизму рода Corynebacterium по настоящему изобретению с использованием генов, кодирующих ODC, полученных из различных видов. Полинуклеотид, кодирующий ODC, может включать, без ограничения ими, полинуклеотид, кодирующий белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 22, и аминокислотной последовательности, имеющей 70% или более, предпочтительно 80% или более, более предпочтительно 90%-ную или более гомологию с ней.
Кроме того, введение орнитиндекарбоксилазной (ODC) активности в микроорганизмы может быть выполнено различными методами, хорошо известными в данной области; например методом вставки полинуклеотида, включающего нуклеотидную последовательность, кодирующую ODC, в хромосому, методом введения полинуклеотида в микроорганизмы посредством введения в векторную систему, методом вставки промотора, который модифицирован или имеет повышенную активность, в вышерасположенную область нуклеотидной последовательности, кодирующей ODC, и методом вставки мутации в нуклеотидную последовательность, кодирующую ODC. Более предпочтительно, когда вводят нуклеотидную последовательность, кодирующую ODC, можно использовать известный промотор CJ7 в качестве промотора для контроля над ее экспрессией.
Кроме того, повышение активности ArgC, ArgJ, ArgB и ArgD может быть достигнуто посредством 1) увеличения числа копий полинуклеотида, кодирующего фермент, 2) модификации последовательности, регулирующей экспрессию, с целью увеличения экспрессии полинуклеотида, 3) модификации полинуклеотидной последовательности, кодирующей фермент, в хромосоме с целью увеличения активности фермента или 4) их комбинации.
В способе (1) увеличение числа копий полинуклеотида, кодирующего фермент, может быть достигнуто посредством функционального связывания полинуклеотида с вектором или его встраивания в хромосому клетки-хозяина. Более конкретно, число копий полинуклеотида клетки-хозяина может быть увеличено путем введения вектора, который способен реплицироваться и функционировать независимо, с которым полинуклеотид, кодирующий фермент по настоящему изобретению, функционально связан, или путем введения вектора, способного встраивать полинуклеотид в хромосому клетки-хозяина, с которым полинуклеотид функционально связан.
При использовании в данном описании термин "вектор" относится к ДНК-конструкции, содержащей нуклеотидную последовательность полинуклеотида, кодирующего целевой белок, функционально связанный с подходящей регуляторной последовательностью, для экспрессии целевого белка в подходящем хозяине. Регуляторная последовательность включает промотор, который может инициировать транскрипцию, какую-нибудь операторную последовательность для контроля над транскрипцией, последовательность, кодирующую соответствующий сайт связывания рибосомы с мРНК, и последовательность для контроля над окончанием транскрипции и трансляции. Вектор может быть трансфицирован в подходящего хозяина, а затем может быть реплицирован или функционировать независимо от генома хозяина, и может быть интегрирован в сам геном.
В настоящем изобретении можно использовать любой вектор, известный в данной области, без какого-либо ограничения, пока он может реплицироваться в хозяине. Примерами обычно используемых векторов являются плазмида, космида, вирус и бактериофаги в природном состоянии или в рекомбинантном состоянии. Например, pWE15, М13, AMBL3, AMBL4, λΙΧΙΙ, AASHII, λΑΡΙΙ, λt10, λt11, Charon4A и Charon21A можно использовать в качестве фагового вектора или космидного вектора, и систему на основе pBR, систему на основе pUC, систему на основе pBluescriptll, систему на основе pGEM, систему на основе pTZ, систему на основе pCL и систему на основе рЕТ можно использовать в качестве плазмидного вектора. Вектор, который может быть использован в настоящем изобретении, конкретно не ограничен, и можно использовать известные экспрессирующие векторы. Конкретно, можно использовать векторы pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118, pCCIBAC. Наиболее конкретно можно использовать векторы pACYC177, pCL, pCCIBAC.
Кроме того, вектор, который может встраивать полинуклеотид, кодирующий целевой белок, в хромосому клетки-хозяина, может конкретно представлять собой, например, шаттл-вектор pECCG112 (корейская патентная публикация 1992-0000933), который способен самостоятельно реплицироваться в бактериях и Е. coli, и Coryneform, без ограничения ими.
Кроме того, полинуклеотид, кодирующий целевой белок в хромосоме, может быть заменен новым полинуклеотидом посредством использования вектора для встраивания гена в хромосому. Встраивание полинуклеотида в хромосому можно осуществить любым известным в данной области техники методом, например посредством гомологичной рекомбинации. Так как вектор по настоящему изобретению может быть встроен в хромосому посредством индукции гомологичной рекомбинации, может быть дополнительно включен селективный маркер для подтверждения удачного встраивания гена в хромосому. Селективный маркер предназначен для скрининга клеток, трансформированных вектором, другими словами, для определения, встроен ли целевой полинуклеотид. Можно использовать маркеры, обеспечивающие селектируемые фенотипы, такие как устойчивость к лекарственным средствам, ауксотрофия, устойчивость к токсическим агентам или экспрессия поверхностных белков. В среде, обработанной селективным агентом, могут выжить только клетки, экспрессирующие селективный маркер, или клетки, демонстрирующие другой фенотип и, таким образом, с помощью этого способа могут быть отобраны успешно трансформированные клетки.
При использовании в данном описании термин "трансформация" относится к введению вектора, содержащего полинуклеотид, кодирующий целевой белок в клетку-хозяина, так чтобы в этой клетке мог экспрессироваться белок. Трансформирующий полинуклеотид включает весь полинуклеотид, кодирующий целевые белки, которые могут экспрессироваться в клетке-хозяине независимо от локализации, является ли он встроенным в хромосому клетки-хозяина или расположен за пределами хромосомы. Кроме того, полинуклеотид включает ДНК и РНК, кодирующую целевой белок. Полинуклеотид может быть введен в любой форме при условии, что он может быть введен в клетку-хозяина и экспрессироваться. Например, полинуклеотид может быть введен в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой генную конструкцию, содержащую все необходимые для самостоятельной экспрессии элементы. Экспрессионная кассета обычно включает промотор, функционально связанный с полинуклеотидом, сигнал окончания транскрипции, сайт связывания рибосомы и сигнал окончания трансляции. Экспрессионная кассета может находиться в форме экспрессирующего вектора, способного к саморепликации. Кроме того, полинуклеотид может быть введен в клетку-хозяина в своей собственной форме и функционально связан с последовательностями, необходимыми для экспрессии в клетке-хозяине.
При использовании в данном описании термин "функционально связанный" относится к функциональной связи между промоторной последовательностью, инициирующей или опосредующей транскрипцию полинуклеотида, кодирующего целевой белок, и полинуклеотидом.
Кроме того, способ (2) модификации последовательности, регулирующей экспрессию, с целью повышения экспрессии полинуклеотида в настоящем изобретении может быть осуществлен путем индукции мутации последовательности в результате удаления, вставки, консервативной или неконсервативной замены нуклеотидной последовательности или их комбинации, или посредством замещения нуклеотидной последовательностью с повышенной активностью. Последовательность, регулирующая экспрессию, включает промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, и последовательность контроля над окончанием транскрипции и трансляции.
Сильный гетерологичный промотор может быть соединен с верхней частью экспрессирующей единицы полинуклеотида вместо исходных промоторов. Примером сильного промотора является промотор pcj7, промотор lysCP1, промотор EF-Tu, промотор groEL, промотор асеА или асеВ и т.д. и, более конкретно, промотор lysCP1 или промотор pcj7, полученный из Corynebacterium, функционально связан с целью повышения экспрессии полинуклеотида, кодирующего фермент. При этом промотор lysCP1, который является улучшенным промотором в результате замены нуклеотидной последовательности промоторной области полинуклеотида, кодирующего аспартаткиназу и аспартатполуальдегиддегидрогеназу, является достаточно сильным, чтобы повысить активность соответствующего фермента в 5 раз по сравнению с диким типом благодаря повышению экспрессии гена аспартаткиназы (международная патентная публикация 2009-096689). Кроме того, установлено, что промотор pcj7 экспрессируется в Corynebacterium ammoniagenes и Escherichia и обладает сильной промоторной активностью, и также может экспрессироваться с высокой интенсивностью в Corynebacterium glutamicum (корейский патент 0620092).
Кроме того, способ (3) модификации полинуклеотидной последовательности в хромосоме может быть выполнен, но конкретно не ограничен этим, путем индуцирования мутации последовательности в результате удаления, вставки, консервативной или неконсервативной замены нуклеотидной последовательности или их комбинации с целью повышения активности этой последовательности или путем замещения нуклеотидной последовательностью с повышенной активностью.
Микроорганизм по настоящему изобретению, который представляет собой микроорганизм, обладающий способностью продуцировать путресцин, включает прокариотический микроорганизм, где экспрессируется белок, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 17 или SEQ ID NO: 19, и может представлять собой, например, микроорганизм Escherichia sp., Shigella sp., Citrobacter sp., Salmonella sp., Enterobacter sp., Yersinia sp., Klebsiella sp., Erwinia sp., Corynebacterium sp., Brevibacterium sp., Lactobacillus sp., Sllenomanas sp. и Vibrio sp.
Микроорганизм по настоящему изобретению конкретно представляет собой микроорганизм рода Corynebacterium и более конкретно может представлять собой Corynebacterium glutamicum.
В одном воплощении настоящего изобретения микроорганизм рода Corynebacterium с учетным номером KCCM11138P (выложенный корейский патент 2012-0064046), который способен продуцировать путресцин в высокой концентрации посредством усиленного пути биосинтеза путресцина, был модифицирован. В частности, штамм KCCM11138P, продуцирующий путресцин, представляет собой штамм, сверхпродуцирующий путресцин, где ген, кодирующий орнитинкарбамоилтрансферазу (ArgF) для накопления орнитина, и ген, кодирующий экспортер глутамата (NCgl1221) для повышения уровня внутриклеточного глутамата, удалены из штаммов АТСС13032, ген, кодирующий орнитиндекарбоксилазу (speC) встроен, и уровень экспрессии генов биосинтеза орнитина (argCJBD) повышен.
В другом воплощении настоящего изобретения путресцин-продуцирующий штамм DAB12, основанный на Corynebacterium glutamicum АТСС13869, модифицирован. Штамм АТСС13869 основан на том же генотипе, что и KCCM11138P, который представляет собой путресцин-продуцирующий штамм, основанный на Corynebacterium glutamicum АТСС13032. В частности, путресцин-продуцирующий штамм DAB12-a происходит от штамма АТСС13869, полученного из Американской коллекции типовых культур (АТСС), где ген, кодирующий орнитинкарбамоилтрансферазу (ArgF), и ген, кодирующий белок NCgl1221 для экспорта глутамата, удалены, ген (speC), кодирующий орнитиндекарбоксилазу (ODC), полученный из Е. coli, введен, и промотор оперона, содержащего гены биосинтеза орнитина (argCJBD), заменен улучшенным промотором.
Согласно одному воплощению настоящего изобретения, микроорганизм рода Corynebacterium (KCCM11138P), обладающий способностью продуцировать путресцин, получен в результате делеции гена, кодирующего орнитинкарбамоилтрансферазу (ArgF), и гена, кодирующего экспортер глутамата (NCgl1221), вовлеченного в экспорт глутамата, замены собственного промотора кластера генов ArgCJBD, кодирующего фермент, вовлеченный в синтез орнитина из глутамата, и введения гена (speC), кодирующего орнитиндекарбоксилазу (ODC) в хромосому штамма Corynebacterium glutamicum АТСС13032 дикого типа. На основе KCCM11138P был выбран клон (А15), хорошо растущий в среде, содержащей высокую концентрацию путресцина, и было подтверждено, что выбранный А15 включает гены, кодирующие NCgl0100, NCgl0101, NCgl0102, NCgl0103 и NCgl0104 (Пример 1). Кроме того, микроорганизм растет в среде, содержащей высокую концентрацию путресцина, благодаря гену, кодирующему NCgl0101, среди пяти типов генов (Пример 2). Что касается характера гена, кодирующего NCgl0101, было подтверждено, что продукция путресцина была понижена в штамме, в котором сверхэкспрессировался ген, кодирующий NCgl0101 (Пример 3), и продуцирование путресцина было повышено в штамме с делецией гена, кодирующего NCgl0101 (Пример 4).
Соответственно, авторы настоящего изобретения обозначили штамм Corynebacterium glutamicum, обладающий повышенной способностью продуцировать путресцин, полученный путем удаления гена NCgl0101 в путресцин-продуцирующем штамме KCCM11138P, как Corynebacterium glutamicum СС01-0244, и депонировали его в Корейском центре культур микроорганизмов (далее сокращенно "KCCM") 26 декабря 2011 года с учетным номером KCCM11241P.
В другом аспекте настоящее изобретение для достижения вышеуказанных целей относится к способу получения путресцина, включающему следующие стадии:
культивирование микроорганизма рода Corynebacterium, обладающего повышенной способностью продуцировать путресцин, модифицированного с целью ослабления активности белка NCgl0101, имеющего аминокислотную последовательность, представленную в SEQ ID NO: 17 или SEQ ID NO: 19; и
выделение путресцина из культуральной жидкости, полученной на вышеуказанной стадии.
Процесс культивирования в настоящем изобретении может быть осуществлен в подходящей среде и в условиях культивирования, известных в данной области техники. Специалисты в данной области техники могут легко подобрать и использовать процесс культивирования в зависимости от выбранных штаммов. Пример процесса культивирования включает периодическую, непрерывную и подпитываемую культуру, но не ограничивается ими. Питательная среда должна подходящим образом удовлетворять требованиям конкретного штамма.
Питательная среда должна соответствующим образом удовлетворять требования конкретных штаммов. Описаны питательные среды для различных микроорганизмов (например, в "Manual of Methods for General Bacteriology" от American Society for Bacteriology (Washington D.C., USA, 1981)). В качестве источника углерода в среде можно использовать сахара и углеводы (например, глюкозу, сахарозу, лактозу, фруктозу, мальтозу, мелассу, крахмал и целлюлозу), молочный жир и жиры (например, соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло), жирные кислоты (например, пальмитиновую кислоту, стеариновую кислоту и линолевую кислоту), спирт (например, глицерин и этанол) и органическую кислоту (например, уксусную кислоту) и т.д. Эти вещества можно использовать отдельно или в виде смеси. В качестве источника азота можно использовать азот-содержащее органическое соединение (например, пептон, дрожжевой экстракт, мясной экстракт, солодовый экстракт, кукурузный экстракт, порошок соевого шрота и мочевину) или неорганическое соединение (например, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония), и эти вещества также можно использовать по отдельности или в виде смеси. В качестве источника фосфора можно использовать дигидрофосфат калия или гидрофосфат калия, или соответствующую натрий-содержащую соль. Кроме того, питательная среда может содержать соль металла (например, сульфат магния или сульфат железа), которая необходима для роста и, наконец, в дополнение к вышеупомянутым веществам можно использовать необходимые вещества, стимулирующие рост, такие как аминокислоты и витамины. Кроме того, к питательной среде может быть добавлен соответствующий предшественник. Питательное вещество может быть добавлено в культуру сразу или в достаточной мере в процессе культивирования.
pH при культивировании может быть отрегулирован с помощью подходящего основного соединения (например, гидроксида натрия, гидроксида калия или аммиака) или кислотного соединения (например, фосфорной кислоты или серной кислоты). Пенообразование может быть скорректирвоано с помощью пеногасителя, например полигликолевого эфира жирной кислоты. Аэробные условия культивирования можно поддерживать путем введения кислорода или кислородсодержащей газовой смеси, например воздуха. Температура культивирования, как правило, может составлять от 20 до 45°C, предпочтительно от 25 до 40°C. Культивирование может быть продолжено до тех пор, пока производство путресцина не достигнет необходимого максимума, для чего может требоваться, как правило, от 10 до 160 часов. Путресцин может быть выделен в среду или содержаться в клетке.
Для способа сбора и выделения полученного путресцина в процессе культивирования по настоящему изобретению целевое вещество может быть выделено из питательной среды с использованием подходящего известного в данной области метода, в зависимости от способа культивирования, например периодического, непрерывного или подпитываемого.
Примеры осуществления изобретения
Далее настоящее изобретение будет описано более подробно с помощью следующих примеров. Однако эти примеры предназначены только для иллюстративных целей, и изобретение не следует ограничивать этими примерами.
Пример 1: Получение библиотеки для селекции эффективных генов для биосинтеза путресцина и селекции клонов
Для скрининга эффективных генов для биосинтеза путресцина из хромосомы штамма Corynebacterium дикого типа, получали хромосомную библиотеку штамма Corynebacterium дикого типа. В частности, хромосому извлекали из штамма Corynebacterium glutamicum АТСС13032 дикого типа, произвольно расщепляли рестриктазой Sau3AI и выбирали полученные фрагменты длиной от 5 до 8 т.н. и затем клонировали в шаттл-вектор pECCG122 E. coli-Corynebacterium (выложенный корейский патент 1992-0000933) для получения хромосомной библиотеки.
Для выбора эффективных генов для биосинтеза путресцина из полученной таким образом хромосомной библиотеки Corynebacterium, получали колонии, растущие в среде, содержащей высокую концентрацию путресцина.
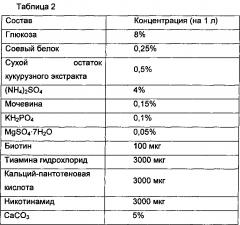
В то же время библиотеки вводили в микроорганизм рода Corynebacterium (KCCM11138P), способный продуцировать путресцин, так, чтобы получить каждый из трансформантов. Были выбраны трансформанты, которые были способны расти в минимальной среде, содержащей 0,35 M путресцина (10 г/л глюкозы, 0,4 г/л MgSO4×7H2O, 4 г/л NH4Cl, 1 г/л KH2PO4, 1 г/л K2HPO4, 2 г/л мочевины, 10 мг/л FeSO4×7H2O, 1 мг/л MnSO4×5H2O, 5 мг/л никотинамида, 5 мг/л тиамина гидрохлорида, 0,1 мг/л биотина, 1 мМ аргинина, 25 мг/л канамицина, 0,35 M путресцина, рН 7,0).
Штамм KCCM11138P, раскрытый в патенте, поданном авторами настоящего изобретения (выложенный корейский патент 2012-0064046), был получен путем удаления генов, кодирующих орнитинкарбамоилтрансферазу (argF) и экспортер глутамата (NCgl1221) в хромосоме штамма Corynebacterium glutamicum АТСС13032 дикого типа, введения гена (speC), кодирующего орнитиндекарбоксилазу (ODC), полученного из штамма W3110 E. coli дикого типа, в хромосому и замещения промотора кластера генов argCJBD, кодирующего фермент, вовлеченный в синтез орнитина из глутамата, так, чтобы получить каждый из трансформантов. В результате были отобраны 275 колоний, и во вторую очередь были выявлены колонии, хорошо растущие в среде, содержащей высокую концентрацию путресцина. Каждый клон библиотеки был получен и снова введен в путресциновый штамм. После этого были идентифицированы колонии, хорошо растущие в среде, содержащей высокую концентрацию путресцина, и таким образом был окончательно выбран клон (А15). Этот выбранный клон идентифицировали с помощью секвенирования. В результате было подтверждено, что клон в совокупности содержит 5 ORF (открытых рамок считывания) NCgl0100, NCgl0101, NCgl0102, NCgl0103 и NCgl0104, у которых 436 аминокислот на N-конце были удалены (Фиг. 1). На Фиг. 1 представлено схематическое изображение, показывающее относительные положения генов, кодирующих NCgl0100, NCgl0101, NCgl0102, NCgl0103 и NCgl0104, которые находятся в хромосоме штамма Corynebacterium glutamicum АТСС13032 дикого типа.
Пример 2: Идентификация эффективных генов для синтеза путресцина в клоне А15
Пример 2-1: Клонирование 5 генов в клоне А15 и получение трансформанта
Нуклеотидная последовательность клона А15, полученного в Примере 1, уже была известна. На основании нуклеотидной последовательности штамма АТСС13032, описанной ранее, были сконструированы NCgl0100-F и NCgl0100-R, представленные в SEQ ID NO: 1 и 2, в качестве праймеров для амплификации гена NCgl0100, NCgl0100-R и tNCgl0100-F, представленные в SEQ ID NO: 2 и 3, в качестве праймеров для амплификации гена tNCgl0100, из которого 436 аминокислот на N-конце были удалены, NCgl0101-F и NCgl0101-R, представленные в SEQ ID NO: 4 и 5, в качестве праймеров для амплификации гена NCgl0101, NCgl0102-F и NCgl0103-R, представленные в SEQ ID NO: 6 и 7, в качестве праймеров для амплификации обоих генов NCgl0102 и NCgl0103, и NCgl0104-F и NCgl0104-R, представленные в SEQ ID NO: 8 и 9, в качестве праймеров для амплификации гена NCgl0104. Кроме того, были сконструированы P(CJ7)-F и P(CJ7)-R, представленные в SEQ ID NO: 10 и 11, в качестве праймеров для амплификации промотора экспрессии Р(CJ7)(или pcj7) (корейский патент 10-0620092) (Таблица 1).
После этого выполняли ПЦР, используя хромосому штамма АТСС13032 в качестве матрицы и каждый из праймеров, представленных в SEQ ID NO: 1-9, (денатурация при 95°C в течение 30 секунд, отжиг при 50°C в течение 30 секунд и удлинение при 72°C в течение 1 минуты ~ 1 мин 30 с, 25 циклов), так чтобы амплифицировать 5 типов фрагментов гена. Кроме того, выполняли ПЦР, используя хромосому Corynebacterium ammoniagenes в качестве матрицы и праймеры, представленные в SEQ ID NO: 10 и 11, так чтобы амплифицировать фрагмент промотора.
5 генов, расщепленных с помощью Kpnl и Xbal, и промотор CJ7, расщепленный с помощью EcoRV и Kpnl, лигировали в экспрессирующий вектор рНС139Т (корейский патент 10-0860932), расщепленный с помощью EcoRV и Xbal, так чтобы получить в совокупности 5 типов экспрессирующих векторов, pHC139T-P(CJ7)-NCgl0100, pHC139T-P(CJ7)-tNCglO100, рНС139Т-P(CJ7)-NCgl0101, pHC139T-P(CJ7)-NCgl0102-NCgl0103 и pHC139T-P(CJ7)-NCgl0104.
5 типов экспрессирующих векторов, полученных таким образом, и контрольную группу рНС139Т вводили в штамм KCCM11138P из Примера 1 посредством электропорации и затем распределяли по планшетам BHIS, содержащим 25 мкг/мл канамицина, для селекции трансформантов.
Пример 2-2: Поиск эффективных генов для путресцина
Из совокупности из 6 типов трансформантов, полученных в Примере 2-1, трансформанты, хорошо растущие в среде, содержащей высокую концентрацию путресцина, выбирали таким же образом, как в Примере 1 (Фиг. 2). На Фиг. 2 представлен результат теста сравнения роста трансформантов, полученных в настоящем изобретении, где 1, 2, 3, 4, 5 и 6 представляют со