Конъюгация капсульных полисахаридов staphylococcus aureus типа 5 и типа 8
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии, в частности к способу получения конъюгата капсульного полисахарида S.aureus типа 5 или типа 8 и белка-носителя. Способ включает стадию деполимеризации капсульного полисахарида путем кислотного гидролиза с получением полисахаридного фрагмента, стадию окисления фрагмента для введения альдегидной группы в по меньшей мере один сахаридный остаток во фрагменте с получением окисленного сахаридного остатка и стадию связывания окисленного сахаридного остатка с белком-носителем через альдегидную группу. На стадии окисления две вицинальные гидроксильные группы полисахарида преобразуются в альдегидные. Настоящее изобретение обеспечивает конъюгат капсульного полисахарида S.aureus типа 5 или типа 8 и белка-носителя, полученный указанным способом, и иммуногенную композицию, включающую указанный конъюгат. Настоящее изобретение позволяет улучшить иммунологические свойства получаемого конъюгата. 3 н. и 10 з.п. ф-лы, 18 ил., 8 табл., 1 пр.
Реферат
Настоящее изобретение заявляет преимущество временной заявки США, серийный № 61/247518, поданной 30 сентября 2009 года, которая включена в настоящую заявку посредством ссылки.
Область изобретения
Настоящее изобретение относится к области конъюгирования бактериальных капсульных сахаридов, в частности, капсульных полисахаридов Staphylococcus aureus типа 5 или типа 8, с носителями для образования гликоконъюгатов. Гликоконъюгаты являются полезными для иммунизации.
Предпосылки изобретения
Капсульные сахариды бактерий используют в течение многих лет в вакцинах против капсулированных бактерий. Поскольку сахариды являются T-независимыми антигенами, они, однако, являются низко иммуногенными. Конъюгация с носителем может преобразовать T-независимые антигены в T-зависимые антигены, усиливая, таким образом, вторичные иммунные ответы и обеспечивая возможность развития защитного иммунитета. Наиболее эффективные сахаридные вакцины, поэтому, основаны на гликоконъюгатах, и прототип конъюгат-вакцины был против Haemophilus influenzae типа b ('Hib') [например, см. главу 14 ссылочного документа 97].
Другая бактерия, для которой были описаны конъюгат-вакцины, представляет собой Staphylococcus aureus (S.aureus). Различные полисахариды были выделены из S.aureus для использования в гликоконъюгатах. Два полисахарида, которые представляют особый интерес, это капсульные полисахариды типа 5 и типа 8. Приблизительно 60% человеческих штаммов S.aureus представляют собой тип 8, и приблизительно 30% представляют собой тип 5. Большая работа с конъюгатами типа 5 и типа 8 была выполнена Fattom et al., и это описано в документах, таких как ссылочные документы 1-9. Способ Fattom для конъюгации типа 5 и типа 8 полисахаридов типично включает тиолирование очищенного полисахарида с использованием цистамина. Реакция основана на присутствии карбоксилатных групп в капсульном полисахариде. Эти группы взаимодействуют с цистамином в присутствии карбодиимида, например, EDAC. Дериватизированный полисахарид затем конъюгируют с белком-носителем, таким как Pseudomononas aeruginosa эндотоксин A (ETA), типично через линкер [2]. Другие исследователи осуществляли конъюгацию очищенных капсульных полисахаридов типа 5 и типа 8 путем восстановительного аминирования [10 и 11]; глутаральдегидного связывания [10]; или взаимодействия гидроксильных групп полисахаридов с агентами цианилирования, такими как CDAP [12] или трихлорид циануровой кислоты [13].
Хотя было показано, что конъюгат-вакцины, полученные способом Fattom, являются безопасными и иммуногенными для человека [5], все еще остается необходимость в других и более лучших способах получения конъюгатов капсульных полисахаридов S.aureus типа 5 или типа 8.
Раскрытие изобретения
Изобретение основано на способе конъюгации, который можно использовать вместо способов конъюгации, раскрытых в предшествующем уровне техники. В отличие от этих способов, способ по настоящему изобретению не включает конъюгацию через гидроксильную или карбоксилатную группы в полисахариде. Способ поэтому оставляет эти группы в форме, которая ближе, чем известные из уровня техники, к форме, наблюдаемой в природном полисахариде. Вместо использования этих групп, способ включает образование реакционноспособных альдегидных групп в полисахариде для использования в конъюгации. Полученные конъюгаты могут иметь другие, предпочтительно улучшенные, иммунологические свойства по сравнению с конъюгатами предшествующего уровня техники.
Изобретение поэтому обеспечивает альтернативные или улучшенные способы конъюгирования капсульного полисахарида S.aureus типа 5 или типа 8 с белком-носителем и конъюгаты, полученные такими способами. Изобретение также обеспечивает промежуточные соединения, которые являются полезными в способах по настоящему изобретению, и способы получения этих промежуточных соединений.
В первом аспекте изобретение обеспечивает способ получения конъюгата капсульного полисахарида S.aureus типа 5 или типа 8 и молекулы носителя, включающий следующие стадии: (a) деполимеризация капсульного полисахарида с получением полисахаридного фрагмента; (b) окисление фрагмента для введения альдегидной группы в, по меньшей мере, один сахаридный остаток во фрагменте с получением окисленного сахаридного остатка; и (c) связывание окисленного сахаридного остатка с молекулой носителя через альдегидную группу с получением, таким образом, конъюгата. Связывание на стадии (c) может быть прямым, или оно может осуществляться через линкерную молекулу. Изобретение также обеспечивает конъюгат, полученный или который можно получить этим способом.
Капсульный полисахарид
Изобретение основано на капсульных полисахаридах S.aureus типа 5 и типа 8. Структуры капсульных полисахаридов типа 5 и типа 8 были описаны в ссылочных документах 14 и 15 следующим образом:
Тип 5
→4)-β-D-ManNAcA(3OAc)-(1→4)-α-L-FucNAc(1→3)-β-D-FucNAc-(1→
Тип 8
→3)-β-D-ManNAcA(4OAc)-(1→3)-α-L-FucNAc(1→3)-β-D-FucNAc-(1→
Полученные в последнее время данные спектроскопии ЯМР [16] привели к пересмотру этих структур:
Тип 5
→4)-β-D-ManNAcA-(1→4)-α-L-FucNAc(3OAc)-(1→3)-β-D-FucNAc-(1→
Тип 8
→3)-β-D-ManNAcA(4OAc)-(1→3)-α-L-FucNAc(1→3)-α-D-FucNAc(1→
Полисахарид может быть химически модифицирован по сравнению с капсульным полисахаридом, присутствующим в природе.
Например, полисахарид может быть де-O-ацетилирован (частично или полностью), де-N-ацетилирован (частично или полностью), N-пропионирован (частично или полностью) и т.п. Деацетилирование может происходить до, в процессе или после конъюгации, но типично происходит до конъюгации. В зависимости от конкретного полисахарида, деацетилирование может влиять или не влиять на иммуногенность, например, для NeisVac-C™ вакцины используют де-O-ацетилированный полисахарид, тогда как Menjugate™ является ацетилированной, но обе вакцины являются эффективными. Эффект деацетилирования и т.п. можно оценить при помощи рутинных анализов. Например, влияние O-ацетилирования на капсульные полисахариды S.aureus типа 5 или типа 8 обсуждается в ссылочном документе 6. Природные полисахариды, как указано в этом документе, имеют 75% O-ацетилирования. Эти полисахариды индуцировали антитела как к полисахаридному остову молекулы, так и к O-ацетильным группам. Полисахариды с 0% O-ацетилирования тем не менее индуцировали антитела к полисахаридному остову молекулы. Оба типа антител были опсоническими против штаммов S.aureus, которые различались по содержанию O-ацетильных групп. Соответственно, капсульные полисахариды типа 5 или типа 8, используемые в настоящем изобретении, могут иметь O-ацетилирование от 0 до 100%. Например, степень O-ацетилирования капсульного полисахарида типа 5 может быть 10-100%, 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90- 100%, 50-90%, 60-90%, 70-90% или 80-90%. Альтернативно, можно использовать капсульный полисахарид типа 5 с 0% O-ацетилирования. Подобным образом, степень O-ацетилирования капсульного полисахарида типа 8 может быть 10-100%, 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%. Альтернативно, можно использовать капсульный полисахарид типа 8 с 0% O-ацетилирования. В одном варианте воплощения степень O-ацетилирования капсульных полисахаридов типа 5 и типа 8 может быть 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%. В других вариантах воплощения используют капсульные полисахариды типа 5 и типа 8 с 0% O-ацетилирования. Степень N-ацетилирования капсульного полисахарида типа 5, используемого в настоящем изобретении, может быть 0-100%, 50-100%, 75-100%, 80-100%, 90-100% или 95-100%. Типично, степень N-ацетилирования капсульного полисахарида типа 5 составляет 100%. Подобным образом, степень N-ацетилирования капсульного полисахарида типа 8, используемого в настоящем изобретении, может быть 0-100%, 50-100%, 75-100%, 80-100%, 90-100% или 95-100%. Типично, степень N-ацетилирования капсульного полисахарида типа 8 составляет 100%. В одном варианте воплощения степень N-ацетилирования капсульных полисахаридов типа 5 и типа 8 может быть 0-100%, 50-100%, 75-100%, 80-100%, 90-100% или 95-100%. Типично, степень N-ацетилирования капсульного полисахарида типа 5 и типа 8 составляет 100%.
Степень O-ацетилирования полисахарида можно определить любым способом, известным из уровня техники, например, способом протонного ЯМР (например, как описано в ссылочных документах 17, 18, 19 или 20). Еще один способ описан в ссылочном документе 21. Подобные способы можно использовать для определения степени N-ацетилирования полисахарида. O-ацетильные группы можно удалить путем гидролиза, например, путем обработки основанием, таким как безводный гидразин [22] или NaOH [6]. Подобные способы можно использовать для удаления N-ацетильных групп. Для поддержания высоких уровней O-ацетилирования в капсульных полисахаридах типа 5 и/или 8 обработки, которые приводят к гидролизу O-ацетильных групп, сводятся к минимуму, например, обработки при предельных значениях pH.
Капсульные полисахариды можно очистить с использованием известных процедур, как описано в ссылочных документах, указанных в настоящей заявке. Типичный способ включает фенол-этанольную инактивацию клеток S.aureus, центрифугирование, обработку лизостафином, обработку РНКазой/ДНКазой, центрифугирование, диализ, обработку протеазой, дополнительный диализ, фильтрование, осаждение этанолом/CaCl2, диализ, лиофилизацию, анионообменную хроматографию, диализ, лиофилизацию, вытеснительную хроматографию с исключением по размеру, диализ и лиофилизацию [1]. Альтернативный способ включает обработку в автоклаве клеток S.aureus, ультрафильтрацию полисахаридсодержащего супернатанта, концентрирование, лиофилизацию, обработку метаперйодатом натрия для удаления тейхоевой кислоты, дополнительную ультрафильтрацию, диафильтрацию, высокоэффективную вытеснительную жидкостную хроматографию с исключением по размеру, диализ и лиофилизацию [23], предпочтительно используют способ очистки, описанный в ссылочном документе 24.
Изобретение, однако, не ограничивается полисахаридами, очищенными из природных источников, и полисахариды можно получить другими способами, такими как общий или частичный синтез.
Молекула носителя
Изобретение включает использование молекул носителей, которые типично представляют собой белки. Как правило, ковалентная конъюгация сахаридов с носителями повышает иммуногенность сахаридов, поскольку превращает их из T-независимых антигенов в T-зависимые антигены, обеспечивая, таким образом, возможность примирования для иммунологической памяти. Конъюгация особенно полезна для педиатрических вакцин [например, ссылочный документ 25] и является широко известным приемом [например, см. обзор в ссылочных документах 26-34].
Предпочтительными белками-носителями являются бактериальные токсины, так как дифтерийный или столбнячный токсины или токсоиды или их мутанты. Авторами настоящего изобретения было обнаружено, что мутантный CRM197 дифтерийный токсин [35] является подходящим. Pseudomonas aeruginosa экзотоксин А (ETA) и его нетоксичный мутантный рекомбинантный экзопротеин (rEPA) используют в качестве белков-носителей для капсульных полисахаридов S.aureus типа 5 или типа 8 ([1] и [2]). Также используют S.aureus α-гемолизин (α-токсин) ([10] и [36]), овальбумин [13] и человеческий сывороточный альбумин [11]. Эти носители можно использовать в настоящем изобретении.
Другие подходящие белки-носители включают белковый комплекс внешней мембраны N.meningitidis [37], синтетические пептиды [38, 39], белки теплового шока [40, 41], коклюшные белки [42, 43], цитокины [44], лимфокины [44], гормоны [44], факторы роста [44], человеческий сывороточный альбумин (типично рекомбинантный), искусственные белки, включающие множественные человеческие CD4+ T-клеточные эпитопы из различных происходящих из патогенов антигенов [45], такие как N19 [46], белок D из H.influenzae [47-49], пневмококковый поверхностный белок PspA [50], пневмолизин [51] или его нетоксичные производные [52], железосодержащие белки [53], токсин А или B из C.difflcile [54], GBS белок [55], GAS белок [56] и т.п.
Другие подходящие белки-носители включают S.aureus белковые антигены, например S.aureus белковые антигены, описанные ниже.
Можно использовать более одного белка-носителя, например, для снижения риска супрессии носителя. Таким образом, различные белки-носители можно использовать для капсульных полисахаридов типа 5 и типа 8, например, полисахарид типа 5 может быть конъюгирован с CRM197, тогда как полисахарид типа 8 может быть конъюгирован с rEPA. Также можно использовать более чем один белок-носитель для конкретного полисахаридного антигена, например, полисахарид типа 5 может быть в двух группах, где одна группа конъюгирована с CRM197, а другая конъюгирована с rEPA. Однако такой же белок-носитель типично используют для всех полисахаридов.
Один белок-носитель может нести более чем один полисахаридный антиген [57, 58]. Например, один белок-носитель может иметь конъюгированные с ним капсульные полисахариды типа 5 и типа 8. Для достижения этой цели можно смешать разные полисахариды до осуществления способа конъюгации. Типично, однако, когда имеются отдельные конъюгаты для каждого полисахарида, при этом различные полисахариды смешивают после конъюгации. Эти отдельные конъюгаты могут быть основаны на одном и том же носителе.
Деполимеризация
На стадии (a) способа по настоящему изобретению капсульный полисахарид подвергают деполимеризации с получением полисахаридного фрагмента. Сообщалось о деполимеризации капсульного полисахарида типа 8 путем обработки ультразвуком перед осуществлением конъюгации [3]. Авторами было сделано заключение, что низкомолекулярный тип 8 не был иммуногенным. Не смотря на то, что эти авторы, поэтому, отдавали предпочтение высокомолекулярным полисахаридам, в настоящем изобретении, к удивлению, используют полисахаридные фрагменты с более низкой молекулярной массой по сравнению с природными капсульными полисахаридами.
Полноразмерные полисахариды могут быть деполимеризованы с получением более коротких фрагментов для использования в изобретении различными способами. Авторами настоящего изобретения было обнаружено, что способы, которые приводят к расщеплению (1→3) гликозидных связей между α-L-FucNAc(3OAc) и β-D-FucNAc остатками в капсульном полисахариде типа 5, являются особенно подходящими. Когда эти способы применяют к капсульному полисахариду типа 5, они приводят к полисахаридному фрагменту, содержащему β-D-FucNAc-(1→часть на его нередуцирующем конце. Эта часть включает две вицинальные гидроксильные группы. Подобным образом, когда эти способы применяют к капсульному полисахариду типа 8, считается, что они приводят к полисахаридному фрагменту, содержащему α-D-FucNAc-(1→часть на его нередуцирующем конце, при этом указанная часть также включает две вицинальные гидроксильные группы. Вицинальные гидроксильные группы в полисахаридном фрагменте типа 5 или типа 8 обеспечивают осуществление последующей конъюгации фрагмента с молекулой носителя, как описано ниже.
Соответственно, в следующем аспекте изобретение обеспечивает способ обработки капсульного полисахарида S.aureus типа 5, включающий стадию деполимеризации капсульного полисахарида, с получением полисахаридного фрагмента, содержащего β-D-FucNAc-(1→часть на его нередуцирующем конце. В родственном аспекте изобретение обеспечивает способ обработки капсульного полисахарида S.aureus типа 8, включающий стадию деполимеризации капсульного полисахарида с получением полисахаридного фрагмента, содержащего α-D-FucNAc-(1→часть на его нередуцирующем конце. Капсульный полисахарид может представлять собой капсульный полисахарид S.aureus типа 5 или типа 8, как описано выше в разделе "Капсульный полисахарид". Изобретение также обеспечивает полисахаридный фрагмент, полученный или который можно получить любым из этих способов.
Авторами настоящего изобретения было обнаружено, что деполимеризацию можно осуществить при помощи кислотного гидролиза. Для кислотного гидролиза предпочтительно использовать мягкую кислоту, например уксусную кислоту, во избежание побочных реакций по другим группам в полисахариде. Специалист в данной области сможет определить подходящие кислоты и условия (например, концентрацию, температуру и/или время) для гидролиза. Например, авторами настоящего изобретения было обнаружено, что обработка полисахарида при 2 мг/мл 2% уксусной кислотой (об./об.) при 90°C в течение 3 часов является подходящей. Авторами настоящего изобретения также было обнаружено, что обработка, при 2 мг/мл 5% уксусной кислотой при 90°C в течение 30 минут, 5 или 6 часов является подходящей. Обработка другими кислотами, например, трифторуксусной или другими органическими кислотами, также может быть подходящей. В частности, авторами настоящего изобретения было обнаружено, что эффективность деполимеризации можно повысить, в частности, для капсульного полисахарида типа 8, с использованием хлористоводородной кислоты. Например, авторами настоящего изобретения было обнаружено, что обработка полисахарида 2M раствором хлористоводородной кислоты при 100°C в течение 30 минут является подходящей. Авторами настоящего изобретения также было обнаружено, что обработка 2M раствором хлористоводородной кислоты при 100°C в течение 1, 1,5, 2 или 2,5 часов является подходящей. Такая обработка хлористоводородной кислотой может привести к де-O-ацетилированию полисахарида, например, как описано ниже.
Другие способы деполимеризации полисахарида могут быть подходящими. Эти способы включают нагревание, микрофлюидизацию [59], обработку ультразвуком [3], окисление-восстановление [60] или озонолиз [61].
Полисахаридные фрагменты можно идентифицировать при помощи хроматографии, например, вытеснительной хроматографии с исключением по размеру. Специфические молекулярные массы можно измерить методом гель-фильтрации по сравнению с пуллулановыми стандартами, такими как поставляемые компанией Polymer Standard Service [62]. Типично, фрагмент по настоящему изобретению представляет собой смесь фрагментов с массами, находящимися в определенных пределах. Для деполимеризованного капсульного полисахарида типа 5 молекулярная масса фрагмента типично варьирует в пределах 1-500 кДа, например в пределах от 5 до 100 кДа, в частности от 10 до 50 кДа, и более конкретно от 20 до 30 кДа. Подобным образом, для деполимеризованного капсульного полисахарида типа 8 молекулярная масса фрагмента может варьировать в пределах 1-500 кДа, например в пределах от 5 до 100 кДа, в частности от 10 до 50 кДа, и более конкретно от 20 до 30 кДа. В некоторых вариантах воплощения низкомолекулярные типа 5 и/или типа 8 полисахаридные фрагменты выбраны для использования в изобретении. Например, фракции, полученные гель-фильтрацией, соответствующие низкомолекулярным фрагментам, могут быть выбраны и объединены. Низкомолекулярные полисахаридные фрагменты типично имеют молекулярную массу, которая варьирует в пределах от 5 до 20 кДа.
Деполимеризация может привести к изменению степени O-ацетилирования капсульного полисахарида. В качестве примера, авторами настоящего изобретения было обнаружено, что кислотный гидролиз может привести к снижению степени O-ацетилирования. В некоторых вариантах воплощения степень O-ацетилирования фрагмента может быть 10-90%, 20-70%, 30-50%, в частности, 35-45%. В других вариантах воплощения степень O-ацетилирования фрагмента может быть 0-10%, 0-5%, 0-2%, в частности 0%.
Введение альдегидной группы
На стадии (b) способа фрагмент подвергают окислению для введения альдегидной группы в, по меньшей мере, один сахаридный остаток во фрагменте. Эта стадия может включать введение более чем одной альдегидной группы в сахаридный остаток. В частности, можно ввести две альдегидные группы. Например, когда деполимеризация на стадии (a) приводит к полисахаридному фрагменту типа 5, содержащему β-D-FucNAc-(1→часть на его нередуцирующем конце, две вицинальные гидроксильные группы в этой части могут быть окислены для введения двух альдегидных групп в эту часть. Таким образом, β-D-FucNAc-(1→часть может представлять собой сахаридный остаток стадии (b). Подобным образом, когда деполимеризация приводит к полисахаридному фрагменту типа 8, содержащему α-D-FucNAc-(1→часть на его нередуцирующем конце, две вицинальные гидроксильные группы в этой части могут быть окислены для введения двух альдегидных групп. Таким образом, α-D-FucNAc-(1→часть может представлять собой сахаридный остаток стадии (b).
Соответственно, в следующем аспекте изобретение представляет способ обеспечения производного капсульного полисахарида S.aureus типа 5, включающий стадию окисления капсульного полисахарида S. aureus типа 5, содержащего β-D-FucNAc-(1→часть на его нередуцирующем конце, для преобразования двух вицинальных гидроксильных групп в β-D-FucNAc-O→части в две альдегидные группы. В родственном аспекте изобретение представляет способ обеспечения производного капсульного полисахарида S. aureus типа 8, включающий стадию окисления капсульного полисахарида S.aureus типа 8, содержащего α-D-FucNAc-(1→часть на его нередуцирующем конце, для преобразования двух вицинальных гидроксильных групп в α-D-Fuc Ac-(1→части в две альдегидные группы. Капсульный полисахарид может представлять собой полисахаридный фрагмент, описанный выше в разделе "Деполимеризация". Изобретение также обеспечивает производное капсульного полисахарида S.aureus, полученное или которое можно получить любым из этих способов.
Типичные реакции для получения альдегидов включают использование перйодатных солей и, в частности, мета-перйодатов (например, мета-перйодат натрия или калия, например, NaIO4), для окисления вицинальных гидроксильных групп [63]. Специалист в данной области сможет определить подходящие условия для окисления. Например, авторами настоящего изобретения было обнаружено, что обработка полисахарида при 2 мг/мл при помощи NaIO4 при 1:1 отношении (масс./масс.) при комнатной температуре в течение 1-2 часов в темноте является подходящей. Авторами настоящего изобретения также было обнаружено, что обработка полисахарида при 2 мг/мл при помощи 93 мМ NaIO4 при комнатной температуре в течение 8 часов в темноте является подходящей. Можно использовать другие условия окисления, например, с использованием тетроксида осмия и т.п.
Связывание с молекулой носителя
Связывание окисленного сахаридного остатка с молекулой носителя на стадии (c) способа можно осуществлять непосредственно или через линкер. Можно использовать любую подходящую реакцию конъюгации с любым подходящим линкером, если это желательно.
Когда окисление на стадии (b) приводит к полисахаридному фрагменту типа 5, содержащему β-D-FucNAc-(1→часть на его нередуцирующем конце, в котором две альдегидные группы были введены в эту часть, связывание на стадии (c) может осуществляться через одну из этих альдегидных групп. Таким образом, окисленная β-D-FucNAc-(1→часть может представлять собой окисленный сахаридный остаток стадии (c). Подобным образом, когда окисление приводит к полисахаридному фрагменту типа 8, содержащему α-D-FucNAc-(1→часть на его нередуцирующем конце, в котором две альдегидные группы были введены в эту часть, связывание на стадии (c) может осуществляться через одну из этих альдегидных групп, таким образом, окисленная α-D-FucNAc-(1→часть может представлять собой окисленный сахаридный остаток стадии (c).
Соответственно, в следующем аспекте изобретение представляет способ обеспечения конъюгированного капсульного полисахарида S.aureus типа 5, включающий стадию связывания с молекулой носителя капсульного полисахарида S.aureus типа 5, содержащего β-D-FucNAc-(1→часть на его нередуцирующем конце, который был окислен для преобразования двух вицинальных гидроксильных групп в две альдегидные группы, где связывание осуществляется через одну из этих альдегидных групп. В родственном аспекте, изобретение представляет способ обеспечения конъюгированного капсульного полисахарида S.aureus типа 8, включающий стадию связывания с молекулой носителя капсульного полисахарида S.aureus типа 8, содержащего α-D-FucNAc-(1→часть на его нередуцирующем конце, который был окислен для преобразования двух вицинальных гидроксильных групп в две альдегидные группы, где связывание осуществляется через одну из этих альдегидных групп. Капсульный полисахарид может представлять собой капсульный полисахарид, описанный выше в разделе "Введение альдегидной группы". Молекула носителя может представлять собой носитель, описанный выше в разделе "Молекула носителя". Изобретение также обеспечивает конъюгированный капсульный полисахарид, полученный или который можно получить любым из этих способов.
Присоединение окисленного сахаридного остатка или линкера к носителю типично происходит через группу амина (-NH2), например, в боковой цепи лизина или остатка в белке-носителе, или аргининового остатка. Присоединение к носителю также может осуществляться через сульфгидрильную (-SH) группу, например, в боковой цепи цистеинового остатка. Авторами настоящего изобретения было обнаружено, что прямое связывание можно удобным образом осуществить путем взаимодействия альдегидной группы в окисленном сахаридном остатке с группой амина в носителе путем восстановительного аминирования. Поэтому прямое связывание такого характера является предпочтительным в настоящем изобретении. В отличие от этого, ссылочный документ 2 предполагает, что линкеры могут быть предпочтительны в конъюгатах S.aureus типа 5 и 8. Если это желательно, связывание через линкер можно использовать в настоящем изобретении, например, путем взаимодействия альдегидной группы в окисленном сахаридном остатке с группой амина в линкере путем восстановительного аминирования, или путем преобразования альдегидной группы в группу амина путем восстановительного аминирования с получением группы амина для присоединения линкера.
Восстановительное аминирование представляет собой стандартную процедуру в органической химии, и его широко используют в получении конъюгатов капсульных полисахаридов для использования в вакцинах, включая капсульные полисахариды S.aureus [10]. В одном варианте воплощения альдегидная группа в окисленном сахаридном остатке взаимодействует с группой амина в носителе или линкере. Это можно удобным образом осуществить путем сочетания полисахарида с носителем или линкером в присутствии подходящего восстановителя (например, цианоборогидридов, таких как цианоборогидрид натрия NaBH3CN; боран-пиридина; триацетоксиборогидрида натрия; борогидридной обменной смолы; и т.п.). В другом варианте воплощения альдегидную группу преобразовывают в группу амина путем восстановительного аминирования с получением группы амина для присоединения линкера. Восстановительное аминирование включает либо аммиак, либо первичный амин (NH2R). Это можно удобным образом осуществить с использованием аммониевой соли (например, хлорида аммония) в сочетании с подходящим восстановителем (например, указанным выше). Специалист в данной области сможет определить подходящие условия для восстановительного аминирования. Например, авторами настоящего изобретения было обнаружено, что обработка полисахарида при 10 мг/мл белком-носителем при отношении 4:1 полисахарид:белок (масс./масс.) и NaBH3CN при отношении 2:1 полисахарид:NaBH3CN является подходящей.
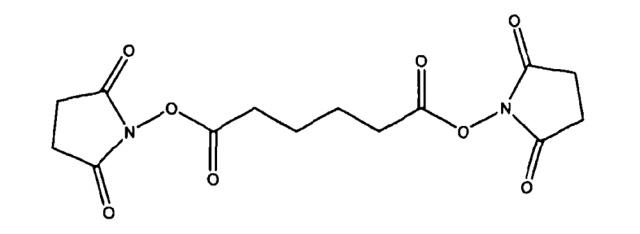
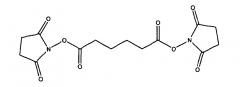
Связывание через линкерную группу можно осуществить с использованием любой известной процедуры, например процедур восстановительного аминирования, описанных выше. В одном варианте воплощения можно использовать бифункциональный линкер с получением первой группы для связывания с альдегидной группой в окисленном сахаридном остатке, и второй группы для связывания с носителем. Например, можно использовать бифункциональный линкер формулы X1-L-X2, где X1 может взаимодействовать с альдегидом; X2 может взаимодействовать с носителем; и L представляет собой связывающую группу в линкере. Типичная X1 группа представляет собой группу амина. Типичные L группы представляют собой алкильные группы с прямой цепью, содержащие от 1 до 10 атомов углерода (например, C1, C2, C3, C4, C5, C6, C7, C8, C9, С10), например -(CH2)4- или -(CH2)3-. В другом варианте воплощения можно использовать бифункциональный линкер с получением первой группы для связывания с группой амина, образованной из альдегидной группы, в окисленном сахаридном остатке (например, путем восстановительного аминирования, как описано выше), и второй группы для связывания с носителем (типично для связывания с амином в носителе). Например, можно использовать гомобифункциональный линкер формулы X-L-X, где две X группы являются одинаковыми и могут взаимодействовать с аминами; и где L представляет собой связывающую группу в линкере. Типичная X группа представляет собой N-оксисукцинимид. L типично имеет формулу -L'-L2-L'-, где L' представляет собой карбонил. Типичные L2 группы представляют собой алкильные группы с прямой цепью, содержащие от 1 до 10 атомов углерода (например, C1, C2, C3, C4, Cs, C6, C7, C8, C9, C10), например -(CH2)4-. Типичный линкер, таким образом, представляет собой N-гидроксисукцинимидный диэфир адипиновой кислоты (SIDEA):
Другие X группы представляют собой такие, которые образуют сложные эфиры при сочетании с HO-L-OH, такие как норборан, п-нитробензойная кислота и сульфо-N-гидроксисукцинимид. Следующие бифункциональные линкеры, которые являются реакционно-способными с аминами, для использования с настоящим изобретением включают акрилоилгалогениды (например, хлорид) [65], галогенацилгалогениды [66], дисукцинимидилглутарат, дисукцинимидилсуберат, этиленгликоль бис[сукцинимидилсукцинат] и т.п.
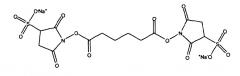
Линкер, как правило, добавляют в молярном избытке к полисахариду. Взаимодействие линкер/полисахарид, как правило, осуществляют в апротонном растворителе (например, DMSO, этилацетат и т.п.), поскольку линкеры обычно нерастворимы в воде. Однако когда используют водорастворимые линкеры, тогда подходящими являются большое количество различных растворителей, включая протонные растворители, такие как вода. Подходящие линкеры включают сульфонированные формы, такие как сульфонированные SIDEA:
Когда используют линкер, конъюгат будет включать линкерную группу. Эта группа не образуется ни в полисахариде, ни в носителе, но представляет собой третью молекулу, используемую в процессе получения конъюгата, и ее легко отличить как от полисахарида, так и белка-носителя в конечном конъюгированном продукте. Линкерная группа может включать атомы, такие как углерод, водород, кислород и/или азот. Линкеры, которые включают углерод и водород, являются типичными, и также типично используют линкеры, которые дополнительно включают кислород и/или азот. Линкеры, которые включают атомы азота, могут включать атом углерода, связанный с атомом азота, который, в свою очередь, связан со вторым атомом углерода (-C-N-C-). Линкеры, которые включают атом кислорода, типично включают его как часть карбонильной группы. Линкерные группы с молекулярной массой в пределах 30-500 Да являются типичными. Линкеры, содержащие две карбонильные группы, также являются типичными.
Особенно полезная линкерная группа представляет собой -NH-C(О)-(CH2)n-C(О)-, где n имеет значение 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. Типично значение n равно 4. Концевая группа -NH- в этом линкере обычно связана с атомом углерода из полисахаридной части. Концевая группа -C(O)- обычно связана с атомом азота в аминокислотной боковой цепи в носителе. Предпочтительную линкерную группу удобным образом можно ввести способом, включающим: восстановительное аминирование альдегида в окисленном сахаридном остатке; взаимодействие полученной -NH2 группы с бифункциональным линкером, который представляет собой диэфир (например, дисукцинимидиловый эфир) диовой кислоты (например, адипиновой кислоты, HOOC-(CH2)4-COOH); и восстановительное аминирование продукта (см. Фиг. 6 [64]).
Другие химические приемы, которые можно использовать для присоединения линкера к -NH2 группе в полисахариде, включают:
- акрилоилирование (например, путем взаимодействия с акрилоилхлоридом), с последующим присоединением по методу Михаэля либо к ε-ΝΗ2 аминокислотной боковой цепи, либо к -SH цистеиновой боковой цепи [65]. Полученный линкер представляет собой -NH-C(О)-(CH2)2- (пропионамидо).
- взаимодействие с галогенацилгалогенидом, с последующим взаимодействием с ε-ΝΗ2 аминокислотной боковой цепи или с -SH цистеиновой боковой цепи [66]. Линкер представляет собой -NH-C(О)-CH2-.
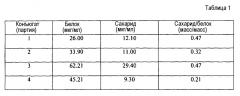
Конъюгаты с отношением полисахарид:белок (масс./масс.) в пределах от 1:20 (т.е. избыток белка) до 20:1 (т.е. избыток полисахарида) типично получают способом по настоящему изобретению. Отношения в пределах от 1:10 до 1:1 являются предпочтительными, в частности отношения в пределах от 1:5 до 1:2, и наиболее предпочтительно около 1:3. В отличие от этого, конъюгаты капсульного полисахарида типа 5 и типа 8, полученные способами предшествующего уровня техники, имеют тенденцию к более высоким отношениям, например в пределах от 0,73:1 до 1,08:1 в ссылочных документах 1, 2 и 3. В конкретных вариантах воплощения настоящего изобретения отношение полисахарид:белок (масс./масс.) для капсульного полисахаридного конъюгата типа 5 находится в пределах от 1:10 до 1:2; и/или отношение полисахарид:белок (масс./масс.) для капсульного полисахаридного конъюгата типа 8 находится в пределах от 1:5 до 7:10.
Композиции могут включать небольшое количество свободного носителя [67]. Когда данный белок-носитель присутствует как в свободной, так и конъюгированной форме в композиции по настоящему изобретению, неконъюгированная форма предпочтительно составляет не более чем 5% от общего количества белка-носителя в композиции в целом, и более предпочтительно присутствует в количестве менее чем 2% масс.
После конъюгации свободные и конъюгированные полисахариды можно разделить. Существует множество подходящих способов, включая гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.п. [см. также ссылочные документы 68 и 69 и т.п.].
Сочетания конъюгатов и других антигенов
Помимо обеспечения индивидуальных конъюгатов, описанных выше, изобретение обеспечивает композицию, включающую конъюгат по настоящему изобретению и один или более дополнительных антигенов. Композиция типично представляет собой иммуногенную композицию.
Дополнительный антиген (антигены) может включать дополнительные конъюгаты по настоящему изобретению, и, таким образом, изобретение обеспечивает композицию, включающую более чем один конъюгат по настоящему изобретению. В частности, настоящее изобретение обеспечивает композицию, включающую конъюгат капсульного полисахарида типа 5 по настоящему изобретению и конъюгат капсульного полисахарида типа 8 по настоящему изобретению. Альтернативно, дополнительный антиген (антигены) может представлять собой конъюгаты капсульного полисахарида типа 5 или типа 8, полученные способами, отличными от способов, раскрытых в настоящем изобретении, например, способами, раскрытыми в ссылочных документах 1-13 выше. Дополнительный антиген (антигены) может также представлять собой конъюгаты капсульного полисахарида типа 5 или типа 8, полученные способами, раскрытыми в ссылочных документах 59, 70, 71, 72, 73, и 74, и, в частности, способами, проиллюстрированными в этих документах. Соответственно, изобретение обеспечивает композицию, включающую конъюгат капсульного полисахарида типа 5 и конъюгат капсульного полисахарида типа 8, где один из конъюгатов (конъюгат типа 5 или конъюгат типа 8) представляет собой конъюгат по настоящему изобретению, а другой конъюгат не является конъюгатом по настоящему изобретению.
Дополнительный антиген (антигены) может включать другие антигены S.aureus, включая белковый и сахаридный антигены, описанные ниже.
Дополнительный антиген (антигены) может включать антигены из не относящихся к S.aureus патогенов. Таким образом, композиции по настоящему изобретению дополнительно могут включать один или более отличных от S.aureus антигенов, включая дополнительные бактериальные, вирусные или паразитические анти