Лечение фармакологически индуцированной гипохлоргидрии
Иллюстрации
Показать всеГруппа изобретений относится к медицине и предназначена для лечения гиперпролиферативных заболеваний и повышения биодоступности препарата для лечения гиперпролиферативного заболевания. Пациентам, принимающим одновременно снижающие кислотность средства, такие как ингибиторы протонной помпы, и ингибитор PI3K, соединение GDC-0941, на фоне этого лечения назначают препараты для повторной ацидификации. Группа изобретений позволяет улучшить биодоступность GDC-0941. 2 н. и 8 з.п. ф - лы, 10 ил., 1 табл., 7 пр.
Реферат
Ссылки на родственные заявки
По настоящей заявке, поданной по статье 37 CFR §1.53(b), заявлен приоритет по статье 35 USC §119(e) в соответствии с предварительной заявкой на выдачу патента США с серийным №61/546814, поданной 13 октября 2011 г., которая включена в настоящий документ посредством ссылки во всей полноте.
Область техники
Настоящее изобретение относится к способам применения соединения-ингибитора PI3K, GDC-0941, для лечения злокачественной опухоли.
Уровень техники
Желудок представляет собой большой орган, который может быть разделен на 3 основные зоны, участвующие в переваривании пищи и стерилизации жидкостей и воды. Функциональный процесс желудка обычно подразделяют на две зоны: верхний желудок и нижний желудок. Верхний желудок, состоящий из дна и верхней части, характеризуется низкой частотой длительных сокращений, которые ответственны за создание базального давления в желудке. Эти тонические сокращения также создают градиент давления от желудка к тонкому кишечнику и отвечают за опорожнение желудка. Проглатывание пищи и происходящее впоследствии растяжение желудка действуют с торможением сокращения этого участка, что позволяет желудку быстро увеличиться с формированием большого резервуара без значительного повышения давления. Нижний желудок участвует в измельчении и разжижении пищи посредством секреции HCl из париетальных клеток, обнаруживаемых в этой секции желудка.
Образование концентрированной 0,16 н. хлористоводородной кислоты париетальными клетками млекопитающего включает комплексную комбинацию нейрональных и гормональных регуляторных петель обратной связи (Hersey S J, Sachs G. Gastric acid secretion. Physiol Rev 1995; 75:155-189; Sachs G, Prinz C, Loo D, Bamberg K, Besancon M, Shin J M. Gastric acid secretion: activation and inhibition. Yale J Biol Med 1994; 67:81-95; Sachs G. Physiology of the parietal cell and therapeutic implications. Pharmacotherapy 2003; 23:68 S-73S). После активации клетки происходит комплексный клеточный перенос ионов, который обеспечивает образование кислоты (Horie S, Yano S, Watanabe K. Effects of drugs acting on Cl(-)-. Eur J Pharmacol 1992; 229:15-19; Helander H F, Keeling D J. Cell biology of gastric acid secretion. Baillieres Clin Gastroenterol 1993; 7:1-21; Soumarmon A, Lewin M J. Gastric (H+,K+)-ATPase. Biochimie 1986; 68:1287-1291; Wolfe M M, Welage L S, Sachs G. Proton pump inhibitors and gastric acid secretion. Am J Gastroenterol 2001; 96:3467-3468). Нарушение любого из этих компонентов (секреторных рецепторов или переносчиков ионов) может привести либо к прекращению секреции кислоты, либо к гиперсекреции кислоты. Что касается последнего, то свыше 30 миллионов пациентов в год страдают от симптомов заболеваний, связанных с кислотой, при этом их число с каждым годом возрастает (Aihara Т, Nakamura Е, Amagase K, Tomita K, Fujishita Т, Furutani K, Okabe S. Pharmacological control of gastric acid secretion for the treatment of acid-related peptic disease: past, present, and future. Pharmacol Ther 2003; 98:109-127; Gardner J D, Sloan S, Miner P B, Robinson M. Meal-stimulated gastric acid secretion and integrated gastric acidity in gastro-oesophageal reflux disease. Aliment Pharmacol Ther (2003) 17:945-953; Williams J L. Gastroesophageal reflux disease: clinical manifestations. Gastroenterol Nurs (2003) 26:195-200; Lehmann F, Hildebrand P, Beglinger C. New molecular targets for treatment of peptic ulcer disease. Drugs (2003) 63:1785-1797). Клинически неконтролируемое высвобождение или непрерывная гиперсекреция кислоты может привести к изменениям как желудочного, так и кишечного эпителия, а в более серьезных случаях может вызвать эрозии пищевода, которые могут привести к развитию метаплазии и к летальному исходу (Brzozowski Т, Konturek Р С, Konturek S J, Drozdowicz D, Kwiecien S, Pajdo R, Bielanski W, Hahn E G. "Role of gastric acid secretion in progression of acute gastric erosions induced by ischemia-reperfusion into gastric ulcers." Eur J Pharmacol 2000; 398:147-158; Franzin G, Manfrini C, Musola R, Rodella S, Fratton A. "Chronic erosions of the stomach-a clinical, endoscopic and histological evaluation." Endoscopy 1984; 16:1-5; Raugstad T S, Svanes K, Ulven A, Molster A. "Interaction between acute gastric ulcer and epinephrine-induced mucosal erosions in the rat: the significance of gastric acid secretion." Digestion 1979; 19:70-72). При попытках разработки терапевтических подходов для предотвращения гиперсекреции кислоты в последние года был применен ряд подходов, среди которых два оказались наиболее успешными: а) ингибирование гистаминового рецептора на базолатеральной мембране париетальных клеток, b) специфичные по отношению к протонной помпе лекарственные средства, нацеленные на Н+/K+-АТФаза, так называемые ингибиторы протонной помпы, «PPI» (Bell N J, Hunt R H. Progress with proton pump inhibition. Yale J Biol Med 1992; 65:649-657; Garnett W R. Lansoprazole: a proton pump inhibitor. Ann Pharmacother 1996; 30:1425-1436; Robinson M. Drugs, bugs, and esophageal pH profiles. Yale J Biol Med 1999; 72:169-172). Оба терапевтических подхода существенно улучшали качество жизни пациентов, страдающих от данного заболевания, однако, число пациентов, испытывающих рецидив заболевания на фоне приема лекарственных средств, постоянно возрастает (Tutuian R, Katz Р О, Castell D О. "Nocturnal acid breakthrough: pH, drugs and bugs." Eur J Gastroenterol Hepatol 2004; 16:441-443; Adachi K, Komazawa Y, Fujishiro H, Mihara T, Ono M, Yuki M, Kawamura A, Karim Rumi M A, Amano Y, Kinoshita Y. "Nocturnal gastric acid breakthrough during the administration of rabeprazole and ranitidine in Helicobacter pylori-negative subjects: effects of different regimens." J Gastroenterol 2003; 38:830-835). Несмотря на высокую степень эффективности и клиническое применение, во всем мире сообщалось о несостоятельности лечения заболеваний, связанных с кислотой, и для пациентов важны степень и скорость купирования симптомов (Kleinman L, Mcintosh Е, Ryan М, Schmier J, Crawley J, Locke G R, III, De L G. Willingness to pay for complete symptom relief of gastroesophageal reflux disease. Arch Intern Med 2002; 162:1361-1366). По оценкам приблизительно у 30% пациентов с GERD сохраняются симптомы на фоне стандартной дозы PPI (Carlsson R, Galmiche J Р, Dent J, Lundell L, Frison L. Prognostic factors influencing relapse of oesophagitis during maintenance therapy with antisecretory drags: a meta-analysis of long-term omeprazole trials. Aliment Pharmacol Ther 1997; 11:473-482). При терапевтических пероральных дозах PPI достигают равновесного состояния и, следовательно, максимальный уровень их эффективности достигается через 4-5 суток при типичных режимах дозирования (Tytgat G N. Shortcomings of the first-generation proton pump inhibitors. Eur J Gastroenterol Hepatol 2001; 13 Suppl 1:S29-S33). Такое медленное и кумулятивное нарастание эффекта PPI связано с их способностью ингибировать только те помпы, которые активны при наличии доступного лекарственного средства PPI. После введения PPI наблюдается возобновление секреции кислоты, которое частично обусловлено синтезом фермента de novo ((Gedda K, Scott D, Besancon M, Lorentzon P, Sachs G. "Turnover of the gastric H+,K(+)-adenosine triphosphatase alpha subunit and its effect on inhibition of rat gastric acid secretion." Gastroenterology 1995; 109:1134-1141).
Желудочная кислота способствует перевариванию белков, облегчает абсорбцию железа, кальция и витамина В12 и предотвращает избыточный рост бактерий. Когда содержание кислоты и протеолитических ферментов преодолевают защитные механизмы слизистой, развиваются язвы. Во избежание повреждений, ассоциированных с такими жесткими условиями, желудочная кислота должна точно регулироваться перекрыванием нервных (например, ацетилхолин), гормональных (например, гастрин и грелин) и паракринных (например, гистамин и соматостатин) путей, и, как стало известно в последнее время, посредством чувствительного к кальцию рецептора. Любые длительные изменения в любом из данных регуляторных путей вызывают разрушение клеток и тканей и клинические проявления, такие как пептическая язвенная болезнь или гастроэзофагеальная рефлюксная болезнь (GERD). Для лечения избыточной продукции кислоты обычно применяются два способа: a) хирургический, путем удаления нейронального элемента (ваготомия), или b) фармакологический, с помощью или антагонистов гистаминового рецептора 2 (H2RA), или ингибиторов протонного помпы (PPI), или комбинации обоих.
Ингибиторы протонного помпы (PPI), такие как омепразол (PRILOSEC®, AstraZeneca), необратимо ингибируют желудочную Н+/K+-АТФазу. Омепразол, рабепразол (ACIPHEX®, Janssen-Cilag) и лансопразол (PREVACID®, Novartis) связываются с множественными остатками цистеина на экзофациальной или люминальной поверхности Н+/K+-АТФазы и активируются в кислотной полости желудочной железы. В покоящейся клетке секретирующие кислоту помпы интернализированы в систему трубчатых везикул и находятся в таком конформационном состоянии, что PPI могут ингибировать только Н+/K+-АТФазы, которые уже были активированы и перенесены на апикальную поверхность париетальной клетки. PPI уменьшают секрецию желудочной кислоты, в том числе секрецию кислоты в дне (путем ингибирования вакуолярной Н+-АТФазы или Н+/K+-АТФазы) и в верхнем отделе желудка (путем ингибирования Н+/K+-АТФазы), что таким образом повышает pH желудка во время фазы покоя, а также сокращает длительность высвобождения желудочной кислоты во время фазы стимуляции секреции. PPI применимы для лечения ряда состояний, включая диспепсию, гастроэзофагеальную рефлюксную болезнь (GERD), неэрозивную рефлюксную болезнь (NERD), синдром Золлингера-Эллисона (синдром ЗЭ), язвенную болезнь и злокачественную опухоль желудка; они также предотвращают или снижают вероятность развития язвенной болезни (WO 2009/017624). Как правило, ингибиторы протонной помпы хорошо переносятся, и частота возникновения кратковременных нежелательных эффектов относительно низкая. Резкое изменение рН и содержания желудочной кислоты в кишечнике, вызванное ингибиторами протонной помпы, может повлиять на биодоступность и абсорбцию перорально применяемых терапевтических средств. Поскольку организм использует желудочную кислоту для высвобождения витамина В12 из частиц пищи, при длительном применении ингибиторов протонной помпы может произойти снижение абсорбции витамина B12, что может вызвать дефицит витамина B12. PPI, включая эзомепразол (NEXIUM®, AstraZeneca), лансопразол, омепразол, декслансопразол, пантопразол и рабепразол, являются наиболее часто выписываемыми лекарственными препаратами в Северной Америке и Западной Европе и оптимальными препаратами для паллиативного купирования симптомов гастроэзофагеальной рефлюксной болезни (GERD), возникающих у пациентов как с эрозивным, так и с неэрозивным эзофагитом, для лечения и предотвращения пептической язвенной болезни, а также у многих пациентов с неязвенной диспепсией (Targownik, L.Е., С. Metge, et al. (2007). "The prevalence of and the clinical and demographic characteristics associated with high-intensity proton pump inhibitor use." Am J Gastroenterol 102(5): 942-50). PPI представляют собой наиболее широко используемые терапевтические средства, снижающие кислотность желудочного сока, поскольку была продемонстрирована их полная безопасность, и, в сущности, они заменили антагонистов гистаминовых Н2-рецепторов (H2RA) и другие снижающие кислотность средства для лечения большинства хронических показаний по причине их ощутимых преимуществ, в том числе их пролонгированного фармакологического эффекта (Yang, Y.X., S. Hennessy, et al. (2007). "Chronic proton pump inhibitor therapy and the risk of colorectal cancer." Gastroenterology 133(3):748-54).
Многие пациенты с онкологическими заболеваниями пользуются терапевтическими средствами, снижающими кислотность желудочного сока, такими как PPI, антагонист Н2-рецепторов или антацид для нарушений со стороны желудка. Антагонисты Н2-рецепторов (H2-RA) включают в себя циметидин (TAGAMET®, GlaxoSmithKline), фамотидин (PEPCID®, Johnson & Johnson/Merck), низатидин (TAZAC®, AXID®, Eli Lilly) и ранитидин (ZANTAC®, Boehringer-Ingelheim). Антациды в своем составе, как правило, содержат гидроксид/карбонат алюминия, гидроксид/карбонат кальция, субсалицилат висмута или другие буферные соли. Большинство пациентов со злокачественными опухолями, принимающих участие в клинических испытаниях, принимают 6-14 лекарственных средств, отпускаемых по рецепту, помимо тестируемого препарата (Т.L. Jorgensen, J. Hallas, и J. Herrstedt. "Polypharmacy in elderly cancer patients", American Society of Clinical Oncology (2010) Chicago, IL: Journal of Clinical Oncology). В частности, многие пациенты в течение некоторого периода получают ту или иную форму лекарственного средства, снижающего кислотность желудочного сока, для лечения побочных эффектов со стороны желудочно-кишечного тракта, таких как гастроэзофагеальная рефлюксная болезнь (GERD), диспепсия или гастрит, часто ассоциированных с противораковой терапией. pH кишечника влияет на биодоступность некоторых перорально вводимых терапевтических средств. Растворимость и проницаемость являются важными детерминантами фармакокинетики (РК) и абсорбции лекарственного средства (Amidon et al (1995) Pharm. Res. 12:413; Wu and Benet (2005) Pharm. Res. 22:11) наряду с потреблением пищи, ахлоргидрией и хирургической резекцией ЖКТ. Один из факторов, наиболее значимо влияющих на меж- и внутрисубъектную вариабельность фармакокинетических параметров, действует во время процесса абсорбции лекарственного средства. Оцененная межсубъектная вариабельность скорости абсорбции Kabs варьирует от 40 до >100% с вариабельностью между событиями (IOV) иногда в диапазоне 40-60% (Sparreboom, А. и J. Verweij, Advances in cancer therapeutics. Clin Pharmacol Ther, 2009. 85(2): p. 113-7; Undevia, S.D., G. Gomez-Abuin, и M.J. Ratain, Pharmacokinetic variability of anticancer agents. Nat Rev Cancer, 2005. 5(6): p. 447-58). Вероятно, в вариабельности абсорбции лекарственного средства играют роль метаболизм «первого прохода» и транспорт лекарственного средства (Wienkers, L.C. и T.G. Heath, "Predicting in vivo drug interactions from in vitro drug discovery data", Nat Rev Drug Discov, 2005. 4(10): p. 825-33; Giacomini, K.M., et al., "Membrane transporters in drug development", Nat Rev Drug Discov. 9(3): p. 215-36).
Намеченный фармакологический эффект снижающих кислотность желудочного сока средств по отношению к повышению pH в желудке может оказывать значительное влияние на растворение лекарственного средства, абсорбцию и фармакокинетику перорально вводимых противораковых терапевтических средств, растворимость которых зависит от pH (Duong, S. and М. Leung "Should the concomitant use of erlotinib and acid-reducing agents be avoided? The drug interaction between erlotinib and acid-reducing agents", J Oncol Pharm Pract; Eley, Т., F.R. Luo, et al. (2009). "Phase I study of the effect of gastric acid pH modulators on the bioavailability of oral dasatinib in healthy subjects", J Clin Pharmacol 49(6): 700-9; Bergman et al (2007) "Pharmacokinetics of gefitinib in humans: the influence of gastrointestinal factors", Intl. J. Pharm. 341:134-142; Sparano et al (2009) "Effect of antacid on imatinib absorption", Cancer Chemother. Pharmacol. 63:525-528). Уменьшение значений общей экспозиции перорально вводимого противоракового терапевтического средства может нарушить фармакодинамический эффект и/или вызвать длительную устойчивость к нескольким лекарственным средствам, что тем самым влияет на исходы у пациента.
Большинство (приблизительно 70%) одобренных перорально вводимых противораковых лекарственных средств, являющихся малыми молекулами, характеризуются зависимой от pH растворимостью. Следовательно, пероральная биодоступность таких лекарственных средств может быть подвержена значительному влиянию вследствие ограниченных поглощения и абсорбции в кишечнике при более высоких значениях pH при совместном введении со снижающими кислотность средствами. Такие зависимые от pH эффекты в отношении экспозиции наиболее выражены для лекарственных средств, которым свойственна экспоненциально снижающаяся в зависимости от pH растворимость, и когда максимальная доза не растворяется в 250 мл воды при более высоких значениях pH (выше желудочных значений pH 1-2). Например, было показано, что повышение pH в желудке приводило к значительному снижению значений экспозиции дазатиниба (SPRYCEL®, Bristol-Myers), гефитиниба, эрлотиниба и нилотиниба (Budha NR, Frymoyer A, Smelick GS, et al. (2012) Drug absorption interactions between oral targeted anticancer agents and PPIs: Is pH-dependent solubility the Achilles heel of targeted therapy? Clinical pharmacology and therapeutics; 92:203-213). Несмотря на то, что потенциальное влияние сопутствующей терапии, снижающей кислотность желудочного сока, на эффективность этих одобренных лекарственных средств не было четко определено, можно выдвинуть гипотезу о том, что измененная растворимость лекарственного средства и последующее снижение экспозиции лекарственного средства могут быть фактором, участвующим в развитии приобретенной устойчивости к лекарственному средству.
Гипохлоргидрия или ахлоргидрия представляет собой состояние, характеризуемое патологически низким содержанием хлористоводородной кислоты в желудке и в большинстве случаев являющееся результатом желудочной атрофии. Желудочная атрофия может быть вызвана различными патофизиологическими состояниями, наиболее распространенным из которых является острый гастрит, вызванный инфекцией Helicobacter pylori. Гипохлоргидрия или ахлоргидрия также чаще наблюдается в пожилом возрасте. Менее распространенные причины включают в себя антрэктомию с ваготомией по поводу пептической язвенной болезни и субтотальную гастрэктомию по поводу злокачественной опухоли.
Предсказуемая пероральная доставка целевых ингибиторов киназного пути остается неудовлетворенной медицинской потребностью. Большинство пациентов со злокачественными опухолями получает ряд лекарственных средств, которые изменяют pH желудка, опорожнение желудка и/или моторику ЖКТ. Приблизительно 10% взрослого населения в США получает PPI, и по оценкам онкологов, 20-100% пациентов со злокачественными опухолями могут принимать PPI с целью контроля паллиативных симптомов, ассоциированных с гастроэзофагеальной рефлюксной болезнью (GERD). Распространенность снижающих кислотность средств в популяциях с различными злокачественными опухолями была определена с использованием эпидемиологического подхода. Были задействованы две большие репрезентативные базы данных здравоохранения: ретроспективный кросс-секционный анализ с использованием информационной системы MarketScan (N=1776443) и базы данных Медицинского центра ветеранов (VA, N=1171833). Злокачественную опухоль определяли как ≥2 по специальным кодам Калифорнии ICD-9-CM в течение 180 суток и с интервалом ≥1 день. Записи пациентов с октября 1999 г. по январь 2011 г. и с января 1999 г. по июнь 2009 г. анализировали по базам данных VA и MarketScan соответственно. Назначения и повторные назначения снижающих кислотность средств (ARA) идентифицировали от 1 месяца и до 6 месяцев после индексной даты злокачественной опухоли. Общая распространенность снижающих кислотность средств у пациентов со злокачественными опухолями составляла 20% и 33% по базам данных MarketScan и VA соответственно. Повышение pH в желудке может оказывать существенное влияние на растворимость/растворение лекарственного средства и его проницаемость, тем самым влияя на абсорбцию лекарственного средства, прогнозируемую системную экспозицию и ответ пациента. Повторная ацидификация полости желудка после лечения PPI может временно преодолевать pH-опосредованные лекарственные взаимодействия (DDI) и повышать значения экспозиции (AUC/Cmax), что приводит к желаемому терапевтическому исходу.
Сущность изобретения
Настоящее изобретение относится к способам лечения фармакологически индуцированной гипохлоргидрии у пациентов со злокачественными опухолями с помощью соединения для повторной ацидификации.
Способы в соответствии с настоящим изобретением охватывают пути введения, дозирование, схемы и терапевтические режимы.
Пациенты со злокачественными опухолями, получающие лечение ингибитором PI3K GDC-0941, 4-(2-(1Н-индазол-4-ил)-6-((4-(метилсульфонил)пиперазин-1-ил)метил)тиено[3,2-d]пиримидин-4-ил)морфолином (регистрационный № CAS 957054-30-7), которые также принимают снижающее кислотность желудочного сока терапевтическое средство, такое как ингибитор протонной помпы, антагонист H2-рецептора или антацид, в дальнейшем получают лечение соединением для повторной ацидификации для улучшения биодоступности GDC-0941 путем повышения кислотности желудка и снижения pH в желудке.
Способы в соответствии с настоящим изобретением включают такие, при которых структуру модели PK/PD, описывающую эффекты снижающего кислотность желудочного сока терапевтического средства в отношении фармакокинетики GDC-0941, устанавливают на основе клинических данных. Способы включают такие, при которых стимуляция PK/PD в комбинации с биомаркером продукции желудочной кислоты с использованием установленной модели PK/PD может быть использована для прогнозирования эффектов снижающего кислотность желудочного сока терапевтического средства с кислотной повторной ацидификацией на фармакокинетику GDC-0941, оптимизирования дизайна клинических испытаний, обеспечения пациентов индивидуальными рекомендациями по дозированию и прогнозированию РК профиля субстрата у пациентов с варьирующими значениями pH желудка (например, при GERD).
Краткое описание чертежей
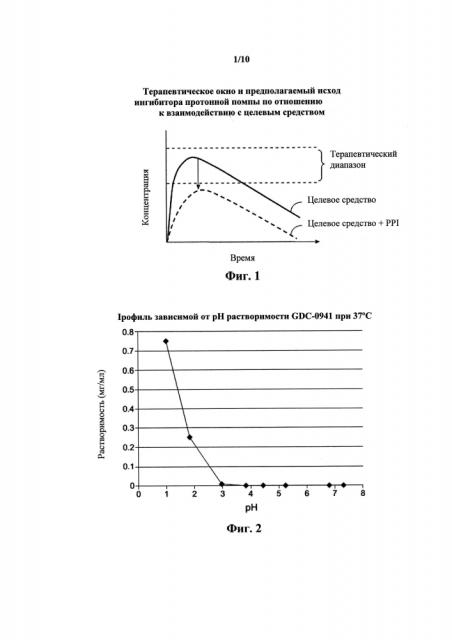
На фиг. 1 показаны терапевтическое окно и ожидаемый исход взаимодействия PPI с целевым средством.
На фиг. 2 показана кривая зависимой от pH растворимости GDC-0941, 4-(2-(1H-индазол-4-ил)-6-((4-(металсульфонил)пиперазин-1-ил)метил)тиено[3,2-е]пиримидин-4-ил)морфолино, при 37°С.
На фиг. 3 показано улучшенное растворение GDC-0941 in vitro в присутствии бетаина-HCl.
На фиг. 4 показано, что повторная ацидификация бетаином-HCl у собак улучшает фармакокинетику GDC-0941.
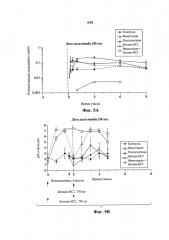
На фиг. 5 показаны эффекты на биодоступность дазатиниба (фиг. 5А и 5С) и pH желудка (фиг. 5В) у собак, предварительно получивших фамотидин или пентагастрин, и эффекты бетаина-HCl.
На фиг. 6 показано, что рабепразол (PPI) существенно снижает AUC и Стах GDC-0941 натощак и после еды у здоровых волонтеров.
На фиг. 7 показано, что рабепразол (PPI) существенно снижает AUC GDC-0941 у пациентов со злокачественными опухолями в фазе I.
На фиг. 8 показана улучшенная экспозиция (AUC) дазатиниба после повторной ацидификации бетаином-HCl у здорового волонтера с индуцированной рабепразолом гипохлоргидрией при мониторинге рН с помощью капсулы Гейдельберга.
На фиг. 9 показана обратимость фармакологически индуцированной гипохлоргидрии после повторной ацидификации бетаином-HCl (BHCl) у здоровых волонтеров с индуцированной рабепразолом гипохлоргидрией.
На фиг. 10 показана количественная фармакологическая модель фармакокинетики/фармакодинамики (PK/PD) GDC-0941 и дазатиниба.
Подробное описание изобретения
Если не указано иное, используемые в настоящем документе технические и специфические термины имеют такое же значение, которое является общепринятым среди специалистов в области, к которой принадлежит настоящее изобретение, и согласуются с нижеприведенными определениями.
Определения
Используемые в данном описании и формуле изобретения слова «содержать», «содержащий», «включать в себя», «включающий в себя» и «включает в себя» предназначаются для указания наличия заявленных признаков, целых чисел, компонентов или стадий, но они не исключают наличие или добавление одного или нескольких других признаков, целых чисел, компонентов, стадий или их групп.
Термин «соединение для повторной ацидификации» относится к соединению, вводимому пациенту, получающему терапию, снижающую кислотность желудочного сока, во время лечения объектным лекарственным средством, таким как GDC-0941, которое улучшает биодоступность объектного лекарственного средства. Типичные соединения для повторной ацидификации включают в себя без ограничения бетаин-HCl, цитрат бетаина и другие соли бетаина, а также глутаминовой кислоты гидрохлорид (ACIDULIN®, Eli Lilly) и другие соли глутаминовой кислоты.
Термины «лечить» и «лечение» относятся как к терапевтическому лечению, так и к профилактическим или превентивным мерам, целью которых является предотвращение или замедление (уменьшение) нежелаемого физиологического изменения или нарушения, такого как рост, развитие или распространение гиперпролиферативного состояния, такого как злокачественная опухоль. Для целей настоящего изобретения положительные или желаемые клинические результаты включают в себя без ограничения ослабление симптомов, снижение степени заболевания, стабилизацию (т.е. отсутствие ухудшения) состояния заболевания, задержку или замедление прогрессирования заболевания, облегчение или ослабление течения заболевания и ремиссию (частичную или полную), выявляемые или невыявляемые. Термин «лечение» может также означать удлинение выживаемости по сравнению с ожидаемой выживаемостью без получаемого лечения. Нуждающиеся в лечении включают в себя лица с уже имеющимся состоянием или нарушением, а также лица, подверженные развитию такого состояния или нарушения, или лица, у которых состояние или нарушение необходимо предотвратить.
Фраза «терапевтически эффективное количество» означает количество соединения в соответствии с настоящим изобретением, которое (i) лечит конкретное заболевание, состояние или нарушение, (ii) подавляет, облегчает или устраняет один или нескольких симптомов конкретного заболевания, состояния или нарушения или (iii) предотвращает или замедляет начало развития одного или нескольких симптомов конкретного заболевания, состояния или нарушения, описанных в настоящем документе. В случае злокачественной опухоли терапевтически эффективное количество лекарственного средства может уменьшать число злокачественных клеток; уменьшать размер опухоли; ингибировать (т.е. до некоторой степени замедлять и предпочтительно останавливать) инфильтрацию злокачественных клеток в периферические органы; ингибировать (т.е. до некоторой степени замедлять и предпочтительно останавливать) образование опухолевых метастазов; ингибировать до некоторой степени рост опухоли и/или облегчать до некоторой степени один или несколько симптомов, ассоциированных со злокачественной опухолью. В зависимости от того, может ли лекарственное средство предотвращать рост и/или убивать существующие злокачественные клетки, оно может быть цитостатическим и/или цитотоксическим. Для терапии злокачественной опухоли эффективность может быть измерена, например, путем оценивания времени до прогрессирования заболевания (ТТР) и/или определением частоты ответа (RR).
Термины «злокачественная опухоль» и «злокачественный» относятся к физиологическому состоянию у млекопитающих, которое в типичном случае характеризуется неконтролируемым ростом клеток, или описывают таковое. Термин «опухоль» включает одну или несколько злокачественных клеток. Примеры злокачественной опухоли включают в себя без ограничения мезотелиому, карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные новообразования. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточную злокачественную опухоль (например, эпителиальную плоскоклеточную злокачественную опухоль), злокачественную опухоль легкого, в том числе мелкоклеточный рак легкого, немелкоклеточный рак легкого (NSCLC), аденокарциному легкого и плоскоклеточную карциному легкого, злокачественную опухоль брюшины, гепатоцеллюлярную злокачественную опухоль, злокачественную опухоль желудка, в том числе желудочно-кишечную злокачественную опухоль, злокачественную опухоль поджелудочной железы, глиобластому, злокачественную опухоль шейки матки, злокачественную опухоль яичника, злокачественную опухоль печени, злокачественную опухоль мочевого пузыря, гепатому, злокачественную опухоль молочной железы, злокачественную опухоль толстой кишки, злокачественную опухоль прямой кишки, колоректальную злокачественную опухоль, карциному эндометрия или матки, карциному слюнных желез, злокачественную опухоль почки, злокачественную опухоль предстательной железы, злокачественную опухоль вульвы, злокачественную опухоль щитовидной железы, карциному печени, карциному заднего прохода, карциному полового члена, а также злокачественную опухоль головы и шеи.
Термин «выживаемость без прогрессирования» (PFS) означает время от первых суток лечения до документально зарегистрированного прогрессирования заболевания (включая выделяемое прогрессирование в ЦНС) или летального исхода по любой причине, связанной с заболеванием во время исследования, в зависимости от того, что наступит раньше.
Термин «общая выживаемость» означает время от первых суток лечения до летального исхода по любой причине, связанной с заболеванием.
Термин «лимитирующая дозу токсичность» (DLT) определяется по снижению прогнозируемой диффузионной способности для монооксида углерода (DLCO) на ≥20 процентов (с поправкой на уровень гемоглобина и альвеолярный объем).
Используемый термин «листок-вкладыш» относится к инструкциям, прилагаемым обычно к коммерческим упаковкам терапевтических продуктов, которые содержат информацию о показаниях, использовании, дозировке, введении, противопоказаниях и/или предупреждениях относительно применения этих терапевтических продуктов.
Термин «нежелательное явление» (AE) означает любой неблагоприятный и непредвиденный признак, симптом или заболевание, связанное по времени с применением исследуемого (медицинского) продукта или другого предусмотренного протоколом вмешательства, независимо от взаимосвязи с таковым; и включает в себя: AE, не наблюдавшиеся ранее у пациента и возникшие во время предусмотренного протоколом периода отчетности по AE, в том числе признаки или симптомы, связанные со злокачественной опухолью молочной железы, которые отсутствовали до периода отчетности по AE; осложнения, возникающие в результате требуемых протоколом вмешательств (например, инвазивных процедур, таких как биопсия); если применимо, AE, возникающее до назначения исследуемого лечения, связанное с отмывочным периодом средства, вводным периодом до начала лечения или другим требуемым протоколом вмешательством; существовавшие ранее медицинские состояния (отличные от исследуемого состояния), которые, по мнению исследователя, ухудшились по тяжести или по частоте, либо изменились по характеру в течение предусмотренного протоколом периода отчетности по AE.
Нежелательное явление классифицируется как «серьезное нежелательное явление» (SAE), если оно соответствует следующим критериям: приводит к летальному исходу (т.е. AE действительно вызывает летальный исход или приводит к таковому); угрожает жизни (т.е. AE, по мнению исследователя, подвергает пациента непосредственному риску летального исхода, при этом не учитывается АЕ, которое в случае более тяжелой формы могло бы вызвать летальный исход); требует или удлиняет срок госпитализации; приводит к стойкой или существенной нетрудоспособности/инвалидности (т.е. AE приводит к существенному нарушению способности пациента осуществлять нормальную жизнедеятельность); приводит к врожденной патологии/врожденному пороку развития у новорожденного/грудного ребенка, мать которого подверглась воздействию исследуемого продукта; или считается значительным медицинским явлением, по мнению исследователя, основанному на медицинском заключении (например, может представлять угрозу для пациента или требовать медицинского/хирургического вмешательства для предотвращения одного из вышеперечисленных исходов). Все AE, которые не соответствуют какому-либо из критериев серьезности, считаются несерьезными AE. Термины «тяжелый» и «серьезный» не являются синонимами. Термин «тяжесть» (или «интенсивность») относится к степени конкретного AE, например легкий (1-й степени), умеренный (2-й степени) или тяжелый (3-й степени) инфаркт миокарда. «Серьезные» является регламентирующим определением (см. предыдущее определение) и основывается на исходе для пациента или явления, или на критериях принятых мер, как правило, связанных с явлениями, которые представляют угрозу для жизни или функционирования пациента. Термин «серьезность» (не «тяжесть») служит критерием для определения обязательств спонсора по регламентируемой отчетности перед соответствующими уполномоченными органами. Тяжесть и серьезность необходимо оценивать независимо при регистрации AE и SAE в eCRF.
Термины «гипохлоргидрия» и «ахлоргидрия» относятся к состояниям, при которых продукция желудочной кислоты в желудке низкая или отсутствует соответственно. Желудочная кислота представляет собой пищеварительную жидкость, образующуюся в желудке. Ее pH составляет приблизительно 1 до 2 и она состоит из хлористоводородной кислоты (HCl), приблизительно 0,5%, хлорида калия (KCl) и хлорида натрия (NaCl). Желудочная кислота играет ключевую роль в переваривании белков благодаря активации пищеварительных ферментов. Гипохлоргидрия и ахлоргидрия ассоциируются с различными медицинскими проблемами.
Бетаина гидрохлорид, так же известный как хлористоводородная соль триметилглицина, 2-триметиламминиоацетат, TMG, глицинбетаин, безводный бетаин и N,N,N-триметилглицин, имеет формулу [(СН3)3N+СН2СО2Н]+Cl- (регистрационный номер CAS 107-43-7).
Heidelberg рН Diagnostic System™ (Heidelberg Medical Incorporated, Mineral Bluff, GA) содержит фиксированный микроэлектронный капсульный высокочастотный передатчик, инкапсулированный внутри чехла из полиакрилата и сконструированный для глотания пациентом. Капсулу Heidelberg используют для измерения уровней pH в пищеварительном тракте и она способна проводить диагностику пациента, у которого может быть гипохлоргидрия, гиперхлоргидрия, ахлоргидрия, недостаточность привратника и интенсивное накопление слизи. По размеру капсула Heidelberg pH подобна витаминной капсуле, ее диаметр составляет 7,1 мм, а длина - 15,4 мм, что обеспечивает легкость ее проглатывания пациентом или экспериментальным животным.
Дазатиниб (SPRYCEL®, Bristol-Myers) представляет собой малую молекулу, являющуюся ингибитором киназы, и показан для лечения хронического миелоидного лейкоза. Безводное свободное основание дазатиниба имеет молекулярную массу 488,01 Да. Дазатиниб является свободным основанием с тремя константами ионизации: 3,1, 6,8 и 10,8. Растворимость дазатиниба в воде зависит от pH; растворимость экспоненциально снижается при увеличении pH выше нормального физиологического диапазона (Eley, Т., et al., Phase I study of the effect of gastric acid pH modulators on the bioavailability of oral dasatinib in healthy subjects. J Clin Pharmacol, 2009. 49(6): p. 700-9). Согласно данной публикации здоровые волонтеры перорально получали 50 мг дазатиниба дважды в сутки и однократную дозу фамотидина (антагонист H2-рецептора), равную 40 мг, за 10 часов до приема дазатиниба. Снижение биодоступности (AUC) на 61% определяли по измерению концентраций дазатиниба в образцах плазмы. Растворимость дазатиниба варьирует от ~18 мг/мл при pH 2,6, ~690 мкг/мл при pH 4,0, 205 мкг/мл при pH 4,28 до <1 мкг/мл при pH 7,0 при 24°С. Наиболее высокая коммерческая доза (140 мг) дазатиниба не растворима в 250 мл воды в диапазоне pH от 4,3 до 7,0 при 24°С. Биодоступность дазатиниба увеличивается при введении вместе с пищей. Однако повышение AUCinf при приеме вместе с пищей с высоким содержанием жиров (14%) и с низким содержанием жиров (21%) находится далеко за нижним пределом вариабельности AUCinf при приеме натощак и, следовательно, не считается клинически значимым.
Вариабельность экспозиции дазатиниба ранее изучали с использованием данных одного исследования фазы I и пяти исследований фазы II (Dai, G., et al., "Importance of characterizing determinants of variability in exposure: application to dasatinib in subjects with chronic myeloid leukemia." J Clin Pharmacol, 2008. 48(11): 1254-69). Межсубъектная вариабельность Ka превосходила 100%, тогда как межсубъектная вариабельность относительной биодоступности (FR) составляла 33%. Вариабельность FR между событиями (IOV) у одного субъекта, согласно оценкам, должна была составлять 44%. Применение PPI снижало FR дазатиниба на 17% (статистически незначимо). Подобным образом, антациды и H2-RA не оказывают какого-либо значимого эффекта на FR дазатиниба. Отсутствие эффекта снижающих кислотность средств на FR может быть обусловлено малым количеством субъектов (3 получали антациды, а 10-H2RA), недоступностью действительных временных точек дозирования для этих средств и взаимодействиями между несколькими лекарственными средствами (Dai, G., et al., "Importance of characterizing determinants of variability in exposure: application to dasatinib in subjects with chronic myeloid leukemia", J Clin Pharmacol, 2008. 48(11): p. 1254-69). Вследствие чрезвычайно высокой вариабельности абсорбции лекарственного средства, комплексной популяции пациентов и взаимодействий между несколькими лекарственными средствами сложно оценивать влияние PPI на абсорбцию дазатиниба с использованием неконтролируемых фармакокинетических дизайнов популяции в рамках более масштабного исследования. В рамках хорошо контролируемого перекрестного клинического фармакологического исследования с участием здоровых волонтеров эффект кислотно-супрессивной терапии на дазатиниб оценивали у 22 здоровых субъектов. Введение однократной 50 мг дозы дазатиниба через 10 часов после приема 40 мг фамотидина приводило к снижению как AUC0-12, так и Cmax дазатиниба на ~60% (Eley, Т., et al., "Phase I study of the effect of gastric acid pH modulators on the bioavailability of oral dasatinib in healthy subjects", J Clin Pharmacol, 2009. 49(6): p. 700-9). Напротив, экспозиция дазатиниба оставалась неизменной при введении антацида, содержащего гидроксиды алюминия/магния (Maalox®, 30 мл) за 2 часа до введения дазатиниба. Однако совместное введение дазатиниба с Maalox® приводило к снижению экспозиции дазатиниба на 55-58%. В другом исследовании эффект ингибитора протонной помпы омепразола, изучали по фармакокинетике 100 мг дазатиниба у 14 здоровых субъектов. Биодоступность дазатиниба была понижена на ~40% после 40 мг дозы омепразола ежесуточно на протяжении 4 суток. AUCinf и Cmax дазатиниба были снижены на 43% и 42% соответственно. В заключение сопутствующее применение антагонистов Н2, антацидов или ингибиторов протонной помпы с дазатинибом не рекомендуется, что упомянуто соответствующим образом в инструкции по медицинскому применению.
GDC-0941
GDC-0941 (Genentech Inc.) является селективным перорально биодоступным тиенопиримидиновым инги