Генная терапия нейродегенеративных нарушений
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Описан самокомплементарный аденоассоциированный вирусный вектор для лечения нарушений двигательных нейронов, таких как спинальная мышечная атрофия, боковой амиотрофический склероз, спинобульбарная мышечная атрофия, спиноцеребеллярная атаксия, первичный латеральный склероз и травматическое повреждение спинного мозга. Также описаны композиции и способы для лечения нарушений, влияющих на двигательную функцию, например двигательную функцию, на которую влияет заболевание или повреждение головного мозга и/или спинного мозга. Предложенная группа изобретений может быть использована в медицине. 7 н. и 9 з.п. ф-лы, 17 ил., 4 пр.
Реферат
Перекрестная ссылка на связанные заявки
По данной заявке испрашивается приоритет на основании 35 USC §119(e)(1) по предварительным заявкам США № 61/174/982, поданной 2 мая 2009 года, и 61/268059, поданной 8 июня 2009 года, которые включены в настоящий документ посредством ссылки в полном объеме.
Область техники
Настоящее изобретение главным образом относится к способам доставки генов. В частности, изобретение относится к композициям и способам для лечения нарушений, влияющих на двигательную функцию, такую как двигательная функция, затронутая заболеванием или повреждением головного и/или спинного мозга.
Описание изобретения
Генная терапия представляет собой перспективный способ лечения нарушений, которые влияют на центральную нервную систему (ЦНС). Генную терапию ЦНС облегчает разработка вирусных векторов, которые способны эффективно инфицировать постмитотические нейроны. Центральная нервная система состоит из спинного мозга и головного мозга. Спинной мозг проводит сенсорную информацию от периферической нервной системы к головному мозгу и проводит двигательную информацию от головного мозга к различным эффекторам. Обзор вирусных векторов для доставки генов в центральную нервную систему можно найти в публикации Davidson et al., Nature Rev. (2003) 4:353-364.
Аденоассоциированные вирусные (AAV) векторы считаются эффективными для генной терапии ЦНС, поскольку они обладают подходящим профилем токсичности и иммуногенности, их можно использовать в трансдукции нервных клеток, и они способны опосредовать длительную экспрессию в ЦНС (Kaplitt et al., Nat. Genet. (1994) 8:148-154; Bartlett et al., Hum. Gene Ther. (1998) 9:1181-1186; и Passini et al., J. Neurosci. (2002) 22:6437-6446).
Одно полезное свойство векторов AAV заключается в способности некоторых векторов AAV подвергаться ретроградному и/или антероградному транспорту в нервных клетках. Нейроны в одной области головного мозга соединены аксонами с дистальными областями головного мозга, тем самым предоставляя транспортную систему для доставки вектора. Например, вектор AAV можно вводить в терминали аксонов нейронов или рядом с ними. Нейроны интернализируют вектор AAV и транспортируют его ретроградным способом по аксону в тело клетки. У аденовируса, HSV, и вируса псевдобешенства показаны схожие свойства в отношении доставки генов в дистальные структуры головного мозга (Soudas et al., FASEB J. (2001) 15:2283-2285; Breakefield et al., New Biol. (1991) 3:203-218; и deFalco et al., Science (2001) 291:2608-2613).
Некоторые исследователи сообщали о том, что трансдукция головного мозга с использованием серотипа AAV 2 (AAV2) ограничена внутричерепным местом инъекции (Kaplitt et al., Nat. Genet. (1994) 8:148-154; Passini et al., J. Neurosci. (2002) 22:6437-6446; и Chamberlin et al., Brain Res. (1998) 793:169-175). Также существует доказательство того, что ретроградный аксональный транспорт нейротропных вирусных векторов, включая векторы AAV и лентивирусные векторы, также может происходить в выбранных цепях головного мозга нормальной крысы (Kaspar et al., Mol. Ther. (2002) 5:50-56; Kasper et al., Science (2003) 301: 839-842 и Azzouz et al., Nature (2004) 429:413-417. Roaul et al., Nat. Med. (2005) 11(4):423-428 и Ralph et al., Nat. Med. (2005) 11(4):429-433 сообщают, что внутримышечная инъекция лентивируса, экспрессирующего интерферирующую РНК для подавления экспрессии Cu/Zn-супероксиддисмутазы (SOD1) человека, задерживала начало заболевания боковым амиотрофическим склерозом (ALS) в терапевтически уместной модели ALS на грызунах.
Клетки, трансдуцированные векторами AAV, могут экспрессировать продукт терапевтического трансгена, такой как фермент или нейротрофический фактор, чтобы опосредовать положительное воздействие внутриклеточно. Эти клетки также могут секретировать продукт терапевтического трансгена, который впоследствии может быть захвачен дистальными клетками, где он может опосредовать свое положительное воздействие. Этот процесс описан как кросс-коррекция (Νeufeld et al., Science (1970) 169:141-146).
Свойство описанных выше рекомбинантных векторов AAV заключается в том, что перед экспрессией кодируемого трансгена нужно конвертировать одноцепочечную ДНК (оцДНК) генома AAV в двухцепочечную ДНК (дцДНК). Эту стадию можно обойти посредством самокомплементарных векторов, в которых упакован геном с инвертированными повторами, который уложен в дцДНК, не требуя синтеза ДНК или спаривания оснований нескольких векторных геномов, тем самым повышая эффективность опосредованного AAV переноса генов. Обзор самокомплементарных векторов AAV см., например, в публикации McCarty, D.M. Molec. Ther. (2008) 16:1648-1656.
Спинальная мышечная атрофия (SMA) представляет собой аутосомное рецессивное нервно-мышечное нарушение, вызванное мутациями в гене выживаемости двигательных нейронов 1 (SMΝ1) и утратой кодируемого SMΝ белка (Lefebvre et al., Cell (1995) 80:155-165). Отсутствие SMΝ ведет к дегенерации двигательных нейронов в брюшном (переднем) роге спинного мозга, что ведет к слабости проксимальных мышц, отвечающих за ползание, ходьбу, движение шеи и глотание, и непроизвольно сокращающихся мышц, которые управляют дыханием и кашлем (Sumner C.J., NeuroRx (2006) 3:235-245). Таким образом, пациенты с SMA предрасположены к пневмониям и другим пульмональным проблемам, таким как рестриктивное легочное заболевание. Начало заболевания и степень тяжести отчасти определяет фенотипический ген-модификатор SMN2, который способен обеспечить образование малого количества SMN (Monani et al., Hum. Mol. Genet. (1999) 8:1177-1183; Lorson et al., Proc. Natl. Acad. Sci. USA (1999) 96:6307-6311). Таким образом, пациенты с высоким числом копий SMN2 (3-4 копии) переносят менее тяжелую форму заболевания (именуемую II или III типом), тогда как 1-2 копии SMN2 обычно ведут к более тяжелому заболеванию I типа (Campbell et al., Am. J. Hum. Genet. (1997) 61:40-50; Lefebvre et al., Nat. Genet. (1997) 16:265-269). В настоящее время не существует эффективного лечения SMA.
Фундаментальная стратегия лечения данного моногенного нарушения состоит в повышении уровней SMN у пациентов с SMA. Один подход для достижения этого состоит в модуляции эндогенного гена SMN2 с использованием низкомолекулярных соединений, которые активируют промотор SMN2 или корректируют паттерн сплайсинга предшественника мРНК SMN2. Изменение сплайсинга SMN2 также можно реализовать с использованием антисмысловых олигонуклеотидов и транс-сплайсинга РНК. Однако несмотря на то, что модуляция SMN2 повышала уровень SMN in vitro и восстанавливала ядерные кристаллические структуры в клеточных линиях с SMA, исследования эффективности с использованием низкомолекулярных лекарственных средств не перешли в поддающиеся измерению улучшения в клинике (Oskoui et al., Neurotherapeutics (2008) 5:499-506).
Сущность изобретения
Настоящее изобретение основано на открытии того, что как стандартные рекомбинантные вирионы AAV (rAAV), так и рекомбинантные самокомплементарные векторы AAV (scAAV) способны доставлять гены в ЦНС при успешной экспрессии в ЦНС и лечении нейродегенеративного заболевания. Этот терапевтический подход для доставки генов, кодирующих терапевтические молекулы, которая ведет по меньшей мере к частичной коррекции неврологических патологий, предоставляет крайне желательный способ лечения различных нейродегенеративных нарушений, включая SMA.
Таким образом, в одном из вариантов осуществления изобретение относится к самокомплементарному аденоассоциированному вирусному (scAAV) вектору, содержащему полинуклеотид, кодирующий белок, который модулирует двигательную функцию у субъекта с нарушением двигательных нейронов. В определенных вариантах осуществления нарушение двигательных нейронов выбирают из спинальной мышечной атрофии (SMA), бокового амиотрофического склероза (ALS), спинобульбарной мышечной атрофии, спиноцеребеллярной атаксии, первичного латерального склероза (PLS) или травматического повреждения спинного мозга.
В дополнительных вариантах осуществления полинуклеотид, присутствующий в векторе scAAV, кодирует белок выживаемости двигательных нейронов (SMN). В определенных вариантах осуществления белок SMN представляет собой SMN-1 человека. В дополнительных вариантах осуществления SMN-1 содержит аминокислотную последовательность, которая обладает по меньшей мере 90% идентичностью последовательности с последовательностью, изображенной на фиг.9B. В дополнительных вариантах осуществления SMN-1 содержит аминокислотную последовательность, как изображено на фиг.9B.
В других вариантах осуществления изобретение относится к рекомбинантному вириону AAV, содержащему вектор scAAV, как описано выше.
В дополнительных вариантах осуществления изобретение относится к композиции, содержащей рекомбинантный вирион AAV, как указано выше, и фармацевтически приемлемый эксципиент.
В дополнительных вариантах осуществления изобретение относится к способу модуляции двигательной функции у субъекта с нарушением двигательных нейронов, включающему введение терапевтически эффективного количества указанной выше композиции в клетки субъекта. В определенных вариантах осуществления композицию вводят в клетки in vitro для того, чтобы трансдуцировать клетки, и трансдуцированные клетки вводят субъекту. В альтернативных вариантах осуществления композиции вводят в клетки in vivo.
В дополнительных вариантах осуществления изобретение относится к способу обеспечения белка SMN у субъекта со спинальной мышечной атрофией (SMA), включающему введение рекомбинантного вириона AAV, содержащего вектор AAV, как описано выше, в клетки субъекта, нуждающегося в этом. В определенных вариантах осуществления композицию вводят в клетки in vitro для того, чтобы трансдуцировать клетки, и трансдуцированные клетки вводят субъекту. В альтернативных вариантах осуществления композиции вводят в клетки in vivo.
В каждом указанном выше способе композицию можно вводить непосредственной инъекцией в спинной мозг. В других вариантах осуществления композицию вводят интрацеребровентрикулярной инъекцией. В дополнительных вариантах осуществления композицию вводят в боковой желудочек головного мозга. В определенных вариантах осуществления композицию вводят в оба боковых желудочка головного мозга. В других вариантах осуществления композицию вводят как интрацеребровентрикулярной инъекцией, так и прямой инъекцией в спинной мозг. В дополнительных вариантах осуществления композицию вводят посредством интратекальной инъекции.
Эти и другие варианты осуществления настоящего изобретения легко решат специалисты в данной области с учетом описания, приведенного в настоящем документе.
Краткое описание рисунков
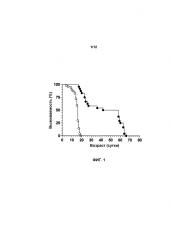
На фиг.1 показана выживаемость мышей, которых лечили с использованием AAVhSMN1, в сравнении с мышами с SMA, которые не получали лечения. Лечение с использованием AAVhSMN1 повышало выживаемость мышей с SMA. Мыши с SMA, не получавшие лечение (n=34, светлые круги), имели среднее значение продолжительности жизни 15 суток. Мыши с SMA, которых лечили при P0 с использованием AAVhSMN1 (n=24, темные круги), имели среднее значение продолжительности жизни 50 суток (p<0,0001), что составило увеличение срока жизни на 233%.
На фиг.2A-2C показано влияние генной терапии на уровни SMN в спинном мозге. Показаны уровни белка hSMN в инъецированных поясничном (фиг.2A), грудном (фиг.2B) и шейном (фиг.2C) отделах по сравнению с мышами с SMA, не получавшими лечение, и мышами дикого типа. Осуществляли вестерн-блоттинг для поясничного, грудного и шейного отделов спинного мозга через 16, 58-66 и 120-220 суток после инъекции. Посредством вестерн-блоттинга проводили количественное определение для трех отделов, а для контроля уровней белка нормализовали SMN к β-тубулину и наносили на график в виде процентной доли мышей дикого типа с совпадающим возрастом. Легенда (и значения n): SMA, с нокаутом, не получавшие лечение (n=5 на 16 сутки); AAV, мыши с SMA, которых лечили с использованием AAV8-hSMN (n=7 на 16 сутки, n=5 на 58-66 сутки); scAAV, мыши с SMA, которых лечили с использованием scAAV8-hSMN (n=5 в каждый момент времени). Значения представляют среднее значение ±SEM (стандартная ошибка среднего значения).
На фиг.3A-3J показано внутриклеточное распределение белка hSMN и экспрессия в двигательных нейронах спинного мозга у мышей с SMA, получавших и не получавших лечение. Белок hSMN в большом количестве обнаруживали в цитоплазме трансдуцированных клеток (фиг.3A и 3B). Кроме того, белок hSMN обнаруживали в ядре, как проиллюстрировано парой кристаллических структур (стрелка), увеличенных во врезке (фиг.3A). Белок hSMN также обнаруживали в дендритах (фиг.3B и 3C) и аксонах (фиг.3D) нейронов. Белок hSMN не поддавался обнаружению на срезах тканей мышей с SMA, не получавших лечение (фиг.3E). Совместная локализация белка hSMN (фиг.3F) и ChAT мыши (фиг.3G) показывала, что подмножество трансдуцированных клеток представляет собой двигательные нейроны (фиг.3H и 3I). Процентную долю ChAT-клеток, иммуноположительных по белку hSMN, определяли на 16 (белые столбцы) и 58-66 (черные столбцы) сутки (фиг.3J). Значения представляют среднее значение ±SEM.
На фиг.4 показано количество двигательных нейронов в спинном мозге у мышей с SMA, получавших и не получавших лечение. Для каждой группы показано среднее число ChAT иммуноположительных нейронов, которое считали на 10 мкм тканевых срезах. Число отражает количество в каждом десятом срезе с различных уровней шейного, грудного, поясничного и крестцового отделов. Значения представляют среднее значение ±SEM. Легенда: *, p<0,05; **, p<0,01; ***, p<0,001.
На фиг.5A-5C показана площадь поперечного сечения мышечного волокна из мышечных групп у мышей с SMA, получавших и не получавших лечение. Площадь поперечного сечения мышечного волокна из нескольких мышечных групп возрастала при лечении с использованием AAVhSMN1. Составные диаграммы для квадрицепсов, икроножных и межреберных мышц на 16 (фиг.5A) и 58-66 (фиг.5B) сутки показывают, что распределение размеров мышечных волокон схожи у мышей с SMA, получавших лечение, и у мышей дикого типа. Общее среднее значение на 16 сутки показывает, что при лечении площадь поперечного сечения мышечного волокна значительно выше (фиг.5C). Кроме того, на 58-66 сутки средняя площадь статистически сходна у мышей с SMA, получавших лечение, и у мышей дикого типа с совпадающим возрастом в икроножных и межреберных мышцах (фиг.5C). Значения представляют среднее значение ±SEM. Легенда: WT, мыши дикого типа, не получавшие лечение; HET, гетерозиготы, не получавшие лечение; SMA, с нокаутом, не получавшие лечение; AAV, мыши с SMA, получавшие лечение с использованием AAVhSMN1; *, p<0,05; **, p<0,01; ***, p<0,001.
На фиг.6A-6F показана структура нервно-мышечного соединения (NMJ) в мышцах у мышей с SMA, получавших и не получавших лечение. Структуру в квадрицепсе, икроножной и межреберной мышцах улучшали при использовании генной терапии. Показаны нервно-мышечные соединения(NMJ) из квадрицепсов мышей с SMA, не получавших лечение (фиг.6A), мышей с SMA, получавших лечение (фиг.6B), и мышей дикого типа, не получавших лечение (фиг.6C), на 16 сутки, и мышей с SMA, получавших лечение (фиг.6D), и мышей дикого типа, не получавших лечение (фиг.6E), на 58-66 сутки. Пре- и постсинаптическое NMJ метили антителом к нейрофиламенту (зеленый) и окрашивали α-бунгаротоксином (красный), соответственно. Стрелка в основной части указывает на NMJ, которое выделено во врезках ниже. У каждого животного в каждой мышце случайно оценивали по меньшей мере 100 NMJ. Нормальное NMJ определяли как имеющее пресинаптическую терминаль, в которой не наблюдали аномального накопления белка нейрофиламента, показанного на фиг.6A. Значения на фиг.6F представляют среднее значение ±SEM. Легенда: WT, мыши дикого типа, не получавшие лечение; HET, гетерозиготы, не получавшие лечение; SMA, мыши с нокаутом, не получавшие лечение; AAV, мыши с SMA, получавшие лечение с использованием AAVhSMN1; *, p<0,05; **, p<0,01; ***, p<0,001. Масштабная метка: 20 мкм.
На фиг.7A-7F показаны результаты поведенческих тестов у мышей с SMA, получавших и не получавших лечение. В поведенческих тестах мыши с SMA, получавшие лечение, показывали значительные улучшения. Мыши с SMA, получавшие лечение (звездочка), и мыши дикого типа (WT), не получавшие лечение, по существу более приспособлены, чем мыши с SMA, не получавшие лечение (отмечены «x»), на 16 сутки (фиг.7A). Мыши с SMA, получавшие лечение, также значительно тяжелее контрольных мышей с SMA, не получавших лечение, с 11 суток и далее (фиг.7B). Мыши с SMA, получавшие лечение, значительно лучше выполняли тесты на выпрямительный рефлекс (фиг.7C), отрицательный геотаксис (фиг.7D), силу хватания (фиг.7E) и разведение задних конечностей (фиг.7F), чем мыши с SMA, не получавшие лечение. Мыши с SMA, получавшие лечение, статистически идентичны мышам дикого типа и гетерозиготам в тестах на выпрямительный рефлекс и отрицательный геотаксис на 12-16 сутки (фиг.7C и 7D). Значения представляют среднее значение ±SEM. Легенда: мыши WT, не получавшие лечение (светлый круг), гетерозиготы, не получавшие лечение (светлый треугольник); мыши с SMA, не получавшие лечение (светлый квадрат); мыши с SMA, получавшие лечение с использованием AAVhSMN1 (темный квадрат); *, p<0,05; **, p<0,01; ***, p<0,001.
На фиг.8 показана выживаемость мышей, получавших лечение с использованием scAAVhSMN1 и не получавших лечение. Лечение с использованием scAAVhSMN1 повышало выживаемость у мышей с SMA. Мыши с SMA, получавшие лечение при P0 с использованием scAAVhSMN1 (n=17, темные треугольники), имели среднее значение продолжительности жизни 157 суток (p<0,0001) по сравнению с 16 сутками у мышей с SMA, не получавшими лечение (n=47, светлые круги).
На фиг.9A-9B (SEQ ID NO:1 и 2) показана кодирующая последовательность ДНК (фиг.9A) и соответствующая аминокислотная последовательность (фиг.9B) характерного гена выживаемости двигательных нейронов (SMN1) человека.
На фиг.10A-10F показано, что экспрессия scAAV8-hSMN увеличивает количество двигательных нейронов и улучшает NMJ у мышей с SMA. На фиг.10A показана процентная доля mChAT иммуноположительных клеток, которые локализованы совместно с экспрессией hSMN в пояснично-грудном отделе на 16 сутки после инъекции. На фиг.10B-10F показаны средние количества mChAT иммуноположительных клеток в поясничном (фиг.10B), грудном (фиг.10C) и шейном (фиг.10D) отделах и средние процентные доли поврежденных NMJ в квадрицепсе (фиг.10E) и межреберных мышцах (фиг.10F) на 16, 58-66 и 214-269 сутки. Точкой отсчета для фиг.10E и 10F служит 75-90% NMJ в квадрицепсе и межреберных мышцах мышей с SMA, не получавших лечение, которые содержали неправильную поврежденную структуру на 16 сутки (см. фиг.6F). Легенда и значения n: SMA, мыши с нокаутом, не получавшие лечение (светлые столбцы, n=8 на 16 сутки), AAV, AAV8-hSMN (заштрихованные столбцы, n=8 на 16 сутки, n=5 на 58-66 сутки); scAAV, scAAV8-hSMN (темные столбцы, n=5 в каждый момент времени); WT, мыши WT, не получавшие лечение (столбцы в клетку, n=8 на 16 сутки, n=5 на 58-66 и 216-269 сутки). Значения представляют среднее значение ±SEM. Статистические сравнения осуществляли, используя однофакторный дисперсионный анализ (ANOVA) и апостериорный критерий Бонферрони для множественных сравнений на 16 сутки (фиг.10B-10F). С помощью непарного двустороннего критерия Стьюдента сравнивали 1) два вектора друг с другом на 16 сутки (фиг.10A) и 58-66 сутки (фиг.10B-10D); 2) относительное число ChAT-клеток в группах 58-66d и 214-269d при лечении с использованием scAAV8-hSMN (фиг.10B-10D); 3) относительное число аномальных NMJ между мышами WT с совпадающим возрастом, не получавшими лечение, и мышами с SMA, получавшими лечение с использованием scAAV8-hSMN, на 214-269 сутки (E, F); *p<0,05, **p<0,01, ***p<0,001.
Подробное описание изобретения
При практическом осуществлении настоящего изобретения используют, если не указано иначе, стандартные способы химии, биохимии, рекомбинантной ДНК и иммунологии, известные специалистам в данной области. Такие способы полностью описаны в литературе. См., например, Fundamental Virology, 2nd Edition, vol. I & II (B.N. Fields and D.M. Knipe, eds.); Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir and C.C. Blackwell eds., Blackwell Scientific Publications); T.E. Creighton, Proteins: Structures and Molecular Properties (W.H. Freeman and Company, 1993); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., current addition); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.).
Все публикации, патенты и патентные заявки, цитируемые в настоящем документе, как выше, так и ниже, настоящим включены посредством ссылки в полном объеме.
1. Определения
В описании настоящего изобретения использованы следующие термины, которые следует использовать в значении, указанном ниже.
Следует отметить, что используемые в данном описании и приложенной формуле изобретения формы единственного числа включают формы множественного числа, если в контексте явно не указано иное. Таким образом, например, упоминание о «рецепторе интерлейкина» включает смесь двух или более таких рецепторов и т.п.
Термины «полипептид» и «белок», используемые взаимозаменяемо в настоящем документе, или кодирующая их нуклеотидная последовательность, относятся к белку или нуклеотидной последовательности, соответственно, которые представляют или нативную последовательность, ее вариант или ее фрагмент. Полноразмерные белки, с сигнальной последовательностью или без нее, и их фрагменты, а также белки с модификациями, такими как делеции, вставки и замены (или консервативные или неконсервативные по природе), в нативной последовательности предназначены для использования в настоящем документе при условии, что белок сохраняет желаемую активность. Эти модификации могут быть преднамеренными, например, введенными посредством сайт-специфического мутагенеза, или могут быть случайными, например, введенными посредством мутаций организма-хозяина, который продуцирует белки, или посредством ошибок ПЦР амплификации. Таким образом, в настоящем документе предполагается использовать активные белки, по существу гомологичные родительской последовательности, например, белки с 70…80…85…90…95…98…99% и т.д. идентичностью, которые сохраняют желаемую активность нативной молекулы.
«Нативный» полипептид, такой как полипептид выживаемости двигательных нейронов (SMN), относится к полипептиду, который имеет такую же аминокислотную последовательность, как и соответствующая молекула, полученная из природы. Такие нативные последовательности можно выделить из природы или можно получить рекомбинантными или синтетическими средствами. Термин «нативная» последовательность, в частности, охватывает природные усеченные или секретируемые формы конкретной молекулы (например, последовательность внеклеточного домена), природные формы вариантов (например, формы, возникшие в результате альтернативного сплайсинга) и природные аллельные варианты полипептида. В различных вариантах осуществления изобретения нативные молекулы, описанные в настоящем документе, представляют собой зрелые или полноразмерные нативные последовательности, содержащие полноразмерные аминокислотные последовательности, представленные на сопроводительных фигурах. Однако несмотря на то, что некоторые молекулы, показанные на сопроводительных фигурах, начинаются с остатков метионина, обозначенных в качестве аминокислотного положения 1 на этой фигуре, другие остатки метионина, расположенные или ближе к 5'-концу, или ближе к 3'-концу относительно аминокислотного положения 1 на этой фигуре, можно использовать в качестве начального аминокислотного остатка для конкретной молекулы. Альтернативно, в зависимости от используемой экспрессирующей системы, у молекул, описанных в настоящем документе, может отсутствовать N-концевой метионин.
Под «вариантом» понимают активный полипептид, как определено в настоящем документе, который обладает по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности с соответствующей полноразмерной нативной последовательностью, полипептид, у которого отсутствует сигнальный пептид, внеклеточный домен полипептида, с сигнальным пептидом или без него, или любой другой фрагмент последовательности полноразмерного полипептида, как описано в настоящем документе. Такие варианты полипептида включают, например, полипептиды, в которых один или несколько аминокислотных остатков добавлены или удалены на N- и/или C-конце полноразмерной нативной аминокислотной последовательности. Как правило, вариант обладает по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 81% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 82% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 83% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 84% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 85% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 86% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 87% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 88% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 89% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 90% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 91% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 92% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 93% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 94% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 95% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 96% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 97% идентичностью аминокислотной последовательности, альтернативно по меньшей мере приблизительно 98% идентичностью аминокислотной последовательности и альтернативно по меньшей мере приблизительно 99% идентичностью аминокислотной последовательности с соответствующей полноразмерной нативной последовательностью. Как правило, полипептиды вариантов составляют по меньшей мере приблизительно 10 аминокислот в длину, например, по меньшей мере приблизительно 20 аминокислот в длину, например, по меньшей мере приблизительно 30 аминокислот в длину, альтернативно по меньшей мере приблизительно 40 аминокислот в длину, альтернативно по меньшей мере приблизительно 50 аминокислот в длину, альтернативно по меньшей мере приблизительно 60 аминокислот в длину, альтернативно по меньшей мере приблизительно 70 аминокислот в длину, альтернативно по меньшей мере приблизительно 80 аминокислот в длину, альтернативно по меньшей мере приблизительно 90 аминокислот в длину, альтернативно по меньшей мере приблизительно 100 аминокислот в длину, альтернативно по меньшей мере приблизительно 150 аминокислот в длину, альтернативно по меньшей мере приблизительно 200 аминокислот в длину, альтернативно по меньшей мере приблизительно 300 аминокислот в длину или более.
Особенно предпочтительные варианты включают замены, которые являются консервативными по природе, т.е. те замены, которые имеют место в семействе аминокислот, которые объединены по их боковым цепям. В частности, аминокислоты обычно делят на четыре семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные - глицин, аспарагин, глутамин, цистеин, серин треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, достаточно обосновано предсказание о том, что выделенная замена лейцина на изолейцин или валин, аспартата на глутамат, треонина на серин или схожая консервативная замена аминокислоты на структурно родственную аминокислоту не окажет важного влияния на биологическую активность. Например, полипептид, представляющий интерес, может включать вплоть до приблизительно 5-10 консервативных или неконсервативных аминокислотных замен, или даже вплоть до приблизительно 15-25 или 50 консервативных или неконсервативных аминокислотных замен, или любое число от 5 до 50 при условии, что желаемая функция молекулы остается незатронутой.
«Гомология» относится к проценту идентичности двух полинуклеотидных или двух полипептидных фрагментов. Две последовательности ДНК или две полипептидные последовательности являются «по существу гомологичными» друг другу, когда последовательности обладают по меньшей мере приблизительно 50%, предпочтительно по меньшей мере приблизительно 75%, более предпочтительно по меньшей мере приблизительно 80%-85%, предпочтительно по меньшей мере приблизительно 90% и наиболее предпочтительно по меньшей мере приблизительно 95%-98% идентичностью последовательностей на протяжении молекул определенной длины. Как используется в настоящем документе, термин по существу гомологичная также относится к последовательности, которая обладает полной идентичностью с точно определенной последовательностью ДНК или полипептида.
Как правило, «идентичность» относится к точному соответствию нуклеотид-в-нуклеотид или аминокислота-в-аминокислоту двух полинуклеотидных или полипептидных последовательностей, соответственно. Процент идентичности можно определить прямым сравнением информации о последовательности для двух молекул посредством выравнивания последовательностей, подсчета точного числа совпадений между двумя выровненными последовательностями, деления на длину более короткой последовательности и умножения результата на 100. Для облегчения этого анализа можно использовать легко доступные компьютерные программы, такие как ALIGN, Dayhoff, M.O. in Atlas of Protein Sequence and Structure M.O. Dayhoff ed., 5 Suppl. 3:353-358, National Biomedical Research Foundation, Washington, DC, в которой адаптирован алгоритм локальной гомологии Smith and Wateraman Advances in Appl. Math. 2:482-489, 1981 для пептидного анализа. Программы для определения идентичности нуклеотидных последовательностей доступны в Wisconsin Sequence Analysis Package, Version 8 (доступен в Genetics Computer Group, Madison, WI), например, программы BESTFIT, FASTA и GAP, которые также основаны на алгоритме Смита-Ватермана. Эти программы легко использовать с параметрами по умолчанию, которые рекомендованы производителем и описаны в Wisconsin Sequence Analysis Package, который указан выше. Например, процент идентичности конкретной нуклеотидной последовательности относительно эталонной последовательности можно определить с помощью алгоритма гомологии Смита-Ватермана, в котором используют по умолчанию матрицу замен и штраф за пропуск шести положений нуклеотидов.
Другой способ определения процента идентичности в контексте настоящего изобретения заключается в использовании пакета программ MPSRCH, права на который принадлежат University of Edinburgh, разработанного John F. Collins и Shane S. Sturrok и распространяемого компанией IntelliGenetics, Inc. (Mountain View, CA). Из этого набора пакетов можно использовать алгоритм Смита-Ватермана с параметрами по умолчанию для матрицы замен (например, штраф за открытие пропуска 12, штраф за продолжение пропуска один и пропуск шесть). В генерируемых данных значение «Match» отражает «идентичность последовательностей». Другие подходящие программы для вычисления процента идентичности или сходства между последовательностями в целом известны в данной области, например, другой программой выравнивания является BLAST, который используют с параметрами по умолчанию. Например, можно использовать BLASTN и BLASTP со следующими параметрами по умолчанию: генетический код = стандартный; фильтр = нет; нить = обе; порог = 60; ожидаемое = 10; матрица = BLOSUM62; описания = 50 последовательностей; сортировка по = наивысшей оценке; базы данных = не избыточные, GenBank + EMBL + DDBJ + PDB + трансляция GenBank CDS + Swiss protein + Spupdate + PIR. Подробности об этих программах хорошо известны в данной области.
Альтернативно, гомологию можно определить гибридизацией полинуклеотидов в условиях, допускающих образование стабильных дуплексов между гомологичными областями, с последующим расщеплением нуклеазой(ами) со специфичностью к одноцепочечной нуклеиновой кислоте, и определением размеров расщепленных фрагментов. По существу гомологичные последовательности ДНК можно идентифицировать в гибридизации по Саузерну, например, в строгих условиях, как определено для этой конкретной системы. Определение соответствующих условий гибридизации известно специалистам в данной области. См., например, Sambrook et al., выше; DNA Cloning, выше; Nucleic Acids Hybridization, выше.
Под термином «вырожденный вариант» понимают полинуклеотид, содержащий изменения в своей последовательности нуклеиновой кислоты, которая кодирует полипептид, имеющий ту же аминокислотную последовательность, что и полипептид, кодируемый тем полинуклеотидом, из которого вырожденный вариант получен.
«Кодирующая последовательность» или последовательность, которая «кодирует» выбранный полипептид, представляет собой молекулу нуклеиновой кислоты, транскрипция (в случае ДНК) и трансляция (в случае мРНК) которой ведет к образованию полипептида in vivo, когда она находится под управлением соответствующих последовательностей регуляции. Границы кодирующей последовательности определены инициирующим кодоном на 5'-конце (N-конце) и терминирующим трансляцию кодоном на 3'-конце (C-конце). Последовательность терминации транскрипции может быть расположена ближе 3'-концу относительно кодирующей последовательности.
Под «вектором» понимают любой генетический элемент, такой как плазмида, фаг, транспозон, космида, хромосома, вирус, вирион и т.д., который способен к репликации, если он связан с подходящими управляющими элементами, и который может переносить последовательности генов в клетки. Таким образом, термин включает клонирующие и экспрессирующие носители, а также вирусные векторы.
Под «рекомбинантным вектором» понимают вектор, который содержит гетерологичную последовательность нуклеиновой кислоты, которая способна к экспрессии in vivo.
Под «рекомбинантным вирусом» понимают вирус, который генетически изменен, например, вставкой или инсерцией гетерологичной конструкции нуклеиновой кислоты в частицу.
Термин «трансген» относится к полинуклеотиду, который вводят в клетку и который способен к транскрипции в РНК и, необязательно, трансляции и/или экспрессии в соответствующих условиях. В одном из аспектов он придает желаемое свойство той клетке, в которую его ввели, или иным образом ведет к желаемому терапевтическому или диагностическому исходу.
Термины «геномные частицы (гч)» или «эквиваленты генома», как используется в отношении вирусного титра, относятся к числу вирионов, содержащих геномную ДНК рекомбинантного AAV, независимо от инфекционности или функциональности. Число геномных частиц в конкретном препарате вектора можно измерить посредством процедур, таких как описано в настоящем документе в примерах или, например, в публикациях Clark et al., Hum. Gene Ther. (1999) 10:1031-1039; и Veldwijk et al., Mol. Ther. (2002) 6:272-278.
Термины «инфекционная единица» (ие), «инфекционная частица» или «репликационная единица», как используется в отношении вирусного титра, относятся к числу инфекционных частиц рекомбинантного вектора AAV, которое измеряют посредством анализа инфекционных центров, также известного как анализ репликационных центров, описанный, например, в публикации McLaughlin et al., J. Virol. (1988) 62:1963-1973.
Термин «трансдуцирующая единица» (те), как используется в отношении вирусного титра, относится к числу инфекционных частиц рекомбинантного вектора AAV, которые ведут к образованию функционального продукта трансгена, как измеряется в функциональных анализах, таких как описано в примерах в настоящем документе или, например, в публикации Xiao et al., Exp. Neurobiol. (1997) 144:113-124; или в публикации Fisher et al., J. Virol. (1996) 70:520-532 (анализ LFU).
Термин «трансфекция» используют для обозначения захвата чужеродной ДНК клеткой, а клетку «трансфицируют», когда экзогенную ДНК вводят внутрь клеточной мембраны. В данной области в целом известно множество способов трансфекции. См., например, публикации Graham et al. (1973) Virology, 52:456, Sambrook et al. (1989) Molecular Cloning, a laboratory manual, Cold Spring Harbor Laboratories, New York, Davis et al. (1986) Basic Methods in Molecular Biology, Elsevier, и Chu et al. (1981) Gene 13:197. Такие способы можно использовать для введения одного или нескольких фрагментов экзогенной ДНК в подходящие клетки-хозяева.