Формирование конъюгированного белка электропрядением
Иллюстрации
Показать всеИзобретение относится к способу получения волокна из конъюгированного с полисахаридом белка молочной сыворотки электропрядением, включающему стадии приготовления водного раствора, включающего полисахарид и белок молочной сыворотки, где указанный полисахарид присутствует в концентрации от 0,1 г/мл до около 5,0 г/мл, приложения к раствору напряжения от 15 до 25 кВ, сбора волокна на сборной пластине. 2 н. и 21 з.п. ф-лы, 29 ил., 9 табл.
Реферат
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет предварительной патентной заявки США с серийным № 61/619996, поданной 4 апреля 2012 года, включенной в данное описание посредством ссылки во всей своей полноте.
Предшествующий уровень техники
Конъюгированные белки, включая белково-полисахаридные конъюгаты, играют значительную роль в структуре и стабильности многих пищевых товаров. Одной реакцией, которая в особенности важна в пищевой промышленности, является реакция Майяра. Реакция Майяра представляет собой неферментативное химическое взаимодействие, включающее конденсацию аминогруппы и восстанавливающей группы. Реакция приводит к образованию промежуточных продуктов, которые позже могут полимеризоваться с образованием коричневых азотсодержащих соединений, известных как меланоидины.
Реакция Майяра имеет три основных стадии. На первой стадии образуется гликозиламин, который затем подвергается перегруппировке в соединение Амадори. На второй стадии аминогруппа утрачивается, и формируется карбонильный промежуточный продукт. Карбонильный промежуточный продукт подвергается дегидратации или расщеплению, с образованием карбонильных соединений с высокой реакционной способностью. На конечной стадии реакционноспособные карбонильные соединения взаимодействуют с другими компонентами пищевого продукта с образованием меланоидинов.
С продуктами реакции Майяра связаны такие позитивные характерные свойства, как аромат, вкус и цвет. Однако реакция также может привести к снижению питательной ценности, сокращению срока хранения и образованию нежелательных соединений, придающих неприятный привкус.
Поэтому контроль реакции Майяра является критически важным при разработке пищевых продуктов с улучшенной питательной ценностью. Предшествующие пути получения белковых конъюгатов не были эффективными по многочисленным причинам. Например, сухая инкубация, при которой используют процесс лиофилизации в комбинации с нагреванием, является медленной и не обеспечивает надлежащих выходов. Следовательно, существует потребность в более эффективных путях контроля образования конъюгированных белков.
Сущность изобретения
Описываемые в данном описании отличительные признаки в основном относятся к способам применения электропрядения для получения конъюгированных белков. Аспекты описываемых в данном описании отличительных признаков относятся к способам получения конъюгированных с декстраном белков молочной сыворотки.
Краткое описание фигур
Настоящее изобретение проиллюстрировано в качестве примера, но не ограничения сопроводительными фигурами, в которых сходные кодовые номера позиций обозначают подобные элементы, и в которых:
на фиг. 1 проиллюстрирован один пример устройства для электропрядения, в котором могут быть реализованы разнообразные признаки изобретения;
на фиг. 2 проиллюстрированы бусинки на волокнах с декстраном (70 кДа (тысяч Дальтон)) при концентрации 0,5 г/мл растворителя;
на фиг. 3 проиллюстрированы волокна, полученные из раствора декстрана (70 кДа) при концентрации 0,7 г/мл растворителя;
на фиг. 4 проиллюстрированы гладкие волокна, полученные из раствора декстрана (70 кДа) при концентрации 0,8 г/мл растворителя;
на фиг. 5 проиллюстрировано LM-изображение (в аналитическом микроскопе) изготовленных электропрядением волокон из чистого декстрана, полученных из водного раствора декстрана (40 кДа) при концентрации 1,0 г/мл;
на фиг. 6 проиллюстрировано LM-изображение изготовленных электропрядением волокон из чистого декстрана, полученных из водного раствора декстрана (100 кДа) при концентрации 0,6 г/мл;
на фиг. 7 проиллюстрирована вязкость смесей декстран-изолят сывороточного белка, полученных с различными декстранами при минимальной пригодной для электропрядения концентрации;
фиг. 8А-F. На фиг. 8А-8С проиллюстрировано полученные в сканирующем электронном микроскопе (SEM) изображения волокон, изготовленных электропрядением из декстрана-изолята сывороточного белка, полученных из декстранов с разнообразными молекулярными массами: 8А: 40 кДа, 8В: 70 кДа и 8С: 100 кДа. Диаметры волокон для волокон на фиг. 8А, 8В и 8С показаны на фиг. 8D, 8E и 8F, соответственно;
на фиг. 9 проиллюстрированы реологические кривые зависимости "напряжение-деформация" водных растворов декстрана при различных концентрациях;
на фиг. 10 проиллюстрировано влияние соотношения смеси на реологические характеристики смесей декстрана и сывороточного белка. Совокупное содержание твердого вещества составляло 0,6 г/мл для каждой смеси;
фиг. 11А-Н. На фиг. 11А-D проиллюстрированы SEM-изображения изготовленных электропрядением волокон, полученных из растворов декстрана при различных концентрациях (11А: 0,3 г/мл растворителя, 11В: 0,45 г/мл растворителя, 11С 0,6 г/мл растворителя и 11D: 0,7 г/мл растворителя). Условия электропрядения поддерживали постоянными при: напряжении, равном 20 кВ, дистанции электропрядения, равной 18 см, и величине расхода потока раствора, равной 12 мкл/мин. Диаметры волокон для волокон на фиг. 11А-D показаны на фиг. 11Е-Н, соответственно;
фиг. 12А-J. На фиг. 12А-Е проиллюстрированы SEM-изображения изготовленных электропрядением волокон, полученных из смесей с различными соотношениями смеси (по массе) декстрана (100 кДа) и изолята сывороточного белка (12А: 1:0, 12В: 0,8:0,2, 12С: 0,75:0,25, 12D: 0,67:0,33 и 12Е: 0,5:0,5). Концентрация всех смесей составляла 0,6 г/мл растворителя, и условия электропрядения поддерживали постоянными при: напряжении, равном 20 кВ, дистанции электропрядения, равной 18 см, и величине расхода потока раствора, равной 12 мкл/мин. Диаметры волокон для волокон на фиг. 12А-Е показаны на фиг. 12F-J, соответственно;
на фиг. 13А показаны ИК-спектры (инфракрасные) смеси между порошком декстрана и порошком изолята сывороточного белка при различном соотношении смеси. На фиг. 13В показана взаимосвязь между содержанием изолята сывороточного белка и соотношением между пиками поглощения при волновых числах 1518 и 1004 см-1;
на фиг. 14 показан внешний вид изготовленных электропрядением пленок, подвергнутых отжигу при температуре 60°C и относительной влажности (RH) 74% в течение различных периодов времени;
на фиг. 15 проиллюстрированы ИК-спектры: а) WPI-декстрана в порошковой форме; b) пленки, изготовленной электропрядением WPI-декстрана, в состоянии сразу после прядения; с)-f) изготовленных электропрядением WPI-декстрана пленок после отжига при температуре 60°C и относительной влажности 74% в течение 2, 6, 20 и 48 часов, соответственно;
на фиг. 16 проиллюстрировано влияние продолжительности отжига на SDS-PAGE-профили (электрофореза в полиамидном геле (PAGE) в присутствии додецилсульфата натрия (SDS)) конъюгатов WPI-декстрана в присутствии 2-меркаптоэтанола. Полоска 1: раствор WPI; полоски 2-8: изготовленная электропрядением конъюгата WPI-декстрана (40 кДа) пленка, подвергнутая отжигу при температуре 60°C и относительной влажности 74% в течение 0, 2, 4, 6, 8, 16, 24 и 48 часов, соответственно;
на фиг. 17А и 17В проиллюстрированы SDS-PAGE-профили конъюгатов WPI-декстрана в присутствии 2-меркаптоэтанола. На фиг. 17А представлено пятно белка. На фиг. 17В представлено пятно гликопротеина. Полоски для обеих фиг. 17А и В представляют собой полоску 1: раствор WPI; полоски 2-5: изготовленная электропрядением конъюгата WPI-декстрана (40 кДа) пленка, подвергнутая нагреванию на 0, 8, 16 и 24 час, соответственно; полоски 6-9: изготовленная электропрядением конъюгата WPI-декстрана (100 кДа) пленка, подвергнутая нагреванию на 0, 8, 16 и 24 час, соответственно;
на фиг. 18А и 18В проиллюстрированы SDS-PAGE-профили конъюгатов WPI-декстрана (70 кДа): на фиг. 18А представлено белковое пятно. На фиг. 18В представлено пятно гликопротеина. Массовое соотношение между декстраном и WPI во всех изготовленных электропрядением пленках составляло 3:1. Полоска 1: маркер молекулярной массы белков (Protein Ladder); полоски 2-5: изготовленные электропрядением пленки, подвергнутые отжигу при температуре 60°С, относительной влажности 74% на 0, 8, 16, и 24 час, соответственно;
на фиг. 19 проиллюстрирована стандартная кривая готового геля TGX-типа (Precast gel), использованного для SDS-PAGE-гелей. Переменные ММ и d, показанные в уравнении, представляют молекулярную массу в кДа и дистанцию перемещения в %, соответственно (R2=99,86%). Центральная линия и две внешних линии показывают прогнозированные значения и 95%-ной доверительный интервал, соответственно;
на фиг. 20А и 20В проиллюстрированы SDS-PAGE-профили конъюгатов WPI-декстрана (100 кДа), сформированных при различных значениях относительной влажности и продолжительностях отжига. Массовое соотношение между декстраном и WPI во всех изготовленных электропрядением пленках составляло 3:1. На фиг. 20А представлено белковое пятно. На фиг. 20В представлено пятно гликопротеина. Полоска 1: пленка в состоянии сразу после прядения; полоски 2-10: изготовленные электропрядением пленки, подвергнутые отжигу при температуре 60°С, но с различной относительной влажностью: полоски 2-4=0%-ная RH; полоски 5-7=44%-ная RH; полоски 8-10=74%-ная RH. Продолжительности отжига составляли 8 часов: полоски 2, 5 и 8; 16 часов: полоски 3, 6 и 9; и 24 часа полоски 4, 7 и 10. Полоска 0 представляет стандартный маркер молекулярных масс белков;
на фиг. 21А и 21В проиллюстрированы SDS-PAGE-профили конъюгатов WPI-декстрана (100 кДа) в условиях постоянной относительной влажности. Изготовленные электропрядением пленки были получены при различных соотношениях смеси между декстраном и WPI: полоски 1-4=1:2; полоски 5-8: 1:1; полоски 9-12: 2:1, соответственно. На фиг. 21А представлено белковое пятно. На фиг. 21В представлено пятно гликопротеина. Все изготовленные электропрядением пленки были подвергнуты отжигу при температуре 60°С и 74%-ной относительной влажности. Продолжительности отжига составляли: полоски 1, 5 и 9: пленки в состоянии сразу после прядения; полоски 2, 6 и 10: 8 часов; полоски 3, 7 и 11: 16 часов; полоски 4, 8 и 12: 24 часа. Полоска 0 представляет стандартный маркер молекулярных масс белков. Использованный краситель является специфичным к N-гликозидам, которые не присутствуют в белке или мальтодекстрине;
на фиг. 22А показаны УФ-спектры (ультрафиолетовые) поглощения изготовленных электропрядением образцов, полученных из смесей WPI и декстрана с 4 0 кДа, подвергнутых отжигу при температуре 60°С и 74%-ной относительной влажности, с различными продолжительностями отжига. На фиг. 22В показана взаимосвязь между пиком поглощения при длине волны 282 нм изготовленных электропрядением образцов и продолжительностью отжига (образцы WPI и декстрана с 40 кДа);
на фиг. 23А показаны УФ-спектры поглощения изготовленных электропрядением образцов, полученных из смесей WPI и декстрана с 70 кДа, подвергнутых отжигу при температуре 60°С и 74%-ной относительной влажности, с различными продолжительностями отжига. На фиг. 23В показана взаимосвязь между пиком поглощения при длине волны 282 нм изготовленных электропрядением образцов и продолжительностью отжига (образцы WPI и декстрана с 70 кДа);
на фиг. 24А и 24В показано влияние концентрации раствора на УФ-поглощение изготовленных электропрядением образцов, полученных из смесей WPI и декстрана со 100 кДа. На фиг. 24А представлена концентрация 5 мг/мл, и на фиг. 24В представлена концентрация 3 мг/мл;
на фиг. 25А и 25В показан пик поглощения при длине волны 282 нм изготовленных электропрядением образцов, полученных из смесей WPI и декстрана со 100 кДа при соотношении смеси 1:1 (фиг. 25А) и 2:1 (фиг. 25В);
на фиг. 26 показаны УФ-спектры поглощения изготовленных электропрядением образцов, полученных из смесей декстрана со 100 кДа и WPI при соотношении смеси 2:1;
на фиг. 27 показаны изготовленные электропрядением пленки, полученные из WPI и декстрана со 100 кДа при различных соотношениях смеси: А) 1:2; В) 1:1 и С) 2:1 (соотношение смеси между декстраном и WPI;
на фиг. 28А-С проиллюстрированы светлота (затемненные кружки) и желтизна (белые кружки) изготовленных электропрядением пленок, измеренные с использованием колориметра, при соотношениях смеси 1:2 (А), 1:1 (В) и 2:1 (С);
на фиг. 29А и В проиллюстрированы NIR-спектры (в ближней инфракрасной области) изготовленных электропрядением пленок из конъюгатов "WPI-декстран со 100 кДа".
Подробное описание изобретения
В одном аспекте изобретения предоставлены способы получения конъюгированных белков в подходе с использованием электропрядения. В некоторых аспектах конъюгат представляет собой белково-углеводный конъюгат (т.е. белок, ковалентно связанный с одним или более углеводами). В некоторых аспектах конъюгат представляет собой белково-полисахаридный конъюгат (т.е. белок, ковалентно связанный с одним или многими полисахаридами). В конкретных аспектах полисахарид представляет собой декстран, и белок представляет собой изолят сывороточного белка (WPI).
а. Сывороточные белки молока и гликозилирование
Сывороточные белки молока представляют собой ключевые ингредиенты, используемые в самых разнообразных пищевых продуктах благодаря их превосходной функциональности (например, стабилизации пены и эмульсий), и высокому содержанию в них питательных веществ (например, высокому содержанию незаменимых аминокислот) [1].
Сывороточные белки молока легко денатурируются во время обработки пищевых продуктов вследствие возникающих в действительности условий окружающей среды, таких как высокая температура, давление и/или присутствие разнообразных кислот. Поэтому повышение стабильности сывороточных белков вызывало особый интерес у изготовителей пищевых продуктов, чтобы улучшить их применение в пищевых целях. Реакция гликозилирования между сывороточным белком и декстраном, протекающая с образованием оснований Шиффа в качестве промежуточных продуктов, была признана эффективным методом повышения термической стабильности белков [1] и улучшения характеристик эмульгирования [3, 4].
Образование белково-полисахаридных конъюгатов улучшает стабильность эмульсии при замораживании-оттаивании, даже после трех циклов замораживания-оттаивания при температуре -18°C в течение 22 часов и +40°C в течение 2 часов [5].
Нехимическое гликозилирование белка и полисахарида может быть проведено сухим нагреванием смеси белкового порошка и порошка, содержащего восстанавливающие сахара, при температуре около 60°C и относительной влажности по меньшей мере ~44%, в течение вплоть до 4 дней [6]. При использовании сухого нагревания, скорее, нежели с подведением теплоты непосредственно к WPI и декстрану в их исходной порошкообразной форме, сначала готовят растворы WPI и декстрана в жидкой форме, с последующей лиофильной сушкой для получения смеси в твердой форме, которая более пригодна для последующей реакции гликозилирования.
Альтернативный способ гликозилирования WPI состоит в нагревании растворов декстрана и изолята сывороточного белка при температуре 60°C и рН ~6,5 в течение 48 часов, так называемым влажным нагреванием. Например, см. опубликованную патентную заявку США 20090311407. Влажное нагревание обусловливает значительно более короткую продолжительность реакции, чем сухое нагревание, и возникающие в ходе процесса продукты реакции Майяра, которые образуют темные пигменты, получаются с меньшей легкостью, чем в методе сухого нагревания. Ни один из способов не соответствует широко распространенному применению вследствие связанных с этим затрат и ввиду того, что оба способа имеют низкие выходы (<5%).
ЭЛЕКТРОПРЯДЕНИЕ
Электропрядение представляет собой форму электроосаждения, и является универсальным способом, который может создавать волокна из синтетических и/или природных полимеров с использованием электрического поля, образуемого высоким напряжением (например, от 15 до 25 кВ). Электропрядение может быть игольным или безыгольным. Конкретная конфигурация электропрядения состоит из контейнера для раствора, оснащенного фильерой, сборной пластины, используемой для сбора осажденных волокон, и высоковольтного блока для генерирования электрических полей между фильерой и сборной пластиной. См. фиг. 1. Контейнер для раствора может представлять собой шприц, оборудованный электропроводной иглой, которая может быть использована как в качестве фильеры, так и в качестве электрода.
Расход потока раствора полимера можно регулировать с использованием шприцевого насоса. Когда раствор полимера электрически заряжается посредством электрода, форма капли раствора полимера на кончике фильеры будет преобразовываться в форму конуса Тейлора. Если напряжение является достаточно высоким, чтобы преодолеть силы поверхностного натяжения, из вершины конуса Тейлора будут выбрасываться тонкие струи полимера. Выброшенные струи полимера быстро высыхают вследствие малых размеров струи, и со сборной пластины могут быть собраны сухие твердые волокна. Средние диаметры изготовленных электропрядением волокон обычно составляют около нескольких сотен нанометров.
Для успешного электропрядения целевого раствора с образованием волокон требуются взаимные сопряжения полимерных цепей. Взаимные сопряжения полимерных цепей предотвращают разрушение полимерных струй под действием электрических растягивающих сил во время электропрядения. Если концентрация полимера является слишком низкой, перекрывание полимерных цепей в растворе отсутствует. Когда концентрация повышается до критической концентрации, с*, инициируется переплетение цепей. Степень переплетения цепей зависит как от концентрации полимера, так и от молекулярной массы, (ne)soln, и может быть определена согласно уравнению 2.1 [12]:
,
где с представляет концентрацию полимера в растворе, Mw представляет молекулярную массу полимера в растворе, и Ме представляет молекулярную массу полимерного переплетения или среднюю молекулярную массу между местами связывания в переплетении.
Из уравнения 2.1 следует, что чем выше молекулярная масса полимера, тем ниже концентрация полимера, необходимая для поддержания постоянного числа переплетений, т.е. поддержания способности раствора к электропрядению.
БЕЛКИ И УГЛЕВОДЫ/ПОЛИСАХАРИДЫ
Сывороточный белок является ключевым ингредиентом в пищевых продуктах. Сывороточные белки обеспечивают хорошую стабильность пены и эмульсий и также имеют высокое содержание незаменимых аминокислот. Получение сывороточных белков известно в данной области. Как правило, молочные сливки центрифугируют для удаления сметаны или жира, затем осаждают казеин, обеспечивая возможность выделения сывороточных белков на дополнительных стадиях центрифугирования, фильтрования и/или ионного обмена. Типичный изолят сывороточного белка (WPI) может содержать β-лактоглобулин (~55%), α-лактальбумин (~25%), иммуноглобулин (~15%), бычий сывороточный альбумин (~4%) и лактоферрин (~2%).
В то время как WPI представляет собой предпочтительный целевой объект гликозилирования, для электропрядения могут быть выбраны самые разнообразные белки. В некоторых аспектах используют белок только одного типа. В других аспектах белок может представлять собой смесь одного или более белков.
Может быть применен любой растворимый белок животного или растительного происхождения, который может быть подвергнут электропрядению и конъюгированию (введен в реакцию с сахаридами). Пригодные белки включают белки растительного происхождения, белки животного происхождения и белки микробного происхождения. Например, пригодные белки растительного происхождения могут включать соевый (концентрат/изолят), гороховый (концентрат/изолят), пшеничный (глиадин, глютен), чечевичный, бобовый, кукурузный (зеин), овсяной, ячменный, амарантовый, рисовый, гречишный, спельтовый, льняного семени, киноа, ржаной, сорговый, тэффовый, подсолнечный, и ореховый (арахисовый, миндальный, пекановый). Пригодные белки животного происхождения могут включать молочный (сывороточный и казеин), рыбный белок, животный белок (говяжий, свиной, телячий, домашней птицы…) и яичный белок. Пригодные белки микробного происхождения могут включать белки морских водорослей, грибковые и бактериальные.
Углеводы, имеющие восстанавливающие функциональные группы, могут быть использованы в условиях непосредственной обработки. В частности, подходящие углеводы либо имеют альдегидную группу, либо способны образовывать альдегид в растворе в результате изомеризации. Пригодные углеводы включают агар, агарозу, альгинат, альгиновую кислоту, альгуроновую кислоту, альфа-глюкан, амилопектин, амилозу, арабиногалактан, арабиноксилан, бета-глюкан, коллаген BioCell, каллозу, капсулан, каррагенан, целлодекстрин, целлулин, целлюлозу, хитин, хитиновые нанофибриллы, хитозан, хризоламинарин, курдлан, циклодекстрин, сефарозу DEAE, декстран, декстрин, экзополисахарид, альфа-циклодекстрин, Fibersol, фиколл, фруктан, фукоидан, галактоглюкоманнан, галактоманнан, геллановую камедь, глюкан, глюкоманнан, гликокаликс, гликоген, гидролизованный гуар, гуаровую камедь, гуммиарабик, гемицеллюлозу, гомополисахарид, гипромеллозу, икодекстрин, инулин, инулозу, кефиран, конжак, ламинарин, лентинан, леван, лихенин, камедь плодов рожкового дерева, MatrixDB, гемицеллюлозный полисахарид "смешанно-связанный глюкан" (mixed-linkage glucan (MLG)), модифицированный крахмал, растительный клей, камедь, окисленную целлюлозу, парамилон, пектиновую кислоту, пектин, пентастарч, плеуран, полидекстрозу, полигликольальгинат, полисахарид, полисахарид-пептид, порфиран, пуллулан, шизофиллан, сефарозу, синистрин, сизофиран, соевое волокно, сугаммадекс, негидролизуемые полимеры глюкозы, велановую камедь, ксантановую камедь, ксилан, ксилоглюкан, экстракты юкки или юкки/квилайи, и зимозан.
Особую категорию пригодных углеводов составляют полисахариды.
Такие сахариды, как полисахариды, представляют собой полимеры сахаридов. Олигосахариды представляют собой полимеры из 2-200 сахаридов. Полисахариды представляют собой более длинные полимеры, чем олигосахариды. Пригодными полисахаридами могут быть полимеры сахаридов числом от 201 до 2500.
Подходящие полисахариды включают декстраны. "Декстран" означает сложный разветвленный полисахарид, включающий многочисленные молекулярные фрагменты глюкозы, связанные в цепи с разнообразными длинами (например, от 10 до 150 кДа). Линейная цепь состоит из α1→6-гликозидных связей между молекулами глюкозы. Боковая цепь (ответвление) может содержать α1→4-связи, α1→2-связи и/или α1→3-связи.
Сахариды (типа сахаров), пригодные для конформации конъюгации, включают восстанавливающие моносахариды, такие как глюкоза, фруктоза, глицериновый альдегид и галактоза. Многие дисахариды, такие как лактоза и мальтоза, также имеют восстанавливающую форму, так как одна из двух структурных единиц может иметь открытоцепную форму с альдегидной группой. В полимерах глюкозы, таких как крахмал и производные крахмала, типа глюкозного сиропа, мальтодекстрина и декстрина, макромолекула начинается с восстанавливающего сахара, который представляет собой свободный альдегид. В большей степени гидролизованный крахмал содержит больше восстанавливающих сахаров. Процентное содержание восстанавливающих сахаров, присутствующих в этих производных крахмала, называется декстрозным эквивалентом (DE).
В некоторых вариантах осуществления углеводы, такие как декстраны, имеют молекулярную массу в диапазоне от около 10 кДа до около 500 кДа. В других вариантах осуществления декстраны имеют молекулярную массу в диапазоне от около 40 кДа до около 100 кДа или от около 70 кДа до около 100 кДа.
Термин "около", как использовано в данном описании, означает ±10% численного значения.
Любые пригодные способы электропрядения и устройства для них могут быть применены в той мере, насколько обеспечивается следующее: подача напряжения высокой мощности, резервуар для раствора полимера, электроды (один заземленный) и приемная пластина. Подходящие устройства для электропрядения включают, но не ограничиваются ими, Needle-less (безыгольное) и Near Field (ближнепольное).
Электропрядение создает существенные преимущества перед предшествующими способами формирования конъюгированных белков. Настоящий способ электропрядения облегчает гликозилирование в гораздо более коротких продолжительностях отжига и с увеличенным выходом.
В изготовленных электропрядением WPI-декстрановых волокнах, например, физическое состояние двух полимеров является таким, что большее число контактов молекулы с молекулой достигается по меньшей мере при трех обстоятельствах. Во-первых, полимеры распределяются более однородно, поскольку электропрядение обусловливает выравнивание молекул благодаря растягивающим и изгибающим перемещениям. Во-вторых, предотвращается разделение фаз вследствие быстрого испарения растворителя. Наконец, малые диаметры волокон проявляются в плотной упаковке волокон, составленных из молекул WPI и декстрана.
Таким образом, без намерения вдаваться в теорию, представляется, что процесс электропрядения побуждает молекулы эффективно выстраиваться в линию, и что это остается неизменным благодаря переплетениям полимерных цепей, приводя к особенно хорошему выходу и сокращению затрат.
Для оптимизации формирования волокон во время электропрядения могут варьироваться разнообразные параметры. Параметры, которые влияют на формирование волокон, включают концентрацию декстрана, вязкость смеси, соотношение "белок-полисахарид" в смеси, допустимую продолжительность отжига.
Приведенное ниже следующее описание сосредоточено на одном аспекте изобретения, а именно, на конъюгате "декстран-сывороточный белок". Должно быть понятно, что способ может быть распространен на любой пригодный белок и углевод.
i. Концентрация декстрана и формирование волокон
Декстран ответственен за пригодность к электропрядению смесей "декстран-сывороточный белок", вместе с тем одновременно служил в качестве восстанавливающего сахара реагента для формирования конъюгата.
Для формирования конъюгатов с белками использовали широкий круг декстранов с молекулярными массами от 10-440 кДа. Более низкие молекулярные массы обычно дают более высокие уровни конъюгатов. Для электропрядения высокие концентрации требуются, когда используют полимеры с низкой молекулярной массой. К сожалению, высокие концентрации приводят к высоковязким растворам, которые непригодны для электропрядения.
Способность декстрана образовывать волокна соотносится с концентрацией и размером декстрана. Все растворы декстрана (ММ=100 кДа) с концентрацией вплоть до 0,45 г/мл проявляли реологические свойства разжижения при сдвиговой нагрузке. Для декстрана с молекулярной массой 100 кДа получение гладких и непрерывных волокон требует концентрации 0,1 г/мл или выше, или 0,6 г/мл или выше. Таким образом, в некоторых аспектах для декстрана со 100 кДа смесь для электропрядения содержит по меньшей мере 0,6 г/мл, по меньшей мере 0,8 г/мл или по меньшей мере 1,0 г/мл декстрана. Верхний предел для декстрана может определяться вязкостью смеси и зависит от типа полимера, и является таким, как 5 г/мл.
Белок и полисахарид для электропрядения могут быть объединены в буфере. Например, смесь для электропрядения может быть приготовлена в фосфатном буфере. рН буфера составляет от 6,0 до 7,0; обычно рН буфера составляет 6,50±0,07.
ii. Вязкость
Вязкость является важным параметром для эффективного электропрядения. Когда вязкость слишком высока, это оказывает негативное влияние на эффективность электропрядения. Например, вязкость раствора, полученного из декстрана с 40 кДа, составляла около 1,8 Па·сек (Пуаз). Этот уровень вязкости был неблагоприятным по ряду причин. Во-первых, приготовление раствора было затруднительным, поскольку раствор становился "липким". Во-вторых, во время приготовления раствора образовывался толстый слой пены вследствие высокого содержания белка в смеси (0,25 г/мл растворителя). Растворитель может представлять собой любой подходящий растворитель, в котором может быть растворен полимер. В идеальном случае, растворитель должен быстро испаряться и не должен быть легковоспламеняющимся. Пригодным растворителем является вода. Поэтому требуется длительное время релаксации для удаления слоя пены из смеси. Более того, во время электропрядения быстро возникало засорение, приводящее к наименьшей наблюдаемой производительности.
Вязкость может быть измерена любым подходящим методом с использованием любых пригодных вискозиметров и реометров, таких, но без ограничения, как вискозиметр Брукфильда. Как правило, вязкость должна следовать желаемой реологической характеристике, и не ограничивается каким-нибудь единичным значением.
Напротив, раствор, приготовленный из декстрана со 100 кДа - испытанного декстрана с наибольшей молекулярной массой - имел наименьшую вязкость. Более низкая вязкость упрощает приготовление раствора, уменьшает образование слоя пены, сокращает частоту засорения.
Подходящая вязкость может быть получена с использованием декстранов с молекулярными массами свыше 40 кДа. Например, такие смеси могут содержать декстраны с молекулярными массами от 50 кДа до около 100 кДа. В вариантах осуществления для получения желаемых уровней вязкости могут быть использованы смеси декстранов с молекулярными массами от 50 кДа до около 100 кДа. В конкретных вариантах осуществления декстран имеет молекулярную массу около 100 кДа.
iii. Размер и формирование волокна
Представляется, что конъюгация полисахарида с белком стимулируется, когда сокращается или устраняется образование бусинок. Бусинки считаются дефектом и тем самым нежелательны. Предпочтительны волокна с малым количеством бусинок или вообще без них. В аспектах изобретения волокна не содержат бусинок, как определяется сканирующей электронной микроскопией.
Диаметр волокна может влиять на конъюгацию. Волокна с меньшими диаметрами обеспечивают плотную упаковку волокон, составленных из молекул WPI и декстрана. Конъюгация стимулируется плотной упаковкой молекул WPI и декстрана. В некоторых аспектах диаметр волокна в некоторых аспектах составляет около 100 нм и около 500 нм. В других аспектах диаметр волокна составляет около 100 нм и около 300 нм. В еще других аспектах диаметр волокна составляет от около 150 нм до около 250 нм. Диаметр волокна может быть измерен, как описано в примере 1.
iv. Соотношение смеси белка и декстрана
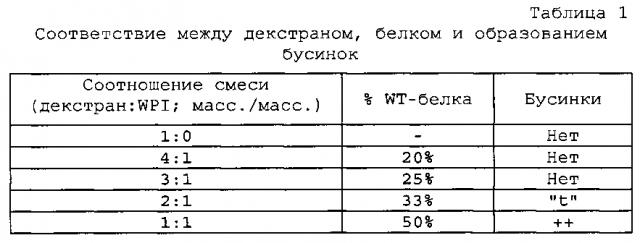
Содержание белка в волокне также влияет как на формирование волокон, так и на конъюгацию. Когда содержание белка в смеси возрастает, диаметр волокна сокращается. Например, см. пример 7. Когда содержание белка повышалось до 33% по массе или выше, образовывались бусинки. Таким образом, для сокращения или устранения образования бусинок на волокнах содержание белка в растворе смеси может составлять до 25% масс. Для получения таких уровней процентного содержания, соотношение смеси (масс./масс.) полисахарида к белку в водном растворе, используемом для злектропрядения, может быть таким, как в таблице 1.
Дополнительные подробности в отношении содержания белка в пленках приведены в таблице 9.
Образование гликопротеина, измеренное гель-электрофорезом, стимулируется, когда соотношение "декстран:WPI" возрастает.
Таким образом, для достижения хороших формирования волокон и конъюгации соотношение смеси полисахарида к белку составляет более 2:1. В некоторых аспектах отношение составляет около 3:1, около 4:1, около 5:1, около 6:1, около 7:1, около 8:1, около 9:1, около 10:1, около 11:1, около 12:1. Соответственно, в конкретных аспектах диапазон соотношений может составлять от около 3:1 до около 10:1. В других аспектах отношение может составлять от около 3:1 до около 4:1.
v. Условия отжига
Электропрядение сближает молекулы друг с другом. Затем отжиг создает температуру, которая инициирует взаимодействие между молекулами. Отжиг, как применяемый в данном описании, представляет собой процесс конъюгации, в результате которого между белком и полисахаридом образуются ковалентные связи. Отжиг может быть усилен применением более длительного периода инкубации. Например, продолжительность отжига может иметь нижний предел 2 часа, 4 часа, 6 часов, 8 часов, 10 часов, 12 часов, 14 часов, 16 часов, 18 часов или 24 часа. Продолжительность отжига может иметь верхний предел 4 часа, 6 часов, 8 часов, 10 часов, 12 часов, 14 часов, 16 часов, 18 часов, 24 часа или 28 часов. Часто продолжительность отжига составляет от 2 часов до 4 часов. Цвет пленок становился слегка более темным, когда использовали более длительную продолжительность отжига, в особенности когда пленки подвергали отжигу в течение более 24 часов.
vi. Влияние величины декстрана на конъюгацию
Гликозилирование было более медленным, когда для получения изготовленной электропрядением пленки использовали декстран с молекулярной массой 100 кДа. Однако величина гликопротеинов, образованных между WPI и декстраном с 100 кДа, была больше, чем ~280 кДа, тогда как при формировании из WPI и декстрана с 40 и 70 кДа величины составляли свыше ~70 и ~200 кДа, соответственно.
vii. Влияние влажности на гликозилирование
Способы могут быть исполнены при конкретных уровнях влажности для стимулирования гликозилирования. Более высокая влажность может стимулировать гликозилирование, как определяется более интенсивной полосой гликопротеинов, наблюдаемой в геле с окрашенным гликопротеином. Гораздо меньшая интенсивность полос гликозилирования в геле с окрашенным гликопротеином наблюдалась, когда образцы были подвергнуты отжигу при низкой влажности. Усиленное гликозилирование было получено при 74%-ной относительной влажности (RH) (фиг. 20А и В; полоски 8-10), сравнительно с 0%-ной RH (фиг. 20А и В; полоски 2-4) и 44%-ной RH (фиг. 20А и В; полоски 5-7). Таким образом, в некоторых аспектах относительная влажность составляет по меньшей мере 44%. В других аспектах относительная влажность составляет от 45% до 75% или 65% и 75%; в других дополнительных аспектах относительная влажность составляет от 70% до 80%.
Температура обычно является примерно комнатной температурой; однако принимается во внимание любая подходящая температура от 10°C до 70°C.
а. Оценка конъюгации
Внешний вид WPI-декстрановых конъюгатов может отслеживаться любым подходящим методом. Например, гель-электрофорез может быть предпочтительным способом подтверждения присутствия гликопротеинов в подвергнутой отжигу пленке, изготовленной электропрядением. Метод FTIR (инфракрасной спектроскопии с преобразованием Фурье) не столь четко показывает разницу между ИК-спектрами пленок в состоянии сразу после прядения и подвергнутых отжигу пленок, и поэтому может быть менее полезным.
Содержание цитированных выше патентов, опубликованных заявок и журнальных статей включено в данное описание посредством ссылки.
Наряду с пунктами патентной формулы, изобретение также определяется следующими пунктами:
1. Способ получения углеводно-белкового волокна или частицы электропрядением, включающий стадии
приготовления водного раствора, включающего углевод и белок,
приложения к раствору напряжения от 15 до 25 кВ,
сбора волокна на сборной пластине.
2. Способ по пункту 1, в котором электропрядение является безыгольным.
3. Способ по пункту 1 или пункту 2, в котором углевод имеет альдегидную группу или образует альдегидную группу в результате изомеризации.
4. Способ по пункту 1 или пункту 2, в котором углевод представляет собой декстран.
5. Способ по пункту 4, в котором молекулярная масса декстрана составляет от около 10 кДа до около 500 кДа.
6. Способ по пункту 4, в котором декстран присутствует в концентрации от 0,1 г/мл до около 5,0 г/мл.
7. Способ по любому из предшествующих пунктов, в котором белок выбирают из белков микробного, животного, молочного или растительного происхождения.
8. Способ по любому из предшествующих пунктов, в котором белок представляет собой изолят сывороточного белка (WPI).
9. Способ по любому из предшествующих пунктов, в котором водный раствор включает углевод и белок в молярном соотношении (масс./масс.) от 50:1 до 1:50.
10. Способ по любому из предшествующих пунктов, в котором водный раствор включает углевод и белок в молярном соотношении (масс./масс.) от 3:1 до 1:10.
11. Способ по любому из предшествующих пунктов, в котором водный раствор включает декстран и WPI.
12. Способ по любому из предшествующих пунктов, дополнитель