Замещённые 2-(1,3-бензотиазол-2-ил)-3-фенил-1н-1,2,4-триазол-5-ил) пропановые кислоты и способ их получения
Иллюстрации
Показать всеИзобретение относится к новым замещенным 2-(1-(1,3-бензотиазол-2-ил)-3-фенил-1Н-1,2,4-триазол-5-ил) пропановым кислотам общей формулы I
,
а также к способу их получения. Технический результат: получены новые замещенные 2-(1-(1,3-бензотиазол-2-ил)-3-фенил-1Н-1,2,4-триазол-5-ил) пропановые кислоты, которые могут быть использованы в качестве противомикробных средств. 2 н. и 1 з.п. ф-лы, 3 табл., 5 пр.
Реферат
Изобретение относится к области органической и медицинской химии, а именно: к способу получения соединений класса гетероциклических систем - замещенным 2-(1-(1,3-бензотиазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил) пропановым кислотам общей формулы (I), которые могут быть использованы для синтеза новых гетероциклических соединений и в медицине в качестве потенциального противомикробного средства
,
где R = NO2 (Ia - 2-(1-(1,3-бензотиазол-2-ил)-3-(4-нитрофенил)-1H-1,2,4-триазол-5-ил) пропановая кислота;
R = OCH3 (Iб - 2-(1-(1,3-бензотиазол-2-ил)-3-(4-метоксифенил)-1H-1,2,4-триазол-5-ил) пропановая кислота;
R = CH3 (Iв - 2-(1-(1,3-бензотиазол-2-ил)-3-(4-метилфенил)-1H-1,2,4-триазол-5-ил) пропановая кислота;
R = Н (Iг - 2-(1-(1,3-бензотиазол-2-ил)-3-фенил)-1H-1,2,4-триазол-5-ил) пропановая кислота.
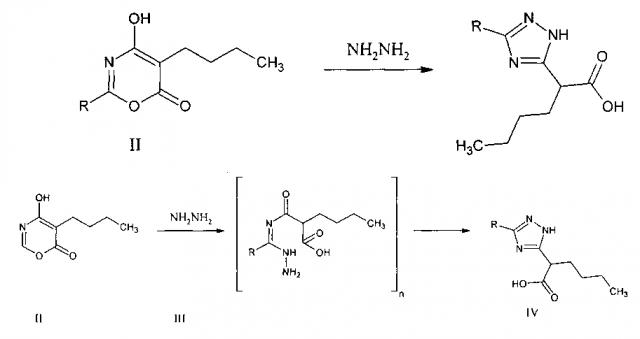
Описан триазол 2-(1,2,4-триазол-5-ил) гексановая кислота IV, которая была получена взаимодействием оксазина II с гидразином III в среде абсолютного метанола [Яковлев И.П. Пути образования, строение и свойства 1,3-оксазин-4,6-дионов и их производных [Текст]: диссертация на соискание ученой степени д-ра хим. наук 02.00.03, защищена 1996, утв. 1997 / Игорь Павлович Яковлев. - Санкт-Петербург, 1996].
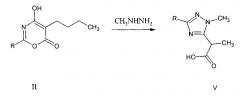
Известна триазол 2-(1-метил-1,2,4-триазол-5-ил) пропановая кислота V, полученная взаимодействием оксазина II с метанольным раствором метилгидразина в среде абсолютного метанола [Яковлев И.П. Пути образования, строение и свойства 1,3-оксазин-4,6-дионов и их производных [Текст]: диссертация на соискание ученой степени д-ра хим. наук 02.00.03, защищена 1996, утв. 1997 / Игорь Павлович Яковлев. - Санкт-Петербург, 1996].
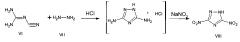
Описан однореакторный способ получения 3,5-динитро-1,2,4-триазола VIII из циангуанидина VI и гидразина VII [Синтез 3,5-динитро-1,2,4-триазола / В.М. Чернышев, Н.Д. Земляков, В.Б. Ильин, В.А. Таранушич // ЖПХ - 2000. - Т. 73, №5. C. 791-793].
В литературе описаны 3(5)-нитрамино-1,2,4-триазолы X, получаемые циклизацией ацилпроизводных нитроаминогуанидина в щелочной среде [Чипен Г.И., Гринштейн В.Я, Прейман Р.П. // ЖОХ. - 1962. - Т. 32, №8, - С. 1230-1233].
Из патентной и научно-технической литературы не выявлены ни способы получения новых, заявляемых авторами соединений, ни сама структура.
Задачей предлагаемой группы изобретений является создание новых неописанных в литературе соединений - замещенных 2-(1-(1,3-бензотиазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил) пропановых кислот (I), что позволит расширить ассортимент потенциальных противомикробных средств.
Техническими результатами, на решение которых направлена группа изобретений, являются получение новых гетероциклических соединений формулы I, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в медицине, например, в качестве антимикробного средства; разработка простого способа их получения с высоким выходом продукта.
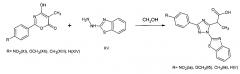
Поставленная задача осуществляется путем взаимодействия 2,5-замещенного-4-гидрокси-6H-1,3-оксазин-6она с бензтиазол-2-илгидразином в соотношении (моль) 1:1 в среде безводного полярного органического растворителя (метанол), причем смесь перемешивают в течение 48 часов при комнатной температуре, полученный осадок подкисляют и выделяют целевой продукт.
Поставленная задача осуществляется также тем, что для выделения целевого продукта осадок промывают водой, сушат, перекристаллизовывают из метанола и выделяют вакуумным фильтрованием по схеме:
Способ получения замещенных 2-(1-бензоил-3-фенил-1,2,3-триазол-5-ил) пропановых кислот (Iа, б, в, г), изучен и проведен в лабораторных условиях на стандартном товарном сырье.
Данные элементного анализа, выход продукта реакции, температура плавления и величина Rf приведены в табл. 1, спектральные характеристики полученного соединения приведены в табл. 2 и 3.
Пример 1. Получение 2-(1-(1,3-бензотиазол-2-ил)-3-(4-нитрофенил)-1H-1,2,4-триазол-5-ил) пропановой кислоты (Ia)
В плоскодонную колбу емкостью 100 мл загружают 5,0 г (0,02 моль) 2-(4-нитрофенил)-4-гидрокси-5-метил-6H-1,3-оксазин-6она и 30 мл абсолютного метанола в качестве среды, а затем к суспензии добавляют 3,31 г (0,02 моль) бензтиазол-2-илгидразина.
Реакционную смесь перемешивают в течение 48 часов при комнатной температуре, сначала смесь приобретает оранжевый цвет, затем бежевый. Смесь отфильтровывают и подкисляют соляной кислотой, промывают водой. Осадок сушат и перекристаллизовывают из метанола.
Перекристаллизованный продукт бежевого цвета составляет 5,7 г, 72,2% от теоретического из расчета на 2-(4-нитрофенил)-4-гидрокси-5-метил-6H-1,3-оксазин-6он. Температура плавления 192-195°C. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в ацетоне в системе этилацетат.Rf=0,76. Состав синтезированного соединения подтвержден элементным анализом. Брутто-Формула: C18H13N5O4S. Найдено %: C - 54,68, Н - 3,31, N - 17,71, О - 16,19, S - 8,11. Вычислено %: С - 54,63, Н - 3,29, N - 17,7, О - 16,22, S - 8,16.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1H и 13C, УФ-, ИК-спектроскопией, масс-спектрометрией.
В ИК-спектрах вещества (таблетки KBr) наиболее характеристической является область 3050-2850 см-1, где наблюдаются полосы поглощения, соответствующие валентным колебаниям связей С-Н. Аналогичные колебания C=O связей карбоксильной группы находятся 1700 см-1.Также валентные колебания в области 1300 см-1 сигналы связей C=N, и сигналы ОН группы в области 3400 см-1.
УФ-спектр 2-(1-(1,3-бензотиазол-2-ил)-3-(4-нитрофенил)-1Н-1,2,4-триазол-5-ил) пропановой кислоты в 96% этаноле имеет максимум поглощения в области длины волны 275 нм.
В спектре ЯМР 1H полученного соединения в ДМСО-d6 присутствуют сигналы протонов бензольных колец (57.52-8.41) и сигналы протона карбоксильной группы δ 13.0, сигналы метальной группы δ 1.77. А также сигналы СН группы пропановой кислоты δ 4,99.
Спектр ЯМР 13C этого соединения присутствуют сигналы углерода метальной группы в области (δ 15,35 м.д.), сигналы CH группы в области (δ 21.93 м.д.), углероды бензольных колец в области (δ 113.80-135.30 м.д.), к углеродам карбоксильной группы относятся сигналы (δ 172,78 м.д.)
Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=395).
Пример 2. Получение 2-(1-(1,3-бензотиазол-2-ил)-3-(4-метоксифенил)-1H-1,2,4-триазол-5-ил) пропановой кислоты (Iб)
В плоскодонную колбу емкостью 100 мл загружают 5,0 г (0,021 моль) 2-(4-метоксифенил)-4-гидрокси-5-метил-6H-1,3-оксазин-6она и 30 мл абсолютного метанола в качестве среды, а затем к суспензии добавляют 3,47 г (0,021 моль) бензтиазол-2-илгидразина.
Реакционную смесь перемешивают в течение 48 часов при комнатной температуре смесь приобретает белый цвет. Смесь отфильтровывают и подкисляют соляной кислотой, промывают водой. Осадок сушат и перекристаллизовывают из метанола.
Перекристаллизованный продукт белого цвета составляет 6,2 г, 77,6% от теоретического из расчета на 2-(4-метоксифенил)-4-гидрокси-5-метил-6H-1,3-оксазин-6он. Температура плавления 160-162°C. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в ацетоне в системе этилацетат Rf=0,65. Состав синтезированного соединения подтвержден элементным анализом. Брутто-Формула: C19H16N4O3S. Найдено %: С - 59,99, Н - 4,24, N - 14,73, О - 12,62, S - 8,43. Вычислено %: С - 60, Н - 4,21, N - 14,71, О - 12,64, S - 8,44.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1H и 13C, УФ-, ИК-спектроскопией, масс-спектрометрией.
В ИК-спектрах вещества (таблетки KBr) наиболее характеристической является область 3050-2800 см-1, где наблюдаются полосы поглощения, соответствующие валентным колебаниям связей С-Н. Аналогичные колебания C=O связей карбоксильной группы находятся 1700 см-1. Также валентные колебания в области 1550 см-1 сигналы связей C=N, и сигналы ОН группы в области 3400 см-1.
УФ-спектр 2-(1-(1,3-бензотиазол-2-ил)-3-(4-метоксифенил)-1H-1,2,4-триазол-5-ил) пропановой кислоты в 96% этаноле имеет максимум поглощения в области длины волны 285 нм и 310 нм.
В спектре ЯМР 1H полученного соединения в ДМСО-d6 присутствуют сигналы протонов бензольных колец (δ7.13-8.17) и сигналы протона карбоксильной группы δ 12.9, сигналы метальной группы δ 1.72. А также сигналы CH группы пропановой кислоты δ 4,96, и сигналы метокси группы δ 3.85.
Спектр ЯМР 13C этого соединения присутствуют сигналы углерода метальной группы в области (δ 16,05 м.д.), сигналы СН группы в области (δ 27.74 м.д.), углероды бензольных колец в области (δ 115.93-151.55 м.д.), к углеродам карбоксильной группы относятся сигналы (δ 176,18 м.д.).
Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=380).
Пример 3. Получение 2-(1-(1,3-бензотиазол-2-ил)-3-(4-метилфенил)-1H-1,2,4-триазол-5-ил) пропановая кислота (Iв)
В плоскодонную колбу емкостью 100 мл загружают 5,0 г (0,023 моль) 2-(4-метилфенил)-4-гидрокси-5-метил-6H-1,3-оксазин-6она и 30 мл абсолютного метанола в качестве среды, а затем к суспензии добавляют 3,8 г (0,023 моль) бензтиазол-2-илгидразина.
Реакционную смесь перемешивают в течение 48 часов при комнатной температуре, смесь приобретает нежно-оранжевый цвет. Смесь отфильтровывают и подкисляют соляной кислотой, промывают водой. Осадок сушат и перекристаллизовывают из метанола.
Перекристаллизованный продукт персикового цвета составляет 6,45 г - 76,97%) от теоретического из расчета на 2-(4-метилфенил)-4-гидрокси-5-метил-6H-1,3-оксазин-6он. Температура плавления 165-167°C. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в ацетоне в системе этилацетат. Rf=0,56. Состав синтезированного соединения подтвержден элементным анализом. Брутто-Формула: C19H16N4O2S. Найдено %: С - 62,62, Н - 4,43, N - 15,37, О - 8,78, S - 8,8. Вычислено %: С - 62,59, Н - 4,45, N - 15,35,0 - 8,77, S - 8,84.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1H и 13C, УФ-, ИК-спектроскопией, масс-спектрометрией, а также рентгеноструктурным анализом.
В ИК-спектрах вещества (таблетки KBr) наиболее характеристической является область 3100-2850 см-1, где наблюдаются полосы поглощения, соответствующие валентным колебаниям связей С-Н. Аналогичные колебания C=O связей карбоксильной группы находятся 1650 см-1. Также валентные колебания в области 1550 см-1 сигналы связей C=N, и сигналы OH группы в области 3450 см-1.
УФ-спектр 2-(1-(1,3-бензотиазол-2-ил)-3-(4-метоксифенил)-1Н-1,2,4-триазол-5-ил) пропановой кислоты в 96% этаноле имеет максимум поглощения в области длины волны 310 нм.
В спектре ЯМР 1H полученного соединения в ДМСО-d6 присутствуют сигналы протонов бензольных колец (δ7.36-8.18) и сигналы протона карбоксильной группы δ 13.1, сигналы метальной группы δ 1.74. А также сигналы СН группы пропановой кислоты δ 4,96, и сигналы метальной группы бензольного кольца δ 2.41.
Спектр ЯМР 13C этого соединения присутствуют сигналы углерода метильной группы в области (δ 16,05 м.д.), сигналы CH группы в области (δ 21.13 м.д.), углероды бензольных колец в области (δ 119.52-135.76 м.д.), к углеродам карбоксильной группы относятся сигналы (δ 176,18 м.д.)
Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=364).
Пример 4. Получение 2-(1-(1,3-бензотиазол-2-ил)-3-фенил-1Н-1,2,4-триазол-5-ил) пропановая кислота (Iг)
В плоскодонную колбу емкостью 100 мл загружают 5,0 г (0,025 моль) 2-фенил-4-гидрокси-5-метил-6H-1,3-оксазин-6она и 30 мл абсолютного метанола в качестве среды, а затем к суспензии добавляют 4,13 г (0,025 моль) бензтиазол-2-илгидразина.
Реакционную смесь перемешивают в течение 48 часов при комнатной температуре, смесь приобретает бежевый цвет. Затем смесь отфильтровывают и подкисляют соляной кислотой и промывают водой. Осадок сушат и перекристаллизовывают из метанола.
Перекристаллизованный продукт белого цвета составляет 7,27 г - 83% от теоретического из расчета на 2-фенил-4-гидрокси-5-метил-6H-1,3-оксазин-6он. Температура плавления 170-172°C. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в ацетоне в системе этилацетат. Rf=0,67. Состав синтезированного соединения подтвержден элементным анализом. Брутто-Формула: C18H14N4O2S. Найдено %: С - 61,66, Н - 4,03, N - 15,97, О - 9,18, S - 9,15. Вычислено %: С - 61,70, Н - 4,03, N - 15,99, О - 9,13, S - 9,15.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1H и 13C, УФ-, ИК-спектроскопией, масс-спектрометрией.
В ИК-спектрах вещества (таблетки KBr) наиболее характеристической является область 3100-2900 см-1, где наблюдаются полосы поглощения, соответствующие валентным колебаниям связей C-H. Аналогичные колебания C=O связей карбоксильной группы находятся 1600 см-1. Также валентные колебания в области 1550 см-1 сигналы связей C=N, и сигналы OH группы в области 3400 см-1.
УФ-спектр 2-(1-(1,3-бензотиазол-2-ил)-3-(4-метоксифенил)-1H-1,2,4-триазол-5-ил) пропановой кислоты в 96% этаноле имеет максимум поглощения в области длины волны 265 нм.
В спектре ЯМР 1H полученного соединения в ДМСО-d6 присутствуют сигналы протонов бензольных колец (δ7.20-8.17) и сигналы протона карбоксильной группы δ 13.0, сигналы метальной группы δ 1.74, а также сигналы CH группы пропановой кислоты δ 4,98.
Спектр ЯМР 13C этого соединения характеризуется сигналами ядер углерода бензольных колец (δ 119.52-134.56 м.д.), сигналы углерода метальной группы (δ 16,05 м.д), сигналы карбоксильной группы (δ 176,18 м.д).
Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=350).
Пример 5. Соединение Iа, б, в, г обладают противомикробной активностью. Определение минимально ингибирующих концентраций (МИК) проводили методом серийных разведений в мясопептонном бульоне в отношении тест-культур микроорганизмов Staphylococcus aureus (штамм 209-Р), Escherichia coli (штамм 1257), Candida albicans (штамм АТСС 885-635), рекомендованных Государственной Фармакопеей [Государственная Фармакопея СССР. Вып. 2. Общие методы анализа. Лекарственное растительное сырье / МЗ СССР - 11 изд. доп. - М.: Медицина, 1989. 400 с.]. Исследуемые соединения ограниченно растворяются в воде, поэтому в качестве растворителя использовали 20% раствор ДМСО, не подавляющий роста ни одной из использованных тест-культур в условиях эксперимента. Минимальная ингибирующая концентрация соединения Ia на E. coli и C. albicans составляет 8 и 12 мкг/мл соответственно, а на St. aureus составляет 16 мкг/мл, соединения 16 на E. coli и С. albicans составляет 62,5 и 8 мкг/мл соответственно, а на St. aureus составляет 32 мкг/мл, соединения Iв на E. coli и С. albicans составляет 16 и 32 мкг/мл соответственно, а на St. aureus составляет 62,5 мкг/мл, соединения Iг на E. coli и С. albicans составляет 8 и 16 мкг/мл соответственно, а на St. aureus составляет 4 мкг/мл, соединения, что находится на уровне широко используемого на практике антибиотика (офлоксацин - 16 мкг/мл).
Полученные новые соединения - замещенные 2-(1-(1,3-бензотиазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил) пропановые кислоты (Iа, б, в, г) могут быть использованы для синтеза новых гетероциклических соединений и в медицине в качестве потенциального антимикробного средства; разработан простой способ их синтеза.
1. 2-(1-(1,3-бензотиазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил) пропановые кислоты общей формулы I R=NO2 (Ia - 2-(1-(1,3-бензотиазол-2-ил)-3-(4-нитрофенил)-1H-1,2,4-триазол-5-ил) пропановая кислота;R=ОСН3 (Iб - 2-(1-(1,3-бензотиазол-2-ил)-3-(4-метоксифенил)-1H-1,2,4-триазол-5-ил) пропановая кислота;R=СН3 (Iв - 2-(1-(1,3-бензотиазол-2-ил)-3-(4-метилфенил)-1H-1,2,4-триазол-5-ил) пропановая кислота;R=Н (Iг - 2-(1-(1,3-бензотиазол-2-ил)-3-фенил)-1H-1,2,4-триазол-5-ил) пропановая кислота.
2. Способ получения 2-(1-(1,3-бензотиазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил) пропановых кислот общей формулы I R=NO2 (Ia - 2-(1-(1,3-бензотиазол-2-ил)-3-(4-нитрофенил)-1H-1,2,4-триазол-5-ил) пропановая кислота;R=ОСН3 (Iб - 2-(1-(1,3-бензотиазол-2-ил)-3-(4-метоксифенил)-1H-1,2,4-триазол-5-ил) пропановая кислота;R=СН3 (Iв - 2-(1-(1,3-бензотиазол-2-ил)-3-(4-метилфенил)-1H-1,2,4-триазол-5-ил) пропановая кислота;R=Н (Iг - 2-(1-(1,3-бензотиазол-2-ил)-3-фенил)-1H-1,2,4-триазол-5-ил) пропановая кислота, путем взаимодействия 2,5-замещенного-4-гидрокси-6H-1,3-оксазин-6она с бензтиазол-2-илгидразином в соотношении 1:1 в среде безводного полярного органического растворителя (метанол), причем смесь перемешивают в течение 48 часов при комнатной температуре, полученный осадок подкисляют и выделяют целевой продукт.
3. Способ получения 2-(1-(1,3-бензотиазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил) пропановых кислот общей формулы I по п. 2, отличающийся тем, что для выделения целевого продукта осадок промывают водой, сушат, перекристаллизовывают из метанола и выделяют вакуумным фильтрованием.