Средство для лечения остеомиелита
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к средству для лечения остеомиелита. В качестве средства для лечения остеомиелита предлагается использовать β-аланиламид бетулоновой кислоты формулы (I):
Предлагаемое средство эффективно предотвращает генерализацию воспалительного процесса, формирование обширных зон некроза и инфильтрации, остеокластическую резорбцию кости и формирование секвестров, что, в свою очередь, предотвращает хронизацию воспалительного процесса и способствует его разрешению; способствует более раннему и более выраженному образованию рыхлой волокнистой соединительной и грубоволокнистой костной тканей по сравнению с группами без применения бетамида, что свидетельствует о позитивном влиянии препарата на репаративные процессы в кости; вызывает более быстрое наступление фазы функциональной адаптации, способствуя более быстрому завершению репаративного эндохондрального остеогистогенеза с образованием зрелой костной ткани. 59 ил., 3 табл
Реферат
Изобретение относится к медицине.
Известно, что для лечения остеомиелита применяются антибиотики (A. Trampuz, W. Zimmerli Diagnosis and treatment of infections associated with fracture-fixation devices // Injury, 37 (2006), pp. S59-S66; A. Trampuz, A.F. Widmer Infections associated with orthopedic implants // Curr Opin Infect Dis, 19 (2006), pp. 349-356; T. Miclau, A.H. Schmidt, J.C. Wenke, et al. Infection // Orthop Trauma, 24 (2010), pp. 583-586; L. Frommelt Principles of systemic antimicrobial therapy in foreign material associated infection in bone tissue, with special focus on periprosthetic infection // Injury, 37 (2006), pp. S87-S94; J.A. Forsberg, B.K. Potter, G Cierny 3rd, L. Webb Diagnosis and management of chronic infection // J Am Acad Orthop Surg, 19 (Suppl. 1) (2011), pp. S8-S19; H.G. Schmidt, A.H. Tiemann, R. Braunschweig, et al. Arbeitsgemeinschaft septische Chirugie der DGOUC10 [Definition of the diagnosis osteomyelitis-osteomyelitis diagnosis score (ODS)] // Z Orthop Unfall, 149 (2011), pp. 449-460; R.O. Darouiche Treatment of infections associated with surgical implants // N Engl J Med, 350 (2004), pp. 1422-1429).
Так, используют цефазолин, ванкомицин, а также различные комбинации с рифампицином: рифампицин + ципрофлоксацин, рифампицин + левофлоксацин (Korean Society for Chemotherapy; Korean Society of Infectious Diseases; Korean Orthopaedic Association Clinical guidelines for the antimicrobial treatment of bone and joint infections in Korea // Infect Chemother. 2014 Jun; 46 (2): 125-38).
Однако данные препараты обладают побочными эффектами:
цефазолин (http://www.tiensmed.ru/news/cefazolin-10x.html) - гепатотоксичностью, он инициациирует псевдомембранозный колит, аллергические реакции, нарушения системы кроветворения, обладает нефротоксичностью, способствует развитию суперинфекции;
ванкомицин (https://health.mail.ru/drug/vancomycin/) - кардиотоксичностью, нефротоксичностью, он вызывает нарушения системы кроветворения, аллергические и дерматологические реакции;
рифампицин (https://health.mail.ru/drug/rifampicin/) - гепатотоксичностью, нефротоксичностью, он инициирует псевдомембранозный колит, аллергические реакции, тромбоцитопению, эозинофилию, лейкопению, гемолитическую анемию, нарушение менструального цикла;
ципрофлоксацин (https://health.mail.ru/drug/tsiprofloksatsin/) - гепатотоксичностью, нефротоксичностью, кардиотоксичностью, он инициирует псевдомембранозный колит, расстройство сна, галлюцинации, расстройства зрения, нарушения системы кроветворения, флебиты, васкулиты, аллергические реакции;
левофлоксацин (https://health.mail.ru/drug/levofloxacin_2/) - гепатотоксичностью, кардиотоксичностью, нефротоксичностью, вызывает расстройства сна, галлюцинации, спутанность сознания, двигательные расстройства, нарушения зрения, слуха, нарушения системы кроветворения, артралгии, миалгии, разрыв сухожилий, тендинит, аллергические и дерматологические реакции, способствует развитию суперинфекции.
Из указанных выше лекарственных средств наиболее близок к заявляемому средству рифампицин, но он обладает значительным негативным действием на организм, кроме того его использование в качестве монотерапии для лечения остеомиелита нецелесообразно (W. Zimmerli, A.F. Widmer, М. Blatter, R. Frei, P.E. Ochsner, Foreign-Body Infection (FBI) Study Group Role of rifampin for treatment of orthopedic implant-related staphylococcal infections: a randomized controlled trial // JAMA, 279 (1998), pp. 1537-1541).
β-аланиламид бетулоновой кислоты не обладает гепатотоксичностью, нефротоксичностью, не вызывает аллергических реакций и нарушения эндокринных функций, а также может применяться в качестве монотерапии.
Известны амиды и пептиды бетулоновой кислоты, обладающие противоопухолевой активностью. Так, в работе [B.B. Saxena, L. Zhu, М. Нао, E. Kisilis, M. Katdare, O. Oktem, A. Bomshteyn, P. Rathnam, Bioorg. Med. Chem. Lett., 2006, V. 14. 6349-6358.] описан амид бетулоновой кислоты и N-Boc-лизина, обладающий специфической активностью при раке простаты in vitro и in vivo. Амиды бетулоновой кислоты, содержащие фрагменты каприловой, пеларгоновой и ундекановой кислот ингибируют рост опухолевых клеток МТ-4, MOLT-4, СЕМ и Hep G2 [Покровский А.Г., Шинтяпина А.Б., Н.В. Пронкина, В.С.Кожевников, Плясунова О.А., Шульц Э.Э., Толстиков Г.А. Доклады академии наук. 2006. Т. 407. №5. С. 698-701.]. Дипептид бетулоновой кислоты (N′{N-[3-Оксолуп-20(29)-ен-28-оил]-9-аминононаноил}-3-амино-3-фенилпропионовая кислота) запатентован в качестве агента, обладающего противовирусной (антиВИЧ, противогерпесной) и иммуностимулирующей активностью [патент РФ 2211843]. В работе [Шинтяпина А.Б., Шульц Э.Э., Петренко Н.И., Узенкова Н.В., Толстиков Г.А., Пронкина Н.В., Кожевников B.C., Покровский А.Г. Биоорганическая химия. 2007. Т. 33. №6, 620-626.] показано, что это соединение ингибирует рост опухолевых 3 типов клеток - МТ-4, MOLT-4, СЕМ и Hep G2. Дипептид является активным индуктором апоптоза в лейкозных клетках и клетках гепатокарциномы in vitro [Автандилов Г.Г. Медицинская морфометрия: руководство. М.: Медицина, 1990. 384 с.].
Известно применение β-аланиламид бетулоновой кислоты [3 оксо-20(29)-лупен-28-оил]-3-амино-пропионовая кислота, «бетамид») в качестве корректора цитостатической полихимиотерапии (патент РФ №2353623). Это производное бетулоновой кислоты является малотоксичным веществом (LD50 свыше 5000 мг/кг). Оно оказывает тормозящее влияние на рост опухолей в условиях in vivo, усиливает противоопухолевое действие комплекса химиопрепаратов и оказывает выраженный органопротекторный эффект на состояние печени, почек, сердца, тимуса, крови, проявляя цитопротекторное действие.
Цитопротекторные свойства бетамида выявлены в экспериментах на мышах и крысах на фоне воздействия цитотоксических препаратов, моделирующих полихимиотерапию (ПХТ) CHOP (циклофосфан, доксорубицин, винкристин, преднизолон) и монотерапию (циклофосфан, доксорубицин). На фоне ПХТ CHOP курсовое введение бетамида (7 дней в дозе 50 мг/кг) мышам с перевиваемыми злокачественными опухолями снижает тяжесть вызванных полихимиотерапией дистрофических и некробиотических изменений, улучшает состояние микроциркуляторного русла в тканях внутренних органов, повышает пластические резервы клеток. В почках мышей CBA/Lac с лимфомой RLS количество некротизированных нефроцитов снижалось на 77%, в связи с чем число клеток со слабо выраженной гиалиново-капельной дистрофией увеличивалось на 53%, просвет проксимальных канальцев уменьшался на 43% по сравнению с группой ПХТ [Н.А. Жукова, Д.Е. Семенов, И.В. Сорокина, Т.Г. Толстикова, С.В. Позднякова, О.Р. Грек. Влияние производных бетулина на структуру почки при лимфоме RLS/Сибирский научный вестник - IX. Новосибирск, 2006. Стр 49-51]. В печени объемная плотность зон некрозов уменьшалась на 63%, а зон с дистрофически измененными гепатоцитами увеличивалась на 19%, при этом степень дистрофии снижалась до слабо выраженной гиалиново-капельной, повышалась объемная плотность синусоидов (на 28%), уменьшался внутрипеченочный холестаз, увеличивалось количество гликогена во всех гепатоцитах [Н.А. Жукова, Д.Е. Семенов, И.В. Сорокина, Т.Г. Толстикова, С.В. Позднякова, О.Р. Грек. Влияние бетулоновой кислоты и ее производного [3-оксо-20(29)-лупен-28-оил]-3-аминопропионовой кислоты на структуру печени мышей с лимфомой RLS / Бюллетень экспериментальной биологии и медицины. 2005. Том 140, №9, стр.348-351].
В печени мышей С57B1/6 с карциномой легких Льюиса введение бетамида после ПХТ вызывало снижение моноцеллюлярных некрозов на 53% и уменьшение тяжести дистрофии по сравнению с группой ПХТ. В гепатоцитах практически отсутствовали зоны «опустошения» цитоплазмы и липидная инфильтрация, отмечалась незначительная субплазмалеммальная вакуолизация цитоплазмы. Введение бетамида в сочетании с ПХТ увеличило объемную плотность синусоидов на 33-40%) и снизило в них количество метастазов по сравнению с введением только ПХТ [Н.А. Жукова, И.В. Сорокина, Т.Г. Толстикова, Е.Л. Лушникова, Л.М. Непомнящих, Д.Е. Семенов. Структура печени мышей с перевитой карциномой легких Льюис при полихимиотерапии и коррекции бетулоновой кислотой и ее производными / Бюллетень экспериментальной биологии и медицины. 2010. Том 150, №7, стр. 108-112]. В почках этих же мышей под влиянием бетамида уменьшалась на 80-98% объемная плотность эпителиоцитов в состоянии некроза, снижалась на 54-60% доля клеток с гидропической и баллонной дистрофией и увеличивался на 170-180% объем эпителиоцитов с признаками слабо выраженной дегенерации. Уменьшение отека эпителиоцитов и щеточной каймы на фоне введения бетамида сопровождалось увеличением объемной плотности просвета проксимальных канальцев (на 50%-75%) [Н.А. Жукова, И.В. Сорокина, Т.Г. Толстикова, М.П. Долгих, Д.Е. Семенов. Влияние бетулоновой кислоты и ее производных на морфологию почек животных с перевитой карциномой легких Льюис на фоне полихимиотерапии и без ее воздействия / Химия в интересах устойчивого развития. 2010. Том 18, №4, стр. 483-488].
Введение аланиламида бетулоновой кислоты здоровым крысам Wistar в течение 14 дней в дозе 50 мг/кг на фоне однократного введения цитостатиков по схеме ПХТ CHOP снижало на 75-90% количество гепатоцитов с дистрофическими изменениями и уменьшало на 35-45% число некротизированных клеток. Объемная плотность двуядерных гепатоцитов возрастала на 36-58%), что отражает повышение регенераторного потенциала печени. В почках аланиламид бетулоновой кислоты существенно ослаблял воспалительный эффект цитостатиков, уменьшал на 65-72% долю нефроцитов проксимальных канальцев с гидропической дистрофией, снижал на 60% долю некротических изменений. В тимусе отмечен протекторный эффект аланиламида бетулоновой кислоты, проявившийся в повышении корково-мозгового индекса и снижении количества телец Гассаля в мозговой части [И.В. Сорокина, Т.Г. Толстикова, Н.А. Жукова, Н.И. Петренко, Э.Э. Шульц, Н.В. Узенкова, О.Р. Грек, С.В. Позднякова, Г.А. Толстиков. Бетулоновая кислота и ее произвоные - новая группа агентов, снижающих побочное действие цитостатиков // Доклады Академии наук. 2004. Том 399, №2, стр. 274-277; Грек О.Р., Позднякова С.В., Надеев А.П., Пронин B.C., Жукова Н.А., Сорокина И.В., Волкова Е.Б., Толстикова Т.Г. Эффективность бетулоновой кислоты и ее аланинамидных производных при восстановлении паренхимы печени крыс в постцитостатический период // Эксп. и клин, фармакология. 2005, Т. 68, №6, с. 49-51; Позднякова С.В., Грек О.Р., Фунтиков А.С., Жукова Н.А., Сорокина И.В. Толстикова Т.Г. Сравнительное изучение нефропротективной активности бетулоновой кислоты и ее производных при экспериментальной полихимиотерапии // Журн. экспер. клин. мед.2006, №1-2, с. 15-17]. Тимус-протекторное действие аланиламида бетулоновой кислоты отмечено на фоне однократного введения циклофосфана здоровым крысам в токсической дозе 125 мг/кг, вызывающего стойкое угнетение кроветворных органов. Протекторное действие аланиламида бетулоновой кислоты выражалось в поддержании нормальной массы тимуса в течение 14-ти дневного введения данного средства в дозе 50 мг/кг. При сочетанном введении аланиламида бетулоновой кислоты с доксорубицином наблюдалась тенденция к более быстрому восстановлению массы тимуса [И.В. Сорокина. Реф. дисс. докт. биол. наук. 2010].
Курсовое введение аланиламида бетулоновой кислоты на фоне комплекса цитостатиков (циклофосфан, доксорубицин, винкристин, преднизолон в дозах 1/20 от ЛД50) восстанавливало активность цитохрома Р450IIIA4 через 6 дней после воздействия и увеличивало активность P450IIE1 на 26,5 и 24,1% соответственно на 7-е и 14-е сутки наблюдения. [С.В. Позднякова, О.Р. Грек, Р.А. Жоголь, И.В. Шарапов, В.И. Шарапов, И.В. Сорокина, Т.Г. Толстикова. Активность монооксигеназ печени и биологические эффекты бетулоновой кислоты и ее амидных производных // Вестник НГУ. Серия: Биология, клиническая медицина. 2006. Том 4, вып. 3, с. 66-70].
В многочисленных экспериментах in vitro была выявлена противовирусная активность бетулоновой кислоты и ее амида, в том числе против вируса иммунодефицита человека, вирусов гриппа А, герпеса простого типа 1; антибактериальный эффект в отношении Staphylococcus aureus, Bacillus antracoides, Eschericha coli и Salmonella typhimurium и противогрибковая активность в отношении Candida albicans и Aspergillus niger, (Флехтер О.Б., Бореко Е.И., Нигматуллина Л.Р., Третьякова Е.В., Павлова Н.И., Балтина Л.А., Николаева С.Н., Савинова О.В., Еремин В.Ф., Галин Ф.З., Толстиков Г.А. Синтез и противовирусная активность амидов и конъюгатов бетулоновой кислоты с аминокислотами // Биоорганическая химия. - 2004. - Т. 30. - №1. - С. 89-98).
Применение производных бетулоновой кислоты в качестве средства для лечения остемиелита описано не было.
Раскрытие изобретения
В качестве средства для лечения остеомиелита предлагается использовать β-аланиламид бетулоновой кислоты (название по номенклатуре IUPAC: N-[3-оксо-20(29)лупен-28-оил]-3-аминопропионовая кислота; предполагаемое коммерческое название - «бетамид») формулы (I):
Технический результат
β-аланиламид бетулоновой кислоты:
1) предотвращает генерализацию воспалительного процесса, формирование обширных зон некроза и инфильтрации, остеокластическую резорбцию кости и формирование секвестров, что в свою очередь предотвращает хронизацию воспалительного процесса и способствует его разрешению;
2) способствует более раннему и более выраженному образованию рыхлой волокнистой соединительной и грубоволокнистой костной тканей, по сравнению с группами без применения бетамида, что свидетельствует о позитивном влиянии препарата на репаративные процессы в кости;
3) вызывает более быстрое наступление фазы функциональной адаптации, способствуя более быстрому завершению репаративного эндохондрального остеогистогенеза с образованием зрелой костной ткани.
Способ получения β-аланиламида бетулоновой кислоты описан в патенте РФ №2353623.
Перечень фигур
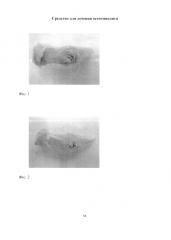
Фиг. 1. Проксимальный конец большеберцовой кости крысы через 1 мес после инокуляции Золотистого стафилококка. Деформация кости за счет сформированной костной мозоли. Макропрепарат.
Фиг. 2. Проксимальный конец большеберцовой кости крысы через 1 мес после инокуляции Золотистого стафилококка. В зоне трепанационного отверстия просматриваются введенные хлопчатобумажные нити. Казеозное содержимое трепанационного отверстия, шероховатая структура поверхности большеберцовой кости, отсутствие просвечивания костного мозга сквозь пластинку диафиза свидетельствуют о развитии остемиелита. Макропрепарат.
Фиг. 3. Участок большеберцовой кости крысы через 1 мес после инокуляции Золотистого стафилококка. Зона некроза, остеокластическая резорбция большеберцовой кости. Окраска гематоксилином и эозином. Ув. 100.
Фиг. 4. Участок большеберцовой кости крысы через 1 мес после инокуляции Золотистого стафилококка. Гранулоцитарно-лимфоцитарная инфильтрация в области введенных в трепанационное отверстие нитей с Золотистым стафилококком. Окраска гематоксилином и эозином. Ув. 400.
Фиг. 5. Участок большеберцовой кости крысы через 1 мес после инокуляции Золотистого стафилококка. Большое количество макрофагов в зоне, ограничивающей участок некроза. Иммуногистохимическая реакция на ED1 подобный антиген. Ув. 400.
Фиг. 6. Участок большеберцовой кости крысы через 1 мес после инокуляции Золотистого стафилококка. Неоднородность распределения коллагеновых волокон в относительно сохраненных костных балках, связанная с остеокластической резорбцией участка кости, располагающейся в непосредственной близости к зоне инфильтрации и некроза. Окраска пикрофуксином по ван Гизону. Ув. 100.
Фиг. 7. Участок большеберцовой кости крысы через 1 мес после инокуляции Золотистого стафилококка. Образование тонких балок грубоволокнистой костной ткани. Окраска пикрофуксином по ван Гизону. Ув. 400.
Фиг. 8. Участок большеберцовой кости крысы через 1 мес после инокуляции Золотистого стафилококка. Врастание сосудов в подвергающуюся дистрофии и деструкции гиалиновую хрящевую ткань Образование тонких балок грубоволокнистой костной ткани. Окраска альциановым синим и кармалюмом Майера. Ув. 400.
Фиг. 9. Участок большеберцовой кости крысы через 1 мес после инокуляции Золотистого стафилококка, повышенное содержание адипоцитов и единичные мастоциты в костном мозге. Окраска альциановым синим (pH=1,0) и кармалюмом Майера. Ув. 400.
Фиг. 10. Проксимальный конец большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Выраженная деформация кости за счет сформированной костной мозоли. Макропрепарат.
Фиг. 11. Проксимальный конец большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Сформированная костная мозоль, в зоне трепанационного отверстия просматриваются введенные хлопчатобумажные нити и желтое казеозное содержимое. Снижение просвечивания костного мозга сквозь пластинку диафиза. Макропрепарат.
Фиг. 12. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Зона некроза и жирового перерождения костного мозга. Окраска пикрофуксином по ван Гизону. Ув. 100.
Фиг. 13. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Сохранение зоны некроза костного мозга, ограниченной лимфоцитарно-макрофагальных валом, в непосредственной близости к введенным хлопчатобумажным нитям. Окраска гематоксилином и эозином. Ув. 100.
Фиг. 14. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Формирование макрофагально-фибробластического барьера, ограничивающего зону некроза. Иммуногистохимическая реакция на ED1-подобный антиген с последующей докраской ядер гематоксилином. Ув. 600.
Фиг. 15. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Грануляционная ткань, ограничивающая очаги некроза, остеокластическая резорбция большеберцовой кости. Окраска гематоксилином и эозином. Ув. 400.
Фиг. 16. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Деструкция и гибель хондроцитов, врастание кровеносного сосуда, репаративный эндохондральный остеогистогенез. Окраска альциановым синим при pH=1,0 с докраской кармалюмом Майера. Ув. 400.
Фиг.17. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Активное формирование межклеточного вещества рыхлой соединительной ткани, содержащей сульфатированные (хондроитин-4 сульфат, хондроитин-6-сульфат) гликозаминогликаны, многочисленные кровеносные сосуды. Окраска альциановым синим при pH 1,0 с докраской кармалюмом Майера. Ув. 400.
Фиг. 18. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Активное формирование межклеточного вещества рыхлой соединительной ткани, содержащей коллагеновые волокона. Окраска пикрофуксином по ван Гизону. Ув. 100.
Фиг. 19. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Наличие костных осколков с погибшими остеоцитами в зоне некроза. Окраска пикрофуксином по ван Гизону. Ув. 100.
Фиг. 20. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Повышенное содержание адипоцитов и отсутствие мастоцитов в костном мозге. Окраска альциановым синим (рН=1,0) и кармалюмом Майера. Ув. 400.
Фиг. 21. Проксимальный конец большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка. Деформация кости за счет сформированной костной мозоли. Макропрепарат.
Фиг. 22. Проксимальный конец большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка. Закрытие трепанационного отверстия, формирование костных выступов, окружающих концы введенной нити. Четко заметна граница снижения просвечивания костного мозга сквозь пластинку диафиза. Макропрепарат.
Фиг. 23. Участок большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка. Сохранение зоны некроза, ограниченной макрофагально-фиброцитарным валом, в непосредственной близости от введенных хлопчатобумажных нитей. Фрагментация костных балок, наличие зон с очаговым просветлением, неравномерное расположение остеоцитов. Окраска гематоксилином и эозином. Ув. 100.
Фиг. 24. Участок большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка. Большое количество макрофагов рядом с введенной нитью. Иммуногистохимическая реакция на ED1-подобный антиген. Ув. 400
Фиг.25. Участок большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка. Гигантская многоядерная клетка Пирогова-Лангханса, содержащая многочисленные ядра по периферии цитоплазмы в виде кольца. Окраска гематоксилином и эозином. Ув. 400.
Фиг. 26. Участок большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка. Заполнение пространств между костными балками фиброзной тканью с большим содержанием коллагеновых волокон, а также повышенное содержание жировых клеток в костном мозге. Иммуногистохимическое выявление коллагена II типа с последующей докраской ядер гематоксилином. Ув. 100.
Фиг. 27. Участок большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка. Повышенное содержание адипоцитов в пограничной с воспалительным инфильтратом зоне и единичные мастоциты в костном мозге. Окраска альциановым синим (рН=1,0) и кармалюмом Майера. Ув. 400.
Фиг. 28. Участок большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка. Наличие костных осколков с погибшими остеоцитами в зоне некроза. Окраска пикрофуксином по ван Гизону. Ув. 100.
Фиг. 29. Проксимальный конец большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка и введения масляной эмульсии. Деформация кости за счет сформированной костной мозоли. В области трепанационного отверстия имеется казеозное содержимое желтого цвета. Макропрепарат.
Фиг. 30. Большеберцовая кость крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Участок некроза, зональное распределение иммунокомпетентных клеточных элементов. Окраска гематоксилином Эрлиха и эозином. Ув. 100.
Фиг. 31. Большеберцовая кость крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Зональное распределение иммунокомпетентных клеточных элементов Иммуногистохимическая реакция на ED1-подобный антиген. Ув. 400.
Фиг. 32. Большеберцовая кость крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Остеокластическая резорбция кости. Окраска гематоксилином Эрлиха и эозином. Ув. 100.
Фиг. 33. Большеберцовая кость крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Образование тонких балок грубоволокнистой костной ткани, формирование грубоволокнистой соединительной ткани, жировое перерождение костного мозга. Окраска пикрофуксином по ван Гизону. Ув. 400.
Фиг. 34. Большеберцовая кость крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Наличие костного осколка с погибшими остеоцитами в зоне некроза. Окраска пикрофуксином по ван Гизону. Ув. 100.
Фиг. 35. Большеберцовая кость крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Очаги деструкции и гибели хондроцитов и репаративный эндохондральный остеогистогенез. Окраска альциановым синим (pH 1,0) и кармалюмом Майера. Ув. 100.
Фиг. 36. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка. Активное формирование межклеточного вещества рыхлой соединительной ткани, многочисленные кровеносные сосуды. Окраска пикрофуксином по ван Гизону. Ув. 400.
Фиг. 37. Большеберцовая кость крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Увеличение количества мастоцитов в пограничной с воспалительным инфильтратом зоне костного мозга. Окраска альциановым синим (pH 1,0) и кармалюмом Майера. Ув. 100.
Фиг. 38. Проксимальный конец большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка и введения масляной эмульсии. Сохранение деформации кости за счет сформированной костной мозоли. Макропрепарат.
Фиг. 39. Большеберцовая кость крысы через 3 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Участок некроза, зональное распределение иммунокомпетентных клеточных элементов, жировое перерождение костного мозга. Окраска гематоксилином Эрлиха и эозином. Ув. 100.
Фиг. 40. Большеберцовая кость крысы через 3 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Формирование макрофагально-фибробластического барьера, ограничивающего зону некроза. Иммуногистохимическая реакция на ED1-подобный антиген с последующей докраской ядер гематоксилином. Ув. 600.
Фиг. 41. Большеберцовая кость крысы через 3 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Фрагментация костных балок, содержащих немногочисленные остеоциты. Окраска пикрофуксином по ван Гизону. Ув. 100.
Фиг. 42. Большеберцовая кость крысы через 3 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Неравномерное распределение коллагеновых волокон в костных балках, с образованием участков просветления. Окраска пикрофуксином по ван Гизону. Ув. 100.
Фиг. 43. Большеберцовая кость крысы через 3 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Образование фиброзной ткани с большим содержанием коллагеновых волокон. Окраска пикрофуксином по ван Гизону. Ув. 400.
Фиг. 44. Большеберцовая кость крысы через 3 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии. Образование фиброзной ткани с большим содержанием сульфатированных гликозаминогликанов. Окраска альциановым синим (pH 1,0) и кармалюмом Майера. Ув. 400.
Фиг. 45. Проксимальный конец большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка и введения масляной эмульсии с бетамидом. Уменьшение деформации кости за счет сформированной костной мозоли. Макропрепарат.
Фиг. 46. Проксимальный конец большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка и введения масляной эмульсии с бетамидом. В зоне трепанационного отверстия имеется желтоватое казеозное содержимое. Поверхность большеберцовой кости сохраняет гладкую структуру, отмечается просвечивание костного мозга сквозь пластинку диафиза. Макропрепарат.
Фиг. 47. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Отсутствие зон некроза и существенное снижение зон инфильтрации. Окраска гематоксилином Эрлиха и эозином. Ув. 100.
Фиг. 48. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Высокое содержание макрофагов в воспалительном инфильтрате. Иммуногистохимическая реакция на ED1-подобный антиген с последующей докраской ядер гематоксилином. Ув. 600.
Фиг. 49. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Отсутствие гранулоцитов в фокусах воспалительных инфильтратов. Окраска гематоксилином Эрлиха и эозином. Ув. 400.
Фиг. 50. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Формирование рыхлой волокнистой соединительной и грубоволокнистой костной тканей в непосредственной близости к введенным в трепанационное отверстие нитям с культурой бактерий. Окраска пикрофуксином по ван Гизону. Ув. 400.
Фиг. 51. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Образование рыхлой волокнистой соединительной ткани с большим содержанием сульфатированных гликозаминогликанов. Окраска альциановым синим (pH 1,0) и кармалюмом Майера. Ув. 400.
Фиг. 52. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Остеокластическая резорбция кости. Окраска гематоксилином Эрлиха и эозином. Ув. 400.
Фиг. 53. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Репаративный эндохондральный остеогистогенез, включение в новообразованную костную ткань хлопчатобумажной нити, введенной в трепанационное отверстие. Окраска альциановым синим (pH 1,0) и кармалюмом Майера. Ув. 400.
Фиг. 54. Участок большеберцовой кости крысы через 2 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Жировое перерождение костного мозга, выраженное возрастание количества мастоцитов. Окраска альциановым синим (pH 1,0) и кармалюмом Майера. Ув. 400.
Фиг. 55. Проксимальный конец большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка и введения масляной эмульсии с бетамидом. Незначительная деформация кости за счет сформированной костной мозоли. Макропрепарат.
Фиг. 56. Проксимальный конец большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка и введения масляной эмульсии с бетамидом. В зоне трепанационного отверстия имеется выступающее над поверхностью кости фиброзное образование. Поверхность большеберцовой кости сохраняет гладкую структуру, отмечается просвечивание костного мозга сквозь пластинку диафиза. Макропрепарат.
Фиг. 57. Участок большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Формирование рыхлой волокнистой соединительной и грубоволокнистой костной тканей вокруг введенных в трепанационное отверстие нитей с культурой микроорганизмов. Окраска пикрофуксином по ван Гизону. Ув. 100.
Фиг. 58. Участок большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Отграничение от окружающего костного мозга новообразованной костной тканью введенных нитей с культурой микроорганизмов. Окраска пикрофуксином по ван Гизону. Ув. 100.
Фиг. 59. Участок большеберцовой кости крысы через 3 мес после инокуляции Золотистого стафилококка и введения per os масляной эмульсии бетамида. Отграничение от окружающего костного мозга новообразованной костной тканью введенных нитей с культурой микроорганизмов. Жировое перерождение костного мозга, высокое содержание мастоцитов Окраска альциановым синим (pH 1,0) и кармалюмом Майера. Ув. 100.
Обоснование изобретения
Было проведено исследование, целью которого являлось изучение влияния бетамида на развитие хронического остеомиелита.
Материал и методы исследования
Эксперимент проведен на 48 половозрелых крысах-самцах Wistar с исходной массой 180-220 г. У экспериментальных животных под общим ингаляционным наркозом была проведена трепанация большеберцовой кости с последующим тампонированием отверстия хлопчатобумажной нитью, находившейся 30 минут в смыве суточной культуры Золотистого стафилококка (штамм 209). Предварительное исследование позволило установить, что при подобной обработке нити на ней содержится 1×107 колониеобразующих единиц. В последующем у крыс развивался остеомиелит большеберцовой кости.
Животных выводили из эксперимента через 1, 2 и 3 месяца с момента инокуляции Золотистого стафилококка (группы «В 1 мес»; «В 2 мес»; «В 3 мес», буква «В» обозначает «воспаление»).
В качестве контроля использовали 6 интактных животных (группа инт). В течение 10 дней до истечения 2-месячного срока с момента инокуляции Золотистого стафилококка 12 животным вводили водно-масляную эмульсию (6 животных в группе «ВО 2 мес» и 6 животных в группе «ВО 3 мес»; буквосочетание «ВО» обозначает «воспаление + олеум»). В группе «ВО 3 мес» введение водно-масляной эмульсии продолжали еще в течение 1 месяца до истечения 3-месячного срока с момента инокуляции Золотистого стафилококка.
В течении 10 дней до истечения 2-месячного срока с момента инокуляции Золотистого стафилококка 12 животным вводили водно-жировую эмульсию с бетамидом (группы «ВОБ 2 мес» - 6 животных; группа «ВОБ 3 мес» - 6 животных; буквосочетание «ВОБ» обозначает «воспаление + олеум + бетамид»). В группе «ВОБ 3 мес» введение водно-масляной эмульсии с бетамидом продолжали еще в течение 1 месяца до истечения 3-месячного срока с момента инокуляции Золотистого стафилококка.
Всего в эксперименте было 7 групп с воспроизведением остемиелита (по 6 животных) и одна группа интактных животных (также 6 особей).
Эксперимент выполнялся с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинской декларации по защите позвоночных животных, используемых для лабораторных и иных целей.
Большеберцовую кость фиксировали в 12% формалине. Из залитых в парафин объектов делали серийные срезы толщиной 7 мкм. Морфология большеберцовой кости оценивалась при обзорной микроскопии после окраски срезов гематоксилином Эрлиха и эозином. Коллагеновые волокна выявлялись пикрофуксином по ван Гизону, сульфатированные гликозаминогликаны - альциановым синим при pH 1,0, популяцию тучных клеток оценивали после окраски альциановым синим при pH 1,0 с последующей докраской ядер кармалюмом Майера.
При подготовке гистологических препаратов для иммуногистохимического анализа использовали стандартный метод фиксации тканей в нейтральном формалине с последующей дегидратацией и заливкой в парафин. Иммуногистохимическое исследование по оценке уровня экспрессии маркера клеток макрофагального ряда (ED1-подобный антиген) проводили с помощью непрямого стрептавидин-биотинового пероксидазного метода. В работе использовали систему визуализации Peroxidase Detection System (Novocastra). После процедуры демаскировки иммуногистохимическую окраску препаратов проводили в соответствии с общепринятыми стандартами указанной методики (Ramos-Vara J.А., 2005; Bibeau F. et al., 2006) и в соответствии с рекомендациями фирм-производителей.
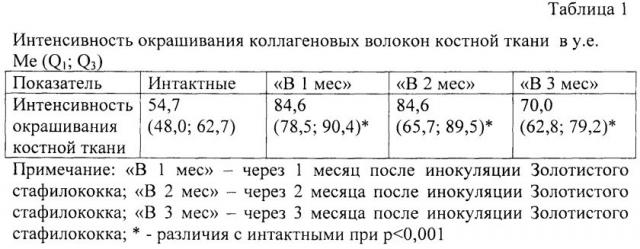
Анализ интенсивности окрашивания коллагеновых волокон проводился с помощью светооптического микроскопа и морфометрического комплекса на базе микроскопа Micros МС 300А, цифровой камеры СХ 13 с («Baumer Electric GmbH», Германия) и программного обеспечения ImageJ 1.42g (Национальный институт здоровья, США). Для каждой группы оценивалось по 48 изображений.
Статистическую обработку результатов исследования проводили с использованием программного пакета для статистической обработки SPSS v 13.0 for Windows. Для сравнения независимых групп использовали критерий Крускала-Уоллиса с последующим межгрупповым сравнением с помощью критерия Манна-Уитни. Различия между значениями сравниваемых параметров расценивали как статистически значимые при p<0,05. Полученные в ходе исследования данные представлены как медиана (Me) и интерквартильный размах (Q1; Q3).
Результаты исследования
При макроскопическом исследовании большеберцовой кости через 1 месяц после инокуляции Золотистого стафилококка отмечалась деформация кости за счет формирующейся костной мозоли (фиг. 1). В зоне трепанационного отверстия отчетливо просматривались введенные хлопчатобумажные нити и казеозное содержимое (фиг. 2). Гладкая в норме поверхность большеберцовой кости в проксимальном отделе приобрела шероховатую структуру. Костный мозг не просвечивался сквозь пластинку диафиза.
При морфологическом исследовании большеберцовой кости через 1 месяц после трепанации и введения нити с культурой Золотистого стафилококка выявлялись признаки остеомиелита. Так, в месте костного дефекта выявлялись обширные зоны некроза и инфильтрации грануло-, лимфо- и гистиоцитарными элементами (фиг. 3), располагающимися в непосредственной близости к введенным в трепанационное отверстие нитям с Золотистым стафилококком. При этом отмечалось достаточно четкое зонирование клеточных элементов. Как правило, в фокусе таких инфильтратов находились скопления нейтрофилов (рис 4), которые были окружены лимфоцитарно-макрофагальным валом (фиг. 5). Обращало на себя внимание отсутствие на данном сроке признаков васкулогенеза, присущих неинфицированному перелому и появляющихся, по литературным данным, уже на 10 сутки после неинфицированной травмы.
Со стороны сохраненных балок наблюдалась остеокластическая резорбция костной ткани (фиг. 6), а также продуктивно-воспалительная реакция эндоста и периоста.
Наряду с описанными выше признаками остеомиелита, наблюдались признаки регенерационного остеогистогенеза. Так, у животных данной группы было выявлено образование тонких балок грубоволокнистой костной ткани (фиг. 7) по краю разрыва костных пластинок гаверсовых систем, а также увеличение доли костной ткани за счет ее образования на месте хряща (фиг. 8). В подвергающуюся дистрофии и деструкции гиалиновую хрящевую ткань врастали сосуды, вместе с которыми внедрялись клетки с остеогенными потенциями, обеспечивая формирование ретикулофиброзной костной ткани.
Изучение костного мозга позволил