Способ оценки функционального состояния растений in vitro без нарушения стерильности
Иллюстрации
Показать всеИзобретение относится к области сельского хозяйства, биологии и физиологии растений. В способе оценивают функциональное состояние растений in vitro путем определения параметров флуоресценции хлорофилла. При этом регистрируют динамику изменения сигнала медленной индукции флуоресценции хлорофилла в диапазоне длин волн от 670 до 760 нм в течение 10-30 с. Рассчитывают скорость изменения сигнала МИФХ на 10-30 секунде после достижения максимального уровня флуоресценции FM, рассчитывают значение виртуального стационарного уровня флуоресценции методом экстраполяции полученных данных для 120-300 секунды виртуальных измерений, определяют величину удельной фотосинтетической активности по формуле . О функциональном состоянии растений судят по соотношению значения удельной фотосинтетической активности, полученной в результате экстраполяции, и скорости изменения сигнала МИФХ - чем выше один или оба параметра, тем лучше функциональное состояние растений in vitro. Способ позволяет сохранять жизнеспособность растений, оценить функциональное состояние и жизнеспособность клеток, тканей и органов растений in vitro без нарушения стерильности среды обитания, а также выявлять степень устойчивости растений к различным неблагоприятным факторам. 1 ил., 1 пр., 3 табл.
Реферат
Изобретение относится к биологии, физиологии растений и сельскому хозяйству и позволяет оценить функциональное состояние и жизнеспособность клеток, тканей и органов растений in vitro без нарушения стерильности среды обитания, в том числе при оптимизации условий выращивания, а также для выявления степени устойчивости растений к различным неблагоприятным факторам и т.п.
В настоящее время при выращивании растений в культуре ткани используют визуальный контроль за состоянием растений [1, 2). Однако он не позволяет выявить наиболее важный физиологический параметр - активность фотосинтезирующего аппарата. Известны методы оценки функционального состояния растений, основанные на определении количественного содержания фотосинтезирующих пигментов и их качественного состояния по фотометрическим параметрам, когда определяются коэффициенты пропускания, отражения или поглощения на определенных длинах волн [3, 4]. Однако данные методы и реализующая их аппаратура в принципе не позволяют получить достоверную информацию. Получаемые фотометрические коэффициенты в существенной степени зависят от геометрии расположения объекта в оптическом тракте, и она должна быть строго фиксированная и неизменная, что при работе с культурой ткани без нарушения ее стерильности невозможно.
Наиболее близким к заявляемому способу являются методы определения функционального состояния растений по параметрам медленной индукции флуоресценции хлорофилла (МИФХ), когда в течение нескольких десятков секунд снимают кривую Каутского и о функциональном состоянии судят по удельной фотосинтетической активности Y, которая определяется как
Y = ( F м − F c ) / F c , ( 1 )
где Fм - максимальный уровень сигнала флуоресценции, определяемый в течение первых 2-5 секунд возбуждения флуоресценции, Fc - стационарный уровень сигнала флуоресценции, определяемый на 120-180 секунде возбуждения флуоресценции [5-8]. Данный критерий является относительным и поэтому может использоваться для работы с растениями, находящимися в пробирках или колбах и по-разному ориентированных в зоне измерений относительно источника и приемника оптического излучения [8]. Недостатками данного метода является длительное время проведения измерений - не менее 2 минут. Растения в культуре ткани отличаются от полевых существенно меньшим порогом устойчивости к фотоокислению. Поэтому в процессе измерений высокие уровни оптического излучения, используемые для возбуждения флуоресценции, могут привести к фотодеструктивному повреждению хлоропластов. Основная проблема заключается в том, что и процессы индукции флуоресценции и процессы фотодеструкции отражаются на стационарном уровне кривой Каутского одинаково. В результате происходит завышение оценки удельной фотосинтетической активности из-за наличия фотодеструкции. Кроме этого, растения получают необратимые фотодеструктивные повреждения, что сказывается на их последующей жизнедеятельности. Заведомо низкие уровни возбуждающего излучения устанавливать неэффективно, так как в этом случае не происходит достаточного восстановления реакционных центров фотосистемы 2 (ФС 2), и значение удельной фотосинтетической активности определяется с занижением ее истинной величины.
Целью данного изобретения является увеличение достоверности информации о функциональном состоянии растений in vitro без нарушения стерильности среды, а также сохранение жизнеспособности растений.
Способ осуществляется следующим образом. Оптическое излучение с длиной волны 460…470 нм и выходной мощностью 4…7 мВт направляют через стенку сосуда (пробирки, колбы) на хлорофилл-содержащий участок растения in vitro, регистрируют динамику изменения сигнала МИФХ в диапазоне длин волн от 670 до 760 нм в течение 10-30 секунд, рассчитывают скорость изменения сигнала МИФХ на 10…30 секунде после достижения максимального уровня флуоресценции FM, рассчитывают значение виртуального стационарного уровня флуоресценции F c ∗ методом экстраполяции полученных данных для 120…300 секунды виртуальных измерений и определяют величину удельной фотосинтетической активности по формуле
Y = ( F м − F c ∗ ) / F c ∗ , ( 2 )
Функциональное состояния растений in vitro оценивается по соотношению значения удельной фотосинтетической активности, полученной в результате экстраполяции и скорости изменения сигнала МИФХ - чем выше один или оба параметра, тем лучше функциональное состояния растений in vitro. Благодаря тому, что измерительный цикл сокращается, уменьшается доза излучения до уровней, не приводящих к фотодеструктивным повреждениям клеток, и данный способ можно использовать для оценки активности фотосинтетического аппарата растений in vitro.
Устройство для осуществления предлагаемого способа включает источник оптического излучения синей области спектра (460…470 нм) 1; блок управления мощностью источника 2; регистратор интенсивности рассеянного объектом излучения 3, предварительный усилитель с блоком оцифровки сигналов 4; интерфейс 5; расчетное устройство 6 (фиг. 1). Поток монохроматического излучения направляется на актуальную зону измеряемого объекта 7. Рассеянное от объекта 7 излучение воспринимается регистратором 3, где оптическое излучение преобразуется в электрический сигнал, пропорциональный МИФХ (690-740 нм), и направляется в блок 4 для усиления и оцифровки. С помощью интерфейса 5 данные передаются в расчетное устройство 6, производящее расчет скорости изменения сигнала МИФХ, экстраполяцию кривой МИФХ на 120…300 секунд виртуального времени измерений по 10…30 секундам реального времени измерений и определение удельной фотосинтетической активности на заданное виртуальное время измерений. В качестве расчетного устройства может использоваться компьютер, оснащенный специализированной программой.
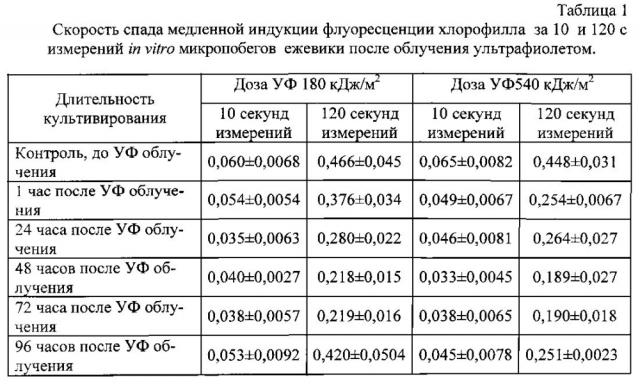
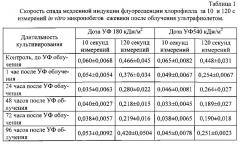
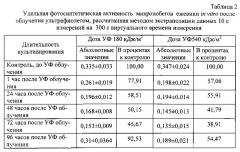
Пример. Способ был применен для инструментальной оценки влияния ультрафиолетового излучения на функциональное состояние микропобегов ежевики сорта Блэк сэтин. Для атонального размножения in vitro применяли питательную среду по прописи Murashige, Skoog (MS) [9] с добавлением 1,0 мг/л 6-бензиламинопурина (6-БАП), 0,1 мг/л β-индолил-3-масляной кислоты (ИМК) и 1,0 мг/л гибберелловой кислоты. Культивирование осуществляли при 16-часовом световом дне, освещенности 2500 лк (люминесцентные лампы) и температуре 23±2°С. Через несколько дней после высадки на питательную среду экспланты были подвергнуты облучению ультрафиолетовым излучением УФ-А (300-400 им по уровню 0,1 спектральной кривой) дозами 180 и 540 кДж/м2. Через 1 час после облучения ультрафиолетом и далее в то же самое время суток каждые 24 часа в течение последующих 4 дней проводили оценку функционального состояния фотосинтетического аппарата растений in vitro по заявленным способу и устройству. Запись медленной индукции флуоресценции осуществляли в течение 20 секунд при интенсивности возбуждающего излучения 6500 мкМ/м2с с длиной волны 470±10 нм. Измерения осуществляли через стеклянные стенки колб, без нарушения стерильности культуры, выбирая участки листовой поверхности микропобегов, максимально приближенных к стенке колбы. Определяли максимальный уровень флуоресценции, скорость спада флуоресценции на 5, 10 и 15 секунде от времени отсчета максимума, осуществляли экстраполяцию полученных данных на виртуальное время измерений, равное 120 секундам, по логарифмическому закону, для определения стационарного уровня флуоресценции и рассчитывали удельную фотосинтетическую активность по формуле (2).
Заявляемые способ и устройство позволили уже через 1 час после УФ-облучения зафиксировать достоверное снижение функционального состояния растений in vitro (табл. 1 и 2). Как и следовало ожидать, более негативная реакция соответствует более высоким дозам ультрафиолетового излучения. Благодаря малой длительности измерений кривой МИФХ непосредственно через стенку колбы, без нарушения стерильности культивируемых, растений, можно следить за динамикой изменения функционального состояния растений в пострадиационный период. Растения in vitro, обученные УФ в дозе 180 кДж/м2, практически полностью восстановили свою фотосинтетическую активность на 5 сутки после обработки. А растения, обработанные УФ в дозе 540 кДж/м2, несмотря на попытку запуска репарационных процессов на 2 сутки после облучения, так и не смогли восстановиться ни по одному из измеренный показателей.
Данный способ и устройство позволяют практически мгновенно определять изменения функционального состояния растений in vitro с минимальным влиянием на их жизнедеятельность и благодаря этому их можно использовать для оптимизации условий выращивания, выявления порога устойчивости к различным неблагоприятным факторам, следить за динамикой развития репарационных процессов на всех этапах культивирования, не нарушая при этом условия стерильности.
Литература
1. Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнология на их основе: Учебное пособие. - М: ФБК-ПРЕСС, 1999. - 160 с.
2. Калинин Ф.Л., Сарнацкая В.В., Полищук В.Е. Методы культуры тканей в физиологии и биохимии растений. - Киев: Наукова думка, 1980. - 487 с.
3. Мерзляк, М.Н. Гительсон Α.Α., Чивкунова О.Б., Соловченко А.Е., Погосян С.И. Использование спектроскопии отражения в анализе пигментов высших растений // Физиология растений. - 2003. - Т. 50, №5. - С. 785-792.
4. Кувалдин, Э.В. Специализированный фотометр для измерения патологических и физиологических изменений в растениях / Э.В. Кувалдин, В.Г. Сурин // Оптический журнал. - 1998. - Т. 65, №5. - С. 43-46.
5. Веселовский R.A., Веселова Т.В. Люминесценция растений. Теоретические и практические аспекты. - М.: Наука, 1990. - 200 с.
6. Корнеев, Д.Ю. Информационные возможности метода индукции флуоресценции хлорофилла / Д.Ю. Корнеев. - Киев: Альтенпресс, 2002. - 188 с.
7. Веселова, Т.В. Оценка состояния растений земляники, культивируемых in vitro, люминесцентным методом / Т.В. Веселова, О.Н. Высоцкая, В.А. Веселовский // Физиология растений. - 1994. - Т. 41, №6. - С. 942-946.
8. А.с. №1750556 Способ отбора пробирочных растений земляники для беспересадочного хранения / В.А. Веселовский, Т.В. Веселова, О.Н. Самсонова // Б.И. 1992, №28, с. 18.
9. Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiol. Plarit. - 1962. - V. 15, №13. - P. 473-497.
Способ оценки функционального состояния растений in vitro, заключающийся в определении параметров флуоресценции хлорофилла, отличающийся тем, что регистрируют динамику изменения сигнала медленной индукции флуоресценции хлорофилла в диапазоне длин волн от 670 до 760 нм в течение 10-30 с, рассчитывают скорость изменения сигнала МИФХ на 10-30 секунде после достижения максимального уровня флуоресценции FM, рассчитывают значение виртуального стационарного уровня флуоресценции методом экстраполяции полученных данных для 120-300 секунды виртуальных измерений и определяют величину удельной фотосинтетической активности по формуле: , при этом о функциональном состоянии растений судят по соотношению значения удельной фотосинтетической активности, полученной в результате экстраполяции, и скорости изменения сигнала МИФХ - чем выше один или оба параметра, тем лучше функциональное состояние растений in vitro.