Кристаллическая форма и способ ее очистки
Иллюстрации
Показать всеНастоящее изобретение относится к новой кристаллической Форме А 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона, которая обладает действием ингибитора дофамин-β-гидроксилазы, и к способу ее очистки. Технический результат - высокий выход целевого продукта и его высокая стабильность. 2 н. и 14 з.п. ф-лы, 18 ил., 23 табл.
Реферат
Область техники, к которой относится изобретение
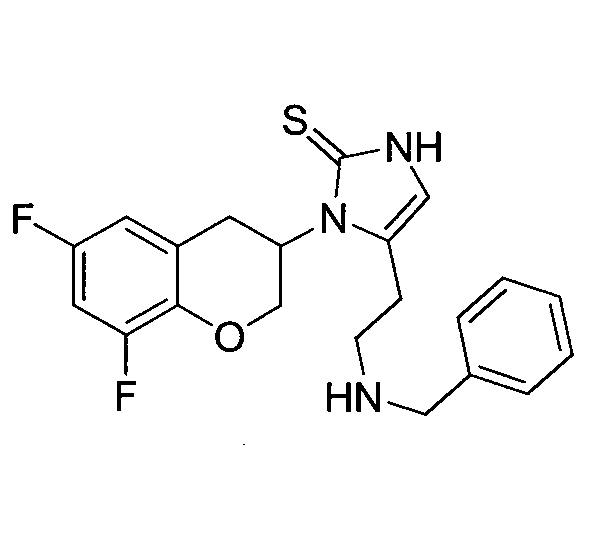
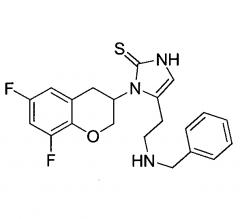
Настоящее изобретение относится к новым кристаллическим формам 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона, т.е. к R-энантиомеру соединения:
и к способам его получения.
Предпосылки создания изобретения и известный уровень техники
Интерес к разработке ингибиторов дофамин-β-гидроксилазы (DβΗ) сосредоточен на гипотезе о том, что ингибирование этого фермента может способствовать значительному улучшению клинического состояния пациентов, страдающих сердечно-сосудистыми расстройствами, такими как гипертензия или хроническая сердечная недостаточность. Целесообразность применения ингибиторов DβΗ обосновывается их способностью ингибировать биосинтез норадреналина, который осуществляется посредством ферментативного гидроксилирования дофамина. Главным клиническим проявлением застойной сердечной недостаточности является активация нейрогуморальных систем, преимущественносимпатической нервной системы (Parmley, W.W., Clinical Cardiology, 18: 440-445, 1995). Пациенты с застойной сердечной недостаточностью имеют повышенные концентрации норадреналина в плазме (Levine, T.B. et al., Am. J. Cardiol., 49: 1659-1666, 1982), у них усилено влияние центральных симпатических факторов (Leimbach, W.N. et al., Circulation, 73: 913-919, 1986) и увеличен кардиоренальный выброс (spillover) норадреналина (Hasking, G.J. et al., Circulation, 73: 615-621, 1966). Продолжительное и избыточное воздействие норадреналина на миокард может приводить к понижающей регуляции сердечных β1-адренорецепторов, ремоделированию левого желудочка, аритмиям и некрозу, и все эти эффекты могут уменьшать функциональную целостность сердца. Пациенты с застойной сердечной недостаточностью, которые имеют высокие концентрации норадреналина в плазме, имеют и самый неблагоприятный отдаленный прогноз (Cohn, J.N. et al., N. Engl. J. Med., 311: 819-823, 1984). Более важным является наблюдение, что в плазме бессимптомных пациентов без явных признаков сердечной недостаточности концентрации норадреналина являются уже повышенными и это можно использовать для прогноза возможной заболеваемости и летальности (Benedict, C.R. et al., Circulation, 94: 690-697, 1996). Поэтому активированный симпатический эффект не является всего лишь клиническим маркером застойной сердечной недостаточности, но может вносить свой вклад и в прогрессирующее ухудшение заболевания.
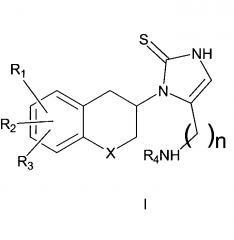
Сильные ингибиторы дофамин-β-гидроксилазы, обладающие высокой активностью и значительно пониженным доступом в мозг, раскрыты в WO 2008/136695. WO 2008/136695 описывает соединения формулы I:
где R1, R2 и R3 являются одинаковыми или разными и обозначают водороды, галогены, алкил, нитрогруппу, аминогруппу, алкилкарбониламиногруппу, алкиламиногруппу или диалкиламиногруппу; R4 обозначает алкиларил или алкилгетероарил; X обозначает CH2, атом кислорода или атом серы; n равно 2 или 3; включая их индивидуальные (R)- и (S)-энантиомеры или смеси их энантиомеров и включая их фармацевтически приемлемые соли и сложные эфиры, где термин «алкил» означает углеводородные цепи, прямые или разветвленные, содержащие от одного до шести углеродных атомов, необязательно, замещенных арильными, алкоксильными, галогенными, алкоксикарбонильными или гидроксикарбонильными группами; термин «арил» означает фенильную или нафтильную группу, необязательно, замещенную алкильной, алкилоксильной, галогенной или нитрогруппой; термин «галоген» означает фтор, хлор, бром или йод; термин гетероарил означает гетероароматическую группу. В частности, WO 2008/136695 описывает 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тион.
Способы получения соединений формулы I и конкретно 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона описаны в WO 2008/136695, они включены в настоящий документ посредством ссылки.
Известно, что полиморфные формы одного и того же лекарственного средства могут иметь существенно разные фармацевтически важные свойства, такие как характеристики растворимости и биодоступность, а также стабильность лекарственного средства. Кроме того, разные формы могут иметь разный размер частиц, твердость и температуру стеклования. В частности, одна форма может предоставлять значительно большие преимущества по сравнению с другими формами того же лекарственного средства в способах изготовления твердых дозированных форм, такие как более точное измерение количества активных ингредиентов, более легкое фильтрование или повышенная стабильность при гранулировании или хранении. Кроме того, конкретный способ, подходящий для какой-либо одной формы, может также предоставить изготовителям такие преимущества, как экономически или экологически подходящие растворители и технологические процессы, или обеспечить более высокую чистоту или более высокий выход желаемого продукта.
Сущность изобретения
Настоящее изобретение предоставляет кристаллические полиморфы 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона и способы их получения. Новые полиморфные формы 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона демонстрируют высокую стабильность при интенсивном механическом воздействии и/или интенсивном воздействии водяным паром. Настоящее изобретение также предоставляет аморфную форму 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона и способы ее получения. Указанная аморфная форма также является частью настоящего изобретения.
Далее в настоящем документе 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тион будет указываться либо как таковойлибо как «соединение 2».
В нижеследующем описании настоящего изобретения полиморфные формы описаны как обладающие дифрактограммой XRPD с пиками в положениях, перечисленных в соответствующих таблицах. Следует также понимать, что в одном варианте осуществления настоящего изобретения полиморфная форма имеет дифрактограмму XRPD с пиками в положениях со значениями °2θ, приведенными с точностью до±0,2°2θ при любом значении интенсивности (% (I/I0)); или в другом варианте осуществления настоящего изобретения она имеет дифрактограмму XRPD с пиками в положениях со значениями °2θ, приведенными с точностью до ±0,1°2θ. Следует также заметить, что значения интенсивности приведены только для информации и определение каждого из пиков не подразумевает их ограничения конкретными значениями интенсивности.
Согласно одному аспекту настоящего изобретения предоставлена кристаллическая Форма А 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона.
В варианте осуществления настоящего изобретения кристаллическая Форма А соединения 2 не является сольватом, т.е. Форма А соединения 2 является несольватированной формой.
Согласно настоящему изобретению термин «несольватированная» означает, что термогравиметрическая (TGA) кривая кристаллической Формы A соединения 2 показывает потерю массы менее чем приблизительно на 1% по массе, предпочтительно, менее чем приблизительно на 0,6%, более предпочтительно, не показывает никакой потери массы при температуре, более низкой, чем приблизительно 200°C.
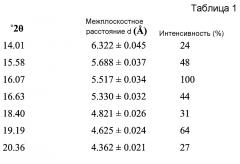
Согласно другому аспекту настоящего изобретения, предоставлена Форма A соединения 2, имеющая дифрактограмму XRPD с пиками при 14,0, 16,1, 16,6, 19,2 и 20,4°2θ±0,2°2θ. Дифрактограмма XRPD может иметь дополнительные пики при 15,6 и 18,4°2θ±0,2°2θ.
Форма A может быть охарактеризована как имеющая дифрактограмму рентгеновской порошковой дифракции (X-ray powder diffraction, XRPD) с пиками, представленными в Таблице 1.
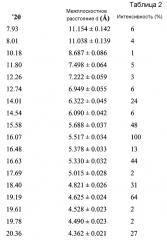
В варианте осуществления настоящего изобретения Форма А охарактеризована как имеющая дифрактограмму рентгеновской порошковой дифракции (XRPD) с одним или более из пиков, представленных в Таблице 2.
В другом варианте осуществления настоящего изобретения Форма A имеет дифрактограмму XRPD, как показано на Фигуре 2.
Согласно другому варианту осуществления настоящего изобретения предоставлена кристаллическая Форма A 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона, имеющая термограмму термогравиметрического анализа (thermogravimetric analysis, TGA), показывающую потерю массы, начинающуюся при температуре 259°C±5°C. В варианте осуществления настоящего изобретения термограмма TGA показывает потерю массы, начинающуюся при температуре в диапазоне от приблизительно 257°C до приблизительно 262°C. В варианте осуществления настоящего изобретения Форма A имеет термограмму TGA, показывающую потерю массы, начинающуюся при температуре приблизительно 259°C.
В варианте осуществления настоящего изобретения Форма A имеет термограмму TGA, как показано на Фигуре 3.
Согласно другому варианту осуществления настоящего изобретения предоставлена кристаллическая Форма A 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона, имеющая термограмму дифференциальной сканирующей калориметрии (differential scanning calorimetry, DSC), показывающую эндотермический пик, начинающийся при температуре 192°C±2°C и с максимумом при 193°C±2°C. В варианте осуществления настоящего изобретения термограмма DSC показывает эндотермический пик, начинающийся при температуре в диапазоне от приблизительно 190°C до приблизительно 192°C. В варианте осуществления настоящего изобретения DSC показывает эндотермический пик с максимумом в диапазоне от приблизительно 193°C до приблизительно 194°C. В варианте осуществления настоящего изобретения Форма A имеет термограмму DSC, имеющую эндотермический пик, начинающийся при температуре приблизительно 192°C и с максимумом приблизительно при 193°C. В варианте осуществления настоящего изобретения термограмма DSC показывает теплоту плавления 141 Дж/г±10 Дж/г. В варианте осуществления настоящего изобретения термограмма DSC показывает теплоту плавления в диапазоне от приблизительно 139 Дж/г до приблизительно 147 Дж/г. В варианте осуществления настоящего изобретения термограмма DSC показывает теплоту плавления приблизительно 147 Дж/г.
В варианте осуществления настоящего изобретения Форма A соединения 2 имеет термограмму DSC, как показано на Фигуре 4.
В следующем варианте осуществления настоящего изобретения Форма A соединения 2 представляет собой материал, демонстрирующий низкую гигроскопичность в диапазоне от 5% до 95% относительной влажности (relative humidity, RH). Материал с малой гигроскопичностью может быть определен как материал, который демонстрирует <0,5 масс. % поглощения воды в указанном диапазоне относительной влажности.
В следующем варианте осуществления настоящего изобретения Форма A демонстрирует незначительную потерю массы при уравновешивании при RH, составляющей ~5%. В контексте настоящей спецификации«незначительный» означает менее 0,5 масс.%.
В другом варианте осуществления настоящего изобретения Форма A демонстрирует приблизительно 0,02%-ное увеличение массы в диапазоне RH от приблизительно 5% до приблизительно 75%. В варианте осуществления настоящего изобретения Форма A демонстрирует приблизительно 0,19%-ное увеличение массы в диапазоне RH от приблизительно 75% до приблизительно 95%. В другом варианте осуществления настоящего изобретения Форма A демонстрирует приблизительно 0,20%-ное уменьшение массы в диапазоне RH от приблизительно 95% до приблизительно 5% с гистерезисом в диапазоне RH от приблизительно 85% до приблизительно 45% после десорбции.
Выгодным образом, Форма A имеет низкую гигроскопичность и остается стабильной кристаллической формой после интенсивного механического воздействия и интенсивного воздействия водяным паром.
В другом аспекте настоящее изобретение предоставляет кристаллическую Форму B 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона.
Кристаллическая Форма B соединения 2 представляет собой этилацетатный сольват. В варианте осуществления настоящего изобретения Форма B содержит 0,1-0,2 моля этилацетата. В варианте осуществления настоящего изобретения Форма B содержит приблизительно 0,1 моля этилацетата. В другом варианте осуществления настоящего изобретения форма B содержит приблизительно 0,2 моля этилацетата.
Согласно другому аспекту настоящего изобретения предоставлена Форма B 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона, которая представляет собой этилацетатный сольват, предпочтительно содержащий 0,1-0,2 моля этилацетата, и имеющая дифрактограмму XRPD с пиками при 7,9-8,0, 14,0, 16,0-16,1, 19,2 и 20,4°2θ±0,2°2θ. Дифрактограмма XRPD может иметь дополнительные пики при 15,6, 16,7 и 18,4°2θ±0,2°2θ.
В другом варианте осуществления настоящего изобретения Форма B соединения 2 охарактеризована как имеющая дифрактограмму рентгеновской порошковой дифракции (XRPD) с пиками, представленными в Таблице 3.
В варианте осуществления настоящего изобретения Форма B охарактеризована как имеющая дифрактограмму рентгеновской порошковой дифракции (XRPD) с одним или более из пиков, представленных в Таблице 4.
Как можно видеть из Таблиц 3 и 4, положения некоторых пиков указаны в виде некоторых диапазонов. Причиной этого является то, что материал представляет собой переменный сольват (в варианте осуществления настоящего изобретения содержащий 0,1-0,2 моль этилацетата).
В варианте осуществления настоящего изобретения Форма B имеет дифрактограмму XRPD, как показано на Фигуре 5.
Согласно другому варианту осуществления настоящего изобретения предоставлена кристаллическая Форма B соединения 2, имеющая термограмму TGA, показывающую уменьшение массы, начинающееся при температуре 257°C±5°C, и уменьшение массы в диапазоне от приблизительно 130°C до приблизительно 200°C. В варианте осуществления настоящего изобретения термограмма TGA, кроме того, имеет приблизительно 2,3%-ное уменьшение массы в диапазоне от приблизительно 162°C до приблизительно 200°C или приблизительно 4,7%-ное уменьшение массы в диапазоне от приблизительно 138°C до приблизительно 190°C.
В другом варианте осуществления настоящего изобретения Форма B соединения 2 имеет термограмму TGA, как показано на Фигуре 6.
Согласно другому аспекту настоящего изобретения предоставлена кристаллическая Форма B соединения 2, имеющая термограмму DSC, показывающую эндотермический пик, начинающийся при температуре приблизительно 190°C±2°C и с максимумом приблизительно при 192°C±2°C. В варианте осуществления настоящего изобретения термограмма DSC показывает теплоту плавления, составляющую приблизительно 141 Дж/г±10 Дж/г.
В варианте осуществления настоящего изобретения Форма B соединения 2 имеет термограмму DSC, как показано на Фигуре 7.
Согласно другому аспекту настоящего изобретения предоставлена кристаллическая Форма B соединения 2, имеющая спектр 1H ЯМР, содержащий пики, которые можно признать принадлежащими этилацетату. В варианте осуществления настоящего изобретения пики, которые можно приписать этилацетату, находятся приблизительно при 4,0 м.д., приблизительно при 2,0 м.д. и приблизительно при 1,2 м.д. Как будет понятно квалифицированному специалисту, спектр 1Н ЯМР будет также содержать пики, которые можно признать принадлежащими протонам 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона.
В варианте осуществления настоящего изобретения кристаллическая Форма B соединения 2 имеет спектр 1H ЯМР, как показано на Фигуре 8A. В варианте осуществления настоящего изобретения спектр 1H ЯМР является таким, как показано на Фигурах 8A-8E.
Согласно другому аспекту настоящего изобретения имеется 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тион в аморфной форме.
В контексте настоящей спецификации термин «аморфный» означает «рентгеновски аморфный», что означает, что в дифрактограмме XRPD материала отсутствуют пики рентгеновской дифракции. В варианте осуществления настоящего изобретения рентгеновски аморфные материалы являются:
- нанокристаллическими;
- кристаллическими с очень большой плотностью дефектов;
- кинетическими аморфными материалами; или
- термодинамическими аморфными материалами;
или комбинацией вышеуказанного.
В варианте осуществления настоящего изобретения аморфная форма имеет дифрактограмму XRPD, демонстрирующую гало.
В варианте осуществления настоящего изобретения аморфная форма имеет дифрактограмму XRPD, как показано на Фигуре 9.
Согласно другому аспекту настоящего изобретенияпредоставлен аморфный 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тион, имеющий термограмму термогравиметрического анализа (TGA), показывающую уменьшение массы, начинающееся при температуре 258°C±5°C, и приблизительно 1,2%-ное уменьшение массы в диапазоне от приблизительно 26°C до приблизительно 71°C.
В варианте осуществления настоящего изобретения аморфная форма имеет термограмму TGA, как показано на Фигуре 10.
В варианте осуществления настоящего изобретения аморфный 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тион имеет термограмму циклической дифференциальной сканирующей калориметрии (цикло-DSC), показывающую ступенчатое изменение, обусловленное стеклованием. В варианте осуществления настоящего изобретения указанное ступенчатое изменение происходит при температуре 50°C±2°C. В варианте осуществления настоящего изобретения циклическая процедура включает в себя 2 цикла, причем стеклование происходит в цикле 2.
В варианте осуществления настоящего изобретения аморфный 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тион имеет термограмму циклической дифференциальной сканирующей калориметрии (цикло-ДСК), показывающую экзотермический пик с максимумом в диапазоне от приблизительно 115°C и приблизительно 124°C. В варианте осуществления настоящего изобретения циклическая процедура включает в себя 2 цикла, причем экзотермический пик проявляется в цикле 2. В варианте осуществления настоящего изобретения процесс кристаллизации продуцирует Форму А.
В варианте осуществления настоящего изобретения аморфная форма имеет термограмму цикло-ДСК, как показано на Фигурах 11 и 12 (циклы 1 и 2 соответственно).
В следующем варианте осуществления настоящего изобретения аморфное соединение 2 представляет собой материал, демонстрирующий значительную гигроскопичность в диапазоне RH от приблизительно 5% до приблизительно 75%. Материал может быть определен как значительно гигроскопичный, если он демонстрирует поглощение воды, составляющее не менее 2,0 масс.% в указанном диапазоне RH.
В другом варианте осуществления настоящего изобретения аморфное соединение 2 демонстрирует приблизительно 0,08%-ное увеличение массы после уравновешивания при RH, составляющей приблизительно 5%.
В варианте осуществления настоящего изобретения аморфное соединение 2 демонстрирует приблизительно 1,2%-ное увеличение массы в диапазоне RH от приблизительно 5% до приблизительно 75%. В варианте осуществления настоящего изобретения аморфное соединение 2 демонстрирует приблизительно 8,7%-ное увеличение массы в диапазоне RH от приблизительно 75% до приблизительно 95%. В варианте осуществления настоящего изобретения аморфное соединение 2 демонстрирует приблизительно 8,6%-ное уменьшение массы в диапазоне RH от приблизительно 95% до приблизительно 5% и гистерезис при RH более 50%. Гистерезис может иметь место после десорбции в диапазоне RH от приблизительно 85% до приблизительно 15%.
Аморфная форма выгодна тем, что она представляет собой универсальную промежуточную форму, которую можно применять для изготовления других форм соединения 2. Например, аморфное соединение 2 можно применять для получения Формы B соединения 2, используя этилацетат в качестве растворителя при кристаллизации, и аморфное соединение 2 можно применять для получения Формы А соединения 2, используя при кристаллизации растворители, отличные от этилацетата. Если кристаллические формы соединения 2 обладают низкой растворимостью в воде, полезными материалами могут оказаться аморфные формы. При сольватировании аморфным формам не требуется энергия для разрушения кристаллической решетки (в отличие от соответствующих кристаллических форм), и поэтому они лучше подходят для приготовления фармацевтических композиций с более высокой растворимостью и с более высокой биодоступностью.
Кристаллические Формы A и B и аморфная форма описаны выше в связи с указанием данных XRPD, данных DSC, данных TGA и/или данных 1Н ЯМР (и мольных процентов сольвата в случае Формы В). Следует понимать, что эти формы можно охарактеризовать каждым набором данных индивидуально или комбинацией одного или более наборов данных.
Следует понимать, что положения пиков могут в небольшой степени меняться в зависимости от того, какой аппарат применяют для анализа образца. Поэтому все определения полиморфов, которые ссылаются на положения пиков с указанием значений °2θ, подразумевают их вариации в пределах ±0,2°2θ. Если не указано иначе (как например, в тех таблицах, где значения даны с указанием плюс-минус-вариаций), значения °2θ для положений пиков даны с вариациями, составляющими ±0,2°2θ.
Выгодным образом кристаллическая Форма A, как она описана в настоящем документе, кристаллическая Форма B, как она описана в настоящем документе, и/или аморфная форма, как она описана в настоящем документе, соединения 2 могут показывать дополнительные улучшенные свойства, такие как улучшенные биодоступность, растворимость, гигроскопичность, скорость растворения, профиль безопасности, стабильность (устойчивость к теплу, воздуху, давлению, свету), совместимость с эксципиентами в фармацевтическом препарате, (более высокую) точку плавления, плотность, твердость, более продолжительное ингибирование DβΗ, большую степень ингибирования DβΗ и/или более высокую периферическую селективность, когда их применяют в лекарственном средстве, по сравнению с другими формами соединения 2. Также выгодным образом кристаллическая Форма A, как она описана в настоящем документе, кристаллическая Форма B, как она описана в настоящем документе, и/или аморфная форма, как она описана в настоящем документе, соединения 2 могут показывать дополнительные улучшенные свойства, такие как стабильность при хранении, фильтруемость в технологическом процессе (размеры кристаллов, распределение частиц по размерам), технологичность (например, отсутствие налипания на оборудование), легкость высушивания, чистоту и величину выхода и/или смачиваемость (в терминах технологии изготовления) по сравнению с другими формами соединения 2.
Согласно другому аспекту настоящего изобретения предоставлен способ очистки кристаллической Формы A соединения 2, который включает в себя перекристаллизацию гидрохлорида (R)-5-(2-(бензиламино)этил)-1-(6,8-дифторхроман-3-ил)-1H-имидазол-2(3H)-тиона по меньшей мере в одном органическом растворителе. Предпочтительно, указанный органический растворитель представляет собой смесь толуола и метанола. В предпочтительном варианте осуществления настоящего изобретения толуол и метанол присутствуют в этой смеси в соотношении 62:38 по массе. В варианте осуществления настоящего изобретения органический растворитель отгоняют и заменяют толуолом.
Подходящим образом указанный способ очистки дополнительно включает в себя преобразование гидрохлорида (R)-5-(2-(бензиламино)этил)-1-(6,8-дифторхроман-3-ил)-1H-имидазол-2(3H)-тиона в (R)-5-(2-(бензиламино)этил)-1-(6,8-дифторхроман-3-ил)-1H-имидазол-2(3H)-тион. В варианте осуществления настоящего изобретения преобразование гидрохлорида (R)-5-(2-(бензиламино)этил)-1-(6,8-дифторхроман-3-ил)-1H-имидазол-2(3H)-тиона осуществляют, применяя гидроксид щелочного металла. Предпочтительно, указанный гидроксид щелочного металла представляет собой гидроксид натрия. В варианте осуществления настоящего изобретения указанное преобразование проводят в смеси метанола и воды.
Выгодным образом чистота (R)-5-(2-(бензиламино)этил)-1-(6,8-дифторхроман-3-ил)-1H-имидазол-2(3H)-тиона, полученного с применением способа очистки согласно настоящему изобретению, составляет, по меньшей мере, 95% (предпочтительно, по меньшей мере, 98%, наиболее предпочтительно ≥99,0%).
Согласно другому аспекту настоящего изобретения предоставлено применение Формы A, как она описана в настоящем документе, Формы B, как она описана в настоящем документе, или аморфной формы, как она описана в настоящем документе, 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона и одного или более фармацевтически приемлемых носителей или эксципиентов.
Фармацевтический препарат может также включать в себя по меньшей мере один другой активный фармацевтический ингредиент.
В другом аспекте настоящее изобретение также предоставляет способы лечения расстройств, при которых терапевтически полезно уменьшение гидроксилирования дофамина до норадреналина, которое включает в себя введение млекопитающему, нуждающемуся в этом, эффективного количества Формы А, как она описана в настоящем документе, Формы B, как она описана в настоящем документе, или аморфной формы, как она описана в настоящем документе, 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона.
Согласно другому аспекту настоящего изобретения предоставлено применение Формы А, как она описана в настоящем документе, Формы B, как она описана в настоящем документе, или аморфной формы, как она описана в настоящем документе, 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона при изготовлении лекарственного средства для лечения тревожных расстройств, мигреней, сердечно-сосудистых расстройств, гипертензии, хронической или застойной сердечной недостаточности, стенокардии, аритмий и расстройств кровообращения, таких как феномен Рейно (виброболезнь).
В вышеуказанных способах Форма А как она описана в настоящем документе, Форма B, как она описана в настоящем документе, или аморфная форма, как она описана в настоящем документе, 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона предоставлены для применения при лечении тревожных расстройств, мигреней, сердечно-сосудистых расстройств, гипертензии, хронической или застойной сердечной недостаточности, стенокардии, аритмий и расстройств кровообращения, таких как феномен Рейно (виброболезнь).
Согласно другому аспекту настоящего изобретения предоставлено применение Формы A, как она описана в настоящем документе, Формы B, как она описана в настоящем документе, или аморфной формы, как она описана в настоящем документе, 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона при изготовлении лекарственного средства для ингибирования DβΗ.
Согласно другому аспекту настоящего изобретения, предоставлена Форма A, как она описана в настоящем документе, Форма B, как она описана в настоящем документе, или аморфная форма, как она описана в настоящем документе 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона для применения при ингибировании DβΗ.
В вышеуказанных аспектах, Форму A, как она описана в настоящем документе, Форму B, как она описана в настоящем документе, или аморфную форму, как она описана в настоящем документе 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона, можно применять в комбинации, по меньшей мере, с одним другим активным фармацевтическим ингредиентом.
В другом аспекте настоящее изобретение также предоставляет способы лечения расстройств, при которых терапевтически полезно уменьшение гидроксилирования дофамина до норадреналина, которое включает в себя введение млекопитающему, нуждающемуся в этом, эффективного количества Формы А, как она описана в настоящем документе, Формы B, как она описана в настоящем документе, или аморфной формы, как она описана в настоящем документе, 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона.
В другом аспекте настоящее изобретение также предоставляет способы лечения по одному или более из следующих показаний: тревожных расстройств, мигреней, сердечнососудистых расстройств, гипертензии, хронической или застойной сердечной недостаточности, стенокардии, аритмий и расстройств кровообращения, таких как феномен Рейно (виброболезнь), которое включает в себя введение млекопитающему, нуждающемуся в этом, эффективного количества Формы А, как она описана в настоящем документе, Формы B, как она описана в настоящем документе, или аморфной формы, как она описана в настоящем документе, 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона.
В вышеуказанных способах Форму A, как она описана в настоящем документе, Форму B, как она описана в настоящем документе, или аморфную форму, как она описана в настоящем документе 1-[(3R)-6,8-дифтор-3,4-дигидро-2H-1-бензопиран-3-ил]-1,3-дигидро-5-[2-[(фенилметил)-амино]-этил]-2H-имидазол-2-тиона, можно вводить в комбинации, по меньшей мере, с одним другим активным фармацевтическим ингредиентом.
Комбинированное лечение или применение, описанные в настоящем документе, можно проводить с одновременным или неодновременным введением.
К тревожным расстройствам относятся, но не ограничиваются ими, генерализованные тревожные расстройства, социальные тревожные расстройства, посттравматическое стрессовое расстройство, расстройство, обусловленное острой реакцией на стресс, обсессивно-компульсивные расстройства, панические расстройства, такие как панические атаки, и фобии, такие как агорафобия, социальные фобии, специфические фобии. Другие тревожные расстройства, которые можно лечить, применяя соединения согласно настоящему изобретению, можно найти на стр. 429-484 публикации American Psychiatric Association: Diagnostic and Statistic Manual of Mental Disorders, 4th edition, Text Revision, Washington, DC, American Psychiatric Association, 2000.
Термин «лечение» и его варианты, такие как «лечить» или «лечащий», используемые в настоящем документе, относятся к любому режиму, который может быть благоприятным для человека или животного, отличного от человека. Лечение может производиться в отношении существующего состояния или может быть профилактическим (превентивное лечение). Лечение может включать в себя лечебные, облегчающие или профилактические эффекты.
Краткое описание фигур
Ссылки даны на приложенные Фигуры, в которых:
Фигура 1 показывает ориентировочную индикацию для соединения 2 - линии указывают разрешенные рефлексы, соответствующие размерам элементарной ячейки и приписанной пространственной группе (P1, #1).
Фигура 2 показывает дифрактограмму XRPD кристаллической Формы A соединения 2
ПАРАМЕТРЫ:
Panalytical X-Pert Pro MPD PW3040 Pro
Рентгеновская трубка: Cu (1,54059 Å)
Напряжение: 45 кВ
Сила тока: 40 мА
Диапазон сканирования: 1,01-40,00°2θ
Размер шага: 0,017°2θ
Продолжительность сбора данных: 1940 с
Скорость сканирования: 1,2°/мин
Щель: Щель расходимости, DS перед зеркалом: 1/2°
Антирассеивающая щель падающего луча, SS: 1/4°
Время одного оборота: 0,5 с
Режим: пропускание
Обработка изображения File Monkey v3.2.3
Фигура 3 показывает термограмму TGA Формы A соединения 2
Методика: 00-350-10
Инструмент: AutoTGA 2950 V5.4A
Universal V4.4A TA Instruments
Фигура 4 показывает термограмму DSC кристаллической Формы A соединения 2
Методика: (-30)-250-10
Инструмент: DSC Q2000 V23.10 Build 79
Universal V4.4A TA Instruments
Фигура 5 показывает дифрактограмму XRPD Формы B соединения 2
ПАРАМЕТРЫ:
Panalytical X-Pert Pro MPD PW3040 Pro
Рентгеновская трубка: Cu (1,54059 Å)
Напряжение: 45 кВ
Сила тока: 40 мА
Диапазон сканирования: 1,01-39,99°2θ
Размер шага: 0,017°2θ
Продолжительность сбора данных: 1939 с
Скорость сканирования: 1,2°/мин
Щель: Щель расходимости (DS) перед зеркалом: 1/2°
Антирассеивающая щель падающего луча (SS): 1/4°
Время одного оборота: 0,5 с
Режим: пропускание
Обработка изображения - File Monkey v3.2.3
Фигура 6 показывает термограмму TGA Формы B соединения 2
Методика: 00-350-10
Инструмент: AutoTGA 2950 V5.4A
Universal V4.4A TA Instruments
Фигура 7 показывает термограмму DSC Формы B соединения 2
Методика: (-30)-250-10
Инструмент: 2920 MDSC V2.6A
Universal V4.4A TA Instruments
Фигура 8 A показывает спектр 1Н ЯМР для Формы B соединения 2
ПАРАМЕТРЫ:
в DMSO-d6 с TMS относительно TMS при 0,0 м.д.
Зонд: 5 мм VIDP
Растворитель: DMSO
Температура окружающей среды
Скорость вращения: 20 Гц
Последовательность импульсов: s2pul
Задержка релаксации: 5,000 с
Ширина импульса: 8,0 мкс (90,0°)
Время сбора данных: 2,500 с
Ширина спектра: 6400,0 Гц (16,008 м.д.)
40 сканирований
Число точек при сборе данных: 32000
Наблюдаемое ядро: H1 (399,7957232 МГц)
ОБРАБОТКА ДАННЫХ:
Уширение линий: 0,2 Гц
Размер преобразования Фурье (FT) 131072
Список пиков на Фигуре 8A:
Фигура 8B показывает увеличенный фрагмент спектра 1Н ЯМР для Формы B соединения 2 (как показано на Фигуре 8A)
Параметры: как для Фигуры 8A
Список пиков на Фигуре 8B:
Фигура 8C показывает увеличенный фрагмент спектра 1Н ЯМР для Формы B соединения 2 (как показано на Фигуре 8A)
Параметры: как для Фигуры 8A
Список пиков на Фигуре 8C:
(продолжение)
Фигура 8D показывает увеличенный фрагмент спектра 1Н ЯМР для Формы B соединения 2 (как показано на Фигуре 8A)
Параметры: как для Фигуры 8A
Список пиков на Фигуре 8D:
(продолжение)
Фигура 8E показывает увеличенный фрагмент спектра 1Н ЯМР для Формы B соединения 2 (как показано на Фигуре 8A)
Параметры: как для Фигуры 8A
Список пиков на Фигуре 8E:
(продолжение)
Фигура 9 показывает XRPD соединения 2 в аморфной форме
Фигура 10 показывает термограмму TGA соединения 2 в аморфной форме
Методика: 00-350-10
Инструмент: TGA Q5000 V3.3 Build 250
Universal V4.4A TA Instruments
Фигура 11 показывает анализ циклической дифференциальной сканирующей калориметрии соединения 2 в аморфной форме - цикл 1
Методика: (-50)-(70-(-50)-250)-20
Инструмент: 2920 MDSC V2.6A
Universal V4.4A TA Instruments
Фигура 12 показывает анализ циклической дифференциальной сканирующей калориметрии соединения 2 в аморфной форме - цикл 2
Методика: (-50)-(70-(-50)-250)-20
Инструмент: 2920 MDSC V2.6A
Universal V4.4A TA Instruments
Фигура 13 показывает дифрактограмму XRPD материала C соединения 2
ПАРАМЕТРЫ:
Bruker Discovery D8
Рентгеновская трубка: Cu (1,54059 Å)
Диапазон сканирования: 2,12-37,00°2θ
Размер шага: 0,02°2θ
Продолжительность сбора данных: 900 с
Обработка изображений - File Monkey v3.2.3
Фигура 14 показывает дифрактограмму XRPD материала D соединения 2
ПАРАМЕТРЫ:
INEL XRG-3000
Рентгеновская трубка: 1,54187000 Å
Напряжение: 40 кВ
Сила тока: 30 мА
Размер шага: приблизительно 0,03°2θ
Продолжительность сбора данных: 300 с
Вращающийся капилляр
Обработка изображений - File Monkey v3.2.3
Подробное описание
Анализ, выполненный авторами настоящего изобретения, показал, что Форма А представляет собой несольватированный материал с низкой гигроскопичностью, плавящийся при ~187,9-192,2°C, а Форма B представл