Аналоги паратиреоидного гормона и их применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению агониста рецептора паратиреоидного гормона (PTH), и может быть использовано в медицине. Полученный пептид или его фармацевтическую соль используют в составе фармацевтической композиции для лечения заболеваний, характеризующихся дисфункцией РТН или дисбалансом кальция или фосфатов. Изобретение позволяет получить агонист PTH, обладающий активностью более длительного действия, по сравнению с природным гормоном PTH (1-34). 9 н. и 12 з.п. ф-лы., 20 ил., 3 табл., 9 пр.
Реферат
Заявление в отношении финансируемого государством исследования
Это изобретение получено при поддержке правительства Соединенных Штатов Америки в виде гранта DK-11794, присужденного национальным институтам здоровья. Правительство обладает определенными правами на это изобретение.
Уровень техники, предшествующий изобретению
В основном изобретение относится к аналогам паратиреоидного гормона (PTH), конкретно к тем, что обладают активностью агониста длительного действия рецептора PTH. Эти аналоги можно использовать для лечения заболеваний, где желательна активность длительного действия, таких как гипопаратиреоз.
PTH(1-34) представляет собой эффективное терапевтическое средство для лечения остеопороза и состояний дефицита PTH, а именно гипопаратиреоза.
Гипопаратиреоз представляет собой пожизненное заболевание, характеризующееся недостаточной продукцией паратиреоидного гормона (PTH) паращитовидными железами. Поскольку PTH является крайне важным для регуляции уровней кальция и фосфатов, потеря PTH снижает уровни кальция в крови, и костях и повышает уровни фосфатов (гипокальциемия и гиперфосфатемия). Гипокальциемия приводит к симптомам, таким как нервно-мышечная возбудимость, включая парестезии, мышечная судорога, горловым спазмам (которые могут приводить к неспособности говорить, и настораживать врачей и медицинские учреждения в отношении сопутствующего медицинского состояния, что приводит к отсроченному или неправильному лечению) и возможно к тетании и судорогам. Это единственное эндокринное заболевание, для которого отсутствующий гормон (а именно PTH) еще не доступен в качестве терапии.
PTH(1-34) определен как безопасная и эффективная альтернатива терапии кальцитриолом гипопаратиреоза и способен поддерживать нормальные уровни кальция в сыворотке без гиперкальциурии (Winer et al., J Clin Endocrinol Metab 88:4214-4220, 2003). Тем не менее, для полипептида необходима инъекция по меньшей мере дважды в сутки, и, таким образом, признана необходимость в аналоге PTH(1-34) длительного действия при этом заболевании (Winer et al. выше).
Таким образом, существует необходимость в дополнительных агонистах рецептора PTH, конкретно в тех, что обладают активностью длительного действия на рецептор PTH.
Сущность изобретения
Настоящее изобретение относится к получению аналогов PTH и PTHrP. Описываемые в настоящем документе примерные полипептиды SP-PTH-AAK и Aib-SP-PTH-AAK обладают активностью длительного действия в отношении рецептора PTH in vitro, и in vivo и демонстрируют высокую растворимость в нейтральном водном растворе. Полипептиды по изобретению являются, таким образом, пригодными для лечения заболевания, для которого желательная активность длительного действия, включая гипопаратиреоз.
Таким образом, изобретение относится к полипептиду (например, выделенному) или его фармацевтически приемлемой соли, содержащему аминокислотную последовательность формулы (I):
X01-Val-X03-Glu-Ile-Gln-Leu-X08-His-X10-X11-X12-X13-X14-X15-X16-X17-X18-Arg-Arg-Arg-X22-Phe-Leu-X25-X26-Leu-Ile-Ala-Glu-Ile-His-Thr-Ala-Glu-Ile
(I)
где X01 представляет собой Ser, Ala или Aib; X03 представляет собой Ser, Ala или Aib; X08 представляет собой Met, Leu или Nle; X10 представляет собой Asn, Ala, Val, Asp, Ile, Glu или Gln; X11 представляет собой Leu, Ala, Val, Met, Lys, Arg, Har или Trp; X12 представляет собой Gly, Ala, His или Arg; X13 представляет собой Lys, Ala, Leu, Gln, Arg, His или Trp; X14 представляет собой His, Leu, Arg, Phe, Trp или Ser; X15 представляет собой Ile или Leu; X16 представляет собой Gln или Asn; X17 представляет собой Asp или Ser; X18 представляет собой Ala, Leu, Met, Glu, Ser или Phe; X22 представляет собой Ala, Phe, Glu, Ser, Leu, Asn, Trp или Lys; X25 представляет собой His, Arg, Leu, Trp или Lys и X26 представляет собой Lys, His, Ala, Ser, Asn или Arg или его фрагмент, содержащий аминокислоты 1-28, 1-29, 1-30, 1-31, 1-32, 1-33, 1-34 или 1-35 формулы (I), при условии, что по меньшей мере один из X18 не представляет собой Leu или Met, X22 не представляет собой Phe и X26 не представляет собой His.
В определенных вариантах осуществления полипептид содержит формулу (II):
X01-Val-X03-Glu-Ile-Gln-Leu-X08-His-X10-X11-X12-Lys-X14-X15-X16-X17-X18-Arg-Arg-Arg-X22-Phe-Leu-His-X26-Leu-Ile-Ala-Glu-Ile-His-Thr-Ala-Glu-Ile
(II)
где X01 представляет собой Ser, Ala или Aib; X03 представляет собой Ser, Ala или Aib; X08 представляет собой Met, Leu или Nle; X10 представляет собой Asn, Gln или Asp; X11 представляет собой Leu, Arg, Har или Lys; X]2 представляет собой Gly или Ala; X14 представляет собой His, Trp или Ser; X15 представляет собой Ile или Leu; X16 представляет собой Gln или Asn; X17 представляет собой Asp или Ser; X18 представляет собой Ala или Leu; X22 представляет собой Ala или Phe; и X26 представляет собой Lys или His или его фрагмент, содержащий аминокислоты 1-28, 1-29, 1-30, 1-31, 1-32, 1-33, 1-34 или 1-35 формулы (II).
В других вариантах осуществления полипептид содержит формулу (III):
X01-Val-X03-Glu-Ile-Gln-Leu-X08-His-X10-X11-X12-Lys-X14-Ile-X16-X17-X18-Arg-Arg-Arg-X22-Phe-Leu-His-X26-Leu-Ile-Ala-Glu-Ile-His-Thr-Ala-Glu-Ile
(III)
где, X01 представляет собой Ser, Ala или Aib; X03 представляет собой Ser, Ala или Aib; X08 представляет собой Met, Leu или Nle; X10 представляет собой Asn или Gln; X11 представляет собой Leu, Arg или Har; X12 представляет собой Gly или Ala; X14 представляет собой His или Trp; Xl6 представляет собой Gln или Asn; X17 представляет собой Asp или Ser; X18 представляет собой Ala или Leu; X22 представляет собой Ala или Phe; и X26 представляет собой Lys или His или его фрагмент, содержащий аминокислоты 1-28, 1-29, 1-30, 1-31, 1-32, 1-33, 1-34 или 1-35 формулы (III).
В конкретных вариантах осуществления любого из указанных выше полипептидов X01 и X03 представляют собой Ala; X10 представляет собой Gln; X11 представляет собой Arg; X12 представляет собой Ala, и X14 представляет собой Trp. В других вариантах осуществления X01 представляет собой Ala; X03 представляет собой Aib; X10 представляет собой Gln; X11 представляет собой Har; X12 представляет собой Ala, и X14 представляет собой Trp. В любом из указанных выше полипептидов X18 может представлять собой Ala; X22 может представлять собой Ala и/или X26 может представлять собой Lys.
В определенных вариантах осуществления полипептид является по существу идентичным (например, по меньшей мере 90% или 95% идентичным) описанному выше полипептиду (например, где X18 и X22 представляют собой Ala, и где X26 представляет собой Lys). В определенных вариантах осуществления полипептид демонстрирует большую растворимость в нейтральном водном растворе (например, фосфатно-солевом буфере (PBS) при pH 7,4) по сравнению с SP-PTH (например, является по меньшей мере 40%, 50%, 60%, 70%, 80%, 90%, или 95% растворимым в нейтральном водном растворе по сравнению с кислым раствором (например, pH 1, 2, 3, 4 таким как 10 мМ уксусная кислота (pH 2,9)). В определенных вариантах осуществления полипептид является биологически активным (например, агонистом рецептора PTH). В определенных вариантах осуществления полипептид связывается рецептором PTH-1 человека в состоянии R0 с большей аффинностью, чем hPTH(1-34). В других вариантах осуществления длина полипептида составляет меньше 200, 150, 100, 75, 50, 40, 39, 38 или 37 аминокислот. Полипептид может являться амидированным на его C-конце.
В конкретном варианте осуществления полипептид содержит или представляет собой аминокислотную последовательность:
Ala-Val-Ala-Glu-Ile-Gln-Leu-Met-His-Gln-Arg-Ala-Lys-Trp-Ile-Gln-Asp-Ala-Arg-Arg-Arg-Ala-Phe-Leu-His-Lys-Leu-Ile-Ala-Glu-Ile-His-Thr-Ala-Glu-Ile,
или ее фрагмент, содержащий аминокислоты 1-28, 1-29, 1-30, 1-31, 1-32, 1-33, 1-34 или 1-35 указанной выше последовательности. В другом варианте осуществления полипептид содержит или представляет собой аминокислотную последовательность:
Ala-Val-Aib-Glu-Ile-Gln-Leu-Met-His-Gln-Har-Ala-Lys-Trp-Ile-Gln-Asp-AIa-Arg-Arg-Arg-Ala-Phe-Leu-His-Lys-Leu-Ile-Ala-Glu-Ile-His-Thr-Ala-Glu-Ile,
или ее фрагмент, содержащий аминокислоты 1-28, 1-29, 1-30, 1-31, 1-32, 1-33, 1-34 или 1-35 указанной выше последовательности. В других вариантах осуществления пептид содержит или представляет собой аминокислотную последовательность, выбранную из группы, состоящей из:
Ala-Val-Ala-Glu-Ile-Gln-Leu-Nle-His-Gln-Arg-Ala-Lys-Trp-Ile-Gln-Asp-Ala-Arg-Arg-Arg-Ala-Phe-Leu-His-Lys-Leu-Ile-Ala-Glu-Ile-His-Thr-Ala-Glu-Ile;
Ala-Val-Ala-Glu-Ile-Gln-Leu-Leu-His-Gln-Arg-Ala-Lys-Trp-Ile-Gln-Asp-Ala-Arg-Arg-Arg-Ala-Phe-Leu-His-Lys-Leu-Ile-Ala-Glu-Ile-His-Thr-Ala-Glu-Ile;
Ala-Val-Aib-Glu-Ile-Gln-Leu-Nle-His-Gln-Har-Ala-Lys-Trp-Ile-Gln-Asp-Ala-Arg-Arg-Arg-Ala-Phe-Leu-His-Lys-Leu-Ile-Ala-Glu-Ile-His-Thr-Ala-Glu-Ile
и
Ala-Val-Aib-Glu-Ile-Gln-Leu-Leu-His-Gln-Har-Ala-Lys-Trp-Ile-Gln-Asp-Ala-Arg-Arg-Arg-Ala-Phe-Leu-His-Lys-Leu-Ile-Ala-Glu-Ile-His-Thr-Ala-Glu-Ile,
или ее фрагмент, содержащий аминокислоты 1-28, 1-29, 1-30, 1-31, 1-32, 1-33, 1-34 или 1-35 указанной выше последовательности.
Любой из описанных выше полипептидов может являться амидированным на его C-конце.
Изобретение также относится к фармацевтической композиции, которая содержит полипептид по изобретению (например, любой описанный выше или в настоящем документе полипептид) и фармацевтически приемлемый носитель.
В определенных вариантах осуществления полипептид по изобретению синтезируют посредством твердофазного синтеза или получают рекомбинантно.
Изобретение также относится к способу лечения индивидуума с заболеванием, выбранным, например, из группы, состоящей из гипопаратиреоза, гиперфосфатемии, остеопороза, перелома кости, остеомаляции, артрита и тромбоцитопении. Способ включает введение полипептида по изобретению или фармацевтической композиции, содержащей полипептид по изобретению, индивидууму в достаточном для лечения заболевания количестве. Полипептид или фармацевтическую композицию можно вводить, например, подкожно, внутривенно, интраназально, внутрилегочно, трансдермально и перорально.
Изобретение также относится к нуклеиновой кислоте, содержащей последовательность, кодирующую полипептид по изобретению. Нуклеиновая кислота может являться функционально связанной с промотором. Нуклеиновая кислота может являться частью вектора. Изобретение также относится к содержащей вектор клетке и к способу получения полипептида посредством выращивания клетки в условиях, при которых закодированный полипептид экспрессируется.
Под "индивидуум" подразумевают человека или не являющееся человеком животное (например, млекопитающее).
Под "лечением" подразумевают улучшение по меньшей мере одного симптома состояния или заболевания у индивидуума с состоянием или заболеванием (например, индивидуума с установленным диагнозом гипопаратиреоз) по сравнению с равноценным нелеченым контролем. Такое уменьшение симптома (например, снижение уровней кальция в крови или повышение уровней фосфатов в сыворотке) составляет по меньшей мере 5%, 10%, 20%, 40%, 50%, 60%, 80%, 90%, 95% или 100% как измерено любым стандартным способом.
Под "очищенным полипептидом" или "выделенным полипептидом" подразумевают полипептид, который отделили от других компонентов. Как правило, полипептид является по существу чистым, когда по меньшей мере 30% по массе не содержит других компонентов. В определенных вариантах осуществления препарат по меньшей мере 50%, 60%, 75%, 85%, 90%, 95%, 96%, 97%, 98% или 99% по массе не содержит других компонентов. Очищенный полипептид можно получать, например, экстрагированием из природного источника, экспрессией рекомбинантного полинуклеотида, кодирующего такой полипептид или посредством химического синтеза полипептида. Чистоту можно измерять любым соответствующим способом, например, колоночной хроматографией, электрофорезом в полиакриламидном геле или посредством анализа ВЭЖХ.
Под "биологически активным" подразумевают, что соединение или композиция (например, описываемый в настоящем документе полипептид) обладает по меньшей мере одним достоверным биологическим эффектом при введении в клетку или животное (например, человеку или не принадлежащему человеку млекопитающему). Виды биологической активности PTH, PTHrP и их аналогов (например, тех, что описаны в настоящем документе) в качестве неограничивающих примеров включают связывание с рецептором, продукцию цАМФ или IP3, активацию протеинкиназы A, протеинкиназы C, фосфолипазы C, фосфолипазы D и фосфолипазы A2, изменения (например, увеличения или снижения) внутриклеточных, в плазме или в моче уровней кальция или фосфатов и изменения в костном метаболизме или катаболизме in vivo или in vitro. Биологически активный полипептид по изобретению (например, любой описываемый в настоящем документе полипептид), например, может демонстрировать увеличения (например, по меньшей мере 5%, 10%, 25%, 50%, 100%, 500%, 1000%, 10000%) или снижения (например, 95%, 90%, 75%, 50%, 25%, 10%, 5%, 1%, 0,1%, 0,01% или 0,001%) любой биологической активности по сравнению с соответствующим контролем (например, полипептидом дикого типа или его фенокопией, такой как PTH(1-34) или PTHrP(1-36)).
Под "по существу идентичный" подразумевают нуклеиновую кислоту или аминокислотную последовательность которая, при оптимальном выравнивании, например, описанными выше методами, разделяет по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности со второй нуклеиновой кислотой или аминокислотной последовательностью, например, последовательностью PTH или PTHrP или их фрагментом. "Существенную идентичность" можно использовать для обозначения различных типов и длин последовательности, такой как полноразмерная последовательность, эпитопы или иммуногенные пептиды, функциональные домены, кодирующие и/или регуляторные последовательности, экзоны, интроны, промоторы и геномные последовательности. Процент идентичности между двумя полипептидами или последовательностями нуклеиновых кислот определяют различными способами, которые известны специалистам в данной области, например, посредством общедоступного компьютерного программного обеспечения, такого как Smith Waterman Alignment (Smith et al., J Mol Biol 147:195-7, 1981), "Best Fit" (Smith and Waterman, Advances in Applied Mathematics, 482-489, 1981) в виде встроенных в GeneMatcher Plus™, Schwarz and Dayhof (1979) Atlas of Protein Sequence and Structure, Dayhof, M. O., Ed pp 353-358; программы BLAST (Basic Local Alignment Search Tool; (Altschul et al., J Mol Biol 215: 403-10, 1990), программного обеспечения BLAST-2, BLAST-P, BLAST-N, BLAST-X, WU-BLAST-2, ALIGN, ALIGN-2, CLUSTAL или Megalign (DNASTAR). Кроме того, специалисты в данной области могут определять соответствующие параметры для измерения выравнивания, включая любые необходимые алгоритмы для получения максимального выравнивания по всей длине сравниваемых последовательностей. В основном для белков длина последовательностей сравнения составляет по меньшей мере 6 или 8 аминокислот, предпочтительно 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20,21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 40, 50, 60, 70, 80, 90, 100, 125, 150, 200, 250, 300, 350, 400 или 500 аминокислот или больше вплоть до полной длины белка. Для нуклеиновых кислот длина последовательностей сравнения в основном составляет по меньшей мере 18, 21, 24, 27, 30, 33, 36, 39, 42, 45, 48, 51, 54, 57, 60, 63, 66, 69, 72, 75, 78, 81, 84, 87, 90, 93, 96, 99, 102, 105, 108, 111, 125, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 800, 900, 1000, 1100, 1200 или по меньшей мере 1500 нуклеотидов или больше вплоть до полной длины молекулы нуклеиновой кислоты. Следует понимать, что для целей определения идентичности последовательности при сравнении последовательности ДНК с последовательностью РНК, нуклеотид тимин является эквивалентным нуклеотиду урацил. Консервативные замены, как правило, включают замены в следующих группах: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин; серин, треонин; лизин, аргинин и фенилаланин, тирозин.
Под "нейтральным pH" подразумевают pH приблизительно 6-9 (например, 6,5-8,0). Конкретные нейтральные значения pH включают 6,5, 6,6, 6,8, 7,0, 7,2, 7,4, 7,6, 7,8 и 8,0.
Другие характеристики и преимущества изобретения станут очевидными из следующего подробного описания, рисунков и формулы изобретения.
Краткое описание рисунков
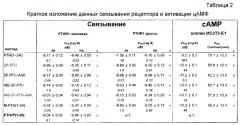
Фигуры 1A и 1B представляют собой графики, демонстрирующие аффинности связывания аналогов PTH к конформациям PTHR1 крысы в R0 (фигура 1 A) и RG (фигура 1B). Как показано, SP-PTH-AAK демонстрируют наиболее сильное связывание с формами R0 и RG рецептора. PTH(1-34) демонстрирует наиболее слабое связывание с формой R0 рецептора. Параметры подбора кривой показаны под каждым графиком.
Фигура 2 представляет собой график, демонстрирующий отклики цАМФ на PTH(1-34), SP-PTH, SP-PTH-AAK, Aib-SP-PTH и Aib-SP-PTH-AAK в клетках MC3T3-E1. Параметры подбора кривой показаны под каждым графиком.
Фигура 3 представляет собой график, демонстрирующий люминесценцию в клетках MC3T3-E1, трансфицированных конструкцией цАМФ-ответного элемента гена люциферазы с последующей обработкой PTH(1-34), SP-PTH, SP-PTH-AAK, Aib-SP-PTH, Aib-SP-PTH-AAK или PTH(3-34). Параметры подбора кривой показаны под каждым графиком.
Фигуры 4A и 4B представляют собой графики, демонстрирующие корреляцию между стимуляцией цАМФ и связыванием R0 (фигура 4A) или RG (фигура 4B).
Фигуры 5A и 5B представляют собой графики, демонстрирующие аффинность связывания PTH(1-34), SP-PTH, SP-PTH-AAK, Aib-SP-PTH и Aib-SP-PTH-AAK к формами R0 (фигура 5A) и RG (фигура 5B) рецептора PTH-1 человека. Параметры подбора кривой показаны под каждым графиком.
Фигура 6 представляет собой график, демонстрирующий стимуляцию цАМФ PTH(1-34), SP-PTH, SP-PTH-AAK, Aib-SP-PTH, и Aib-SP-PTH-AAK в рецепторе PTH-1 человека, экспрессируемого в клетках HKRK-B7.
Фигуры 7A и 7B представляют собой графики, демонстрирующие стимуляцию цАМФ, следующую после вымывания лиганда. На фигуре 7A представлена выработка цАМФ в пмоль/лунку, и на фигуре 7B представлены результаты, нормализованные к максимальной стимуляции цАМФ для каждого лиганда.
Фигуры 8A-8E представляют собой графики, демонстрирующие уровни кальция в крови мышей, получавших подкожные инъекции носителя или 5 нмоль/кг PTH(1-34), SP-PTH, SP-PTH-AAK, Aib-SP-PTH или Aib-SP-PTH-AAK в течение 0-8 часов (фигура 8A) или 0-30 часов (фигура 8B). Подобные результаты показаны для 10 нмоль/кг инъецированных подкожно пептидов на фигуре 8C (0-24 часов) и на фигуре 8D (0-54 часов). Также показаны результаты подобного эксперимента натощак (фигура 8E).
Фигура 9 представляет собой схематическое представление, демонстрирующее протокол эксперимента, применяемый при измерении уровней кальция в крови, фосфатов в сыворотке и отношения кальция-к-креатинину в моче крыс TPTX.
Фигуры 10A-10E представляют собой графики, демонстрирующие изменения кальция в крови (фигура 10A) и неорганических фосфатов в сыворотке (фигура 10B) крыс TPTX, подвергнутых введению носителя, SP-PTH, SP-PTH-AAK, Aib-SP-PTH или Aib-SP-PTH-AAK. Крысы с ложной операцией показаны как контроль. Также приведен подобный эксперимент, сравнивающий SP-PTH при 1,25 и 5 нмоль/кг с PTH(1-34) при 1,25, 5 и 20 нмоль/кг (фигура 10C). Фармакокинетические профили здоровых крыс, инъецированных внутривенно 10 нмоль/кг PTH(1-34) или SP-PTH также представлены (фигура 10D). Фармакокинетические профили крыс TPTX, инъецированных внутривенно 24,3 нмоль/кг hPTH(1-34), hPTH(1-84) или SP-PTH-AAK также представлены (фигура 10E).
Фигура 11A представляет собой схематическое представление, демонстрирующее протокол эксперимента, применяемый при измерении уровней кальция и фосфатов в сыворотке и моче яванских макак, получавших внутривенную инъекцию SP-PTH или SP-PTH-AAK.
Фигура 11B представляет собой график, демонстрирующий концентрацию SP-PTH в плазме макака после внутривенной инъекции 1 нмоль/кг.
Фигуры 12A-12C представляют собой графики, демонстрирующие кальций в сыворотке (фигуры 12A и 12C) и фосфат в сыворотке (фигура 12B) яванских макак, получавших инъекцию носителя, SP-PTH, SP-PTH-AAK или PTH(1-34) (* P<0,05, по сравнению с носителем; ** P<0,01 по сравнению с носителем). На фигурах 12A и 12B показаны результаты применения 0,25 нмоль/кг SP-PTH или SP-PTH-AAK или контроля носителем, инъецированного внутривенно. На фигуре 12C показаны концентрации кальция в сыворотке после инъецированного подкожно PTH(1-34) в 40 раз увеличенной дозе (10 нмоль/кг).
Фигуры 13A и 13B представляют собой графики, демонстрирующие отношения кальция в моче (фигура 13A) и фосфата в моче (фигура 13B) к креатинину у яванских макак, получавших внутривенную инъекцию носителя, SP-PTH или SP-PTH-AAK (* P<0,05, по сравнению с носителем; ** P<0,01 по сравнению с носителем).
Фигура 14 представляет собой схематическое представление, демонстрирующее протокол эксперимента, применяемый при измерении уровней кальция в сыворотке и фосфатов в сыворотке яванских макак, получавших носитель или 2,5 нмоль/кг или 10 нмоль/кг SP-PTH или SP-PTH-AAK.
Фигуры 15A-15H представляют собой графики, демонстрирующие уровни кальция и фосфатов в сыворотке и моче и уровни креатинина в сыворотке яванских макак, получавших носитель, 2,5 нмоль/кг или 10 нмоль/кг SP-PTH-AAK, 10 нмоль/кг PTH(1-34) или 10 нмоль/кг PTH(1-84). На фигуре 15A показаны уровни кальция в сыворотке, и на фигурах 15B и 15C показаны уровни неорганических фосфатов в сыворотке. На фигуре 15D показаны уровни креатинина в сыворотке. На фигурах 15E и 15G показаны уровни кальция в сыворотке, и на фигуре 15F и 15H показаны уровни фосфатов в моче.
Фигуры 16A и 16B представляют собой графики, демонстрирующие растворимость полипептидов в растворе PBS при pH 7,4.
На фигуре 16C представлена стабильность SP-PTH-AAK в фосфатно-цитратных буферах и в 10 мМ уксусной кислоте при 5, 25, и 40°C. Количество оставшегося в образце интактного пептида SP-PTH-AAK по сравнению с начальным образцом измеряли посредством ОФ ВЭЖХ.
Фигуры 17A и 17B представляют собой графики, демонстрирующие влияние PTH(1-34) (фигура 17A) и M-PTH(1-28) (фигура 17B) на уровни кальция в крови мышей, которые экспрессируют рецептор PTH дикого типа или с дефицитом фосфорилирования (PD).
Фигуры 18A и 18B представляют собой графики, демонстрирующие влияние PTH(1-34) (фигура 18A) и M-PTH(1-28) (фигура 18B) на уровни цАМФ в крови мышей, которые экспрессируют рецептор PTH дикого типа или PD.
Фигура 19 представляет собой график, демонстрирующий влияние SP-PTH-AAK на уровни кальция в крови мышей, которые экспрессируют рецептор PTH дикого типа или PD.
Фигуры 20A-20D представляют собой графики, демонстрирующие влияния SP-PTH при введении один раз в сутки на Ca в сыворотке и моче крыс TPTX. Крыс TPTX и контрольных c ложным введением обрабатывали один раз в сутки в течение 10 суток посредством подкожной инъекции носителя (ложное введение и TPTX), или SP-PTH (1, 2,4 или 8 нмоль/кг), или 1,25(OH)2D (0,075 или 0,2 мкг/кг Orn). После последней инъекции на 10 сутки крыс помещали в метаболические клетки и получали кровь из яремной вены через 8 (фигура 20A) и 24 часа (фигура 20B); мочу собирали с интервалами 0-8 (фигуры 20C) и 8-24 часов (фигура 20D); средние значения ± s.e.m.; n=5; "~" P по сравнению с носителем <005.
Подробное описание
Настоящее изобретение относится к новым аналогам паратиреоидного гормона (PTH) с пролонгированной активностью в отношении рецептора PTH. Примером этих аналогов служит SP-PTH-AAK ([Ala1,3,12,18,22, Gln10, Arg11, Trp14, Lys26]PTH(1-14)/PTHrP(15-36)) и Aib-SP-PTH-AAK (Ala1,12,18,22, Aib3, Gln10, homoArg11, Trp14, Lys26]PTH(1-14)/PTHrP(15-36)). Как описано ниже, эти полипептиды связываются с более высокой аффинностью с не сопряженной с G-белком конформацией R0 рецептора PTH-1 (PTHR1) in vitro, чем PTH(1-34) и другие полипептиды сравнения. Таким образом, эти полипептиды вызывают пролонгированные сигнальные отклики цАМФ в культивируемых клетках. Эти полипептиды также демонстрировали пролонгированные повышения в крови уровней ионизированного кальция у лабораторных подопытных животных (мышей, крыс и макак) по сравнению с PTH(1-34) или другими тестируемыми аналогами. Ввиду их подтвержденных свойств длительного действия in vivo аналоги пригодны в качестве лечений состояний, таких как гипопаратиреоз.
Примерные полипептиды SP-PTH-AAK и Aib-SP-PTH-AAK содержат N-концевой участок на основе последовательности PTH(1-14) человека и C-концевой участок на основе последовательности PTHrP человека (см. таблицу 1 ниже), с N- и C-концевыми участками, содержащими усиливающие аффинность аминокислотные замены. Эти полипептиды демонстрируют удивительно высокие аффинности связывания и сигнальные активности цАМФ in vitro, а также увеличенные функциональные эффекты in vivo, как проиллюстрировано в примерах ниже. Наконец, эти полипептиды демонстрируют высокую растворимость, сравнимую с полипептидом PTH(1-34) дикого типа, как описано ниже. Основываясь на этих свойствах, эти полипептиды можно использовать для любого применения, где желательна пролонгированная активность рецептора PTH, например, для лечения гипопаратиреоза.
Связывание R0 по сравнению со связыванием RG агонистов PTH
Как описано в публикации PCT WO 2009/017809, установлено новое состояние "R0" рецептора PTH, в котором рецептор не связан с его G-белком, но способен к связыванию с агонистом. Ранее полагали, что возможно различать две формы сопряженного с G-белком рецептора: форму (RG), которая связана с G-белком и форму (R), которая не связана с G-белком. Для сигнальной системы посредством GPCR необходимо, чтобы рецептор непосредственно активировал G-белок, т.е. необходимо образование состояния RG, и связывание лиганда агониста может вызывать это образование RG. Связывание лиганда агониста вызывает или стабилизирует состояние RG, и соответственно состояние RG стабилизирует высокую аффинность связывания агониста. После связывания GTP или негидролизуемого аналога GTP, такого как GTPγS, сопряженный с рецептором G-белок отделяется от рецептора, вызывая возвращение рецептора в низкоаффинное состояние. В настоящее время установлено, что некоторые GPCR, такие как PTHR, могут образовывать новое состояние (R0), которое может связывать определенные лиганды агонистов с высокой аффинностью даже в присутствии GTPγS, и, таким образом, даже когда рецептор предположительно не связан с G-белком. Основываясь на этом открытии состояния R0, в публикации PCT WO 2009/017809 описано, что лиганды, которые связываются с высокой аффинностью с состоянием R0, в дополнение к состоянию RG, обладают большим периодом спада активности, чем лиганды, которые связываются с R0 с более низкой аффинностью. Эта пролонгированная активность не зависит от биодоступности или фармакокинетики лиганда in vivo. Соответственно агонисты с небольшой продолжительностью действия обладают более низкой аффинностью к форме R0 рецептора.
Как описано в примерах ниже, SP-PTH-AAK и Aib-SP-PTH-AAK демонстрируют по существу большее связывание с формой R0 рецептора PTH по сравнению с hPTH(1-34) in vitro и демонстрируют активность длительного действия in vitro и in vivo. Полипептиды по изобретению являются, таким образом, подходящими в качестве агонистов PTH длительного действия.
Получение полипептидов по изобретению
Полипептиды по изобретению (например, SP-PTH-AAK и Aib-SP-PTH-AAK) являются подходящими для получения жидкофазным или твердофазным пептидным синтезом и синтезом in situ посредством комбинаторной химии. В частности способ твердофазного пептидного синтеза успешно применяют для получения PTH человека и его можно применять для получения этих соединений (для руководства, см. Kimura et al., Supra and Fairwell et al., Biochem. 22:2691, 1983). Успех с получением PTH человека в относительно крупных масштабах опубликован в статье Goud et al., J Bone Min Res 6:781, 1991. Подход синтеза синтетических пептидов в основном влечет за собой использование автоматических синтезаторов и соответствующей смолы в качестве твердой фазы, к которой прикреплена C-концевая аминокислота желаемого полипептида. Удлинение пептида в направлении N-конца затем получают посредством последовательного связывания соответственно защищенной формы следующей желаемой аминокислоты с применением химических протоколов на основе FMOC или BOC, как правило, до завершения синтеза. Защитные группы затем отщепляют от пептида, как правило, одновременно с отщеплением пептида от смолы, и пептид затем выделяют, и очищают общепринятыми способами, такими как обращено-фазовая ВЭЖХ с применением ацетонитрила в качестве растворителя и трифторуксусной кислоты в качестве средства для образования пары ионов. Такие способы широко описаны в многочисленных публикациях, и можно сослаться, например, на Stewart and Young, "Solid Phase Peptide Synthesis", 2nd Edition, Pierce Chemical Company, Rockford, IL (1984).
Полипептиды по изобретению также можно получать рекомбинантно любым известным в данной области способом. Прокариотические (например, бактериальные) и эукариотические (например, дрожжевые и млекопитающего) экспрессирующие системы также можно использовать для получения полипептидов по изобретению, где предпочтительно полипептид содержит только закодированные в геноме аминокислоты (например, не Aib или Har).
Модификации полипептидов
Любой из полипептидов, описываемых в настоящем документе (например, SP-PTH-AAK и Aib-SP-PTH-AAK), может содержать одну или несколько модификаций, таких как N-концевые или C-концевые модификации. Модификации включают ацетилирование, ацилирование, АДФ-рибозилирование, амидирование, ковалентное присоединение флавина, ковалентное присоединение группы гема, ковалентное присоединение нуклеотида или производного нуклеотида, ковалентное присоединение липида или производного липида, ковалентное присоединение фосфотидилинозитола, поперечное сшивание, циклизацию, образование дисульфидной связи, деметилирование, образование ковалентных поперечных связей, образование цистина, образование пироглутамата, формилирование, гамма-карбоксилирование, гликозилирование, образование якоря GPI, гидроксилирование, иодинирование, метилирование, миристоилирование, оксидирование, протеолитическую обработку, фосфорилирование, пренилирование, рацемизацию, селеноилирование, сульфатацию, опосредуемое транспортной РНК добавление аминокислот к белкам, такое как аргинилирование, и убиквитинилирование. См., например, Proteins-Structure and Molecular Properties, 2nd Ed., T. E. Creighton, W. H. Freeman and Company, New York, 1993 and Wold, F., Posttranslational Protein Modifications: Perspectives and Prospects, pp. 1-12 в Posttranslational Covalent Modification of Proteins, B. C. Johnson, Ed., Academic Press, New York, 1983; Seifter et al., Methods Enzymol 182:626 646 (1990) и Rattan et al., Ann NY Acad Sci 663A& 62 (1992).
Любой из полипептидов по изобретению может дополнительно содержать гетерологичную последовательность (партнер слияния), таким образом, образуя слитый белок. Слитый белок может содержать партнер слияния, такой как метка очистки или детекции, например, белки, которые можно непосредственно детектировать или опосредованно, такие как зеленый флуоресцентный белок, гемагглютинин или щелочная фосфатаза, связывающие ДНК домены (например, GAL4 или LexA), домены активации генов (например, GAL4 или VP16), метки очистки или секреторные сигнальные пептиды (например, сигнальная последовательность препротрипсина). В других вариантах осуществления партнер слияния может представлять собой метку, такую как c-myc, полигистидин или FLAG. Каждый партнер слияния может содержать один или несколько доменов, например, сигнальную последовательность препротрипсина или метку FLAG. В других случаях партнер слияния представляет собой Fc-белок (например, Fc мыши или Fc человека).
Способы лечения заболевания
Любое заболевание, ассоциированное с дисфункцией PTH или с дисбалансом кальция или фосфатов, можно лечить описываемыми в настоящем документе полипептидами (например, SP-PTH-AAK и Aib-SP-PTH-AAK). Полипептиды можно использовать для лечения гипопаратиреоза, гиперфосфатемии, остеопороза, заживления перелома, остеомаляции, артрита или тромбоцитопении или можно использовать для увеличения активации стволовых клеток у индивидуума. Можно использовать любой способ введения (например, пероральный, внутривенный, внутримышечный, глазной, местный, кожный, подкожный и ректальный) при лечении способами по изобретению. Практикующий специалист определит соответствующее дозирование для пациента, которому предстоит лечение, которое частично зависит от возраста и размера пациента, тяжести заболевания или состояния и конкретного заболевания или состояния, подвергаемого лечению.
Состав фармацевтических композиций
Введение любого описываемого в настоящем документе полипептида (например, SP-PTH-AAK и Aib-SP-PTH-AAK), результатом которого является концентрация соединения, которым лечат индивидуума и состояние заболевания, можно проводить любыми подходящими способами.
Полипептид может содержаться в любом соответствующем количестве в любом подходящем веществе носителя, и в основном содержится в количестве 1-95% по массе от общей массы композиции. Композицию можно получать в лекарственной форме, которая является подходящей для перорального, парентерального (например, внутривенного или внутримышечного), ректального, накожного, назального, вагинального, ингаляционного, кожного (пластырь), глазного или интракраниального способа введения. Таким образом, композиция может являться в форме, например, таблеток, ампул, капсул, пилюль, порошков, гранулятов, суспензий, эмульсий, растворов, гелей, включая гидрогели, пасты, мази, кремы, пластыри, кисели, устройства с осмотической доставкой, суппозитории, клизмы, инъецируемые лекарственные средства, имплантаты, спреи или аэрозоли. Фармацевтические композиции можно формулировать по общепринятой фармацевтической практике (см., например, Remington: The Science and Practice of Pharmacy, 20th edition, 2000, ed. A.R. Gennaro, Lippincott Williams & Wilkins, Philadelphia и Encyclopedia of Pharmaceutical Technology, eds. J. Swarbrick and J. C. Boylan, 1988-1999, Marcel Dekker, New York).
Фармацевтические композиции можно формулировать для выделения активного соединения сразу после введения или в любое предопределенное время или период времени после введения. Последние типы композиций широко известны как составы с контролируемым высвобождением, которые включают (i) составы, которые создают по существу постоянные концентрации средства (средств) по изобретению в организме в течение длительного периода времени; (ii) составы, которые после предопределенного периода задержки создают по существу постоянные концентрации средств по изобретению в организме в течение длительного периода времени; (iii) составы, которые поддерживают действие средства (средств) в течение предопределенного периода времени посредством поддержания относительно постоянного эффективного уровня средства (средств) в организме с сопутствующей минимизацией побочных эффектов, ассоциированных с флуктуациями уровня средства (средств) в плазме (пилообразный кинетический паттерн); (iv) составы, которые локализуют действие средства (средств), например, пространственное расположение композиции с контролируемым высвобождением, прилежащее к или в больной ткани или органе; (v) составы, которые обеспечивают удобство дозирования, например, введение композиции один раз в неделю или один раз в две недели и (vi) составы, которые определяют цель действия средства (средств), посредством применения носителей или химических производных для доставки соединения в конкретный целевой тип клеток. Введение соединения в форме состава с контролируемым высвобождением, особенно предпочтительно для соединений с узким окном всасывания в желудочно-кишечном тракте или относительно коротким биологическим периодом полувыведения.
Можно использовать любую из ряда стратегий для получения контролируемого высвобождения, в которой скорость высвобождения превосходит скорость метаболизма рассматриваемого соединения. В одном из примеров контролируемое высвобождение получают посредством соответствующего выбора различных параметров состава и ингредиентов, включая, например, различные типы композиций с контролируемым высвобождением и покрытий. Таким образом, соединение формулируют с соответствующими эксципиентами в фармацевтической композиции, которая после введения высвобождает соединение управляемым способом. Примеры включают однокомпонентную или многокомпонентную таблетку или композиции в виде капсул, масляные растворы, суспензии, эмульсии, микрокапсулы, молекулярные комплексы, микросферы, наночастицы, пластыри и липосомы.
Парентеральные композиции
Композицию, содержащую описываемые в настоящем документе полипептиды (например, SP-PTH-AAK и Aib-SP-PTH-AAK), можно вводить парентерально посредством инъекции, вливания или имплантации (подкожно, внутривенно, внутримышечно, интраперитонеально или т.п.) в лекарственных формах, составах или посредством подходящих средств доставки или имплантатов, содержащих общепринятые нетоксические фармацевтически приемлемые носители и адъюванты. Состав и получение таких композиций хорошо известны специалистам в области технологии приготовления лекарственного средства.
Композиции для парентерального применения можно получать в стандартных лекарственных формах (например, в ампулах с однократной дозой) или в пробирках, содержащих несколько доз, и в которые можно добавлять подходящий консервант (см. ниже). Композиция может являться в форме раствора, суспензии, эмульсии, инфузионного устройства или средства доставки для имплантации, или ее можно получать в виде сухого порошка, который ресуспендируют в воде или в другом подходящем н