Фармацевтическая композиция для ингаляции
Иллюстрации
Показать всеНастоящее изобретение относится к ингаляционному порошковому составу. Порошковый состав содержит тонко измельченные частицы со средним диаметром частиц 20 мкм или менее, включающие пирфенидон, эксципиент и носитель со средним диаметром частиц от 10 до 200 мкм. Эксципиент представляет собой одно или более веществ, выбранных из группы, состоящей из сахаридов, сахарных спиртов, жирных кислот и их солей, восков, сульфата кальция, карбоната кальция, талька и оксида титана. Носитель представляет собой сахарид или сахарный спирт. Предпочтительно эксципиент представляет собой эритритол и носитель представляет собой лактозу. Также описан способ получения ингаляционного порошкового состава. Ингаляционный порошковый состав по изобретению снижает риск побочного эффекта фотодерматоза, индуцируемого лекарственным средством пирфенидоном, и в более значительной степени по сравнению с перорально вводимым составом. 3 н. и 12 з.п. ф-лы, 8 ил., 4 табл., 7 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к фармацевтической композиции, которая может регулировать воздействие на весь организм лекарственного препарата, в частности трансмиграцию в кожу лекарственного препарата, обладающего побочным эффектом индуцируемого лекарственным средством фотодерматоза. Настоящее изобретение также относится к составу вдыхаемого порошка, который легко фармацевтически обрабатывать и обеспечивать возможность сохранения однородного содержания лекарственного средства вследствие улучшения дисперсности.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0002] Ингаляционную терапию применяли для лечения заболевания легких и дыхательных путей, диагностики заболевания, введения лекарственного препарата в организм через дыхательные пути и транспульмонально, профилактики заболевания, терапии, направленной на десенсибилизацию иммунитета с введением через дыхательные пути и т.д., вследствие использования дыхательного пути для введения лекарственного препарата. Однако определяющий адаптацию способ такой терапии полностью не изучен ни в одном из случаев. Таким образом, желательной является разработка соответствующего вдыхаемого состава.
В качестве признаков основного вдыхаемого состава выявляют 1) быстрое проявление эффектов лекарственного средства, 2) постепенное сокращение побочных эффектов, 3) возможность введения небольшой дозы, 4) устранение эффекта первого прохождения и т.д. Когда область-мишень представляет собой легкое, вдыхаемый состав наделен дополнительными основными характеристиками, обладая большой площадью поверхности, равной тонкому кишечнику. При применении вдыхаемого состава в качестве направленной терапии необходимо учитывать способ отбора критериев вдыхаемого состава с точки зрения не только эффективности в отношении заболевания, но и способа получения частиц лекарственного препарата, частей поступления и релевантности основных физических свойств лекарственного препарата по отношению к ним. В настоящее время вдыхаемый состав используют для бронхолитика, растворяющего слизь средства, антибиотика, противоаллергического средства, стероида, вакцины, физиологического раствора и т.д., и в случае его клинического применения считают, что место приложения действия ингалируемого средства, механизм действия, композиция, инструкция по применению и т.д. являются важными факторами.
[0003] В последние годы при лечении бронхиальной астмы или хронического заболевания легких внимание привлекает появившийся ингалятор сухого порошка (ингалятор сухого порошка, DPI). Такая форма обладает преимуществом, которое наряду с признаками вдыхаемого состава, как указано выше, заключается в том, что лекарственный препарат можно хранить в стабильной форме в течение длительного периода времени. В DPI существует тесная зависимость между диаметром частиц лекарственного препарата, которые вдыхает пациент, и осаждением в дыхательных путях [Pharmacia (1997), Vol. 33, No.6 и 98-102], и учитывают корреляцию аэродинамических параметров по отношению к тому, частицы лекарственного препарата какого диаметра осаждается в трахеи и легком. В частности, общеизвестно, что оптимальные размеры частиц лекарственного препарата, которые могут попадать в бронх или легкое, представляют собой частицы, которые имеют аэродинамический диаметр приблизительно от 1 до 6 мкм [Int. J. Pharm. (1994), 101 и 1-13].
Предпочтительно частицы размером несколько мкм или менее попадают в альвеолы, и вследствие того, что они эффективно всасываются из слизистой оболочки легкого и мигрируют в кровь, размер частиц становится важным. Однако чем больше частицы становятся мелкодисперсными, тем больше ухудшается текучесть порошка, и в результате беспокойство вызывают ухудшение точности наполнения и свойства обработки во время получения. Кроме того, для разрешения таких проблем при обработке состава DPI хорошо известен указанный ниже способ, в котором смешивают тонко измельченные частицы с крупными частицами, такими как лактоза и эритритол, которые используют в качестве носителя. Согласно этому способу вследствие того, что вызывают налипание тонко измельченных частиц на поверхность носителя посредством межмолекулярного взаимодействия, когезионная сила тонко измельченных частиц становится слабее, и диаметр частиц становится больше в целом, и, таким образом, улучшается текучесть состава. Указаны другие способы, включая гранулирование лекарственного препарата и способ обработки поверхности (патентный документ 1).
[0004] В настоящем описании пирфенидон (далее PFD) представляет собой первое противофиброзное средство, одобренное во всем мире для применения для идиопатического легочного фиброза. Механизм действия заключается в получении модулирующего действия для различных цитокинов, таких как воспалительный цитокин и противовоспалительный цитокин, и для факторов роста, которые вовлечены в образование фиброза, и продемонстрировано противофиброзное действие на основе комплексных эффектов, таких как подавляющее размножение фибробластов действие и подавляющее образование коллагена действие. При сравнении этого средства и преднизолона, несмотря на то, что для преднизолона продемонстрировали только противовоспалительную активность, для этого средства продемонстрировали противовоспалительную активность и противофиброзное действие, таким образом, ожидают, что оно обладает более эффективными терапевтическими результатами по сравнению с тем, что может оказывать стероид. Несмотря на то, что его продают в Японии с 2008 г. и его широко используют для лечения легочного фиброза, у многих пациентов, которые принимали это средство выявляли побочный эффект в виде индуцированного лекарственными средствами фотодерматоза, и его частота проявления составляет приблизительно 60 процентов. Для устранения этой проблемы желательной являлась подходящая лекарственная форма, которая может легко оказывать действие на локальный участок легкого. Однако до настоящего времени доступным на рынке являлся только пероральный состав, и, несмотря на востребованность, проектирование более предпочтительной лекарственной формы, направленной на стабильность и местное введение не рассматривали. Другими словами, крайне желательной является разработка новых лекарственных форм, которые снижают риск фотодерматоза, побочных эффектов пирфенидона и приводят к безопасному лечению легочного фиброза. В качестве составов DPI, в которых тонко измельченные частицы выполняют с возможностью налипать на поверхность носителя, были опубликованы составы, в которых используют лактозу в качестве носителя (патентный документ 2), состав циклоспорина (Непатентный документ 1), состав траниласта (патентный документ 3, непатентные документы 2-3) и т.д. Однако в любых ссылках не описана регуляция трансмиграции в кожу и снижение риска фотодерматоза лекарственного препарата посредством указанного выше состава DPI.
[0005] Список известных уровней техники:
[Патентный документ 1] WO99/27911
[Патентный документ 2] патент Японии 4125512
[Патентный документ 3] патентная публикация Японии 2011-93849A
[Непатентный документ 1] Journal of Controlled Release (2009), 138(1), 16-23
[Непатентный документ 2] Journal of Pharmaceutical Sciences (201 1), 100(2), 622-633
[Непатентный документ 3] European Journal of Pharmaceutics and Biopharmaceutics (2011), 77(1), 178-181
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, ПОДЛЕЖАЩИЕ РЕШЕНИЮ ПОСРЕДСТВОМ ИЗОБРЕТЕНИЯ
[0006] Лекарственные препараты мигрируют по всему организму, как правило, через кровь при пероральном введение, затем, таким образом, они также мигрируют в кожу до некоторой степени, и полагают, что это вызывает побочный эффект. Таким образом, целью изобретения является предоставление состава, который может регулировать воздействие на целый организм лекарственного препарата, обладающего побочным эффектом фотодерматозом, вызываемым лекарственными средствами, в частности трансмиграцию лекарственного препарата в кожу. Еще более предпочтительным является обеспечение вдыхаемого состава, где лекарственный препарат, в частности пирфенидон, проявляет значительную эффективность и главные характеристики ингаляционного средства.
СРЕДСТВА РЕШЕНИЯ ЗАДАЧ
[0007] Авторы настоящего изобретения повторно проводили тщательные исследования для решения указанных выше проблем, и в результате они выполнили настоящее изобретение. Другими словами, пирфенидон, который представляет собой лекарственный препарат, обладающий побочным эффектом фотодерматозом, вызываемым лекарственным средством, измельчали посредством устройства для измельчения, такого как струйная мельница, совместно с эксципиентами с получением тонко измельченных частиц с диаметром, который может аэродинамически попадать в легкое, а затем получаемые тонко измельченные частицы хорошо перемешивали с носителями, которые обладают хорошей совместимостью с получаемыми тонко измельченными частицами и обладают диаметром, который может попадать аэродинамически в дыхательную систему, а затем успешно получали состав с очень высокой однородностью содержимого для выполнения настоящего изобретения. Когда крысе на модели экспериментального воспаления легкого вводили такой состав в дыхательные пути, при этом в контрольной группе выявляли очень выраженные признаки заболевания легких и нейтрофильное воспаление, в группе, в которой вводили пирфенидон во вдыхаемом составе, можно было эффективно контролировать такие состояния. Когда пирфенидон в дозе (30 мг/кг), для которой не выявляют противовоспалительную активность, вводили перорально крысе, не вызывали фотодерматоз, но в короткие сроки наблюдали трансмиграцию в кожу. С другой стороны, когда индивидууму вводили фармакологически эффективную дозу, например 0,1 мг/кг или более, вдыхаемого порошкового состава пирфенидона в дыхательные пути по сравнению с пероральным введением, наблюдали значительное подавление степени экстрагирования из кожи. На основании этих данных можно сделать вывод, что с использованием вдыхаемого порошкового состава по настоящему изобретению заметно снижают дозу посредством доставки лекарственного препарата непосредственно в ткань-мишень с фармакодинамической точки зрения, и, кроме того, в связи с этим состав обладает таким главным эффектом, что можно снижать риск индуцируемого лекарственным средством фотодерматоза, который представляет собой критический побочный эффект. Другими словами, настоящее изобретение относится к следующему, как указано ниже (1)-(22).
[0008] (1) Порошковый состав, содержащий тонко измельченные частицы со средним диаметром частиц 20 мкм или менее, содержащий лекарственное средство, обладающее побочным эффектом фотодерматозом, вызываемым лекарственным средством, и эксципиент и носитель со средним диаметром частиц 10~200 мкм.
(2) Порошковый состав по (1), как указано выше, где лекарственное средство, обладающее побочным эффектом фотодерматоза, индуцируемого лекарственным средством, представляет собой 1 или 2 или более, выбранных из группы, состоящей из антибиотиков, лекарственного средства против злокачественных опухолей, противоэпилептического лекарственного средства, антидепрессанта, противогрибкового средства, антигистаминного средства, противомалярийного средства, противоподагрического лекарственного средства, психотропного лекарственного средства, сердечно-сосудистого средства, диуретика, антилипемического средства, нестероидного противовоспалительного средства, средства для фототерапии, ретиноида и средства для лечения легочного фиброза.
(3) Порошковый состав по (1), как указано выше, где лекарственное средство, обладающее побочным эффектом фотодерматоза, индуцируемого лекарственным средством, представляет собой средство для лечения легочного фиброза.
(4) Порошковый состав по (1), как указано выше, где лекарственное средство, обладающее побочным эффектом фотодерматоза, индуцируемого лекарственным средством, представляет собой пирфенидон.
(5) Порошковый состав по любому из (1)-(4), как указано выше, где тонко измельченные частицы и носители образуют комплексы.
(6) Порошковый состав по (5), как указано выше, где диаметр частицы тонко измельченных частиц является меньше, чем средний диаметр частиц носителей.
(7) Порошковый состав по любому из (1)-(6), как указано выше, где эксципиент и/или носитель представляют собой сахариды.
(8) Порошковый состав по (7), как указано выше, где сахариды представляют собой лактозу.
(9) Порошковый состав по любому из (1)-(6), как указано выше, где эксципиент и/или носитель представляют собой сахарные спирты.
(10) Порошковый состав по (9), как указано выше, где сахарные спирты представляют собой эритритол.
(11) Порошковый состав по любому из (1)-(6), как указано выше, где эксципиент представляет собой макромолекулярные полимеры.
(12) Порошковый состав по любому из (1)-(6), как указано выше, где эксципиент представляет собой эритритол и носитель представляет собой лактозу.
(13) Порошковый состав по любому из (1)-(12), как указано выше, где отношение лекарственного средства, обладающего побочными эффектами фотодерматоза, индуцируемого лекарственным средством, к эксципиенту находится в диапазоне 1:5000~10:1 в массовом отношении.
(14) Порошковый состав по любому из (1)-(13), как указано выше, где отношение тонко измельченных частиц к носителям находится в диапазоне 1:100~10:1 в массовом отношении.
(15) Порошковый состав по любому из (1)-(14), как указано выше, где средний диаметр тонко измельченных частиц находится в диапазоне 1~9 мкм.
(16) Порошковый состав по любому из (1)-(15), как указано выше, где порошковый состав представляет собой транспульмональный вдыхаемый состав.
(17) Порошковый состав по (4), как указано выше, где индуцируемый лекарственным средством фотодерматоз пирфенидона снижают по сравнению с перорально вводимым составом.
(18) Способ получения состава по любому из (1)-(17), как указано выше, где тонко измельченные частицы со средним диаметром частицы 20 мкм или менее, содержащие лекарственное средство, обладающее побочным эффектом фотодерматоза, индуцируемого лекарственным средством, и эксципиент, смешивают с носителем с диаметром частиц 10~200 мкм.
(19) Способ по (18), как указано выше, где тонко измельченные частицы получают смешиванием лекарственного средства, обладающего побочным эффектом фотодерматоза, индуцируемого лекарственным средством, и эксципиента и посредством тонкого измельчения смеси струйной мельницей.
(20) Способ по (19), как указано выше, где тонко измельченные частицы и носители смешивают в контейнере, выполненном из нейлона или полиэтилена.
(21) Способ по любому из (18)-(20), как указано выше, где тонко измельченные частицы и носители образуют комплексы.
(22) Вдыхаемый состав, получаемый способом по любому из (18)-(21), как указано выше.
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
[0009] В соответствии с фармацевтической композицией по настоящему изобретению лекарственный порошок, такой как пирфенидон, который обладает побочным эффектом фотодерматоза, индуцируемого лекарственным средством, можно легко переводить в состояние аэрозоля и посредством доставки лекарственного препарата конкретно в легкое можно эффективно проводить лечение воспалительного заболевания легких, легочного фиброза и т.д. посредством низкой дозы по сравнению с пероральным введением и одновременно посредством предотвращения трансмиграции в кожу лекарственного препарата можно снижать риск фотодерматоза, который представляет собой основной побочный эффект лекарственного препарата. И фармацевтическую композицию по настоящему изобретению можно более предпочтительно получать в виде состава с однородным содержанием.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0010] [Фиг. 1] На фиг. 1 представлено распределение размера частиц в момент времени, когда распыляли состав 1.
[Фиг. 2] На фиг. 2 представлено изображение SEM в момент времени, когда носители и тонко измельченные частицы (частицы эксципиента и пирфенидона) образовывали комплексы.
[Фиг. 3] На фиг. 3 представлен результат теста фотореакционной активности каждого соединения. На фигуре 3 (A) символы представляют собой: □/■: пирфенидон, ∇/▼: 8-метоксипсорален (MOP) и Δ/▲: сулизобензон (□ ∇ Δ представляют собой синглетный кислород и ■ ▼ ▲ представляют собой супероксид). На фиг. 3 (B) символы представляют собой: □: раствор пирфенидона, ◊: порошок пирфенидона и ●: вдыхаемый порошковый состав пирфенидона.
[Фиг. 4] На фиг. 4 представлено количество пирфенидона в организме на каждой стадии в каскадном импакторе в случае использования носителя или без использования.
[Фиг. 5] На фиг. 5 представлены результат подсчета воспалительных клеток в жидкости бронхоальвеолярного лаважа (BALF) крысы на модели астмы и хронического обструктивного заболевания легких, которой вводили состав 1 посредством ингаляции.
[Фиг. 6] На фиг. 6 представлены результаты измерения биомаркеров воспалительных клеток в жидкости бронхоальвеолярного лаважа (BALF) крысы на модели астмы и хронического обструктивного заболевание легких, которой вводили состав 1 посредством ингаляции.
[Фиг. 7] На фиг. 7 представлено количество трансмигрующего пирфенидона в каждой ткани в момент проведения введения однократной дозы перорального и вдыхаемого составов. Символы представляют собой Δ: пероральный пирфенидон 160 мг/кг, ∇: пероральный пирфенидон 30 мг/кг и ●: 1 мг/кг вдыхаемого порошкового состава пирфенидона.
[Фиг. 8] На фиг. 8 представлено изменение концентрации пирфенидона в коже при повторном введении перорального и вдыхаемого составов. Символы представляют собой: Δ: пероральный пирфенидон 160 мг/кг, ∇: пероральный пирфенидон 30 мг/кг и ●: 1 мг/кг вдыхаемого порошкового состава пирфенидона.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0011] Далее в настоящем описании подробно описано настоящее изобретение.
[1] Лекарственный препарат, обладающий побочным эффектом фотодерматоза, индуцируемого лекарственным средством. В частности, в качестве лекарственных препаратов, обладающих побочным эффектом фотодерматоза, индуцируемого лекарственным средством, хотя конкретно не ограничены ими, указаны лекарственные препараты, описанные в таблице 2 Current Drug Safety, (2009), vol 4, pp 123-126. Например, они представляют собой антибиотик, лекарственное средство против злокачественных опухолей, противоэпилептическое лекарственное средство, антидепрессант, противогрибковое средство, антигистаминное средство, противомалярийное средство, противоподагрическое лекарственное средство, психотропное лекарственное средство, средство для лечения сердечно-сосудистой системы, диуретик, антилипемическое средство, нестероидное противовоспалительное средство, средство для фототерапии, ретиноид, средство для лечения легочного фиброза и т.д. В качестве антибиотика указаны ципрофлоксацин, эноксацин, лемефлоксацин, сульфаниламид, сульфаметоксазол, тетрациклин и т.д. В качестве средства против злокачественных опухолей указаны фторурацил, метотрексат и т.д. В качестве противоэпилептического средства указаны карбамазепин, фенобарбитал и т.д. В качестве антидепрессанта указаны амитриптилин, амоксапин и т.д. В качестве противогрибкового средства указаны флуцитозин, итраконазол и т.д. В качестве антигистаминного средства указаны бромфенирамин, дифенгидрамин и т.д. В качестве противомалярийного средства указаны хлорохин, кинин и т.д. В качестве противоподагрического средства указаны бензбромарон и т.д. В качестве психотропного средства указаны хлорпромазин, галоперидол и т.д. В качества средства для лечения сердечно-сосудистой системы указаны каптоприл, клофибрат и т.д. В качества диуретика указаны фуросемид, ацетазоламид и т.д. В качества антилипемического средства указаны глибенкламид, толбутамид и т.д. В качестве нестероидного противовоспалительного средства указаны индометацин, ибупрофен и т.д. В качестве средства для фототерапии указаны 8-MOP (ксантотоксин), фоскан, фотофрин и т.д. В качестве ретиноида указаны ацитретин, этретинат, изотретиноин и т.д. В качестве средства для лечения легочного фиброза, например, указан пирфенидон. В настоящем изобретении пирфенидон является особенно предпочтительным. Вследствие того, что в настоящем изобретении используют пирфенидон, способ его получения не является конкретно ограниченным, и включают то, что используют или будут использовать в будущем в качестве лекарственных средств, таких как его кристаллическая форма, аморфная форма, соль, гидрат и сольват.
[0012] [2] Эксципиент
Используемый в настоящем описании эксципиент представляет собой эксципиент, который, как правило, используют с целью увеличения массы, разбавления, наполнения, поддержания формы и т.д. твердых препаратов, таких как порошки и таблетка. Эксципиент является эффективным для улучшения растворимости лекарственного препарата и/или для снижения способности самоконденсации лекарственного препарата. Таким образом, хотя водорастворимый эксципиент является предпочтительным, эксципиент, который заметно абсорбирует влагу, не является предпочтительным для свойства такого состава. Можно использовать эксципиент, который является биологически неактивным и для которого ожидают, что он в некоторой степени метаболизируется. Также можно использовать водорастворимые полимеры, для них не существует ограничения при условии, что они являются приемлемыми в качестве лекарственного средства. Конкретные примеры таких эксципиентов, которые могут быть использованы, включают сахариды, такие как лактоза, глюкоза, сахароза, трегалоза, сахароза; сахарные спирты, такие как эритрит, маннит, сорбит; крахмалы; высокомолекулярные полимеры, такие как кристаллическая целлюлоза, метилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, кармеллоза натрия, пуллулан, декстрин, гуммиарабик, агар-агар, желатин, трагакант, альгинат натрия, поливинилпирролидон, поливиниловый спирт; стеариновая кислота; жирные кислоты и их соли; воски; сульфат кальция; карбонат кальция; тальк; оксид титана; и легкую безводную кремниевую кислоту. Можно использовать комбинацию одного или нескольких видов, выбранных из эксципиентов. Предпочтительные эксципиенты в настоящем изобретении представляют собой один или несколько, выбранных из группы, состоящей из сахаров, сахарных спиртов, макромолекулярных полимеров и карбонатов кальция, и лактоза или сахароза является предпочтительной в качестве сахаров, эритритол, сорбит или маннит является предпочтительным в качестве сахарных спиртов, и кармеллоза кальция, пуллулан, поливинилпирролидон или метилцеллюлоза является предпочтительной в качестве макромолекулярных полимеров. В частности, предпочтительный эксципиент представляет собой лактозу или эритритол.
[0013] [3] Носитель
В настоящем изобретении носитель используют для предотвращения конденсации лекарственного препарата перед введением порошкового состава и для улучшения эффективности всасывания в качестве транспульмонального вдыхаемого состава в момент введения посредством образования комплекса лекарственного препарата и эксципиента (указанного ниже). В частности, когда проводят операцию ингаляции с использованием ингалятора с целью применения в бронхе или легком, используют ингалятор для эффективного отделения эксципиента от лекарственного средства после ингаляции и в результате для улучшенной эффективности всасывания лекарственного препарата. Когда используют носитель для конструирования состава DPI, желаемым является точное выделение лекарственного препарата из капсулы или устройства и высокая вероятность отделение лекарственного средства от поверхности носителя. Конструирование состава необходимо проводить, хорошо учитывая эти моменты. В случае использования носителей важными становятся текучесть состава, предотвращение агрегации лекарственного препарата и правильность повышения и снижения доз и т.д. С этих точек зрения носители в настоящем изобретении являются предпочтительно порошкообразными. В качестве критериев выбора носителей необходимыми являются простота и способность к обработке, не говоря уже о токсичности или физико-химической стабильности. Для решения этих проблем пригодной по многим параметрам является лактоза, стабильность которой также является общепринято установленной, и которая является нейтральной, обладает небольшой реактивностью, а также обладает немного сладким вкусом, и подтверждена ее пригодность в качестве носителя для DPI [Int. J. Pharm. (1998), 172, 179-188]. В качестве носителей, которые можно использовать в настоящем изобретении, также можно отметить сахара, такие как глюкоза, фруктоза, сахароза, мальтоза и декстран наряду с лактозой, сахарные спирты, такие как эритритол, сорбит и маннит, общепринятые эксципиенты, такие как сульфат кальция, карбонат кальция, тальк и оксид титана, и не существует конкретного ограничения. Предпочтительные носители представляют собой сахара или сахарные спирты, и более предпочтительный носитель представляет собой лактозу или эритритол, и особенно предпочтительной является лактоза.
Когда фармацевтическая композиция по настоящему изобретению представляет собой форму, которую необходимо вводить пациенту с использованием ингалятора, носитель представляет собой носитель, который имеет диаметр частиц, допустимый с точки зрения аэродинамики. В частности, диапазон среднего диаметра частиц носителя составляет 10~200 мкм.
При необходимости получать носитель, который действует только в качестве носителя с точки зрения конструирования лекарственной формы, известно, что достаточным для этого является увеличение диаметра частиц. Однако в то же время, если диаметр частиц увеличивают, также хорошо известным фактом является то, что носитель удерживается в горле или ротовой полости. Таким образом, когда более желательным является предотвращение попадания самого носителя даже в легкое, несмотря на отсутствие его биологической активности, достаточно, если средний диаметр частиц будет составлять по меньшей мере 10 мкм или более. При необходимости еще более лучших условий желательным является выбор вещества после учета совместимости и т.д. основного средства и смешиваемого эксципиента. Однако если наблюдают большие трудности, в частности, предпочтительно выбирать носитель аналогичного качества вещества, что и качество вещества эксципиента.
[0014] [4] Способ смешивания и измельчения лекарственного препарата, обладающего побочным эффектом фотодерматоза, индуцируемого лекарственным средством, и эксципиента
Получение порошкового состава для ингаляционного введения по настоящему изобретению включает способ смешивания и измельчения лекарственного препарата, обладающего побочным эффектом фотодерматоза, индуцируемого лекарственным средством, и эксципиента. Растирание в порошок проводят, например, одновременно, когда эксципиент и лекарственный препарат, обладающий побочным эффектом фотодерматоза, индуцируемого лекарственным средством, смешивают с использованием аэродинамического устройства для измельчения. Способ не является ограничивающим для получения порошкового состава по настоящему изобретению, и можно использовать подходящий способ, который специалист в данной области, как правило, использует. Можно соответствующим образом определять по типу лекарственного препарата и эксципиента размер конечных частиц и т.д., несмотря на то, какой способ используют или не используют. Кристаллическое состояние соединения и характеристики состава, такие как адгезия и диспергируемость, во многих случаях коррелируют, и, таким образом, на этом этапе желательно выбирать последний способ обработки. Однако в случае, когда используют пирфенидон в качестве лекарственного средства, проявляющего побочный эффект фотодерматоза, индуцируемого лекарственным средством, и используют эритритол в качестве эксципиента, вследствие очень высокой ориентации кристаллов пирфенидона, хорошо растертую с порошок смесь можно получать даже при выборе любого этапа.
[0015] Частицы, которые содержат лекарственный препарат и эксципиент, получаемые в соответствии с указанным выше этапом, называют тонко измельченными частицами в этом описании.
В настоящем изобретении, хотя для растирания в порошок лекарственного препарата и эксципиента можно использовать общий способ сушки-измельчения, предпочтительно использовать конкретно аэродинамическое устройство для измельчения. В частности, устройства, которые эффективно измельчают небольшое количество в лаборатории, такие как дробильная и шаровая мельница, часто используют в качестве общепринятой машины для сушки-измельчения. В качестве шаровой мельницы известными являются вальцовая шаровая мельница, центробежная шаровая мельница, вибрационная шаровая мельница и планетарная шаровая мельница, и они могут выполнять растирание в порошок на основании принципов, таких как измельчение, вращение, вибрация и ударное воздействие. Существует много устройств для промышленного использования, предназначенных для эффективного измельчения ряда веществ, таких как средняя мельница типа ксантогенатора, высокоскоростная вращающаяся и ударная мельница и струйная мельница. В качестве высокоскоростной вращающейся мельницы для растирания в порошок существуют дисковая мельница и вальцовая мельница, и в качестве высокоскоростной вращающейся ударной мельницы существуют устройства, такие как режущая мельница (ножевая мельница), молотковая мельница (мельница тонкого помола), штифтовая мельница, мельница с ситами и т.д., которые выполняют растирание в порошок также при воздействии вращения в дополнение к сдвигу. Касательно струйной мельницы многие в основном выполняют растирание в порошок с использованием ударного воздействия. Что касается вида, то существуют наиболее общеизвестного типа столкновения частица-частица, типа столкновения частица-плита соударения и типа продувания через сопло (обдув). В частности, предпочтительно растирание в порошок проводят посредством струйной мельницы.
Касательно массового отношения лекарственного препарата, обладающего побочным эффектом фотодерматоза, индуцируемого лекарственным средством, к эксципиенту в составе по настоящему изобретению предпочтительным является диапазон 1:5000~10:1. Если лекарственный препарат превышает этот диапазон, могут возникать трудности с однородностью состава, и если эксципиент превышает этот диапазон, для определенного типа лекарственных препаратов существует опасность потери фармакологической активности. Массовое отношение лекарственного препарата, обладающего побочным эффектом фотодерматоза, индуцируемого лекарственным средством, к эксципиенту более предпочтительно составляет 1:100~5:1, и еще более предпочтительно 1:10~2:1, и наиболее предпочтительно 3:2.
В процессе измельчения лекарственный препарат, обладающий побочным эффектом фотодерматоза, индуцируемого лекарственным средством, смешивают с эксципиентом до однородности и измельчают таким образом, чтобы средний диаметр частиц мог соответствовать тонко измельченным частицам 20 мкм или менее. Диаметр в этих диапазонах обеспечивает возможность того, что тонко измельченные частицы попадают в часть мишеней, таких как бронх и легкое. Средний диаметр частицы тонко измельченных частиц составляет 10 мкм или менее предпочтительно, 1~9 мкм более предпочтительно и 3~8 мкм наиболее предпочтительно.
[0016] [5] Этап смешивания носителей и тонко измельченных частиц
Затем тонко измельченные частицы, получаемые на указанном выше этапе смешивания/растирания в порошок, смешивают с носителями и перед введением и дают возможность образоваться стабильным комплексам. В описании настоящего изобретения комплекс представляет собой молекулярный агрегат, образованный конденсацией лекарственного средства с эксципиентом и носителем в результате способности к самоконденсации, обусловленной молекулярным взаимодействием лекарственных препаратов. Смешивание носителей и тонко измельченных частиц можно проводить с использованием, как правило, хорошо известного смесителя. В основном существует смеситель с системой периодического действия и системой непрерывного действия, и, кроме того, существует два вида систем периодического действия ротационного типа и типа неподвижной установки. В ротационном типе существуют горизонтальный барабанный смеситель, V-образный ротационный смеситель, барабанный смеситель двухконусного типа и смеситель кубического типа, и в типе неподвижной установки существуют смеситель червячного типа (вертикальный, ступенчатый), вращающийся смеситель червячного типа и смеситель ленточного типа (вертикальный, ступенчатый). Система непрерывного действия также делится на два вида, ротационного типа и типа неподвижной установки. Касательно ротационного типа известны горизонтальный барабанный смеситель и ступенчатый смеситель конического типа, и для типа неподвижной установки известны смеситель червячного типа (вертикальный, ступенчатый), смеситель ленточного типа (вертикальный, ступенчатый) и смеситель ротационно-дискового типа. Кроме того, возможным является способ перемешивания с использованием аэродинамических устройств для измельчения, таких как средняя мельница типа ксантогенатора, высокоскоростная вращающаяся и ударная мельница, и струйная мельница. Можно получать однородно смешанный препарат посредством использования и перемешивания контейнера, который состоит из продукта, выполненного из нейлона, полиэтилена или вещества, обладающего аналогичными им свойствами.
Предпочтительно получать массовое отношение тонко измельченных частиц к носителям в диапазоне 1:100~10:1. Если тонко измельченные частицы превосходят этот диапазон, могут возникать трудности с однородностью состава, и если носители превышают этот диапазон, для определенного типа лекарственных препаратов вызывает беспокойство потеря фармакологической активности. Массовые отношения тонко измельченных частиц к носителям более предпочтительно составляют 1:50~1:1, еще более предпочтительно 1:20~1:5 и наиболее предпочтительно 1:10.
Отношение средних диаметров тонко измельченных частиц к средним диаметрам частиц носителей предпочтительно находится в диапазоне 1:1~1:50 и более предпочтительно 1:5~1:20.
[0017] [6] Ингалятор
Когда комплекс, получаемый на указанном выше этапе, вводят пациенту в виде порошкового состава для ингаляционного введения, индивидуум может получать лечение посредством введения через слизистую, такого как транспульмональное введение, назальное введение и т.д. Когда путь введения представляет собой транспульмональное введение, в частности, можно предписывать пациенту принять порошковый состав с использованием любых ингаляторов, как правило, используемых в данной области.
Касательно ингалятора, можно использовать устройства для ингаляции транспульмональным путем, такие как Spin haler, E-haler, Flow-Caps, Jet haler, Disk haler, Rotor haler, Inspirer ease, Inhalation eight и т.д., и дозирующие распылители и т.д., но не ограничиваясь ими.
Пример 1
[0018] (1) Получение тонко измельченных частиц, используемых для вдыхаемого порошкового состава
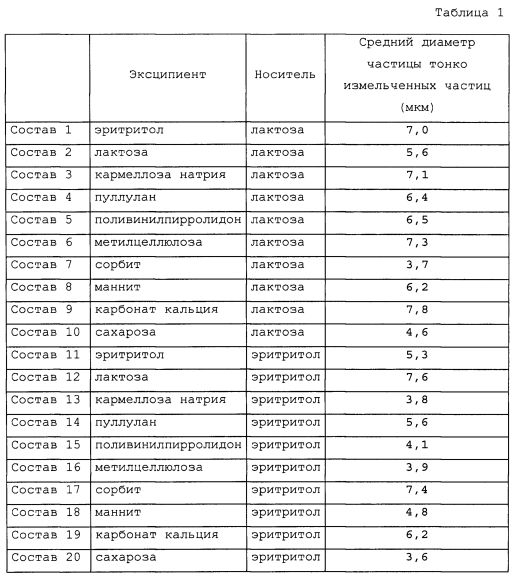
После смешивания кристалла пирфенидона (приблизительно 60 мг) с различными эксципиентами (приблизительно 40 мг) тонкое измельчение проводили с использованием струйной мельницы и таким образом получали тонко измельченные частицы. В качестве эксципиента использовали эритритол (Nikken formation), лактозу (DMV), кармеллозу кальция (Daicel Chemical Industries), пуллулан (Hayashibara), поливинилпирролидон (BASF), метилцеллюлозу (Shin-Etsu Chemical), сорбит (Kao), карбонат кальция (Kanto Kagaku) или белый мягкий сахар (Mitsui Sugar).
(Условия измельчения)
Используемое устройство: A-O-струйная мельница (Seishin Enterprise)
Способ подачи: автоподача
Давление подаваемого воздуха: 6,0 кг/см2изм.
Давление воздуха при измельчении: 6,5 кг/см2изм.
Способ сбора порошка: выходное устройство (полиэтилен)
Выход продукта являлся таким, как указано ниже, соответственно.
| Тонко измельченные частицы 1 (эксципиент: эритритол) | 75,8% |
| Тонко измельченные частицы 2 (эксципиент: лактоза) | 61,0% |
| Тонко измельченные частицы 3 (эксципиент: кармеллоза натрия) | 59,9% |
| Тонко измельченные частицы 4 |