Способ получения 5-замещённых 1,2,4-триазол-3-карбоновых кислот и их производных из универсального предшественника
Иллюстрации
Показать всеИзобретение относится к способу получения 5-замещенных 1,2,4-триазол-3-карбоновых кислот и их производных, включающий синтез ключевых интермедиатов - β-Ν-третбутилоксикарбонил-алкоксикарбониламидразонов взаимодействием третбутилоксикарбонилгидразина с эквимолярными количествами сложных эфиров тиооксамовой кислоты в этиловом спирте, последующей реакции ацилирования ключевого интермедиата хлорангидридами карбоновых кислот в пиридине без выделения продукта реакции - N-ацилированного N-Boc амидразона и его циклизации в пиридине при кипячении, с последующим выделением полученных производных 5-замещенных 1,2,4-триазол-3-карбоновых кислот экстракцией, перекристаллизацией из органических растворителей, таких как простые эфиры или галогенуглеводороды, или колоночной хроматографией. Технический результат: изобретение обеспечивает уменьшение количества стадий процесса получения производных 5-замещенных-1,2,4-триазол-3-карбоновых кислот и увеличение общего выхода целевых соединений. 3 пр.
Реферат
Изобретение относится к области органического синтеза, в частности к способу получения 5-замещенных 1,2,4-триазол-3-карбоновых кислот и их производных, которые могут быть использованы в производстве фармацевтических субстанций, гербицидов, фунгицидов, красителей.
Известен способ получения бензиловых эфиров 5-замещенных 1,2,4-триазол-3-карбоновых кислот циклизацией N-ацилированных производных гидразида 1-бензилоксикарбонилформимидной кислоты (Патент РФ №2446163 (Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Московский государственный университет тонких химических технологий имени М.В. Ломоносова" (МИТХТ)), 27.03.2012). Способ заключается в том, что гидразид 1-бензилоксикарбонилформимидной кислоты подвергают взаимодействию с ацилирующими агентами, такими как ангидриды или хлорангидриды карбоновых кислот, а также имидазолиды карбоновых кислот, полученные N-ацилированные производные гидразида замещенной формимидной кислоты далее циклизуют в целевые производные соответствующих 5-замещенных 1,2,4-триазол-3-карбоновых кислот, при температуре 120-160°С.
Наиболее близким к заявленному по технической сущности является способ получения 5-замещенных 1,2,4-триазол-3-карбонитрилов термической циклизацией N-ацилированных амидразонов (Т. et al, 1984, v. 49, рр. 2492-2495). Метод заключается в том, что тиоамиды сплавляют с гидразидами карбоновых кислот, затем образующиеся амидразоны без выделения плавят при 180°С с последующей кристаллизацией 3,5-замещенных 1,2,4-триазолов из этилацетата.
Недостатками данных способов являются сравнительно жесткие условия циклизации (120-160°С или 180°С), а следовательно невозможность введения лабильных заместителей, наличие дополнительной стадии синтеза, обусловленной необходимостью получения и выделения для каждого конечного продукта уникального промежуточного соединения.
Технический результат изобретения заключается в уменьшении количества стадий процесса получения производных 5-замещенных-1,2,4-триазол-3-карбоновых кислот, использовании стабильного исходного соединения, универсального для ряда 5-замещенных-1,2,4-триазол-3-карбоновых кислот, увеличении общего выхода целевых соединений - 5-замещенных 1,2,4-триазол-3-карбоновых кислот и их производных, отсутствии необходимости использования высокотоксичных реагентов в процессе получения 5-замещенных-1,2,4-триазол-3-карбоновых кислот и использовании более мягких условий проведения стадий предлагаемого способа - циклизация в кипящем пиридине (115°С).
Технический результат достигается способом получения 5-замещенных 1,2,4-триазол-3-карбоновых кислот и их производных, включающим:
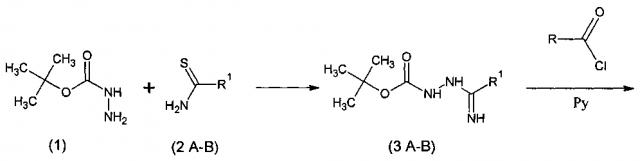
1) синтез ключевых интермедиатов - β-Ν-третбутилоксикарбонил-алкоксикарбониламидразонов (3) (β-Ν-Вос-амидразонов) взаимодействием третбутилоксикарбонилгидразина (1) и эквимолярных количеств сложных эфиров тиооксамовой кислоты (2) в этиловом спирте;
2) реакцию ацилирования ключевых интермедиатов (3) 2,15 эквивалентами хлорангидридов карбоновых кислот в пиридине без выделения продукта реакции - N-ацилированных β-Ν-Вос-амидразонов (4);
3) циклизацию N-ацилированных β-Ν-Вос-амидразонов (4) в пиридине при кипячении с последующим выделением полученных сложных эфиров 5-замещенных 1,2,4-триазол-3-карбоновых кислот (5) экстракцией и/или колоночной хроматографией, а также при необходимости перекристаллизацией из органических растворителей (простые эфиры и галогенуглеводороды);
4) из полученных сложных эфиров 5-замещенных 1,2,4-триазол-3-карбоновых кислот (5) при помощи стандартных методов могут быть получены 5-замещенные 1,2,4-триазол-3-карбоновых кислоты и другие их произаодные, например амиды, моно- и ди- ацил/ариламиды данных кислот.
Существенным является то обстоятельство, что для получения сложных эфиров 5-замещенных 1,2,4-триазол-3-карбоновых кислот (5) при циклизации необходим избыток хлорангидридов карбоновых кислот, больший или равный 2,15 эквивалентам.
Сущность изобретения иллюстрируется следующей схемой:
R= Me (a); Et (б); Pr (в); i-Pr (г); c-Pr (д); i-Bu (e); трет-Bu (ж); Ph (з); AcOCH2- (и); MeOCH2- (к); EtOCH2- (л); MeOCH2CH2OCH2- (м); BzlOCH2- (н); MeSCH2- (о);
PhOCH2- (п);
R1=COOEt (А); СООМе (Б); COOBzl (В).
R2=СООН; CONR′R′′.
R′=H, Alc, Ar. R′′=H, Alc, Ar.
Сущность изобретения поясняется следующими примерами:
Пример 1. Получение ключевых интермедиатов - β-N-Boc-амидразонов (3).
Общая методика: смесь Вос-гидразина и эквимолярного количества сложного эфира тиооксамовой кислоты растворяли в этаноле и перемешивали в течение 24 ч. Выпавший осадок отделяли фильтрованием и промывали на фильтре небольшим количеством этанола.
N-Boc-амидразон (3А) R1=COOEt
Из 16,82 г (0,127 моль) Вос-гидразина и 16,95 г (0,127 моль) этилового эфира тиооксамовой кислоты получено 25,38 г продукта 3А. Выход - 86%.
1H-ЯМР (DMSO-d6): δ 9,23 (s, 1H, NH), 6,23 (с, 2Н, 2NH), 4,19 (к, 2Н, J=7,09 Гц, -CH2CH3), 1,44 (с, 9Н, 3-СН3 Boc), 1,24 (т, 3Н, J=7,09 Гц, -CH2CH3). 13С-ЯМР (DMSO-d6): δ 162,05; 152,53; 136,79; 79,16; 61,30; 28,06; 13,97.
N-Boc-амидразон (3Б) R1=COOMe
Из 3 г (0,023 моль) Вос-гидразина и 2,7 г (0,023 моль) метилового эфира тиооксамовой кислоты получено 3,51 г продукта. Выход - 71%.
1H-ЯМР (DMSO-d6): δ 9,20 (с, 1Н, NH), 6,21 (с, 2Н, 2NH), 3,84 (с, 3Н, СН3), 1,44 (с, 9Н, 3-СН3 Boc). 13С-ЯМР (DMSO-d6): δ 160,64; 157,42; 141,86; 78,69; 53,21; 28,68.
N-Boc-амидразон (3В) R1=COOBzl
Из 3 г (0,023 моль) Вос-гидразина и 4,43 г (0,023 моль) бензилового эфира тиооксамовой кислоты получено 4,12 г продукта. Выход - 62%.
1H-ЯМР (DMSO-d6): δ 9,31 (с, 1H, NH), 7,40-7,30 (м, 5Н, Ph), 6,33 (с, 2H, 2NH), 5,36-5,30 (м, 2Н, CH2 Bzl), 1,43 (с, 9Н, 3-СН3 Вос). 13С-ЯМР (DMSO-d6): δ 162,81; 157,82; 143,05; 135,89; 128,37; 128,08; 127,64; 78,83; 66,24; 28,27.
Пример 2. Получение этиловых эфиров 5-замещенных 1,2,4-триазол-3-карбоновой кислот (5)
Общая методика: К суспензии N-Boc-амидразона (3) (4-21 ммоль) в 10 мл безводного пиридина был по каплям прибавлен хлорангидрид соответствующей карбоновой кислоты (2,15 экв.). Образовавшийся раствор кипятили с обратным холодильником без доступа влаги воздуха 8-30 ч. Затем растворитель удаляли на роторном испарителе при пониженном давлении. Образовавшееся масло растворяли в 50 мл этилацетата и промывали 10 мл 1М раствора хлороводорода, а затем 10 мл 2М раствора гидрокарбоната натрия. Органическую фазу выдерживали над безводным сульфатом натрия и удаляли растворитель на роторном испарителе при пониженном давлении.
Бензиловый эфир 5-метил-1-1,2,4-триазол-3-карбоновой кислоты (5a) R1=COOBzl
Из 3 г (10,2 ммоль) N-Boc-амидразона (3В) и 1,57 мл (22 ммоль) ацетилхлорида согласно общей методике было получено 2,06 г (93%) вещества 5а. Окончательную очистку соединения проводили перекристаллизацией из этилового эфира.
1H-ЯМР (CDCl3) σ м.д.: 7,48-7,33 (м, 5Н, Ph), 5,45 (с, 2Н, CH2 Bzl); 2,95 (с, 1H, Me). 13С-ЯМР (CDCl3) σ м.д.: 156,87; 147,36; 136,12; 128,42; 128,29; 128,06; 66,04; 13,61. m/z молекулярного иона для [C11H11N3O2+Н]+ вычислено 218,0851; найдено 218,0860.
Этиловый эфир 5-этил-1-1,2,4-триазол-3-карбоновой кислоты (5б) R1=COOEt
Из 3,7 г (16 ммоль) N-Boc-амидразона (3А) и 1,61 мл (18 ммоль) хлорангидрида пропионовой кислоты согласно общей методике было получено 2,25 г (83%) вещества 5б. Окончательную очистку соединения проводили перекристаллизацией из этилового эфира.
1H-ЯМР (CDCl3) σ м.д.: 4,45 (к, J=7,16 Гц, 2Н); 2,95 (к, J=7,67 Гц, 2Н); 1,38 (т, J=7,16 Гц, 3Н); 1,35 (т, J=7,67 Гц, 3Н). 13С-ЯМР (CDCl3) σ м.д.: 160,64; 160,36; 153,88; 62,04; 19,96; 14,11; 12,14. m/z молекулярного иона для [C7H11N3O2+Н]+ вычислено 170,0924; найдено 170,0924.
Этиловый эфир 5-пропил-1-1,2,4-триазол-3-карбоновой кислоты (5в) R1=COOEt
Из 4,62 г (20 ммоль) N-Boc-амидразона (3А) и 2,37 мл (23 ммоль) хлорангидрида бутановой кислоты согласно общей методике было получено 2,51 г (69%) вещества 5в. Окончательную очистку соединения проводили перекристаллизацией из этилового эфира.
1H-ЯМР (CDCl3) σ м.д.: 4,44 (к, J=7,09 Гц, 2Н); 2,89 (т, J=7,53 Гц, 2Н); 1,79 (м, J=7,53 Гц, 2Н); 1,37 (т, J=7,16 Гц, 3Н); 0,94 (т, J=7,31 Гц, 3Н). 13С-ЯМР (CDCl3) σ м.д.: 159,95; 159,20; 153,51; 61,60; 27,89; 21,02; 13,73; 13,18. m/z молекулярного иона для [C8H13N3O2+H]+ вычислено 184,1181; найдено 184,1183.
Этиловый эфир 5-изопропил-1-1,2,4-триазол-3 карбоновой кислоты (5г) R1=COOEt
Из 3,93 г (17 ммоль) N-Boc-амидразона (3А) и 2,10 мл (20 ммоль) хлорангидрида изобутановой кислоты согласно общей методике было получено 2,57 г (81%) вещества 5г. Окончательную очистку соединения проводили перекристаллизацией из этилового эфира.
1H-ЯМР (CDCl3) σ м.д.: 4,41 (к, J=7,13 Гц, 2Н); 3,24 (м, 1H); 1,37 (с, 3H); 1,34 (с, 3H); 1,33 (т, J=7,13 Гц, 3H). 13С-ЯМР (CDCl3) σ м.д.: 164,38; 160,19; 153,65; 61,97; 26,98; 20,99; 14,13. m/z молекулярного иона для [C8H13N3O2+Н]+ вычислено 184,1181; найдено 184,1191.
Этиловый эфир 5-циклопропил-1-1,2,4-триазол-3-карбоновой кислоты (5д) R1=COOEt
Из 3,47 г (15 ммоль) N-Boc-амидразона (3А) и 1,57 мл (17 ммоль) хлорангидрида циклопропилкарбоновой кислоты согласно общей методике было получено 1,80 г (66%) вещества 5д. Окончательную очистку соединения проводили перекристаллизацией из этилового эфира.
1H-ЯМР (CDCl3) σ м.д.: 4,45 (к, J=7,09 Гц, 2Н); 2,13 (м, 1H); 1,38 (т, J=7,09 Гц, 3Н); 1,18-1,05 (м, 4Н). 13С-ЯМР (CDCl3) σ м.д.: 161,59; 160,24; 153,61; 62,03; 14,09; 8,98; 7,33. m/z молекулярного иона для [C8H11N3O2+Н]+ вычислено 182,0924; найдено 182,0924.
Этиловый эфир 5-изобутил-1-1,2,4-триазол-3-карбоновой кислоты (5e) R1=COOEt
Из 3,23 г (14 ммоль) N-Boc-амидразона (3А) и 1,95 мл (16 ммоль) хлорангидрида изовалериановой кислоты согласно общей методике было получено 1,85 г (67%) вещества 5е. Окончательную очистку соединения проводили перекристаллизацией из этилового эфира.
1H-ЯМР (CDCl3) σ м.д.: 4,44 (к, J=7,09 Гц, 2Н); 2,81, 2,76 (2с, 2Н); 2,11 (м, 1H); 1,37 (т, J=7,09 Гц, 3H); 0,92, 0,89 (2с, 6Н). 13С-ЯМР (CDCl3) σ м.д.: 160,39; 159,04; 153,99; 62,07; 35,22; 28,21; 22,18; 14,20. m/z молекулярного иона для [C9H15N3O2+Н]+ вычислено 198,1237; найдено 198,1244.
Этиловый эфир 5-третбутил-1-1,2,4-триазол-3-карбоновой кислоты (5ж) R1=COOEt
Из 3,23 г (14 ммоль) N-Boc-амидразона (3А) и 1,97 мл (16 ммоль) хлорангидрида 2,2-диметилпропионовой кислоты согласно общей методике был получен сырой продукт, который затем был растворен в смеси этанол:вода (5:1) и обработан 0,5 г гидрокарбоната натрия. Растворитель был удален на роторном испарителе при пониженном давлении, полученые кристаллы частично растворены в хлороформе, неорганические соли отфильтрованы. Растворитель из фильтрата был удален на роторном испарителе при пониженном давлении. Таким образом было получено 0,82 г (30%) вещества 5ж.
1H-ЯМР (CDCl3) σ м.д.: 4,38 (к, J=7,09 Гц, 2Н); 1,37 (с, 9Н); 1,28 (т, J=7,09 Гц, 3H). 13С-ЯМР (CDCl3) σ м.д.: 167,00; 160,08; 153,65; 61,88; 32,46; 28,94; 14,13. m/z молекулярного иона для [C9H15N3O2+Н]+ вычислено 198,1237; найдено 198,1235.
Этиловый эфир 5-фенил-1-1,2,4-триазол-3-карбоновой кислоты (5з) R1=COOEt
Из 4,85 г (21 ммоль) N-Boc-амидразона (3А) и 2,84 мл (24 ммоль) хлорангидрида бензойной кислоты согласно общей методике был получен сырой продукт. При помощи колоночной хроматографии на силикагеле в системе хлороформ: метанол (с градиентом метанола от 0 до 3%) было получено 1,75 г (38%) вещества 5з.
1H-ЯМР (CDCl3) σ м.д.: 8,05-8,01 (м, 2Н); 7,43-7,36 (м, 3H); 4,40 (к, J=7,16 Гц, 2Н); 1,31 (т, J=7,16 Гц, 3H). 13С-ЯМР (CDCl3) σ м.д.: 159,62; 158,14; 153,39; 130,80; 128,98; 126,78; 62,31; 14,02. m/z для молекулярного иона [C11H11N3O2+H]+ вычислено 218,0924; найдено 218,0937.
Этиловый эфир 5-ацетоксиметил-1,2,4-триазол-3-карбоновой кислоты (5и) R1=COOEt
Из 1,0 г (4,32 ммоль) N-Boc-амидразона (3А) и 1,0 мл (9,29 ммоль) хлорангидрида ацетоксиуксусной кислоты согласно общей методике был получен сырой продукт. При помощи колоночной хроматографии на силикагеле в системе хлороформ: метанол (с градиентом метанола от 0 до 5%) было получено 0,52 г (56%) вещества 5и.
1Н ЯМР-спектр (CDCl3) δ м.д.: 1,38 (3H, тр, J=7,13 Гц, СН3 Et); 2,09 (3H, с, СН3 Ас); 4,44 (2Н, кв, J=7,16 Гц, CH2 Et); 5,32 (2Н, с, 5-CH2). 13С ЯМР-спектр (CDCl3) δ м.д.: 14,03 (СН3 Et); 20,48 (СН3 Ас); 57,54 (5-CH2); 62,41 (CH2 Et); 152,36 (С3); 155,44 (С5); 158,94 (3-СОО); 170,88 (COO Ac). m/z для молекулярного иона [C8H11N3O4+Н]+ вычислено 214,0750; найдено 214,0742.
Этиловый эфир 5-метоксиметил-1-1,2,4-триазол-3 карбоновой кислоты (5к) R1=COOEt
Из 1,0 г (4,32 ммоль) Вос-амидразона (3А) и 0,85 мл (9,31 ммоль) хлорангидрида метоксиуксусной кислоты согласно общей методике был получен сырой продукт, который очищали посредством колоночной хроматографии на силикагеле (элюент хлороформ-метанол (2%)). Фракции, содержащие целевой продукт, объединяли и упаривали. Выход 0,72 г (90%).
1Н ЯМР-спектр (CDCl3) δ м.д.: 1,40 (3H, тр, J=7,14 Гц, СН3 Et); 3,47 (3H, с, СН3 МеО); 4,46 (2Н, кв, J=7,14 Гц, CH2 Et); 4,72 (2Н, с, 5-CH2). 13С ЯМР-спектр (CDCl3) δ м.д.: 13,91 (СН3 Et); 58,86 (ОСН3); 61,96 (CH2 Et); 65,69 (5-CH2); 153,24 (С3); 156,19 (С5); 159,52 (COO). m/z для молекулярного иона [C7H11N3O3+H]+ вычислено 186,0873; найдено 186,0870.
Этиловый эфир 5-(этоксиметил)-1,2,4-триазол-3-карбоновой кислоты (5л) R1=COOEt
Из 1,0 г (4,3 ммоль) Вос-амидразона (3А) и 1,11 г (9,3 ммоль) хлорангидрида этоксиуксусной кислоты согласно общей методике был получен сырой продукт, который очищали посредством колоночной хроматографии на силикагеле (элюент гексан - этилацетат 25%). Фракции, содержащие целевой продукт объединяли и упаривали. Выход 0,19 г (22%).
1Н ЯМР-спектр (CDCl3) δ м.д.: 1,18 (3H, тр, J=7,00 Гц, СН3 EtO); 1,37 (3Н, тр, J=7,14 Гц, СН3 COOEt); 3,61 (2Н, кв, J=7,01 Гц, CH2 EtO); 4,44 (2Н, кв, J=7,14 Гц, CH2 COOEt); 4,75 (2Н, с, 5-CH2). 13С ЯМР-спектр (CDCl3) δ м.д.: 14,09 (СН3 COOEt); 14,84 (СН3 EtO); 58,86 (ОСН3); 62,08 (CH2 COOEt); 67,08 (5-CH2); 77,00 (CH2 EtO); 153,77 (С3); 156,48 (С5); 159,65 (COO). m/z для молекулярного иона [C8H13N3O3+H]+ вычислено 200,1030; найдено 200,1021.
Этиловый эфир 5-([2-метоксиэтокси]метилен)-1,2,4-триазол-3-карбоновой кислоты (5м) R1=COOEt
Из 1,0 г (4,3 ммоль) Вос-амидразона (3А) и 1,4 г (9,3 ммоль) хлорангидрида 1-(2-метокси)этоксиуксусной кислоты согласно общей методике был получен сырой продукт, который очищали посредством колоночной хроматографии на силикагеле (элюент гексан - этилацетат 25%). Фракции, содержащие целевой продукт, объединяли и упаривали. Выход 0,3 г (31%).
1Н ЯМР-спектр (CDCl3) δ м.д.: 1,41 (3H, тр, J=7,11 Гц, СН3 Et); 3,47 (3H, с, СН3 МеО); 3,62-3,65 (2Н, м, MeOCH2CH2O); 3,78-3,81 (2Н, м, MeOCH2CH2O); 4,46 (2Н, кв, J=7,14 Гц, CH2 Et); 4,84 (2Н, с, 5-CH2). 13С ЯМР-спектр (CDCl3) δ м.д.: 14,19 (СН3 Et); 59,01 (ОСН3); 61,91 (CH2 Et); 65,42 (5-CH2); 70,74 (MeOCH2CH2O); 71,82 (MeOCH2CH2O); 154,77 (С3); 156,51 (С5); 159,83 (COO). m/z для молекулярного иона [C9H15N3O4+H]+ вычислено 230,1135; найдено 230,1139.
Этиловый эфир 5-[(бензилокси)метил]-1,2,4-триазол-3-карбоновой кислоты (5н) R1=COOEt
Из 16 г (69 ммоль) Вос-амидразона (3А) и 23,5 мл (149 ммоль) хлорангидрида бензилоксиуксусной кислоты согласно общей методике был получен сырой продукт, который очищали посредством колоночной хроматографии на силикагеле (элюент хлороформ). Фракции, содержащие целевой продукт, объединяли и упаривали. Выход 10,71 г (59%).
1H ЯМР-спектр (CDCl3) δ м.д.: 1,40 (3H, тр, J=7,14 Гц, СН3 Et); 4,45 (2Н, кв, J=7,1 Гц, CH2 Et); 4,61 (2Н, с, 5-CH2); 4,77 (2Н, с, CH2 Bzl); 7,28-7,36 (5Н, м, СН Bzl). 13С ЯМР-спектр (CDCl3) δ м.д.: 14,15 (СН3 Et); 62,13 (CH2 Et); 62,35 (5-CH2); 72,35 (CH2 Bzl); 128,00 (С3 и С5, Bzl); 128,25 (С4 Bzl); 128,56 (С2 и С6, Bzl); 136,57 (С, Bzl); 153,79 (С3); 156,45 (С5); 159,54 (COOEt). m/z для молекулярного иона [C13H15N3O3+H]+ вычислено 262,1186; найдено 262,1195.
Метиловый эфир 5-метилтиометил-1,2,4-триазол-3-карбоновой кислоты (5о). R1=COOMe
Из 1,0 г (4,6 ммоль) Вос-амидразона (3Б) и 1,23 г (9,9 ммоль) хлорангидрида 2-(метилтио)-уксусной кислоты согласно общей методике был получен сырой продукт, который очищали посредством колоночной хроматографии на силикагеле (элюент хлороформ-метанол (2%)). Фракции, содержащие целевой продукт, объединяли и упаривали. Выход 0,32 г (37%).
1Н ЯМР-спектр (CDCl3) δ м.д.: 2,24 (3H, с, SCH3); 3,39 (2Н, d, J=2,58 Гц, 5-CH2); 3,92 (3H, с, ОСН3). 13С ЯМР-спектр (CDCl3) δ м.д.: 14,84 (SCH3); 31,90 (SCH2); 53,12 (ОСН3); 149,24 (С3); 151,89 (С5); 157,72 (COO). m/z для молекулярного иона [C6H9N3O2S+H]+ вычислено 188,0415; найдено 188,0419.
Этиловый эфир 5-феноксиметил-1,2,4-триазол-3-карбоновой кислоты (5п). R1=COOEt
Из 1,19 г (5,15 ммоль) Вос-амидразона (3А) и 1,88 г (11,02 ммоль) хлорангидрида феноксиуксусной кислоты, согласно общей методике, был получен сырой продукт, который очищали посредством перекристаллизации из толуола. Выход 0,98 г (77%). 1Н ЯМР-спектр (CDCl3) δ м.д.: 1,34 (3H, тр, J=7,14 Гц, СН3 Et); 4,38 (2Н, кв, J=7,14 Гц, CH2 Et); 5,29 (2Н, с, 5-CH2); 6,88 (2Н, д, J=8,19 Гц, 2-СН и 6-СН Ph); 6,97 (1Н, тр, J=7,39 Гц, 4-СН Ph); 7,25 (2Н, тр, J=7,98 Гц, 3-СН и 5-СН Ph). 13С ЯМР-спектр (CDCl3) δ м.д.: 14,03 (СН3 Et); 61,98 (5-CH2); 62,31 (CH2 Et); 114,46 (С2 и С6, Ph); 121,90 (С4 Ph); 129,62 (С3 и С5, Ph); 153,42 (С3); 155,78 (С5); 157,41 (C1 Ph); 159,47 (COOEt). m/z для молекулярного иона [C12H13N3O3+H]+ вычислено 248,1030; найдено 248,1036.
Этиловый эфир 5-(1,2,4-триазол-3-ил)-1,2,4-триазол-3 карбоновой кислоты (5р) R1=COOEt
Из 2,5 г (10,81 ммоль) Вос-амидразона (3А) и 3,9 г (23,22 ммоль) хлорангидрида 1,2,4-триазол-3-карбоновой кислоты согласно общей методике был получен сырой продукт, который очищали посредством колоночной хроматографии на силикагеле (элюент хлороформ-метанол (5%)). Фракции, содержащие целевой продукт, объединяли и упаривали. Выход 2,03 г (90%).
1Н ЯМР-спектр (ДМСО-d6) δ м.д.: 1,26 (3H, тр, J=7,09 Гц, СН3 Et); 4,29 (2Н, кв, J=7,11 Гц, CH2 Et), 12,23 (1Н, СН), 12,32 (0,5 H, NH). 13С ЯМР-спектр (ДМСО-d6) δ м.д.: 13,95 (СН3 Et); 61,71 (CH2 Et); 137,98 (С3′); 138,12 (С5′); 155,25 (С5); 155,41 (С3); 156,68 (СОО-). m/z для молекулярного иона [C7H8N6O2+2H]2+ вычислено 210,0854; найдено 210,0849.
Пример 3. Получение 5-замещенных 1,2,4-триазол-3-карбоновых кислот и их производных
5-этил-1,2,4-триазол-3-карбоновая кислота (6б) R2=COOH
К раствору 3,5 г (20,7 ммоль) этилового эфира 5-этил-1-1,2,4-триазол-3-карбоновой кислоты в 15 мл 80% этанола прибавили раствор 2,44 г (43,4 ммоль) гидроксида калия в 25 мл 80% этанола. Реакционную массу перемешивали 24 ч, затем растворитель удалили на роторном испарителе при комнатной температуре. Полученную массу растворили в 15 мл воды и довели рН до 1 концентрированной соляной кислотой при охлаждении. Целевое вещество (6б) R2=COOH экстрагировали этилацетатом 5 раз по 50 мл. Органическую фазу сушили над сульфатом натрия и растворитель удаляли на роторном испарителе при комнатной температуре. Таким образом было получено 2,04 г соединения 6б R2=COOH. Выход 70%.
Элементный анализ: вычислено С: 42,55%; Н: 5,00%; N: 29,77%, найдено С: 42,49%; Н: 5,04%; N: 29,81%. m/z для молекулярного иона [C5H7N3O2+H]+ вычислено 141,0538; найдено 141,0548.
Амид 5-гидроксиметил-1,2,4-триазол-3-карбоновой кислоты (6с) R′=H, R′′=H
К раствору 0,52 г (2,44 ммоль) этилового эфира 5-ацетоксиметил-1,2,4-триазол-3-карбоновой кислоты в 5 мл 10,6 M раствора аммиака в метаноле прибавили 1 мл 30% водного аммиака. Реакционную массу кипятили при постоянном перемешивании в течение 72 ч, каждые 12 ч добавляя по 0,5 мл 30% водного аммиака. После окончания реакции растворитель удаляли на роторном испарителе. Целевой продукт выделяли посредством колоночной хроматографии на силикагеле в системе этилацетат-метанол (с градиентом метанола от 0 до 25%). Фракции, содержащие целевой продукт, объединяли, растворитель удаляли на роторном испарителе. Выход 0,27 г (79%).
1Н ЯМР-спектр (ДМСО-d6) δ м.д.: 7,76 и 7,49 (2Н, 2с, CONH 2); 4,55 (2Н, с, CH 2OH). 13С ЯМР-спектр (ДМСО-d6) δ м.д.: 160,69, 159,70, 154,83, 55,98. m/z для молекулярного иона [C6H9N3O3+Н]+ вычислено 172,0717; найдено 172,0715.
Амиды 5-замещенных-1,2,4-триазол-3-карбоновых кислот (6) (общая методика)
К раствору соединения 16 (2-5 ммоль) в этиловом спирте (5 мл) прибавили 1 мл 30% водного аммиака, нагрели до кипения. Кипятили 72 ч, через каждые 12 ч прибавляя 0,25 мл 34% водного аммиака, выпавший осадок отфильтровали, промыли на фильтре водой и диэтиловым эфиром, высушили на воздухе.
Амид 5-этил-1,2,4-триазол-3-карбоновой кислоты (6б) R′=H, R′′=H
Из 300 мг (1,77 ммоль) соединения 5б получено 226 мг продукта (6б). Выход 91%.
1Н-ЯМР (ДМСО-d6), σ м.д.: 1,33 (3H, т, J=7.64 Гц, -CH2CH 3); 2,92 (2Н, к, J=7.64, CH2CH 3); 7,52-7,83 (0,5Н, уш.м, CONH2); 9,7 (0,6Н, с, 1-NH). 13С-ЯМР (ДМСО-d6) σ м.д.: 165,95; 162,20; 153,13; 16,11; 11,03. m/z для молекулярного иона [C5H8N4O+H]+ вычислено 142,0617; найдено 142,0642.
Амид 5-фенил-1,2,4-триазол-3-карбоновой кислоты (6з) R′=H, R′′=H
Из 300 мг (1,38 ммоль) соединения 5з получено 230 мг продукта (6з). Выход 88%.
1Н-ЯМР (ДМСО-d6) σ м.д.: 7,43-7,36 (м, 3H); 7,58-7,74 (0,5Н, уш.м, CONH2); 8,05-8,01 (м, 2Н); 9,89 (0,5Н, с, 1-NH). 13С-ЯМР (ДМСО-d6) σ м.д.: 160,79; 158,88; 155,20; 129,43; 128,81; 127,89; 127,28. m/z молекулярного иона для [C9H8N4O+H]+ вычислено 189,0771; найдено 189,0778.
Получение замещенных амидов 5-замещенных-1,2,4-триазол-3-карбоновых кислот (6) R2=CONR′R′′ (общая методика на примере производных 5-этил-1,2,4-триазол-3-карбоновой кислоты):
К суспензии 5-этил-1,2,4-триазол-3-карбоновой кислоты в абсолютном хлористом метилене добавили раствор 1,1 экв. карбонилдиимидазола в абсолютном хлористом метилене. Реакционную массу перемешивали 1 ч (контроль при помощи ТСХ элюент 95% хлороформ - 5% метанол). Затем к реакционной массе добавили 1,2 экв. раствора амина в абсолютном хлористом метилене.
N-этиламид 5-этил-1,2,4-триазол-3-карбоновой кислоты R′=H, R′′=Et
Из 300 мг (2,13 ммоль) 5-этил-1,2,4-триазол-3-карбоновой кислоты, 380 мг (2,34 ммоль) карбонилдиимидазола и 2,55 мл 1М раствора этиламина получено 280 мг N-этиламида 5-этил-1,2,4-триазол-3-карбоновой кислоты (R′=H, R′′=Et). Продукт выделяли перекристаллизацией из этилацетата. Выход 78%.
1Н ЯМР-спектр (ДМСО-d6) δ м.д.: 3,25 (2Н, кв, J=6,68 Гц), 2,95 (2Н, кв, J=7,67 Гц), 2,62 (3H, т, J=6,68 Гц), 1,35 (3H, т, J=7,67 Гц). m/z для молекулярного иона [C7H12N4O+H]+ вычислено 168,1011; найдено 168,1020.
N,N-диметиламид 5-этил-1,2,4-триазол-3-карбоновой кислоты R′=Me, R′′=Me
Из 300 мг (2,13 ммоль) 5-этил-1,2,4-триазол-3-карбоновой кислоты, 380 мг (2,34 ммоль) карбонилдиимидазола и 2,55 мл 1М раствора диметиламина получено 190 мг N-диметиламида 5-этил-1,2,4-триазол-3-карбоновой кислоты (R′=Me, R′′=Me). Продукт выделяли перекристаллизацией из этилацетата. Выход 51%.
1Н ЯМР-спектр (ДМСО-d6) δ м.д.: 3,21 (6Н, д, J=13,52 Гц), 2,61 (2Н, кв, J=7,57 Гц), 1,21 (3H, т, J=7,57 Гц). m/z для молекулярного иона [C7H12N4O+H]+ вычислено 168,1011; найдено 168,1007.
N-фениламид 5-этил-1,2,4-триазол-3-карбоновой кислоты R′=H, R′′=Ph
Из 300 мг (2,13 ммоль) 5-этил-1,2,4-триазол-3-карбоновой кислоты, 380 мг (2,34 ммоль) карбонилдиимидазола и 194 мкл анилина получено 240 мг анилида 5-этил-1,2,4-триазол-3-карбоновой кислоты (R′=H, R′′=Ph). Продукт выделяли при помощи колоночной хроматографии на силикагеле, элюент хлороформ. Выход 52%.
1Н ЯМР-спектр (ДМСО-d6) δ м.д.: 10,78 (1H, уш.с), 7,83 (2Н, м), 7,34 (2Н, м), 7,10 (1Н, м), 2,57 (2Н, кв, J=7,57 Гц), 1,20 (3H, т, J=7,57 Гц). m/z для молекулярного иона [C11H12N4O+H]+вычислено 217,1011; найдено 217,1017.
Ν,Ν-дифениламид 5-этил-1,2,4-триазол-3-карбоновой кислоты R′=Ph, R′′=Ph
Из 300 мг (2,13 ммоль) 5-этил-1,2,4-триазол-3-карбоновой кислоты, 380 мг (2,34 ммоль) карбонилдиимидазола и 300 мкл дифениламина получено 380 мг дифениламида 5-этил-1,2,4-триазол-3-карбоновой кислоты (R′=Ph, R′′=Ph). Продукт выделяли при помощи колоночной хроматографии на силикагеле, элюент хлороформ. Выход 61%.
1H ЯМР-спектр (ДМСО-d6) δ м.д.: 8,04 (4Н, м), 7,68-7,55 (6Н, м), 2,54 (2Н, кв, J=7,57 Гц), 1,19 (3H, т, J=7,57 Гц). m/z для молекулярного иона [C17H16N4O+H]+ вычислено 293,1324; найдено 293,1329.
Изобретение может быть применено для синтеза широкого спектра производных 1-Н-1,2,4-триазол-3-карбоновой кислоты, замещенных по положению 5 алкильными, циклоалкильными, арильными, гетероарильными, гетероциклическими группами.
Способ получения 5-замещенных 1,2,4-триазол-3-карбоновых кислот и их производных, включающий синтез ключевых интермедиатов - β-N-третбутилоксикарбонил-алкоксикарбониламидразонов взаимодействием третбутилоксикарбонилгидразина с эквимолярными количествами сложных эфиров тиооксамовой кислоты в этиловом спирте, последующей реакции ацилирования ключевого интермедиата хлорангидридами карбоновых кислот в пиридине без выделения продукта реакции - N-ацилированного N-Boc амидразона и его циклизации в пиридине при кипячении, с последующим выделением полученных производных 5-замещенных 1,2,4-триазол-3-карбоновых кислот экстракцией, перекристаллизацией из органических растворителей, таких как простые эфиры или галогенуглеводороды, или колоночной хроматографией.