Способ получения 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафанов
Иллюстрации
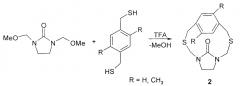
Показать всеИзобретение относится к способу получения 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафанов общей формулы (1)
в котором N,N-бис(метоксиметил)-N-арил(n-метоксифенил, о-метоксифенил, о-метилфенил)амины подвергают взаимодействию с 4,4′-димеркаптодифенилсульфидом в присутствии катализатора кристаллогидрата азотнокислого самария Sm(NO3)3·6H2O, взятыми в мольном соотношении N,N-бис(метоксиметил)-N-ариламин:4,4′-димеркаптодифенилсульфид:Sm(NO3)3·6H2O=1:1:(0.03-0.07) в этиловом эфире уксусной кислоты в качестве растворителя при комнатной температуре (~20°C) и атмосферном давлении в течение 6-8 ч. Технический результат: получение 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафанов общей формулы (1) с высоким выходом. 1 табл., 1 пр.
Реферат
Предлагаемое изобретение относится к области органической химии, конкретно к способу получения 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафанов общей формулы (1)
Циклические азот-, кислород- и серусодержащие макроциклы перспективны в качестве селективных лигандов (Eds. Y. Inoue, G.W. Gokel. Cation Binding by Macrocycles. Marcel Dekker. New York. 1990; R.M. Izatt, K. Pawlak, J.S.Bradshaw, R.L. Bruening. Chem. Rev., 1991, 91, 1721 p.), для экстракции и разделения катионов металлов (А.Т. Yordanov, D.M. Roundhill. Coord. Chem. Rev., 1998, 170, 93 p.; K. Gloe, H. Graubaum, M. Wust, T. Rambusch, W. Seichter. Coord. Chem. Rev., 2001, 222, 103 p.), для транспорта ионов через мембраны (P. Bushlmann, Е. Pretsch, Е. Bakker. Chem. Rev., 1998, 98, 1593 р.), в фоточувствительных системах (В. Valeur, I. Leray. Coord. Chem. Rev., 2000, 205, 3 p), выступают в роли межфазных катализаторов, моделирующих ферментативную активность (М.С. Feiters. In comprehensive Supramolecular Chemistry. Pergamon Press. Oxford. 1996, 9, 267 p.).
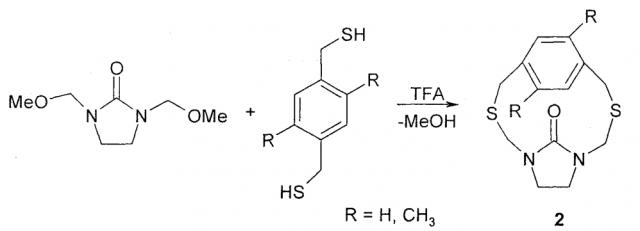
Известен способ (К.К. Ellis, В. Wilke, Y. Zhang, S. Diver. A new method for the synthesis of imidazolidinone- and benzimidazalone-containing[2.2]cyclophanes. Organic Letters, 2000, 2, 24, 3785-3788) получения гетероциклофанов (2) взаимодействием производных бензо-1,4-диметантиола с 1,3-бис(метоксиметил)имидазолидин-2-оном при кипячении в хлористом метилене в присутствии 1% трифторуксусной кислоты с выходом 40%.
Известным способом не могут быть получены 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафаны формулы (1).
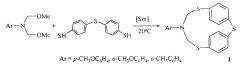
Известен способ (G.R. Khabibullina, V.R. Akhmetova, M.F. Abdullin, T.V. Tyumkina, L.M. Khalilov, A.G. Ibragimov. Multicomponent reactions of amino alcohols with CH2O and dithiols in the synthesis of 1,3,5-dithiazepanes and macroheterocycles. Tetrahedron, 2014, 70, 3502-3509) получения 2-[18,32-бис(2-гидроксиэтил)-11,25,39-триокса-2,6,16,20,30,34-гексатиа-4,18,32-триазагептацикло[38.2.2.27,10.212,15.221,24.226,29.235,38]тетрапентаконта-1(43),7(54),8,10(53),12(52),13,15(51),21(50),22,24(49),26(48),27,29(47),35(46),36,38(45),40,41-октадекаен-4-ил]-1-этанола (3) с выходом 62% в смеси с побочным макрогетероциклом (4) циклоконденсацией моноэтаноламина с CH2O и 4,4′-димеркаптодифенилоксидом (мольное соотношение 1:2:1) в растворе хлороформа за 4 ч.
Известным способом не могут быть получены 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафаны формулы (1).
Таким образом, в литературе отсутствуют сведения о селективном получении 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафанов формулы (1).
Предлагается новый способ получения 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафанов общей формулы (1).
Сущность способа заключается во взаимодействии N,N-бис(метоксиметил)-N-арил(n-метоксифенил, о-метоксифенил, о-метилфенил)амина с 4,4′-димеркаптодифенил сульфидом в присутствии катализатора кристаллогидрата азотнокислого самария Sm(NO3)3·6H2O, взятыми в мольном соотношении N,N-бис(метоксиметил)-N-ариламин:4,4′-димеркаптодифенилсульфид:Sm(NO3)3·6H2O=1:1:(0.03-0.07), предпочтительно 1:1:0.05, при комнатной (~20°C) температуре и атмосферном давлении в этиловом эфире уксусной кислоты в качестве растворителя в течение 6-8 ч, предпочтительно 7 ч. Выход соответствующих 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафанов общей формулы (1) составляет 72-85%. Реакция протекает по схеме:
6-Арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафаны общей формулы (1) образуются только лишь с участием N,N-бис(метоксиметил)-N-ариламинов и 4,4′-димеркаптодифенилсульфида, взятых в стехиометрических количествах. При другом соотношении исходных реагентов снижается выход целевых продуктов (1). Без катализатора реакция не идет.
Проведение указанной реакции в присутствии катализатора Sm(NO3)3·6H2O больше 7 мол.% в расчете на исходный N,N-бмс(метоксиметил)-N-ариламин не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора Sm(NO3)3·6H2O менее 3 мол.% снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 20°C. При температуре выше 20°C (например, 60°C) увеличиваются энергозатраты, а при температуре ниже 20°C (например, 0°C) снижается скорость реакции. Опыты проводили в этиловом эфире уксусной кислоты, т.к. в нем хорошо растворяются исходные реагенты и целевые продукты.
Существенные отличия предлагаемого способа.
В предлагаемом способе в реакцию с N,N-бис(метоксиметил)-N-ариламинами вовлекается 4,4′-димеркаптодифенилсульфид в присутствии каталитических количеств Sm(NO3)3·6H2O. Реакция идет с селективным образованием 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафанов формулы (1).
В известном способе макроцикл формулы (3) получают в смеси с побочным гетероциклом (4) трехкомпонентной конденсацией аминоэтанола с формальдегидом и 4,4′-димеркаптодифенилоксидом.
Предлагаемый способ обладает следующими преимуществами.
Способ позволяет получать с высокой селективностью и выходами 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафаны формулы (1).
Способ поясняется следующими примерами.
ПРИМЕР 1. В сосуд Шленка, установленный на магнитной мешалке, помещают 0.21 г (1 ммоль) N,N-бис(метоксиметил)-N-(n-метоксифенил)амина и 0.25 г (1 ммоль) 4,4′-димеркалтодифенилсульфида, 5 мл этилового эфира уксусной кислоты, 0.02 г [5 мол.% в расчете на N,N-бис(метоксиметил)-N-n-метоксифениламин] Sm(NO3)3·6H2O, перемешивают при комнатной (~20°C) температуре 7 ч, выделяют 6-(4-метоксифенил)-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафан (1) с выходом 74%.
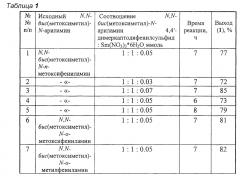
Другие примеры, подтверждающие способ, приведены в табл. 1.
Спектральные характеристики 6-(4-метоксифенил)-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафана:
| Спектр ЯМР 1Н (δ, м.д., CDCl3, J/Гц): 3.77 (с, 9Н, ОСН3); 4.70 (с, 12Н, NCH2S); 6.64-6.69 (м, 6Н, Ph); 6.76-6.85 (м, 6Н, Ph); 7.32-7.36 (м, 12Н, Ph); 7.42-7.46 (м, 6Н, Ph). Спектр ЯМР 13С (δ, м.д., J/Гц): 52.49 (ОМе); 55.75 (NCH2S); 114.45; 114.89; 115.86; 116.43; 120.09; 128.72; 131.47; 133.55; 137.45; 139.87 (Ph) |
Спектральные характеристики 6-(2-метоксифенил)-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафана:
| Спектр ЯМР 1Н (δ, м.д., CDCl3, J/Гц): 3.82 (с., 9Н, ОСН3); 4-80 (с., 12Н, NCH2S); 6.74-6.83 (м, 9Н, Ph); 6.93-6.97 (м, 3Н, Ph); 7.26-7.28 (м, 12Н, Ph); 7.33-7.35 (м, 6Н, Ph). Спектр ЯМР 13С (δ, м.д., J/Гц): 51.12 (ОМе); 55.52 (NCH2S); 109.96; 111.98; 115.03; 118.46; 121.21; 128.52; 131.36; 133.52; 134.74; 147.47 (Ph) |
Спектральные характеристики 6-(2-метилфенил)-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафана:
| Спектр ЯМР 1Н (δ, м.д., CDCl3, J/Гц): 234 (с., 9Н, СН3); 4/71 (с., 12Н, NCH2S); 6.72-6.81 (м, 6Н, Ph); 6.84-6.90 (м, 3H, Ph); 6.95-6.98 (м, 3H, Ph); 7.27-7.29 (м, 12Н, Ph); 7.31-7.33 (м, 6Н, Ph). Спектр ЯМР 13С (δ, м.д., J/Гц): 22.66 (Me); 51.11 (NCH2S); 111.79; 118.77; 122.94; 128.48; 130.42; 131.46; 133.85; 134.95; 142.84 (Ph). |
Способ получения 6-арил-2,4,8-тритиа-6-аза-1,3(1,4)-дибензоциклооктафанов общей формулы (1) отличающийся тем, что N,N-бис(метоксиметил)-N-арил(n-метоксифенил, о-метоксифенил, о-метилфенил)амины подвергают взаимодействию с 4,4′-димеркаптодифенилсульфидом в присутствии катализатора кристаллогидрата азотнокислого самария Sm(NO3)3·6H2O, взятыми в мольном соотношении N,N-бис(метоксиметил)-N-ариламин:4,4′-димеркаптодифенилсульфид:Sm(NO3)3·6H2O=1:1:(0.03-0.07) в этиловом эфире уксусной кислоты в качестве растворителя при комнатной температуре (~20°C) и атмосферном давлении в течение 6-8 ч.