Изготовленные из биомассы сложные полиэфиры на основе 2,5-фурандикарбоновой кислоты
Иллюстрации
Показать всеНастоящее изобретение относится к сложным полиэфирам, изготовленным полностью или частично из биомассы. Описан cложный сополиэфир, образованный из следующих мономеров: (i) 2,5-фурандикарбоновой кислоты, (ii) 1,4-бутандиола, (iii) терефталевой кислоты, (iv) этиленгликоля. Также описан сложный полиэфир, образованный из следующих мономеров (i) 2,5-фурандикарбоновой кислоты или ее сложного низшего алкилэфира, (ii) 1,4-бутандиола, изосорбида или их сочетания, (iii) терефталевой кислоты, и (iv) этиленгликоля. Описано изделие, содержащее указанные выше сложные сополиэфиры. Также описан способ изготовления сложного сополиэфира на основе 2,5-фурандикарбоновой кислоты, причем данный способ включает: объединение мономеров (i) 2,5-фурандикарбоновой кислоты или ее сложного низшего алкилэфира, (ii) 1,4-бутандиола, изосорбида или их сочетания, (iii) терефталевой кислоты, (iv) этиленгликоля, и катализатора для изготовления реакционной смеси; перемешивание реакционной смеси в потоке азота; постепенное нагревание реакционной смеси до первой температуры, составляющей приблизительно от 200 до 230°C, и поддержание первой температуры в течение от приблизительно 8 до приблизительно 12 часов; постепенное нагревание реакционной смеси до второй температуры, составляющей приблизительно от 240 до 260°C, и поддержание второй температуры в течение от приблизительно 12 до приблизительно 18 часов; удаление воды из реакционной смеси; и извлечение получаемого в результате сложного сополиэфира. Технический результат - более экономический и эффективный способ получения сложных сополиэфиров с желаемыми физическими и термическими свойствами. 4 н. и 6 з.п. ф-лы, 58 ил., 4 табл., 9 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
В соответствии с параграфом 119(e) раздела 35 Свода законов США, настоящая заявка испрашивает приоритет в отношении патентной заявки США № 61/582983, поданной 04 января 2012 г., описание которой во всей своей полноте включается в настоящий документ посредством данной ссылки.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В последнее время усиливается тенденция к получению полимерных материалов, производимых из возобновляемых ресурсов, включая химическую модификацию природных полимеров и использование мономеров на основе биомассы для синтеза новых высокомолекулярных соединений. Эта усиливающаяся тенденция представляет собой часть более общей стратегии, направленной на поиск заменителей истощающихся ископаемых ресурсов. Эти глобальные тенденции иллюстрируются концепцией и приложениями переработки биоматериалов. Перспективную альтернативу ископаемому топливу представляет собой биомасса как возобновляемый ресурс, который можно производить без выбросов диоксида углерода. Во избежание конкуренции за земельные ресурсы, предназначенные для производства продуктов питания и кормов для животных, оказывается особенно желательным использование несъедобной биомассы в производстве полимерных материалов. Биомасса на основе древесины представляет собой обильный ресурс, в котором содержатся целлюлоза (от 35 до 50%), гемицеллюлоза (от 25 до 30%) и лигнин (от 25 до 30%). Целлюлоза и гемицеллюлоза могут деполимеризоваться, образуя моносахариды, к которым относятся глюкоза, фруктоза и ксилоза.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
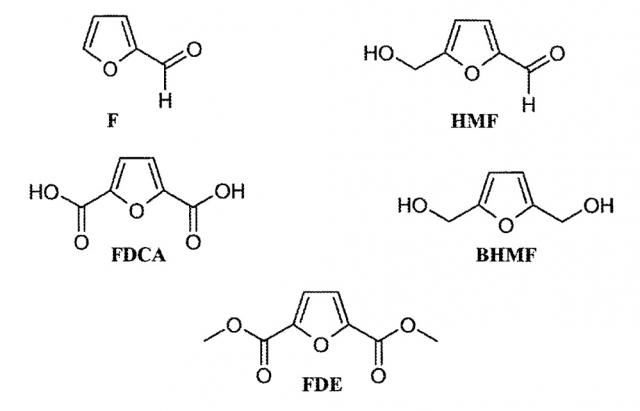
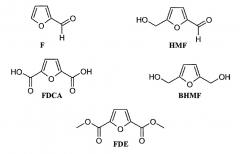
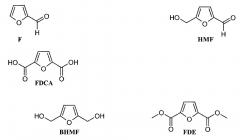
Использование сахаров и/или полисахаридов в качестве предшественников производных фурана представляет собой, вероятно, одну из наиболее перспективных областей изготовления полимеров, которые могли бы потенциально заменять используемые в настоящее время полимеры, производимые из нефти. Фурфураль (F) и гидроксиметилфурфураль (HMF) представляют собой химические вещества, получаемые как производные второго порядка, и для их синтеза используются пентозы и гексозы, соответственно. Фурфураль представляет собой имеющийся в большом количестве химический продукт, который можно производить посредством сравнительно простой технологии, для которой используется широкое разнообразие дешевых и повсеместно присутствующих побочных продуктов сельского хозяйства и лесной промышленности. Природные вещества, используемые в данном синтезе, представляют собой C5-сахара и полисахариды, которые присутствуют в остатках биомассы. В настоящее время мировое производство фурфураля составляет приблизительно 300000 тонн в год. Для получения гидроксиметилфурфураля могут использоваться гексозы, а также фурфураль посредством замещения C5. Гидроксиметилфурфураль можно также окислять или восстанавливать, и при этом получаются 2,5-фурандикарбоновая кислота (FDCA) и 2,5-бис(гидроксиметил)фуран (BHMF). При этерификации FDCA метанолом получается соответствующее сложноэфирное производное метилового спирта (FDE).
Изосорбид (IS) также представляет собой диол, который имеется в продаже и производится из растительной биомассы.
Лигнин представляет собой полимер, занимающий второе место по объему производства из возобновляемых ресурсов. Согласно некоторым аспектам, фрагменты лигнина можно использовать в качестве источника мономеров для синтеза полимеров посредством их введения (лигнин выступает как высокомолекулярный мономер) в древесные смолы на основе формальдегида или полиуретановые композиции. Поскольку лигнин производится в огромных количествах в процессах производства бумаги и расходуется на месте в качестве источника энергии (для регенерации энергии), небольшую его долю можно выделять и использовать в качестве источника мономера, не влияя на его основное использование в качестве топлива. В определенных технологиях производства бумаги, таких как технологии с использованием органических растворителей, и подходах к переработке биомассы, таких как паровой взрыв, образуются фрагменты лигнина, имеющие более регулярные структуры. Таким образом, в настоящее время высокомолекулярные мономеры лигнина представляют собой особенно перспективный источник новых материалов на основе возобновляемых ресурсов. Ванилиновая кислота может быть получена из лигнина.
Согласно другим аспектам, ванилиновая кислота (VA) может быть использована как мономер типа A-B для получения новых сложных полиэфиров на основе растительной биомассы.
Согласно разнообразным аспектам настоящего изобретения, разнообразные сложные полиэфиры содержат фуран и/или другие ароматические молекулы в сочетании с дополнительными молекулами. Согласно одному аспекту, сложный сополиэфир образуют следующие мономеры: (i) 2,5-фурандикарбоновая кислота или ее сложный низший алкилэфир, (ii) по меньшей мере, один алифатический или циклоалифатический C3-C10-диол и (iii) терефталевая кислота.
Согласно следующему аспекту, сложный полиэфир образуют следующие мономеры: 2,5-фурандикарбоновая кислота или ее сложный низший алкилэфир и изосорбид.
Согласно следующему аспекту, сложный полиэфир представляет собой поли(2,5-фурандиметиленадипат).
Согласно следующему аспекту, сложный полиэфир представляет собой сложный эфир поливанилиновой кислоты.
Согласно следующему аспекту, сложный полиэфир представляет собой полиэтиленизосорбидфурандикарбоксилат.
Согласно некоторым вариантам осуществления, сложный полиэфир или сложный сополиэфир получают посредством прямой поликонденсации. Согласно другим вариантам осуществления, сложный полиэфир или сложный сополиэфир получают посредством переэтерификации. Сложные полиэфиры, описанные в настоящем документе, могут иметь физические и термические свойства, которые являются аналогичными или даже улучшенными по сравнению со свойствами, которыми обладает поли(этилентерефталат), что делает их полезными для широкого разнообразия приложений. Согласно некоторым аспектам, из сложных полиэфиров изготавливают изделия, используя подходящие технологии, такие как листовая или пленочная экструзия, соэкструзия, экструзионное покрытие, инжекционное формование, термоформование, раздувное формование, прядение, электропрядение, ламинирование, эмульсионное покрытие и т.п. Согласно одному аспекту, изделие представляет собой пищевую упаковку. Согласно другому аспекту, изделие представляет собой контейнер для напитков. Другие приложения включают, но не ограничиваются этим, волокна для амортизирующих и изолирующих материалов, ориентированные пленки, двуосноориентированные пленки, жидкокристаллические дисплеи, голограммы, покрытия на деревянных изделиях, функциональные добавки в полимерных смешанных системах. Сложные полиэфиры, описанные в настоящем документе, можно использовать в чистом виде или в смеси или композиции, содержащей один или несколько других полимерных компонентов.
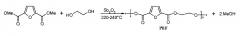
Согласно следующему аспекту, описан способ изготовления сложного сополиэфира на основе 2,5-фурандикарбоновой кислоты. Данный способ включает объединение 2,5-фурандикарбоновой кислоты или ее сложного низшего алкилэфира, по меньшей мере, одного алифатического или циклоалифатического C2-C10-диола, терефталевой кислоты и катализатора для получения реакционной смеси и перемешивание реакционной смеси в потоке азота. Реакционную смесь постепенно нагревают до первой температуры, составляющей приблизительно от 200 до 230°C, и первую температуру поддерживают в течение от приблизительно 8 до приблизительно 12 часов. После этого реакционную смесь постепенно нагревают до второй температуры, составляющей приблизительно от 240 до 260°C, и вторую температуру поддерживают в течение от приблизительно 12 до приблизительно 18 часов. Воду удаляют из реакционной смеси, а затем выделяют получаемый в результате сложный сополиэфир. Обнаружено, что данная методика обеспечивает сокращение продолжительности реакции и представляет собой более эффективный и экономичный путь к синтезу сложных сополиэфиров.
Полимеры, которые составляют мономеры на основе фурана, разнообразные диолы и дикарбоновые кислоты, а также полимер на основе мономера лигнина успешно синтезировали с целью замены полимеров, производимых из нефтехимических продуктов. Поли(бутилен-2,5-фурандикарбоксилат) (PBF) представляет особый интерес. Поскольку его гомологом является поли(этилен-2,5-фурандикарбоксилат) (PEF), можно предполагать, что температура стеклования (Tg) PBF должна быть меньше, чем в случае PEF. Неожиданно наблюдается обратное явление, то есть Tg у PBF оказывается выше, чем у PEF. Кроме того, PBF имеет значительно меньшую температуру плавления (Tm), чем PEF. Меньшее значение Tm благоприятно позволяет обрабатывать материал при меньшей температуре. В совокупности, данные свойства PBF делают его применение в высокой степени желательным в изготовлении упаковок для продуктов питания и напитков, особенно для содержания горячих напитков и т.п. Кроме того, представляет интерес сложный сополиэфир полимера PEF с изосорбидом (IS) и PBTF. Получаемые сложные сополиэфиры, как правило, представляют собой аморфные полимеры. Предполагается, что использование изосорбида в качестве сомономера должно улучшать механические свойства прямоцепочечного сложного полиэфира.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет Фурье-ИК спектр 2,5-фурандикарбоновой кислоты (FDCA).
Фиг. 2 представляет спектр ЯМР FDCA в растворителе DMSO.
Фиг. 3 представляет ДСК FDCA.
Фиг. 4 представляет Фурье-ИК спектр FDE.
Фиг. 5 представляет спектр ЯМР 2,5-диметилфурандикарбоксилата (FDE) в растворителе CD3COCD3.
Фиг. 6 представляет спектр ЯМР FDE в другом растворителе (CF3COOD).
Фиг. 7 представляет ДСК FDE.
Фиг. 8 представляет Фурье-ИК спектр изосорбида (IS).
Фиг. 9 и 10 представляют ДСК IS.
Фиг. 11 представляет спектр ЯМР 2,5-бис(гидроксиметил)фурана (BHMF) в растворителе DMSO.
Фиг. 12 и 13 представляют ДСК BHMF.
Фиг. 14 представляет Фурье-ИК спектр ванилиновой кислоты (VA).
Фиг. 15 представляет спектр ЯМР VA в растворителе CD3COCD3.
Фиг. 16 представляет ДСК VA.
Фиг. 17 представляет Фурье-ИК спектр полиэтилен-2,5-фурандикарбоксилата (PEF), синтезированного путем полипереэтерификации.
Фиг. 18 представляет спектр ЯМР PEF, синтезированного путем полипереэтерификации, в растворителе CF3COOD.
Фиг. 19 и 20 представляют ДСК PEF, синтезированного путем полипереэтерификации.
Фиг. 21 представляет Фурье-ИК спектр полибутилен-2,5-фурандикарбоксилата (PBF), синтезированного путем полипереэтерификации.
Фиг. 22 представляет спектр ЯМР PBF, синтезированного путем полипереэтерификации.
Фиг. 23 и 24 представляют ДСК PBF, синтезированного путем полипереэтерификации.
Фиг. 25 представляет Фурье-ИК спектр полиэтилен-2,5-фурандикарбоксилата (PEF), полученного путем прямой поликонденсации.
Фиг. 27 представляет ДСК PEF, полученного путем прямой поликонденсации.
Фиг. 28 представляет Фурье-ИК спектр полибутилен-2,5-фурандикарбоксилата (PBF), полученного путем прямой поликонденсации.
Фиг. 29 и 30 представляют спектр ЯМР PBF, полученного путем прямой поликонденсации, в растворителе CF3COOD.
Фиг. 31 и 32 представляют ДСК PBF, полученного путем прямой поликонденсации.
Фиг. 33 представляет Фурье-ИК спектр сложного полиэфира, синтезированного из изосорбида (PIF).
Фиг. 34 представляет спектр ЯМР PIF в растворителе CF3COOD.
Фиг. 35 и 36 представляют ДСК PIF.
Фиг. 37 представляет Фурье-ИК спектр поли-2,5-фурандиметиленадипата (PFA).
Фиг. 38 и 39 представляют ДСК PFA.
Фиг. 40 представляет Фурье-ИК спектр сложного эфира поливанилиновой кислоты (PVE), полученного непосредственно после синтеза.
Фиг. 41 представляет Фурье-ИК спектр PVE после очистки.
Фиг. 42 представляет спектр ЯМР PVE, полученного непосредственно после синтеза, в растворителе DMSO.
Фиг. 43 представляет спектр ЯМР PVE после очистки в растворителе DMSO.
Фиг. 44 и 45 представляют ДСК PVE.
Фиг. 46 представляет Фурье-ИК спектр полиэтиленизосорбидфурандикарбоксилата (PEIF).
Фиг. 47 и 48 представляют ДСК PEIF; фиг.48 представляет температуру плавления 184°C сложного сополиэфира с 10% изосорбида.
Фиг. 49 представляет Фурье-ИК спектр сложного сополиэфира PBTF.
Фиг. 50 представляет спектр ЯМР PBTF.
Фиг. 51 представляет ДСК PBTF.
Фиг. 52 представляет рентгенофазовый анализ (РФА) PEF.
Фиг. 53 представляет РФА PBF.
Фиг. 54 представляет РФА PEIF.
Фиг. 55 представляет РФА PBTF.
Фиг. 57 и 58 представляют спектр ЯМР и ДСК, соответственно, PBF, синтезированного с использованием прямой поликонденсации.
ПОДРОБНОЕ ОПИСАНИЕ
Согласно разнообразным аспектам, которые описаны в настоящем документе, сложные полиэфиры можно получать из биомассы, в том числе непосредственно или посредством синтеза мономеров, которые получают из биомассы. Термин «сложный полиэфир», который используется в настоящем документе, распространяется на полимеры, изготовленные из множества мономеров и иногда называемые как «сложные сополиэфиры». Такие термины, как «полимер» и «сложный полиэфир», используются в настоящем документе в широком смысле, означая материалы, которые характеризуются повторяющимися фрагментами и включают молекулы, которые можно описать как олигомеры. Если иное условие четко не следует из контекста, процентные соотношения, приведенные в настоящем документе, представляют собой массовые процентные доли по отношению к суммарной массе композиции.
Фурфураль (F) и гидроксиметилфурфураль (HMF) можно получать, используя пентозы и гексозы, соответственно. При этерификации метанолом 2,5-фурандикарбоновая кислота (FDCA) образует соответствующее сложноэфирное производное (FDE) метилового спирта. Гидроксиметилфурфураль также можно окислять или восстанавливать, и при этом получаются, соответственно, 2,5-фурандикарбоновая кислота (FDCA) и 2,5-бис(гидроксиметил)фуран (BHMF):
Лигнин представляет собой полимер, занимающий второе место по объему производства из возобновляемых ресурсов. Ванилиновая кислота (VA), которая может быть использована как мономер типа A-B для получения новых сложных полиэфиров, производится из растительной биомассы.
Как правило, сложные полиэфиры получаются, когда реагируют дикарбоновая кислота, в которой содержится фурановая и/или другая ароматическая функциональная группа, и, по меньшей мере, один диол. Подходящие диолы включают алифатические или циклоалифатические C3-C10-диолы, неограничительные примеры которых включают 1,4-бутандиол, и изосорбид (IS), имеющийся в продаже диол, который также может присутствовать в разнообразных видах растительной биомассы.
Помимо данных мономеров сложные полиэфиры могут содержать вплоть до приблизительно 25 мол.% других мономеров, таких как этиленгликоль (EG или MEG), и/или другие алифатические дикарбоновые кислоты, содержащие от приблизительно 4 до приблизительно 12 атомов углерода, а также ароматические или циклоалифатические дикарбоновые кислоты, содержащие от приблизительно 8 до приблизительно 14 атомов углерода. Неограничительные примеры этих мономеров представляют собой изофталевая кислота (IPA), фталевая кислота, янтарная кислота, адипиновая кислота, себациновая кислота, азелаиновая кислота, циклогександиуксусная кислота, нафталин-2,6-дикарбоновая кислота, 4,4-дифенилендикарбоновая кислота и их смеси.
В качестве компонентов в полимере также могут содержаться, составляя вплоть до приблизительно 25 мол.%, другие алифатические C2-C10- или циклоалифатические C6-C21-диолы. Неограничительные примеры включают неопентилгликоль, пентан-1,5-диол, циклогексан-1,6-диол, циклогексан-1,4-диметанол, 3-метилпентан-2,4-диол, 2-метилпентан-2,4-диол, пропан-1,3-диол, 2-этилпропан-1,2-диол, 2,2,4-триметилпентан-1,3-диол, 2,2,4-триметилпентан-1,6-диол, 2,2-диметилпропан-1,3-диол, 2-этилгексан-1,3-диол, гексан-2,5-диол, 1,4-ди(β-гидроксиэтокси)бензол, 2,2-бис-(4-гидроксипропоксифенил)пропан и их смеси.
Сложные полиэфиры можно синтезировать, используя хорошо известные технологии полипереэтерификации или прямой поликонденсации. Катализаторы, традиционно используемые в реакциях поликонденсации, включают оксиды или соли кремния, алюминия, циркония, титана, кобальта и их сочетания. В некоторых примерах оксид сурьмы(III) используется в качестве катализатора поликонденсации.
Другие условия, подходящие для реакций поликонденсации, должны быть очевидными для специалистов в данной области техники, особенно в свете примеров, которые описаны ниже.
ПРИМЕРЫ
Следующие примеры представлены, чтобы проиллюстрировать определенные аспекты настоящего изобретения, и их не следует рассматривать как ограничивающие идею или объем настоящего изобретения.
Материалы
2,5-фурандикарбоновая кислота (FDCA) чистоты 97% поставляется на продажу компанией Aldrich. Изосорбид (IS) (1,4:3,6-диангидро-D-глюцит) чистоты 99% поставляется на продажу компанией ADM Chemicals (США). Бис-(гидроксиметил)фуран (BHMF) поставляется на продажу компанией Polysciences, Inc. (Германия). Этиленгликоль чистоты не менее 99,5%, 1,4-бутандиол чистоты 99%, адипиновая кислота чистоты не менее 99,5%, ванилиновая кислота (VA) чистоты не менее 97%, оксид сурьмы(III) чистоты 99,999% и другие растворители, описанные в настоящем документе, поставляются на продажу компанией Aldrich.
Аналитические исследования
Инфракрасные спектры нарушенного полного внутреннего отражения (ИК НПВО) с преобразованием Фурье (Fourier) снимали, используя инфракрасный сканирующий спектрометр модели Paragon 1000 от компании Perkin Elmer с шагом 125 нм. Спектры ЯМР 1H снимали, используя спектрометр Bruker AC 300 с рабочей частотой 300,13 МГц для 1H в CF3COOD, DMSO-D6, CD3COCD3 с импульсами 30°, спектральной шириной 2000/3000 Гц, временем экспозиции 2,048 с, релаксационной задержкой 50 с, суммируя результаты 16-кратного сканирования. Эксперименты методом дифференциальной сканирующей калориметрии (ДСК) проводили, используя дифференциальный калориметр DSC Q100 от компании TA Instruments, оборудованный ручной системой охлаждения жидким азотом. Образцы помещали в герметично закрытые капсулы ДСК. Скорости нагревания и охлаждения составляли 10°C/мин и 5°C/мин в атмосфере азота. Массы образцов составляли от 5 до 15 мг. Структуры подтверждали, используя традиционные методы эксклюзионной хроматографии с детектированием рассеивания лазерного излучения с кратными углами (SEC-MALLS), термогравиметрический анализ (ТГА) и рентгенофазовый анализ (РФА).
Пример 1
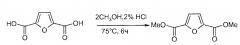
Данный пример описывает способ синтеза мономера 2,5-диметилфурандикарбоксилата (FDE) путем этерификации.
В круглодонную колбу объемом 500 мл помещали 10 г 2,5-фурандикарбоновой кислоты, 5 мл HCl и 120 мл метанола (избыток). Смесь нагревали при 80°C в течение 9 часов с обратным холодильником на магнитной мешалке. Реакционную смесь охлаждали до комнатной температуры (для полного осаждения смесь охлаждали в холодильнике или в морозильнике в течение суток), и образовавшийся беловатый осадок отделяли путем фильтрования раствора и промывали (отдельно осадок промывали повторно в лабораторном стакане, используя метанол и профильтрованный раствор) перед высушиванием. Выход в реакции составлял 97%.
Данный 2,5-диметилфурандикарбоксилат растворяется в метаноле, этаноле, ацетоне, DMSO и диизопропиловом эфире.
Пример 2A
Данный пример описывает изготовление полиэтилен-2,5-фурандикарбоксилата (PEF) путем полипереэтерификации.
В круглодонную колбу объемом 50 мл помещали 3,68 г (0,02 моль) 2,5-диметилфурандикарбоксилата, 1,11 мл (0,02 моль) этиленгликоля и 0,01 г (0,000034 моль) Sb2O3. Данную смесь интенсивно перемешивали в потоке азота в течение одного часа. После этого поток азота останавливали и смесь нагревали в течение 3 часов при 220°C (до тех пор, пока она не становилась вязкой). Когда раствор становился вязким, высвобождающийся метанол удаляли путем откачивания реактора в вакууме. Высвобождающийся метанол собирали в ловушку, охлаждаемую жидким азотом, в течение от 5 до 10 минут. После этого температуру уменьшали до 150°C и вязкий полимер растворяли в DMSO (15 мл) при нагревании. После растворения в DMSO полимер осаждали в метаноле, фильтровали и промывали метанолом перед высушиванием. Выходы в каждом опыте составляли 66, 38 и 30%, соответственно.
Пример 2B
Данный пример описывает изготовление полиэтилен-2,5-фурандикарбоксилата (PEF) путем прямой поликонденсации.
Использовали кислоту и гликоль в молярном соотношении 1:1,5 и 0,02 г Sb2O3. Поскольку в реакции прямой поликонденсации вместо метанола высвобождаются молекулы воды, выход является высоким.
В круглодонную колбу объемом 100 мл помещали 3,12 г (0,02 моль) 2,5-фурандикарбоновой кислоты, 1,64 мл (0,03 моль) этиленгликоля и 0,02 г (0,000068 моль) Sb2O3. Данную смесь интенсивно перемешивали в потоке азота в течение одного часа. Затем поток азота останавливали и смесь нагревали в процессе медленного повышения температуры до 220°C в течение 7 часов. Затем температуру медленно повышали до уровня от 240 до 250°C и смесь выдерживали при нагревании в течение 5 часов. Когда раствор становился вязким, высвобождающуюся воду удаляли путем откачивания реактора в вакууме. Высвобождающуюся воду собирали в ловушку, охлаждаемую жидким азотом, в течение 2-3 минут. После этого температуру уменьшали до 150°C и вязкий полимер растворяли в DMSO (15 мл) в процессе нагревания при 180°C в течение 4-5 часов. После растворения в DMSO полимер осаждали в метаноле, фильтровали, промывали метанолом и высушивали. Выходы составляли 52 и 97%.
Пример 3A
Данный пример иллюстрирует изготовление полибутилен-2,5-фурандикарбоксилата (PBF) путем переэтерификации.
В круглодонную колбу объемом 50 мл помещали 3,68 г (0,02 моль) 2,5-диметилфурандикарбоксилата, 1,76 мл (0,02 моль) 1,4-бутандиола и 0,01 г (0,000034 моль) Sb2O3. Данную смесь тщательно перемешивали в атмосфере азота в течение одного часа. Затем поток азота останавливали и смесь нагревали в течение 7 часов при 220°C (до тех пор, пока она не становилась вязкой). Когда раствор становился вязким, высвобождающийся метанол собирали в вакуумную ловушку, охлаждаемую жидким азотом, в течение от 5 до 10 минут. Затем температуру уменьшали до 150°C и вязкий полимер растворяли в DMSO (15 мл) при нагревании. После растворения в DMSO полимер осаждали в метаноле, фильтровали и промывали метанолом перед высушиванием. Выходы составляли 12 и 9%.
Пример 3B
Данный пример описывает изготовление полибутилен-2,5-фурандикарбоксилата (PBF) путем прямой поликонденсации.
В круглодонную колбу объемом 100 мл помещали 3,12 г (0,02 моль) 2,5-фурандикарбоновой кислоты, 2,65 мл (0,03 моль) 1,4-бутандиола и 0,02 г (0,000068 моль) Sb2O3. Данную смесь интенсивно перемешивали в потоке азота в течение одного часа. После этого поток азота останавливали и смесь нагревали в процессе медленного повышения температуры до уровня 220-230°C. Реакционную смесь затем выдерживали при данной температуре в течение 10 часов. После этого температуру медленно повышали до уровня от 250 до 260°C и смесь выдерживали при нагревании в течение следующих 10 часов. Когда раствор становился вязким, высвобождающуюся воду удаляли путем откачивания реактора в вакууме. Высвобождающуюся воду собирали в ловушку, охлаждаемую жидким азотом, в течение от 4 до 5 минут. После этого температуру уменьшали до 180°C и вязкий полимер растворяли в DMSO (25 мл) в процессе нагревания при 180°C в течение от 3 до 4 часов. После растворения в DMSO полимер осаждали в метаноле, фильтровали, промывали метанолом и высушивали. Выходы составляли 32 и 40%.
Пример 4
Данный пример иллюстрирует изготовление сложного полиэфира из изосорбида (PIF).
В круглодонную колбу объемом 100 мл помещали 3,12 г (0,02 моль) 2,5-фурандикарбоновой кислоты, 4,38 г (0,03 моль) 1,4:3,6-диангидро-D-глюцита и 0,02 г (0,000068 моль) Sb2O3. Данную смесь перемешивали в потоке азота в течение одного часа. Затем поток азота останавливали и смесь нагревали в процессе медленного повышения температуры до уровня от 220 до 230°C. После того, как температура достигала данного уровня, смесь выдерживали для продолжения реакции в течение 10 часов. После этого температуру снова медленно повышали до уровня от 250 до 260°C и смесь снова выдерживали при нагревании в течение следующих 10 часов. Когда раствор становился вязким, высвобождающуюся воду удаляли путем откачивания реактора в вакууме. Высвобождающуюся воду собирали в ловушку, охлаждаемую жидким азотом, в течение 4-5 минут. Затем температуру уменьшали до 180°C и вязкий полимер растворяли в DMSO (20 мл) в процессе нагревания при 180°C в течение 3-4 часов. После растворения в DMSO полимер осаждали в метаноле, фильтровали, промывали метанолом и высушивали. Выход в реакции составлял приблизительно 57%.
Пример 5
Данный пример иллюстрирует изготовление поли-2,5-фурандиметиленадипата (PFA).
В круглодонную колбу объемом 100 мл помещали 2,923 г (0,02 моль) адипиновой кислоты, 3,843 г (0,03 моль) BHMF и 0,02 г (0,000068 моль) Sb2O3. Данную смесь интенсивно перемешивали в потоке азота в течение одного часа. После этого поток азота останавливали и смесь нагревали в течение медленного повышения температуры до уровня от 190 до 220°C. Реакционную смесь затем выдерживали при данной температуре в течение 10 часов. Затем температуру медленно повышали до уровня от 230 до 240°C и смесь выдерживали при нагревании в течение следующих 10 часов. Когда раствор становился вязким, высвобождающуюся воду удаляли путем откачивания реактора в вакууме. Высвобождающуюся воду собирали в ловушку, охлаждаемую жидким азотом, в течение 4-5 минут. Температуру затем уменьшали до комнатной температуры и полимер выделяли, не используя какой-либо растворитель (ни DMSO, ни метанол). Выход в реакции составлял 62%.
Пример 6
Данный пример иллюстрирует изготовление сложного эфира поливанилиновой кислоты (PVE).
В круглодонную колбу объемом 100 мл помещали 5,0445 г (0,03 моль) ванилиновой кислоты, 0,02 г (0,000068 моль) Sb2O3. Данную смесь интенсивно перемешивали в потоке азота в течение одного часа. После этого поток азота останавливали и смесь нагревали в процессе медленного повышения температуры до уровня от 220 до 230°C. На данном уровне смесь выдерживали для реакции в течение 7 часов. Затем температуру медленно повышали до уровня от 250 до 260°C и смесь выдерживали при нагревании в течение следующих 6,5 часов. Когда раствор становился вязким, высвобождающуюся воду удаляли путем откачивания реактора в вакууме. Высвобождающуюся воду собирали в ловушку, охлаждаемую жидким азотом, в течение от 4 до 5 минут. Затем температуру уменьшали до 180°C и вязкий полимер растворяли в DMSO (20 мл) в процессе нагревания при 180°C в течение от 3 до 4 часов. После растворения в DMSO полимер из половины раствора осаждали в метаноле, фильтровали, промывали метанолом и высушивали. Вторую половину извлекали и исследовали в таком виде. Выход в реакции составлял приблизительно 60%.
Пример 7
Данный пример иллюстрирует изготовление полиэтиленизосорбидфурандикарбоксилата (PEIF).
В круглодонную колбу объемом 100 мл помещали 3,12 г (0,02 моль) 2,5-фурандикарбоновой кислоты, (n моль) этиленгликоля, 0,2192 г (m моль) изосорбида и 0,02 г (0,000068 моль) Sb2O3. Данную смесь интенсивно перемешивали в потоке азота в течение одного часа. После этого поток азота останавливали и смесь нагревали в процессе медленного повышения температуры до уровня от 200 до 230°C. Реакционную смесь затем выдерживали при данной температуре в течение 11 часов. После этого температуру медленно повышали до уровня от 245 до 255°C и смесь выдерживали при нагревании в течение следующих 14 часов. Применяли вакуум, чтобы удалять высвобождающуюся воду из реакционной среды посредством откачивания реактора в вакууме. Высвобождающуюся воду собирали в ловушку, охлаждаемую жидким азотом, в течение от 4 до 5 минут. Смесь нагревали в течение следующих 5 часов. После этого температуру уменьшали до комнатной температуры и собирали полимер.
Синтезировали сложные сополиэфиры, имеющие четыре различных соотношения этиленгликоля и изосорбида. Полученные выходы составляли от 70 до 90%.
Пример 8
Данный пример иллюстрирует изготовление сложного сополиэфира PBTF.
В круглодонную колбу объемом 100 мл помещали 1,56 г (0,01 моль) 2,5-фурандикарбоновой кислоты, (0,03 моль) этиленгликоля, 1,66 г (0,01 моль) терефталевой кислоты и 0,02 г (0,000068 моль) Sb2O3. Данную смесь интенсивно перемешивали в потоке азота в течение одного часа. После этого поток азота останавливали и смесь нагревали в процессе медленного повышения температуры до уровня от 200 до 230°C. Реакционную смесь затем выдерживали при данной температуре в течение 12 часов. После этого температуру медленно повышали до уровня от 245 до 255°C и смесь выдерживали при нагревании в течение следующих 18 часов. Применяли вакуум, чтобы удалять высвобождающуюся воду из реакционной среды посредством откачивания реактора в вакууме. Высвобождающуюся воду собирали в ловушку, охлаждаемую жидким азотом, в течение от 4 до 5 минут. Смесь нагревали в течение следующего часа. После этого температуру уменьшали до комнатной температуры и собирали полимер. Выход в реакции составлял приблизительно 40%.
Пример 9
Данный пример иллюстрирует изготовление сложного сополиэфира по изобретению.
В круглодонную 100 мл колбу помещают 1,56 г 2,5-фурандикарбоновой кислоты (0,03 моль), вместе с этиленгликолем и 1,4-бутандиолом, и добавляют 1,66 г терефталевой кислоты (0,01 моль) и 0,02 г Sb2O3 (0,000068 моль). Полученную смесь тщательно перемешивают в токе азота в течение 1 часа. Затем прекращают подачу азота и смесь медленно нагревают до температуры 200-230°С. Реакционную смесь выдерживают при указанной температуре в течение 12 часов. Затем температуру медленно повышают до 245-255°С, и смесь выдерживают при данной температуре в течение 18 часов. Образующуюся в ходе реакции воду удаляют под вакуумом, и собирают ее в охлаждаемую жидким азотом ловушку в течение 4-5 минут. Затем, снова нагревают в течение 1 часа. Наконец, понижают температуру до комнатной и отбирают образовавшийся полимер.
Результаты и обсуждение
Все мономеры, в том числе приобретенные, исследовали, используя методы ДСК, спектроскопии ЯМР, Фурье-ИК спектроскопии ЯМР, SEC-MALLS, РФА и ТГА.
Мономеры
Фиг. 1 представляет Фурье-ИК спектр 2,5-фурандикарбоновой кислоты (FDCA). Определения и положения основных пиков представляют собой следующие:
карбоновая кислота (C=O) - 1678 см-1,
кислота (валентные колебания O-H) - 2700-3400 см-1,
фурановое кольцо (C=C) - 1570 см-1,
кислота (деформационные колебания C-O-H) - 1400 см-1,
фурановое кольцо (деформационные колебания C-H и фуранового кольца) - 960, 840, 762 см-1.
Фиг. 2 представляет спектр 1H ЯМР FDCA в растворителе DMSO. В данном спектре ЯМР сигнал, имеющий химический сдвиг (δ) 7,26 м.д., соответствует протонам H3 и H4 фуранового кольца, в то время как сигнал, имеющий химический сдвиг 3,46 м.д., соответствует группе OH кислоты, а сигнал, наблюдаемый при 2,50 м.д., соответствует DMSO.
Фиг. 3 представляет ДСК FDCA. Анализ методом ДСК осуществляли следующим образом:
(1) нагревание от 50°C до 350°C при скорости 10°C/мин,
(2) изотермическое выдерживание в течение 5 минут,
(3) охлаждение от 350°C до 50°C при скорости 10°C/мин.
Согласно анализу методом ДСК, наблюдаются температура плавления при Tf=334°C и экзотермический эффект кристаллизации при Tc=232°C.
2,5-диметилфурандикарбоксилат (FDE)
Фиг. 4 представляет Фурье-ИК спектр FDE. Определения и положения основных пиков представляют собой следующие:
фурановое кольцо (C=H) - 3142 см-1,
метильная группа (C-H) - 2965 см-1,
C=O - 1712 см-1,
сложный эфир (C-O) - 1298 см-1.
Фиг. 5 представляет спектр ЯМР FDE в растворителе CD3COCD3. В данном спектре сигнал (δ) при 7,33 м.д. соответствует протонам H3 и H4 фуранового кольца, в то время как сигнал, имеющий химический сдвиг 3,86 м.д., может соответствовать CH3 образованной сложноэфирной группы.
Фиг.6 представляет спектр ЯМР FDE в другом растворителе (CF3COOD). Когда используемый растворитель представляет собой CF3COOD, получается аналогичный спектр, имеющий пики (δ) при 7,33 м.д. и 4,02 м.д., которые соответствуют одному протону фуранового кольца и группе CH3 сложного эфира, соответственно. Сигнал при 11,5 м.д. соответствует растворителю.
Фиг. 7 представляет ДСК FDE. Анализ методом ДСК осуществляли следующим образом:
(1) стадия нагревания от 50°C до 150°C при скорости 5°C/мин,
(2) изотермическое выдерживание в течение 5 минут,
(3) стадия охлаждения от 150°C до 50° при скорости 5°C/мин,
(4) изотермическое выдерживание в течение 5 минут,
(5) стадия второго нагревания от 50°C до 150°C при скорости 5°C/мин.
Первое нагревание осуществляли, чтобы устранить термическую историю мономера. На термограмме ДСК можно наблюдать, что Tm диметилового сложноэфирного мономера FDCA составляет приблизительно 110°C. Высокое значение Tf (334°C) FDCA может быть обусловлено высокой энергией сцепления вследствие межмолекулярных водородных связей. Но в случае сложного диэфира такие взаимодействия отсутствуют (110°C), потому что водородные связи, которые образуют карбоксильные функциональные группы, разрушались при превращении групп COOH в группы COOMe.
Изосорбид (IS)
Фиг. 8 представляет Фурье-ИК спектр изосорбида (IS) в KBr. В данном ИК спектре присутствуют пики при 3374 (валентные колебания OH), пики при 2943, 2873 см-1, соответствующие валентным (асимметричным и симметричным) колебаниям метильной группы, и пики при 1120, 1091, 1076, 1046 см-1, соответствующие колебаниям группы C-O-C.
Фиг. 9 и 10 представляют ДСК IS. Анализ методом ДСК осуществляли следующим образом:
(1) стадия нагревания от 50°C до 300°C при скорости 10°C/мин,
(2) изотермическое выдерживание в течение 5 минут,
(3) стадия охлаждения от 300°C до 50° при скорости 10°C/мин,
(4) изотермическое выдерживание в течение 5 минут,
(5) стадия второго нагревания от 50°C до 300°C при скорости 10°C/мин (фиг. 9),
(6) стадия второго нагревания от 50°C до 300°C при скорости 10°C/мин (фиг. 10).
Согласно наблюдениям, изосорбид имеет температуру плавления, составляющую 62°C, и его термическое разложение начинается приблизительно при 205°C.
2,5-бис(гидроксиметил)фуран (BHMF)
Фиг. 11 представляет спектр ЯМР BHMF в растворителе DMSO. Спектр ЯМР представляет несколько сигналов, имеющих химические сдвиги (δ) при 6,18 м.д., который соответствует 2H фуранового кольца, 5,18 м.д., который соответствует OH, 4,35 м.д., который соответствует 4H CH2OH, 3,36 и 2,25 м.д., которые соответствуют растворителю и группе OH присутствующей в ней воды.
Фиг. 12 и 13 представляют ДСК BHMF. Фиг. 12 представляет полную термограмму BHMF, и фиг. 13 представляет стадию второго нагревания. Анализ ДСК осуществляли следующим образом:
(1) стадия нагревания при скорости 10°C/мин до 260°C,
(2) изотермическое выдерживание в течение 5 минут,
(3) стадия охлаждения при скорости 10°C/мин до 45°C,
(4) изотермическое выдерживание в течение 5 минут,
(5) стадия второго нагревания при скорости 10°C/мин до 260°C,
(6) стадия третьего нагревание при скорости 10°C/мин до 260°C.
Согласно термограмме ДСК BHMF, температура плавления Tm наблюдается приблизительно при 77°C. Разложение мономера начинается при температуре, составляющей приблизительно 230°C. На второй и третьей стадиях, т.е. на стадиях охлаждения и нагревания, наблюдается небольшой пик приблизительно при 100°C. Данный пик может быть обусловлен кристаллизацией (стадия охлаждения) и испарением воды (стадия нагревания). Не были обнаружены какие-либо другие пики (Tm, Tc).
Ванилиновая кислота (VA)
Фиг. 14 представляет Фурье-ИК спектр VA. Согласно Фурье-ИК спектру, можно наблюдать сл