Лекарственный препарат противотуберкулезного действия на основе d-циклосерина в виде лиофилизата и способ получения лекарственного препарата
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и медицине и представляет собой лекарственный препарат противотуберкулезного действия в виде лиофилизата для перорального применения массой 2.0±0.20 г, содержащий D-циклосерин 12.5±1.25 мас.%, полимер PLGA 50/50 50±5.0 мас.%, поливиниловый спирт 12.5±1.25 мас.% и D-маннитол 25±2.5 мас.%, с содержанием D-циклосерина от 0.225 до 0.275 г, который при разбавлении водой в количестве 100±10 мл образует суспензию частиц с размером не более 800 нм, составляющих не менее 90%. Изобретение обеспечивает высокую стабильность в условиях долгосрочного хранения при температуре 5±3°С в течение 18 месяцев и ускоренного хранения при температуре 25±2°С в течение 184 дней, высокую биодоступность, в том числе высокую тканевую биодоступность в органах-мишенях инфекционного процесса, и низкую токсичность, нейротоксичность. 2 н. и 4 з.п. ф-лы. 3 пр., 5 табл.
Реферат
Изобретение относится к области фармакологии и медицины, а именно к новому поколению противотуберкулезных препаратов на основе D-циклосерина и способа его получения в виде готовой к применению лекарственной формы.
Одной из проблем современной медицины является резкое увеличение числа больных лекарственно-устойчивыми формами туберкулеза (ЛУ-ТБ). Широкое распространение устойчивых форм микобактерий приводит к необходимости создавать новые лекарственные субстанции, либо использовать для лечения пациентов различные комбинации 4-5 препаратов, что резко повышает уровень побочных эффектов и значительно ухудшает качество жизни больного. При лечении больных ЛУ-ТБ, согласно рекомендациям Всемирной организации здравоохранения, применяют комбинированную схему лечения. Одним из обязательных компонентов таких схем лечения в РФ является D-Циклосерин, представляющий собой аналог и конкурентный антагонист D-аланина. Механизм действия данного препарата основан на способности ингибировать активность ферментов, участвующих в синтезе клеточной стенки бактерий, что позволяет проявлять бактериостатический и бактерицидный эффект в отношении как грамположительных, так и грамотрицательных бактерий. Помимо широкого спектра антибактериальной активности особенностью D-циклосерина является то, что лекарственная устойчивость М. tuberculosis к нему развивается редко и медленно - в процессе продолжительного (6 месяцев и более) лечения выделяется до 20-30% устойчивых штаммов [1, 2, 3]. Перекрестной резистентности с другими противотуберкулезными средствами для циклосерина не выявлено. Показана эффективность D-циклосерина при атипичных микобактериозах, вызываемых комплексом M. avium-intracellulare, M. xenopi и др [4]. Также возможно применение D-циклосерина при для лечения острых инфекций мочевыводящих путей, вызванных чувствительными штаммами грамположительных и грамотрицательных бактерий, в особенности видами Klebsiella/Enterobacter и Escherichia coli [5].
Принимают циклосерин перорально в виде таблеток или капсул. Разовая доза циклосерина для взрослых составляет - 250 мг. Циклосерин принимают 2-4 раза в день: начало лечения 250 мг каждые 12 ч и при необходимости, с учетом переносимости, дозу постепенно повышают до 250 мг каждые 6-8 ч. Средняя суточная доза - 500-750 мг/сут в 2-3 приема, максимальная суточная доза - 1 г в 4 приема [6]. Суточная доза для детей - 10 мг/кг массы тела (не выше 750 мг/сут). Курс лечения циклосерином при туберкулезе составляет 6 месяцев и более.
Длительное применение D-циклосерина затруднено вследствие выраженного отрицательного действия на состояние центральной нервной системы (ЦНС). Высокие дозы препарата вызывают галлюцинаторный психоз с дезориентацией, эйфорией или агрессивностью, кошмарными сновидениями, расстройством памяти. Нестабильность D-циклосерина в нейтральных и кислых водных средах также является одной из основных причин ограничивающих применение в медицинской практике этого феноменального по свойствам биологически активного соединения. Не случайно, что когда все противотуберкулезные препараты оказываются бессильными, прибегают именно к его использованию. Правомерно предположить, что использование лекарственных форм D-циклосерина, позволяющих увеличить стабильность и биодоступность, достигать положительного фармакодинамического действия при меньших вводимых дозах, снизить риск возникновения побочных эффектов, главным образом, нейротоксических, увеличить терапевтический индекс, может привести к значительному прогрессу при лечении туберкулеза.
Уменьшение токсического действия циклосерина достигается назначением в период лечения либо глутаминовой кислоты (по 0,5 г 3-4 раза в день), либо внутримышечным введением натриевой соли аденозинтрифосфорной кислоты (по 1 мл 1% раствора ежедневно), либо внутримышечной инъекцией пиридоксина (1-2 мл 5% раствора в сутки) [7]. По этому, с целью уменьшения осложнений со стороны ЦНС, был создан оригинальный препарат в желатиновых капсулах, содержащий одновременно с циклосерином 2-5 мас.% глутаминой кислоты. Лекарственное средство, описанное в патенте РФ №2248205 «Лекарственное средство в виде желатиновой капсулы» [7] состоит из циклосерина и вспомогательных добавок, включая кальция фосфат дигидрат, аэросил, кальция стеарат при определенном соотношении ингредиентов.
В патенте РФ №103473 «Фармацевтическая капсула противотуберкулезного действия» [8] описана фармацевтическая капсула противотуберкулезного действия, которая содержит два действующих вещества - циклосерин и пиридоксин гидрохлорид, а также вспомогательные вещества (оксид магния, сополимер метакриловой кислоты и метакрилата, стеариновую кислоту, целлюлозу микрокристаллическую, лактозу, кремния диоксид коллоидный, карбоксиметилкрахмал натрия, стеарат магния). Включение пиридоксина в состав способствует нормализации обмена аминокислот и уменьшает интенсивность побочных реакций циклосерина со стороны центральной нервной системы.
Перспективным направлением в создании лекарственных средств нового поколения является создание полимерсодержащих лекарственных средств на основе биодеградируемых полимеров, разрешенных для применения в медицинской практике [9-12], в виде полимерных частиц с включенным (адсорбированным) действующим веществом.
В патентах РФ №2318513 «Лекарственное средство на основе d-циклосерина, препарат пролонгированного действия, содержащий наночастицы, способ его получения» [1] и №2327459 «Лекарственное средство противомикробного действия, способ получения лекарственного препарата направленного действия, содержащего наночастицы» [13] раскрывается способ получения лекарственных средств в виде концентратов в диметилсульфоксиде (ДМСО), содержащих D-циклосерин (патент №2318513) или комбинацию из рифабутина, D-циклосерина, изониазида и пиразинамида (патент №2327459), а также D-маннитол, полисорбат 80, которые в определенном соотношении нагревают при 50-60°С с растворителем (ДМСО) до образования однородной прозрачной жидкости, которую далее охлаждают до комнатной температуры и после разбавления водой образующуюся суспензию, содержащую частицы (размер до 200 нм - патент №2318513; 200-400 нм - патент №2327459), используют по назначению. Экспериментальные данные, приведенные в патентах, свидетельствуют о замедленном выделении в организме активно действующих веществ и достаточно высоком быстродействии в отношении микроорганизмов разных типов (Escherichia coli, Staphylococcus aureus 906, Salmonella spp.), однако противотуберкулезная активность описанных лекарственных средств не изучена. Отличительной особенностью методики приготовления лекарственных средств, описанных в патентах РФ №2318513 и №2327459, является то, что в качестве растворителя компонентов на первой стадии применяется диметилсульфоксид. Недостатком данных композиций является неполная изученность биосовместимости и безопасности использования диметилсульфоксида.
В патенте РФ №2403041 «Лекарственное средство пролонгированного действия с дозированным высвобождением в органы-мишени на основе d-циклосерина для лечения резистентных форм туберкулеза», описывается лекарственное средство противомикробного действия в виде стабильных наночастиц следующего состава и при следующем соотношении компонентов, мас.%: D-циклосерин от 1 до 15; ПЛГА 50/50 от 20 до 40; D-маннитол от 5 до 40; поливиниловый спирт от 5 до 15 [14]. Фармацевтическую композицию получали методом двойного эмульгирования с использованием погружного гомогенизатора типа ротор-статор. Лекарственное средство представляло собой лиофильно высушенный порошок. Средний размер частиц, полученных описанным способом, составлял от 250 до 500 нм. Согласно патенту №2403041 при получении данной фармацевтической композиции в качестве органического растворителя используется хлороформ, что является крайне нежелательным в плане использования такой композиции в клинической практике из-за возможного присутствия посторонних (специфических) примесей в виде данного органического растворителя. Таким образом, в патенте описано лекарственное средство в виде фармацевтической композиции в виде наночастиц, однако отсутствует описание готового лекарственного препарата (лекарственной формы) и способа его получения; такие основные характеристики лекарственных препаратов как стабильность при длительном хранении, биодоступность, токсичность этого лекарственного средства не исследовались.
Сущность настоящего изобретения заключается в разработке нового лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата и законченного технологического цикла его получения, характеристики препарата должны превосходить характеристики существующих препаратов того же назначения.
Следует отметить, что прием лекарственных препаратов в виде суспензий для перорального применения широко используется в клинической практике, в том числе для приема антибактериальных препаратов. Лекарственная форма в виде суспензии обладает рядом преимуществ, к числу которых относятся высокая биодоступность, удобство приема.
Фармацевтической промышленностью выпускаются как собственно суспензии (дисперсная фаза - твердое тело + дисперсионная среда - жидкость), примером которых являются суспензии парацетамола, противогельминтных средств, ряда нитрофуранов и т.д., так и порошки и гранулы, которые образуют суспензии при добавлении к ним воды. К числу последних могут быть отнесены: «Амоксиклав» (амоксициллин + клавулановая кислота), лекарственная форма - порошок для приготовления суспензии для применения внутрь во флаконах, производства фирмы LEK D.D.; «Цефалексин» - порошок/гранулы для приготовления суспензии для приема внутрь, производства фирмы Hemofarm (Сербия); «Сумамед» - порошок для приготовления суспензии для приема внутрь; «Лексин» - порошок для приготовления суспензии для приема внутрь, производства фирмы Hikma (Иордания).
Также на российском фармацевтическом рынке зарегистрированы препараты: «Споридекс», порошок для приготовления суспензии для приема внутрь (Ranbaxi, Индия); «Дурацеф», порошок для приготовления суспензии для приема внутрь (UPSA, Франция); Микстура от кашля для детей сухая Mixture conta tussis for children siccum, представляющий порошок для приготовления раствора для приема внутрь (ЗАО ВИФИТЕХ, РФ); «Бифидумбактерин», лиофилизат для приготовления раствора для приема внутрь (Микроген, РФ); «Пробифор», бифидобактерии, сорбированные на активированном угле; «Оспексин», гранулы для приготовления суспензии для приема внутрь (Biochemie, Австрия), и другие.
Перечисленные выше лекарственные препараты выпускаются в виде порошков/гранул, расфасованы во флаконы, иногда, как микстура от кашля сухая или различные виды пробиотиков - в пакеты из фольги, и предназначены для растворения в воде кипяченой перед приемом внутрь.
Таким образом, при создании лекарственного препарата противотуберкулезного действия на основе D-циклосерина наиболее предпочтительным представлялось разработка технологии получения препарата в виде лиофилизата для приготовления суспензии для перорального применения.
Техническим результатом заявленного изобретения является разработка законченного технологического цикла получения противотуберкулезного лекарственного препарата на основе D-циклосерина в виде лиофилизата для перорального применения, обладающего высокой стабильностью (в условиях долгосрочного хранения - при температуре 5±3 С в течение 18 месяцев, и ускоренного хранения - при температуре 25±2 С в течении 184 дней, что соответствует 2 годам хранения при температуре 5±3 С), высокой биодоступностью, в том числе высокой тканевой биодоступностью в органах-мишенях инфекционного процесса (легкие, почки, селезенка), и низкой побочной токсичностью (нейротоксичностью).
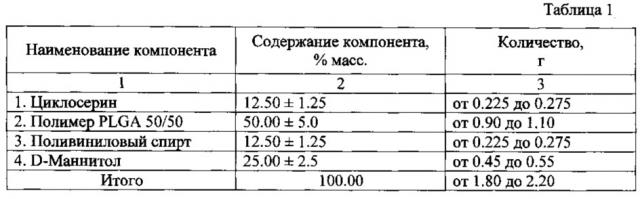
Для этого предложен лекарственный препарат противотуберкулезного действия в виде лиофилизата для перорального применения массой 2.0±0.20 г, содержащий D-циклосерин 12.5±1.25 мас.%, полимер PLGA 50/50 50±5.0, мас.%, поливиниловый спирт 12.5±1.25 мас.% и D-маннитол 25±2.5 мас.%, с содержанием D-циклосерина от 0.225 до 0.275 г, который при разбавлении водой в количестве 100±10 мл образует суспензию частиц с размером не более 800 нм, составляющими не менее 90%.
Кроме того,используют полимер PLGA 50/50 со средним значением характеристической вязкости 0,41 см3/г.
Также предложен способ получения лекарственного препарата приведенного выше, заключающийся в смешивании водного раствора D-циклосерина с раствором PLGA 50/50 в органическом растворителе дихлорметане с последующим эмульгированием смеси с получением первичной эмульсии, добавлении полученной первичной эмульсии к водному раствору поливинилового спирта с последующим эмульгированием с получением вторичной эмульсии, удалении органического растворителя с получением суспензии, фильтровании суспензии, смешивании суспензии с водным раствором D-маннитола с последующим ее замораживанием и лиофилизацией, при этом при эмульгировании с получением вторичной эмульсии проводят ультразвуковую обработку, перед замораживанием суспензию дозируют в контейнеры равными порциями по 63-67 г для получения конечного лиофилизата массой 2.0±0.20 г, замораживание суспензии проводят при температуре минус 40÷450 С в течение от 10-18 часов, лиофилизацию дозированной замороженной суспензии проводят при остаточном давлении 0.03÷0.1 мбар и комнатной температуре в течение 45-48 ч, с последующим герметичным укупориванием контейнеров.
Кроме того:
- в качестве водного растворителя используют деионизированную воду.
- используют полимер PLGA 50/50 со средним значением характеристической вязкости 0,41 см3/г.
- дозирование суспензии проводят в пластиковые контейнеры объемом 125 мл.
В ходе экспериментальных исследований применен способ получения лекарственного препарата с использованием в качестве органического растворителя хлористого метилена (метиленхлорид), как наиболее технологичного (легкокипящий и менее токсичный) по сравнению с хлороформом. Для приготовления водных растворов компонентов стала использоваться более чистая деионизированная вода, получаемая из воды очищенной. Для получения частиц использовали сополимер молочной и гликолевой кислот с характеристической вязкостью 0,41 см3/г и молярным соотношением остатков молочной и гликолевой кислот 50 на 50%. При этом увеличенное содержание полимера позволяет повысить стабильность препарата. При отработке процесса получения вторичной эмульсии была введена дополнительная стадия - дополнительное диспергирование вторичной эмульсии с помощью ультразвука. Суспензию, полученную после удаления растворителя, фильтрации и последующего добавления D-маннитола, дозировали - равномерно разливали по 63-67 г в пластиковые контейнеры и после замораживания и лиофилизации получали по 2,0±0,20 г лиофилизата в контейнере (1 доза), содержащем от 0.225 до 0.275 г циклосерина,
Замораживание суспензии, дозированной по пластиковым контейнерам объемом 125 мл выполненными, например, из полиэтилентерефталата (ПЭТФ 37/20/125-Л, 2189) проводили при температуре минус 40÷45°С, в течение 10-18 часов, что обеспечивает получение качественного продукта и возможность перехода к промышленным сублимационным сушкам для лиофолизации препарата.
Лиофилизацию дозированной замороженной суспензии в контейнере проводили при остаточном давлении 0.03÷0.1 мбар и комнатной температуре в течение 45-48 ч, с последующим герметичным укупориванием контейнеров крышками, выполненными, например, из полиэтилена (ПЭ 37-Л, 9160).
Для перорального применения лиофилизат в контейнере разбавляют водой в количестве 100±10 мл с образованием суспензии.
Конечное соотношение компонентов в лиофилизате представлено в таблице 1 «Состав лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата, количество компонентов в контейнере».
При изучении стабильности лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата испытания проводили в двух режимах: а) долгосрочное хранение - при температуре (5±3)°С; б) ускоренное хранение - при температуре (25±2)°С (метод «ускоренного старения»). Метод «ускоренного старения» (хранение при повышенной температуре) основан на зависимости скорости химической реакции от температуры в соответствии с правилом Вант-Гоффа: при повышении температуры на 10°С скорость химической реакции возрастает в 2-4 раза. Срок годности лекарственного средства (С) при температуре хранения (Тхр) рассчитывается по формуле (1):
где
С - срок годности, дней;
Сэ - экспериментальный срок годности, дней;
К - коэффициент соответствия, который рассчитывается по формуле (2):
где
А - температурный коэффициент скорости химической реакции (принимается равным 2);
Тэ - температура экспериментального хранения, °С;
Тхр - температура хранения, °С.
При пересчете срока годности методом ускоренного хранения при температуре (25±2)°С по формуле (1) срок хранения составляет 184 дня, что соответствует 2 годам хранения при температуре (5±3)°С. В процессе хранения образцы лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата контролировались по показателям качества, в числе которых: описание, растворимость, подлинность, показатель pH, размер частиц, суспендируемость, содержание воды, остаточные органические растворители, количественное определение, примеси (родственные соединения). Образцы лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата показали высокую стабильность в условия долгосрочного хранения при температуре (5±3)°С в течение 18 месяцев. Образцы лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата показали высокую стабильность в условия ускоренного хранения при температуре (25±2)°С в течение 184 дней, что соответствует 2 годам хранения при температуре (5±3)°С.
Для определения относительной биодоступности было проведено биофармацевтическое исследование лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата. Проведенное биофармацевтическое исследование выявило оптимизацию фармакокинетических параметров действия D-циклосерина при использовании лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата по сравнению с известным препаратом «Циклосерин», лекарственной формой которого являются капсулы для приема внутрь, что проявилось в увеличении периода полувыведения (Т1/2), среднего времени удерживания лекарственного вещества в организме (MRT), увеличении максимальной концентрации лекарственного вещества в крови (Cmax); снижении скорости элиминации (Kel) и клиренса (Cl.); возрастании площади под фармакокинетической кривой «концентрация - время» (AUC(0→36)) (примерно в 2 раза по сравнению с препаратом сравнения «Циклосерин»). Относительная биодоступность D-циклосерина из лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата по отношению к препарату сравнения «Циклосерин» составляет примерно 200%. Полученные данные свидетельствуют о более высокой биодоступности разработанного лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата и о более длительном нахождении D-циклосерина в кровяном русле в концентрациях достаточных для эффективного лечебного воздействия.
Заявленное изобретение иллюстрируется нижеследующими примерами.
Пример 1. Получение лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата.
В стеклянном флаконе вместимостью 20 мл растворяли 0.790 г D-циклосерина в 8 мл воды деионизированной (вода для инъекций) при перемешивании на магнитной мешалке при 500 об/мин и комнатной температуре в течение 30÷35 мин. В стеклянном реакторе с крышкой, вместимостью 100 мл растворяли 3.152 г полимера PLGA 50/50 (PURASORB PDLG 5004) в 45 мл (59.7 г) метилена хлористого (дихлорметана) при перемешивании на магнитной мешалке при комнатной температуре в течение 15÷20 мин. К полученному раствору полимера PLGA 50/50 постепенно добавляли раствор D-циклосерина (примерно 1 мл за 15÷20 с) при перемешивании (500 об/мин) на магнитной мешалке. Перемешивание смеси продолжали в течение 13÷15 мин. После этого магнит извлекали и проводили эмульгирование смеси при помощи погружного гомогенизатора IKA® Ultra-Turrax® Т-25 basic (ФРГ), оснащенного диспергирующим элементом (насадкой) S25N - 25F при 24 тыс. об/мин в режиме 3 раза по 0,5 мин с 2 перерывами по 0,5 мин. Температуру смеси поддерживали в пределах 18÷25°С, помещая реакционный сосуд в баню с охлаждающей водой. Полученную первичную эмульсию постепенно добавляли порциями по 4 мл к 0,5% раствору поливинилового спирта (ПВС) в количестве 154.00 г в пластиковом цилиндрическом сосуде вместимостью 1 л при интенсивном перемешивании на магнитной мешалке (700 об/мин) в течение 2÷3 мин. Смесь продолжали перемешивать в течение 13÷15 мин. Затем магнит извлекали и при помощи погружного гомогенизатора IKA® Ultra-Turrax® Т-25 basic, оснащенного диспергирующим элементом S25N - 25F, эмульгировали смесь при 24 тыс. об/мин в режиме 3 раза по 0.5 мин с 2 перерывами по 0,5 мин. Дополнительно проводили обработку полученной вторичной эмульсии ультразвуком с помощью гомогенизатора LABSONIC® U (В. Braun, США) мощностью 400 Вт при уровне энергии 305÷320 ед. (от максимума 370 ед.). Режим УЗ-обработки: 2 раза по 1 мин и 1,5 мин с перерывом 1 мин. Озвучивание проводили помощью зонда (∅ 19×70 мм) при охлаждении сосуда со смесью в бане с ледяной водой. Полученную эмульсию перегружали в круглодонную колбу вместимостью 2 л, остатки реакционной смеси из реакционного сосуда смывали туда же деионизированной водой (3 раза по 4 мл). Удаление органического растворителя дихлорметана проводили упариванием в вакууме с помощью роторного испарителя. Полученную суспензию фильтровали через стеклянный фильтр (пористость 40÷110 мкм) в круглодонную колбу вместимостью 0.25 л с приготовленным заранее раствором 1.54 г D-маннитола в 10 мл деионизированной воды. Для увеличения скорости фильтрования систему подключали к вакууму. Остатки суспензии из колбы для упаривания и с пористого фильтра смывали деионизированной водой (3 раза по 4 мл). Смесь фильтрата с D-маннитолом перемешивали с помощью магнитной мешалки в течение 8+10 мин. Полученную суспензию разливали поровну (по 63-67 г) стерильным дозатором (шприцем) в три предварительно подготовленные контейнеры вместимостью 125 мл из полиэтилентерефталата (ПЭТФ 37/20/125-Л, 2189). В качестве укупорочного средства для них использовали крышки, выполненные из полиэтилена (ПЭ 37-Л, 9160). Чистоту подготовленной тары контролировали микробиологически. Контроль равномерности наполнения контейнеров осуществляли с помощью весов (с точностью 0,01 г).
Наполненные контейнеры накрывали крышками и помещали для замораживания в камеру морозильника при температуре минус 40÷45°С на период от 10 до 18 ч. Контейнеры с замороженной суспензией помещали под колпак лиофильной сушилки на полку и проводили процесс лиофилизации при остаточном давлении 0.03÷0.1 мбар в течение 45÷48 ч. После окончания процесса высушивания контейнеры с лиофилизатом герметично укупоривали крышками. Проводили анализ продукта. Среднюю массу лиофилизата в контейнере контролировали весовым способом (она должна быть в пределах (2,00±0,20) г).
При этом содержание D-циклосерина в контейнере должно быть в пределах от 0,225 до 0,275 г. Для употребления препарат разбавляют водой в количестве 100±10 мл с образованием суспензии с наночастицами с размером не более 800 нм, составляющими не менее 90%. Средний размер частиц определялся методом динамического светорассеяния.
Пример 2. Изучение стабильности лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата.
Изучение стабильности лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата проводили в двух режимах: а) долгосрочное хранение - при температуре (5±3)°С; б) ускоренное хранение - при температуре (25±2)°С (метод «ускоренного старения»). Контроль показателей качества лекарственного препарата проводили на трех сериях (по 4 образца в каждой серии): при рекомендованных условиях хранения при температуре (5±3)°С - через каждые 6 месяцев, а при ускоренном хранении - через каждые 46 суток, что соответствовало 6 месяцам хранения при рекомендуемой температуре (5±3)°С. Для обеспечения условий долгосрочного хранения образцов использовали холодильник Maxicoldlab 2021 (LKB Branma, Швеция) с температурой внутри камеры (5±3)°С. Для обеспечения условий ускоренного хранения с поддержанием температуры (25±2)°С применяли термостат ТСН 100 (Чехословакия). Температуру в холодильнике и термостате контролировали еженедельно в течение всего срока хранения, поместив внутрь камер стеклянные ртутные термометры. В качестве тары для хранения образцов использовались пластиковые банки из полиэтилентерефталата, укупоренные крышками из полиэтилена (вместимость 125 мл). В процессе хранения образцы контролировались по показателям качества, в числе которых были описание, растворимость, подлинность, показатель рН, размер частиц, суспендируемость, содержание воды, остаточные органические растворители, количественное определение, примеси (родственные соединения). По достижении контрольного срока хранения контейнер с образцом для остановки процесса «старения» помещался в морозильник с температурой -70°С (Ultra-Low Temperature Freezer MDF-382AT Sanyo, Япония) до начала проведения аналитических работ (август-октябрь 2014 г.). Перед проведением анализа контейнер с образцом нагревался на воздухе до комнатной температуры. Результаты анализа образцов после истечения контрольных сроков в условиях долгосрочного и ускоренного хранения приведены в таблице 2 «Результаты исследования показателей качества образцов лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата. в условиях ускоренного хранения при температуре (25±2)°С» и Таблице 3 «Результаты исследования показателей качества образца лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата в условиях долгосрочного хранения при температуре (5±3)°С».
Пример 3. Исследование биодоступности лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата.
Для определения относительной биодоступности было проведено биофармацевтическое исследование лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата на 2-х видах животных: на крысах популяции Wistar и кроликах породы Серый великан. Биофармацевтические исследования проведены в сравнении с известным препаратом «Циклосерин», лекарственной формой которого являются капсулы для приема внутрь. Исследование проводилось при однократном внутрижелудочном введении (в/ж) препаратов, путем измерения концентрации D-циклосерина в сыворотке крови крыс через 0.5, 1, 2, 4, 6, 8, 10, 24, 36 часов после введения методом ВЭЖХ, расчета фармакокинетических параметров по полученным фармакокинетическим кривым и оценки относительной биодоступности полимерной лекарственного препарата. Минимальная из выбранных доз (1 ТД) близка к терапевтической дозе, рекомендуемой для клинического изучения - 0.25 мг/сут. Вторая из выбранных доз (3 ТД) соответствует нижнему уровню из диапазона максимальных суточных доз, при которой возможны эффекты передозировок - 0.75÷1 г/сут. Третья выбранная доза - промежуточная, 2 ТД. При пересчете этих доз, в соответствии с правилами межвидового переноса дозировок с человека на крысу и кролика, получили величину 1 ТД=22 мг/кг (по действующему веществу циклосерину) для крысы и величины 1 ТД=10 мг/кг, 2 ТД=20 мг/кг и 3 ТД=30 мг/кг (по действующему веществу циклосерину) для кролика. Для количественного определения концентрации D-циклосерина в биологических образцах был выбран метод ВЭЖХ с тандемным масс-спектрометрическим детектированием (MS/MS). Предварительно проводили хроматографический анализ модельных растворов стандартного образца D-циклосерина в сыворотке крови крыс. Полученные экспериментальные данные хроматографического анализа модельных растворов стандартного образца D-циклосерина в сыворотке крови крыс были подвергнуты математической статистической обработке с помощью программы «Origin 8.5». По полученным значениям строили калибровочный график и определяли линейность калибровочной кривой в диапазоне анализируемых концентраций по среднему коэффициенту корреляции. Калибровочная кривая описывается уравнением: S = 627.093 Сх + 323.863 (где S - площадь пика; Сх - концентрация циклосерина, мкг/мл). Линейность калибровочной кривой в диапазоне концентраций 0.5÷30.0 мкг/мл циклосерина сыворотки демонстрируется средними коэффициентами корреляции г = 0,9971. После однократного внутрижелудочного введения исследуемого препарата и препарата сравненя в дозе 1 ТД (22 мг/кг по действующему веществу циклосерину) проводили измерение концентрации D-циклосерина в сыворотке крови крыс (в контрольной пробе до введения препаратов и через 0.5, 1, 2, 4, 6, 8, 10, 24, 36 часов после введения) строили фармакокинетические кривые и рассчитывали фармакокинетические параметры по полученным фармакокинетическим кривым. В таблицах 4 и 5 приведены рассчитанные по полученным кривым фармакокинетические параметры Tmax; Cmax; AUC(0→36); Cl.; T1/2; kel; MRT; Vd и отношение Cmax/AUC(0→36), отражающие степень, скорость всасывания распределения и элиминацию D-циклосерина при применении изучаемых препаратов и позволяющие оценить относительную биодоступность исследуемого препарата.
В Таблице 4 даны значения фармакокинетических параметров лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата после однократного перорального введения крысам в дозе 1 ТД, 22 мг/кг. В Таблице 5 приведены значения фармакокинетических параметров лекарственного препарата противотуберкулезного действия на основе D-циклосерина в виде лиофилизата после однократного перорального введения кроликам в дозах 1 ТД, 10 мг/кг, 2 ТД, 20 мг/кг и 3 ТД, 30 мг/кг.
В исследованиях противотуберкулезной активности разработанного препарата препарата было установлено, что препарат обладает бактериостатической активностью в отношении М. tuberculosis штамма H37Rv на острой модели генерализованного туберкулеза in vivo на мышах линии BALB/c и аутбредных морских свинках-альбиносах. Следует отметить расширение диапазона терапевтических доз разработанного лекарственного препарата - все использованные дозы от 1 ТД до 6 ТД оказались эффективными, тогда как в случае препарата сравнения «Циклосерина» эффективной была доза 6 ТД, эффект от применения которой был сравним с эффектом лечения разработанным лекарственным препаратом в дозе 1 ТД (эффективность выросла в 6 раз).
В исследовании нейротоксического воздействия разработанного препарата в тесте по оценке ориентировочно-исследовательской активности (тест «открытое поле») и тесте по определению суммационно-порогового потенциала на крысах было установлено, что введение разрабатываемого препарата не сопровождалось изменениями поведения в тесте «открытое поле» и изменением суммационно-порогового показателя в отличие от препарата сравнения «Циклосерина», введение которого сопровождалось нейротоксическими проявлениями в данных тестах.
Таким образом, по совокупности всех полученных результатов испытаний лекарственный препарат, содержащий D-циклосерин, полимер PLGA 50/50, поливиниловый спирт, D-маннитол, выполненный в виде дозированного по 2.0±0.20 г лиофилизата, который при разбавлении водой образует суспензию частиц с размером не более 800 нм, характеризуется высокой стабильностью при длительном хранении (не менее 18 месяцев), повышенной биодоступностью при пероральном применении, а также обладает высокой противотуберкулезной активностью, расширенным диапазоном терапевтических доз, сниженной побочной токсичностью, что свидетельствует об увеличении терапевтического индекса для разработанного лекарственного препарата.
Источники информации
1. Патент РФ №2318513 на изобретение «Лекарственное средство на основе d-циклосерина, препарат пролонгированного действия, содержащий наночастицы, способ его получения », опубл. 10.03.2008.
2. Da Silva, Р.Е.А.; Palomino, J.C. Molecular basis and mechanisms of drug resistance in Mycobacterium tuberculosis: classical and new drugs // J. Antimicrob. Chemother. - 2011. - Vol. 66. - P. 1417-1430.
3. «Инструкция по унифицированным методам микробиологических исследований при выявлении, диагностике и лечении туберкулеза» Приложение №11 к приказу Минздрава России от 21.03.2003 №109.
4. Inderlied, С.В.; Kemper, С.А. and Bermudez, L.E.M. The Mycobacterium avium complex // Clin. Microbiol. Rev. - 1993. - Vol. 6. - P. 266-310.
5. Lambert, M.P. and Neuhaus, F.C. Mechanism of D-cycloserine action: alanine racemase from Escherichia coli // W.J. Bacteriol. - 1972. - Vol. 110 - P. 978-987.
6. Машковский, М.Д. Лекарственные средства [Текст] / Машковский М.Д. // В двух частях. - 12-е изд., перераб. - М.: - Медицина, 1993. - С. 381-382.
7. Патент РФ №2248205 на изобретение «Лекарственное средство в виде желатиновой капсулы», опубл. 20.03.2005.
8. Патент РФ №103473 на изобретение «Фармацевтическая капсула противотуберкулезного действия» опубл. 20.04.2011.
9. Du Toit, L.C.; Pillay, V. and Danckwerts, M.P. Tuberculosis chemotherapy: current drug delivery approaches // Respiratory Research. - 2006. - Vol. 7. - P. 118.
10. Sosnik, A.; Carcaboso, A.; Glisoni, R.; Moretton, M.; Chiappetta, D. New old challenges in tuberculosis: Potentially effective nanotechnologies in drug delivery // Advanced Drug Delivery Reviews. - 2010. - Vol. 62. - P. 547-559.
11. Ranjita, S.; Loaye, S.; Khalil, M. Present status of nanoparticle research for treatment of tuberculosis // J. Pharm. Pharmaceut. Sci. - 2011. - Vol. 14(1). - P. 100-116.
12. Mathuria, J. Nanoparticles in tuberculosis diagnosis, treatment and prevention // Journal of Nanomaterials and Biostructures. - 2009. - Vol. 4(2). - P. 309-321.
13. Патент РФ №2 327459 на изобретение «Лекарственное средство противомикробного действия, способ получения лекарственного препарата направленного действия, содержащего наночастицы», опубл. 27.06.2008.
14. Патент РФ №2403041 на изобретение «Лекарственное средство пролонгированного действия с дозированным высвобождением в органы-мишени на основе d-циклосерина для лечения резистентных форм туберкулеза», опубл. 10.11.2010.
1. Лекарственный препарат противотуберкулезного действия в виде лиофилизата для перорального применения массой 2.0±0.20 г, содержащий D-циклосерин 12.5±1.25 мас.%, полимер PLGA 50/50 50±5.0, мас.%, поливиниловый спирт 12.5±1.25 мас.% и D-маннитол 25±2.5 мас.%, с содержанием D-циклосерина от 0.225 до 0.275 г, который при разбавлении водой в количестве 100±10 мл образует суспензию частиц с размером не более 800 нм, составляющих не менее 90%.
2. Лекарственный препарат по п. 1, отличающийся тем, что используют полимер PLGA 50/50 со средним значением характеристической вязкости 0,41 см3/г.
3. Способ получения лекарственного препарата по п. 1, заключающийся в смешивании водного раствора D-циклосерина с раствором PLGA 50/50 в органическом растворителе дихлорметане с последующим эмульгированием смеси с получением первичной эмульсии, добавлении полученной первичной эмульсии к водному раствору поливинилового спирта с последующим эмульгированием с получением вторичной эмульсии, удалении органического растворителя с получением суспензии, фильтровании суспензии, смешивании суспензии с водным раствором D-маннитола с последующим ее замораживанием и лиофилизацией, при этом при эмульгировании с получением вторичной эмульсии проводят ультразвуковую обработку, перед замораживанием суспензию дозируют в контейнеры равными порциями по 63-67 г для получения конечного лиофилизата массой 2.0±0.20 г, замораживание суспензии проводят при температуре минус 40÷45°С в течение от 10-18 часов, лиоф