Эмульсии типа "масло в воде", которые содержат нуклеиновые кислоты
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается иммуногенной катионной эмульсии типа «масло в воде», включающей эмульсионные частицы, содержащие масляную сердцевину и катионный липид, и молекулу нуклеиновой кислоты, образующую комплекс с эмульсионными частицами, где средний диаметр эмульсионных частиц составляет от приблизительно 80 нм до приблизительно 150 нм, а отношение N/P в этой эмульсии составляет от приблизительно 4:1 до приблизительно 20:1. Группа изобретений также касается способа получения указанной иммуногенной катионной эмульсии типа «масло в воде»; применения указанной иммуногенной катионной эмульсии типа «масло в воде» в получении иммунного ответа у пациента. Группа изобретений обеспечивает улучшенную иммуногенность частиц катионной эмульсии. 4 н. и 23 з.п. ф-лы, 5 ил., 6 табл., 4 пр.
Реферат
Родственные заявки
По этой заявке испрашивается приоритет временной заявки на патент США № 61/505091, поданной 6 июля 2011, и временной заявки на патент США № 61/585639, поданной 11 января 2012, каждая из которых полностью включена в настоящее описание посредством ссылки.
Список последовательностей
Настоящая заявка включает список последовательностей, который представлен в формате ASCII на сайте EFS-Web и полностью включен в настоящее описание посредством ссылки. Указанная копия ASCII была создана 5 июля, 2012, под именем PAT054719.txt и имеет размер 32421 байт.
Предшествующий уровень техники
Терапевтические нуклеиновые кислоты являются перспективными для лечения как наследственных, так и приобретенных заболеваний, таких как рак, инфекционные заболевания (СПИД), болезнь сердца, артрит и нейродегенеративные расстройства (например, болезни Паркинсона и Альцгеймера). Для устранения дефицита определенных генов или индуцирования экспрессии продуктов экзогенных генов могут быть введены не только функциональные гены, но также и нуклеиновые кислоты, которые могут ингибировать экспрессию эндогенных генов и, тем самым, продуцировать терапевтический эффект. Ингибирование экспрессии генов может опосредоваться, например, антисмысловыми олигонуклеотидами, двухцепочечными РНК (например, киРНК, миРНК) или рибозимами.
Ключевой стадией такой терапии является доставка молекул нуклеиновой кислоты в клетки in vivo. Однако, доставка молекул нуклеиновой кислоты in vivo, а в частности, молекул РНК, связана с рядом технических проблем. Во-первых, из-за присутствия клеточных и сывороточных нуклеаз, время полужизни РНК, инъецируемой in vivo, приблизительно составляет только 70 секунд (см., например, Kurreck, Eur. J. Bioch. 270: 1628-44 (2003)). Были предприняты попытки повысить стабильность инъецируемой РНК путем введения химических модификаций, однако, в некоторых случаях, химические модификации могут приводить к усилению цитотоксических эффектов или к потере или к снижению ее функций. В одном конкретном примере, клетки являются чувствительными к дозам иРНК-дуплекса, в котором каждый второй фосфат был заменен фосфортиоатом (Harborth, et al., Antisense Nucleic Acid Drug Rev. 13(2): 83-105 (2003)). Поэтому, необходимо разработать такие системы доставки, которые позволяли бы вводить молекулы нуклеиновой кислоты (а в частности, молекулы РНК) в количестве, достаточном для вырабатывания терапевтического ответа in vivo, но не токсичном для хозяина.
Вакцины на основе нуклеиновых кислот являются привлекательным средством для вакцинации. Так, например, внутримышечная (i.m.) иммунизация плазмидной ДНК, кодирующей антиген, может индуцировать клеточный и гуморальный иммунные ответы и защищать от заражения. ДНК-вакцины имеют ряд преимуществ по сравнению с традиционными вакцинами, полученными на основе белковых антигенов или аттенуированных патогенов. Так, например, по сравнению с белковыми вакцинами, ДНК-вакцины могут оказаться более эффективными для продуцирования антигена, имеющего правильную сборку в его нативной конформации, и для вырабатывания клеточного иммунного ответа. ДНК-вакцины также не создают каких-либо проблем в отношении безопасности, которые обычно связаны с «убитыми» или аттенуированными патогенами. Так, например, препарат на основе нейтрализованного вируса может содержать остаточные «живые» вирусы, а аттенуированный вирус может мутировать и изменять свой патогенный фенотип.
Другие ограничения применения вакцин на основе нуклеиновых кислот заключаются в том, что для вырабатывания сильных иммунных ответов у приматов, не являющихся человеком, и у человека, требуются, в основном, высокие дозы нуклеиновой кислоты. Поэтому, для повышения активности вакцин на основе нуклеиновых кислот могут потребоваться определенные системы доставки и адъюванты. Для введения молекул нуклеиновых кислот в клетки были разработаны различные методы, такие как трансфекция фосфатом кальция, трансфекция полипреном, слияние протопластов, электропорация, микроинжекция и липофекция.
Катионные липиды широко применяются в виде липосом для доставки генов в клетки. Однако, даже небольшое количество сыворотки (~10%) может резко снижать трансфекционную активность комплексов «липосома/ДНК», поскольку сыворотка содержит анионные соединения. Недавно была получена эмульсия на основе катионных липидов для доставки молекул ДНК в клетки. См., например, Kim, et al., International Journal of Pharmaceutics, 295, 35-45 (2005).
В патентах США №№ 6753015 и 6855492 описан метод доставки молекул нуклеиновой кислоты позвоночным с использованием катионных микрочастиц. Эти микрочастицы содержат полимер, такой как поли(α-гидроксикислота), полигидроксимасляная кислота, поликапролактон, полиортоэфир, полиангидрид и т.п., и были получены с использованием катионных поверхностно-активных веществ. Молекулы нуклеиновой кислоты адсорбируются на поверхностях этих микрочастиц.
В публикациях Kim et al. (Pharmaceutical Research, vol. 18, pages 54-60, 2001) и Chung et al. (Journal of Controlled Release, volume 71, pages 339-350, 2001) описаны различные препараты, полученные в виде эмульсий типа «масло в воде», которые используются для повышения эффективности трансфекции молекул ДНК in vitro и in vivo.
В публикации Ott et al. (Journal of Controlled Release, volume 79, pages 1-5, 2002) описан метод получения катионной субмикронной эмульсии, которая может быть использована в качестве системы доставки ДНК/адъюванта. Способ применения субмикронной эмульсии основан на использовании MF59, то есть, активного адъюванта, такого как сквален в воде, который изготавливается промышленностью и используется для приготовления коммерчески доступного и разрешенного к применению продукта (Fluad®). Для облегчения внутриклеточной доставки плазмидной ДНК используется 1,2-диолеоил-3-триметиламмоний-пропан (DOTAP).
Хотя вакцины на основе ДНК являются в высокой степени перспективными средствами для предупреждения и лечения заболеваний, однако, обычно, их применение связано с некоторыми проблемами безопасности. Введенные молекулы ДНК могут интегрироваться в геном хозяина, либо, они могут вызывать нежелательную длительную экспрессию антигенов, что обусловлено распределением этих молекул в различных тканях. Кроме того, некоторые ДНК-вирусы могут быть также использованы в качестве носителя для доставки молекул ДНК. Такие вирусы, благодаря их инфекционным свойствам, имеют очень высокую скорость трансфекции. Используемые вирусы генетически модифицируют так, чтобы в трансфицированной клетке не образовывались функциональные инфекционные частицы. Однако, несмотря на такие меры предосторожности, все же нельзя полностью исключить риск неконтролируемой репликации введенных генов и вирусных генов, что, например, обусловлено, потенциальными событиями рекомбинации. Это также повышает риск встраивания ДНК в интактный ген генома клетки-хозяина, например, посредством рекомбинации, в результате чего этот ген может мутировать и тем самым полностью или частично инактивироваться, либо он может давать ошибочную информацию. Другими словами, синтез генного продукта, который является жизненно важным для клетки, может полностью ингибироваться или, альтернативно, при таком синтезе может экспрессироваться модифицированный или нерелевантный генный продукт. Кроме того, это создает определенные трудности при изготовлении и очистке клинически ценных вирусных векторов в промышленных масштабах.
Особенно высокий риск возникает в том случае, когда ДНК интегрируется в ген, ответственный за регуляцию клеточного роста. В этом случае, клетка-хозяин может разрушаться, что будет приводить к развитию рака или к образованию опухоли. Кроме того, если ДНК, введенная в клетку, экспрессируется, то необходимо, чтобы соответствующий ДНК-носитель содержал сильный промотор, такой как вирусный промотор на основе CMV. Интеграция таких промоторов в геном обработанной клетки может приводить к нежелательным изменениям регуляции экспрессии гена в клетке. Другой риск, связанный с применением ДНК в качестве агента для индуцирования иммунного ответа (например, в качестве вакцины), заключается в вырабатывании патогенных анти-ДНК антител у пациента, которому вводят чужеродную ДНК, что приводит к нежелательному иммунному ответу.
Молекулы РНК, кодирующие антиген или его производное, могут быть также использованы в качестве вакцин. РНК-вакцины имеют ряд преимуществ по сравнению с ДНК-вакцинами. Во-первых, РНК не может интегрироваться в геном хозяина, что предотвращает риск развития злокачественных заболеваний. Во-вторых, из-за быстрого разложения РНК, экспрессия чужеродного трансгена часто происходит за короткий промежуток времени, что позволяет избежать длительной нерегулируемой экспрессии антигена. В-третьих, для достижения экспрессии кодируемого антигена, молекулы РНК должны доставляться лишь в цитоплазму, тогда как молекулы ДНК должны проникать через ядерную мембрану.
Тем не менее, по сравнению с вакцинами на основе ДНК, вакцинам на основе РНК уделяется относительно мало внимания. РНК и олигонуклеотиды представляют собой гидрофильные, отрицательно заряженные молекулы, которые являются в высокой степени восприимчивыми к разложению нуклеазами при введении этих молекул в качестве терапевтических средств или вакцин. Кроме того, РНК и олигонуклеотиды не могут активно транспортироваться в клетки. См., например, Vajdy, M., et al., Mucosal adjuvants and delivery systemsfor protein-, DNA- and RNA-based vaccines, Immunol Cell Biol, 2004. 82(6): p. 617-27.
В публикации Ying et al. (Nature Medicine, vol. 5, pages 823-827, 1999) описана вакцина на основе аутореплицирующейся РНК, в которую была введена «оголенная» РНК, кодирующая β-галактозидазу, и имеются также сообщения об индуцировании CD8+-клеток.
В публикации Montana et al. (Bioconjugate Chem. 2007, 18, pages 302-308) описано применение катионных твердых липидных наночастиц в качестве РНК-носителей для переноса генов. Было обнаружено, что твердые липидные наночастицы защищают молекулу РНК от разложения, а экспрессия репортерного белка (флуоресцеина) может быть детектирована после микроинжекции комплекса «РНК-частица» в яйца морского ежа.
В WO 2010/009277 описаны наночастицы на основе липидных пептидов (NLPPs), содержащие (a) амфипатический пептид, (b) липид и (c) по меньшей мере одну иммуногенную молекулу. В некоторых вариантах изобретения NLPP также включают положительно заряженный «агент для захвата», такой как катионный липид. Агент для захвата используется для заякоривания отрицательно заряженных иммуногенных молекул (например, молекулы ДНК или молекулы РНК). Для получения NLPP требуются амфипатические пептиды, используемые для солюбилизации липидного компонента и для образования наночастиц.
Поэтому необходимо разработать системы доставки молекул нуклеиновой кислоты. Такие системы доставки могут быть использованы для приготовления вакцин на основе нуклеиновой кислоты, а в частности, вакцин на основе РНК.
Сущность изобретения
В общих чертах, настоящее изобретение относится к катионным эмульсиям типа «масло в воде», в которых молекула нуклеиновой кислоты образует комплекс с эмульсионными частицами. Эти эмульсии могут быть использованы для доставки молекул нуклеиновой кислоты, таких как молекула РНК, в клетки. Эмульсионные частицы содержат масляную сердцевину и катионный липид. Катионный липид может взаимодействовать с отрицательно заряженной молекулой, что будет приводить к заякориванию молекулы с эмульсионными частицами. Эмульсионные частицы имеют средний диаметр приблизительно от 80 нм до 180 нм, а эмульсия имеет отношение N/P, составляющее по меньшей мере 4:1.
В некоторых вариантах изобретения эмульсионные частицы имеют средний диаметр приблизительно от 80 нм до 180 нм, а эмульсия имеет отношение N/P, составляющее по меньшей мере 1,1:1, по меньшей мере 1,5:1, по меньшей мере 2:1, по меньшей мере 2,5:1, по меньшей мере 3:1 или по меньшей мере 3,5:1.
Настоящее изобретение относится к иммуногенной катионной эмульсии типа «масло в воде», включающей эмульсионные частицы, содержащие масляную сердцевину и катионный липид, и молекулу нуклеиновой кислоты, образующую комплекс с эмульсионными частицами, где средний диаметр эмульсионных частиц составляет приблизительно от 80 нм до 180 нм, а отношение N/P в этой эмульсии составляет по меньшей мере 4:1, при условии, что указанная молекула нуклеиновой кислоты не кодирует секретированную щелочную фосфатазу, и при условии, что такая молекула нуклеиновой кислоты не является молекулой РНК, кодируемой плазмидой A317, последовательность которой представлена на фиг. 7A заявки на патент США № 61/361892. В некоторых своих вариантах настоящее изобретение также включает условие, при котором молекула нуклеиновой кислоты не кодирует белковый антиген RSV F, и/или дополнительное условие, при котором молекула нуклеиновой кислоты не кодирует белок RSV. При этом, предпочтительно, чтобы молекула нуклеиновой кислоты кодировала антиген и представляла собой молекулу РНК, такую как аутореплицирующаяся РНК.
Иммуногенная катионная эмульсия типа «масло в воде» может быть забуферена (например, цитратным буфером, сукцинатным буфером, ацетатным буфером) и имеет pH приблизительно от 6,0 до 8,0, а предпочтительно, приблизительно от 6,2 до 6,8. При этом, иммуногенная катионная эмульсия типа «масло в воде» может, но необязательно, дополнительно содержать неорганическую соль в концентрации, предпочтительно, не превышающей 30 мM. Альтернативно или дополнительно, иммуногенная катионная эмульсия типа «масло в воде» также содержит неионный агент, придающий тоничность, такой как сахар, спирт ряда сахаров или их комбинации, и/или полимер, такой как полоксамер в водной фазе. Количество полимера, если он присутствует, может составлять приблизительно от 0,05% до 20% (масс/об). В некоторых вариантах изобретения иммуногенная катионная эмульсия типа «масло в воде» является изотонической. В других вариантах изобретения иммуногенные катионные эмульсии типа «масло в воде» являются гипотоническими или гипертоническими.
В некоторых вариантах изобретения масляная сердцевина эмульсионных частиц содержит масло, выбранное из группы, состоящей из касторового масла, кокосового масла, кукурузного масла, масла семян хлопчатника, масла ипомеи, рыбьего жира, масла жожобы, лярда, льняного масла, оливкового масла, арахисового масла, сафлорового масла, кунжутного масла, соевого масла, сквалена, сквалана, подсолнечного масла, масла грушанки и их комбинаций. В конкретных вариантах изобретения масляной сердцевиной является сквален. Катионный липид может быть выбран из группы, состоящей из l,2-диолеоилокси-3-(триметиламмоний)пропана (DOTAP), 3β-[N-(N',N'-диметилaминоэтан)карбамоил]холестерина (холестерина DC), диметилдиоктадециламмония (DDA), 1,2-димиристоил-3-триметиламмонийпропана (DMTAP), дипальмитоил(C16:0)триметил аммонийпропана (DPTAP), дистеароилтриметиламмонийпропана (DSTAP), хлорида N-[l-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA), хлорида N,N-диолеоил-N,N-диметиламмония (DODAC), l,2-диолеоил-sn-глицеро-3-этилфосфохолина (DOEPC), l,2-диолеоил-3-диметиламмонийпропана (DODAP), l,2-дилинолеилокси-3-диметиламинопропана (DLinDMA), липидов E0001-E0118 и их комбинаций. В предпочтительном варианте изобретения катионным липидом является DOTAP.
Эмульсионные частицы могут также включать поверхностно-активное вещество, такое как неионное поверхностно-активное вещество. Предпочтительно, чтобы такое поверхностно-активное вещество не являлось полиэтиленгликолем (ПЭГ)-липидом. Поверхностно-активное вещество может присутствовать в количестве приблизительно от 0,01% до 2,5% (масс./об.). В некоторых вариантах изобретения поверхностно-активным веществом является SPAN85 (сорбитантриолеат), твин 80 (полисорбат 80) или их комбинация. В некоторых вариантах изобретения эмульсия типа «масло в воде» содержит равные количества SPAN85 (сорбитантриолеата), твина 80 (полисорбата 80), например, 0,5% (масс./об.) каждой частицы также содержит поверхностно-активное вещество.
Настоящее изобретение также относится к способу получения иммуногенной катионной эмульсии типа «масло в воде», включающей эмульсионные частицы, содержащие масляную сердцевину и катионный липид, и молекулу нуклеиновой кислоты, образующую комплекс с эмульсионными частицами, где средний диаметр эмульсионных частиц составляет приблизительно от 80 нм до 180 нм, а отношение N/P в этой эмульсии составляет по меньшей мере 4:1, при условии, что указанная молекула нуклеиновой кислоты не кодирует секретированную щелочную фосфатазу, и при условии, что такая молекула нуклеиновой кислоты не является молекулой РНК, кодируемой плазмидой A317, последовательность которой представлена на фиг. 7A заявки на патент США № 61/361892. Указанный способ включает получение (i) катионных эмульсий типа «масло в воде», содержащих эмульсионные частицы, которые включают описанную здесь масляную сердцевину и катионный липид, и (ii) водный раствор, содержащий нуклеиновую кислоту, и объединение стадий (i) и (ii) с образованием указанной иммуногенной катионной эмульсии типа «масло в воде».
Настоящее изобретение также относится к способу продуцирования иммунного ответа у индивидуума, где указанный способ включает введение указанному индивидууму эффективного количества описанной здесь иммуногенной катионной эмульсии типа «масло в воде».
Краткое описание графического материала
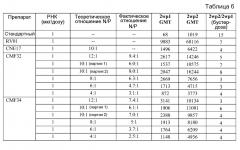
На фиг. 1A представлены результаты in vivo анализа на SEAP, проводимого с использованием 1 мкг РНК-репликона vA306, образующего комплекс с CNE17 в отношении N:P=10:1 На фиг. 1В представлены общие титры IgG у мышей BALB/c через две недели после 1-ой иммунизации (2wp1) и через две недели после 2-ой иммунизации (2wp2) РНК-репликоном A317, который кодирует белок RSV F и образует комплекс с CNE17. Эти данные показали, что по мере увеличения размера частиц, уровень экспрессии SEAP снижается и снижается иммунный ответ на белок RSV F.
На фиг. 2A-2C проиллюстрировано влияние образования РНК-комплекса и различных составов буфера на размер частиц. На фиг. 2A показано, что образование РНК-комплекса приводит к увеличению размера частиц в эмульсии CNE17, и что присутствие сахара и/или низкой концентрации соли (NaCl, 10 мМ) приводит к уменьшению размера частиц. Добавление плюроника F127 приводит к снижению размера частиц до их размера перед образованием комплекса. На фиг. 2В проиллюстрировано влияние цитратного буфера на размер частиц. На фиг. 2С проиллюстрировано влияние полимеров на размер частиц.
Подробное описание изобретения
1. Общий обзор
В общих чертах, настоящее изобретение относится к катионным эмульсиям типа «масло в воде», в которых молекула нуклеиновой кислоты образует комплекс с эмульсионными частицами, где указанные эмульсионные частицы имеют средний диаметр приблизительно от 80 нм до 180 нм, а отношение N/P в этой эмульсии составляет по меньшей мере 4:1. Эмульсионные частицы содержат масляную сердцевину и катионный липид. Катионный липид может взаимодействовать с отрицательно заряженной молекулой, что будет приводить к заякориванию молекулы на эмульсионных частицах. Указанные эмульсии могут быть использованы для доставки молекул нуклеиновой кислоты, таких как молекула РНК, в клетки.
Настоящее изобретение основано на обнаружении того факта, что при введении индивидууму катионной эмульсии типа «масло в воде», содержащей антиген-кодирующую молекулу РНК, на иммунный ответ, вырабатываемый против кодируемого РНК-антигена, влияют на свойства данной эмульсии, включая средний диаметр эмульсионных частиц и количество РНК, образующей комплекс с эмульсионными частицами (то есть, отношение N/P). Авторами настоящего изобретения было определено, что средний диаметр эмульсионных частиц увеличивается в случае образования комплекса молекул РНК с эмульсией, и что частицы большого диаметра способствуют снижению нейтрализующих титров. Эмульсии, в которых средний диаметр частиц составляет приблизительно от 80 нм до 180 нм, дают хорошие нейтрализующие титры. Но даже в этом интервале значений, эмульсии с частицами, имеющими средний диаметр, равный верхнему предельному значению данного интервала, являются менее предпочтительными, а особенно предпочтительным является средний размер частиц приблизительно 100 нм. Также предпочтительным является средний диаметр частиц, составляющий приблизительно от 100 нм до 130 нм. Авторами настоящего изобретения было неожиданно обнаружено, что иммунный ответ прямо пропорционально не зависит от количества РНК, образующей комплекс с эмульсией. Отношение N/P=4:1 дает хороший иммунный ответ на кодируемый антиген, однако, более высокие отношения N/P необязательно будут давать более высокие нейтрализующие титры.
В случае образования комплексов молекул РНК с эмульсией, средний диаметр частиц катионной эмульсии типа «масло в воде» увеличивается. Этот эффект может быть снижен путем введения в эмульсию неорганических солей. Однако, неорганические соли могут ингибировать связывание молекул нуклеиновой кислоты с эмульсионными частицами, а поэтому неорганическая(ие) соль(и) должна(ы) присутствовать лишь в небольших концентрациях (например, не более, чем приблизительно 30 мМ). При желании, для уменьшения размера частиц, возрастание которого связано с образованием комплекса нуклеиновой кислоты, могут быть использованы гидрофильные полимеры. Однако, и в этом случае, гидрофильные полимеры могут ингибировать связывание молекул нуклеиновой кислоты с эмульсионными частицами, а поэтому гидрофильный(е) полимер(ы) должен(ны) присутствовать лишь в небольших концентрациях (например, приблизительно от 0,05% до 20% (масс./об.)).
Катионные эмульсии типа «масло в воде», содержащие молекулу РНК, кодирующую антиген, могут быть введены индивидууму для индуцирования иммунного ответа на кодируемый антиген. При использовании катионных эмульсий типа «масло в воде» в этих целях, предпочтительно, чтобы такие эмульсии были изотоническими. Однако, поскольку неорганические соли могут ингибировать связывание молекул нуклеиновой кислоты с эмульсионными частицами, то тоничность эмульсии должна быть, предпочтительно, скорректирована путем добавления неионного агента, придающего тоничность. В предпочтительных вариантах изобретения катионные эмульсии типа «масло в воде», содержащие молукулу РНК, доводят до концентрации, составляющей от 250 мОсм/кг воды до приблизительно 320 мОсм/кг, с использованием сахара, спирта ряда сахаров или их комбинаций.
2. Определения
При употреблении артиклей «a», «an» и «the» с существительными в единственном числе подразумевается, что эти существительные могут означать множество объектов, если это не оговорено особо.
Используемый здесь термин «приблизительно» относится к величине, имеющей значение ± 10% от исходной величины.
Термин «поверхностно-активное вещество» известен специалистам и обычно означает любую молекулу, имеющую гидрофильную группу (например, полярную группу), энергетически предпочитаемой реакцией которой является сольватация с водой, и гидрофобную группу, плохо вступающую в реакцию сольватации с водой. Термин «неионное поверхностно-активное вещество» известен специалистам, и обычно означает молекулу поверхностно-активного вещества, у которого гидрофильная группа (например, полярная группа) не является электростатически заряженной.
Термин «полимер» означает молекулу, состоящую из отдельных химических групп, которые могут быть одинаковыми или различными, и которые связаны друг с другом. Используемый здесь термин «полимер» означает отдельные химические группы, которые присоединяются последовательно «друг к другу» с образованием молекулы с прямой цепью, а также отдельные химические группы, которые соединены друг с другом в форме разветвленной структуры (например, в «сверхразветвленной» или «звездообразной» форме). Репрезентативными полимерами являются, например, полоксамеры. Полоксамеры представляют собой неионные триблоксополимеры, имеющие центральную гидрофобную цепь полиоксипропилена (полипропиленоксида), фланкированную двумя гидрофильными цепями полиоксиэтилена (полиэтиленоксида).
Термин «буфер» означает водный раствор, устойчивый к изменениям pH раствора.
Используемые здесь термины «нуклеотидный аналог» или «модифицированный нуклеотид» означают нуклеотид, который содержит одну или более химических модификаций (например, замен) внутри или на поверхности азотистого основания нуклеозида (например, цитозина (C), тимина (T) или урацила (U)), аденина (A) или гуанина (G)). Нуклеотидный аналог может содержать дополнительные химические модификации внутри или на поверхности сахарной группы нуклеозида (например, рибозы, дезоксирибозы, модифицированной рибозы, модифицированной дезоксирибозы, шестичленного аналога сахаров или аналога сахаров с незамкнутой цепью) или фосфата.
Используемый здесь термин «сахарид» включает моносахариды, олигосахариды или полисахариды, имеющие прямую или кольцевую форму или их комбинацию и образующие сахаридную цепь. Олигосахаридами являются сахариды, имеющие два или более моносахаридных остатков. Примерами сахаридов являются глюкоза, мальтоза, мальтотриоза, мальтотетраоза, сахароза и трегалоза.
Термины «аутореплицирующаяся РНК», «РНК-репликон» или «РНК-вектор» известны специалистам и, по существу, означают молекулу РНК, способную регулировать свою собственную амплификацию или «ауторепликацию» in vivo обычно в клетке-мишени. РНК-репликон используется непосредственно, то есть, при этом, не требуется введения ДНК в клетку и ее транспорта в ядро, в котором происходит транскрипция. При использовании РНК-вектора для прямой доставки в цитоплазму клетки-хозяина, автономная репликация и трансляция гетерологичной последовательности нуклеиновой кислоты происходят достаточно эффективно. Запускаемая альфавирусом система ауторепликации РНК может содержать следующие компоненты в соответствующем порядке: вирусную 5'-последовательность, необходимую для in cis репликации (также обычно обозначаемую 5'-CSE); последовательности, которые, при их экспрессии, кодируют биологически активные неструктурные белки альфавируса (например, nsP1, nsP2, nsP3, nsP4); вирусные 3'-последовательности, необходимые для in cis репликации (также обычно обозначаемые 3'-CSE) и полиаденилатный путь. Запускаемая альфавирусом система ауторепликации РНК может также содержать вирусный промотор субгеномной «области стыка», последовательности одного или более генов структурных белков или их частей, чужеродную(ые) молекулу(ы) нуклеиновой кислоты, которая(ые) имеет(ют) размер, достаточный для продуцирования рекомбинантных альфавирусных частиц, а также гетерологичную(ые) последовательность(и), которая(ые) должна(ы) быть экспрессирована(ы).
Термин «адъювант» означает любое вещество, которое усиливает или модифицирует действие фармацевтического средства, включая, но не ограничиваясь ими, иммунологические адъюванты, которые усиливают и/или диверсифицируют иммунный ответ на антиген. Следовательно, иммунологическими адъювантами являются соединения, способные усиливать иммунный ответ на антигены. Иммунологические адъюванты могут усиливать гуморальный и/или клеточный иммунитет. В определение используемых здесь терминов «иммунологические адъюванты» входят вещества, стимулирующие природный иммунный ответ. Иммунологические адъюванты могут также называться «усилителями иммунных ответов».
Используемый здесь термин «антиген» означает молекулу, содержащую один или более эпитопов (например, линейный эпитоп, конформационный эпитоп или оба этих эпитопа). Используемый здесь термин «эпитоп» означает часть данной молекулы (например, антигенной молекулы или антигенного комплекса), которая определяет ее иммунологическую специфичность. Эпитоп входит в объем определенного здесь термина «антиген». Используемый здесь термин «антиген» включает субъединичные антигены, то есть, антигены, которые отделены от целого организма или отличаются от целого организма, с которым они ассоциируются в природе.
Термины «иммунологический ответ» или «иммунный ответ» означают вырабатывание у индивидуума гуморального и/или клеточного иммунного ответа на антиген или иммунологический адъювант.
Иммунные ответы включают природные и адаптивные иммунные ответы. Природные иммунные ответы представляют собой быстро действующие ответы, которые обеспечивают защиту иммунной системы организма первого ряда. В противоположность этому, при вырабатывании адаптивного иммунитета происходит отбор и клональная экспансия иммунных клеток, имеющих соматически реаранжированные гены рецепторов (например, T- и B-клеточных рецепторов), которые распознают антигены данного патогена или антигены, ассоциированные с данным расстройством (например, с опухолью), и тем самым сообщают специфичность и иммунологическую память. Природные иммунные ответы и многие ассоциированные с ними эффекты приводят к быстрой вспышке воспалительных цитокинов и к активации антигенпрезентирующих клеток (АПК), таких как макрофаги и дендритные клетки. Для дифференциации патогенов от собственных компонентов, природная иммунная система использует ряд относительно инвариабельных рецепторов, которые детектируют отличительные признаки патогенов, известные как ассоциированные с патогеном молекулярные паттерны или PAMP. Добавление микробиологических компонентов в экспериментальные вакцины приводит, как известно, к вырабатыванию стойких и длительных адаптивных иммунных ответов. Сообщалось, что после такого потенцирования иммунных ответов начинают действовать паттерн-распознающие рецепторы (PRR), которые дифференциально экспрессируются на различных иммунных клетках, включая нейтрофилы, макрофаги, дендритные клетки, природные клетки-киллеры, В-клетки и некоторые неиммунные клетки, такие как эпителиальные и эндотелиальные клетки. Действие PRR приводит к активации некоторых из этих клеток и к секреции ими цитокинов и хемокинов, а также к созреванию и миграции других клеток. В целом, это создает воспалительную среду и приводит к вырабатыванию устойчивого адаптивного иммунного ответа. PRR включают не-фагоцитарные рецепторы, такие как ловушко-подобные рецепторы (TLR) и нуклеотид-связывающие белки домена олигомеризации (NOD), и рецепторы, индуцирующие фагоцитоз, такие как рецепторы супероксидных радикалов, маннозные рецепторы и β-глюкановые рецепторы. Описанными в литературе TLR (наряду с примерами некоторых описанных лигандов, которые могут быть использованы в качестве иммуногенной молекулы в различных вариантах изобретения) являются: TLR1 (бактериальные липопротеины, происходящие от микобактерий Mycobacteria, Neisseria), TLR2 (дрожжевые зимозановые частицы, пептидогликан, липопротеины, липопептиды, гликолипиды, липополисахарид), TLR3 (двухцепочечная вирусная РНК, poly:IC), TLR4 (бактериальные липополисахариды, таксол растительного происхождения), TLR5 (бактериальные флагеллины), TLR6 (дрожжевые зимозановые частицы, липотехоевая кислота, липопептиды от mycoplasma), TLR7 (одноцепочечная РНК, имихимод, резимихимод и другие синтетические соединения, такие как локсорибин и бропиримин), TLR8 (одноцепочечная РНК, резимихимод) и TLR9 (CpG-олигонуклеотиды) и т.п. Дендритные клетки известны как типы клеток, играющие наиболее важную роль в инициации примирования «необученных» хелперных CD4+-T-клеток (TH) и в индуцировании дифференцировки CD8+-T-клеток в клетки-киллеры. Сообщалось, что передача TLR-сигнала играет важную роль в определении качества этих хелперных Т-клеточных ответов, например, природы TLR-сигнала, определяющего конкретный тип наблюдаемого TH-ответа (например, преимущественно TH1-ответа, а не TH2 ответа). Комбинация ответов с вырабатыванием антитела (гуморального ответа) и клеточного иммунного ответа продуцируется как часть ответа TH1-типа, тогда как преобладающим гуморальным ответом является ответ TH2-типа. Существует множество задокументированных данных, указывающих на то, что различные лиганды TLR, такие как CpG-ДНК (TLR9) и имидазохинолины (TLR7, TLR8), стимулируют продуцирование цитокинов иммунными клетками in vitro. Было обнаружено, что имидазохинолины представляют собой, главным образом, небольшие, соединения, которые, по своему действию, подобны лекарственным средствам и представляют собой агонисты TLR. Дополнительную информацию можно найти, например, в публикациях A. Pashine, N. M. Valiante and J. B. Ulmer, Nature Medicine 11, S63-S68 (2005), K. S. Rosenthal and D. H. Zimmerman, Clinical and Vaccine Immunology, 13(8), 821-829 (2006), и в цитируемых там работах.
В описании настоящего изобретения термин «гуморальный иммунный ответ» означает иммунный ответ, опосредуемый молекулами антител, а термин «клеточный иммунный ответ» означает ответ, опосредуемый Т-лимфоцитами и/или другими лейкоцитами. Один из важных аспектов клеточного иммунитета заключается в вырабатывании антигенспецифического ответа цитолитическими T-клетками (CTL). CTL обладают специфичностью к пептидным антигенам, которые презентируются вместе с белками, кодируемыми генами главного комплекса гистосовместимости (MHC), и экспрессируются на поверхности клеток. CTL индуцируют и стимулируют внутриклеточную деструкцию внутриклеточных микробов или лизис клеток, инфицированных такими микробами. Другим аспектом клеточного иммунитета является антигенспецифический ответ, вырабатываемый хелперными Т-клетками. Хелперные Т-клетки стимулируют функцию неспецифических эффекторных клеток и направляют их активность против клеток, которые представляют на своей поверхности пептидные антигены вместе с молекулами MHC. Термин «клеточный иммунный ответ» также означает продуцирование цитокинов, химокинов и других молекул, образующихся под действием активированных Т-клеток и/или других лейкоцитов, включая лейкоциты, происходящие от CD4+- и CD8+-T-клеток.
Композиция, такая как иммуногенная композиция или вакцина, которая вырабатывает клеточный иммунный ответ, может также служить для сенсибилизации позвоночного посредством презентации антигена вместе с молекулами МНС на клеточной поверхности. Клеточно-опосредуемый иммунный ответ вырабатывается на клетках, презентирующих антиген на своей поверхности, или на участке, находящемся поблизости от этих клеток. Кроме того, могут продуцироваться антиген-специфические Т-лимфоциты, которые будут в дальнейшем обеспечивать защиту иммунизированного хозяина. Способность конкретного антигена или композиции стимулировать клеточно-опосредуемый иммунологический ответ может быть определена с помощью различных анализов, известных специалистам, таких как анализы на лимфопролиферацию (активацию лимфоцитов), анализы на цитотоксичность CTL-клеток, анализы на T-лимфоциты, специфичные к антигену у сенсибилизированного индивидуума, или определение уровня продуцирования цитокинов Т-клетками в ответ на повторную стимуляцию антигеном. Такие анализы хорошо известны специалистам. См., например, Erickson et al. (1993) J. Immunol 151:4189-4199; Doe et al. (1994) Eur. J. Immunol 24:2369-2376. Таким образом, иммунологический ответ, определенный в настоящем изобретении, может представлять собой ответ, стимулирующий продуцирование CTL и/или продуцирование или активацию хелперных Т-клеток. Представляющий интерес антиген может также вырабатывать опосредуемый антителом иммунный ответ. Следовательно, иммунологический ответ может включать, например, один или более из нижеследующих эффектов, которыми, среди прочих, являются: продуцирование антител, например, В-клетками; и/или активация супрессорных Т-клеток и/или γδ T-клеток, специфичных к антигену или антигенам, присутствующим в представляющей интерес композиции или в вакцине. Такие ответы могут служить, например, в целях нейтрализации инфекции и/или опосредования антитело-комплементарной или антитело-зависимой клеточной цитотоксичности (ADCC) для обеспечения защиты иммунизированного хозяина. Такие ответы могут быть определены с помощью стандартных иммуноанализов и анализов на нейтрализацию, хорошо известных специалистам.
Композиции согласно изобретению обладают «повышенной иммуногенностью» для данного антигена, если они обладают повышенной способностью вырабатывать иммунный ответ по сравнению с иммунным ответом, вырабатываемым эквивалентным количеством антигена в другой композиции (например, где антиген вводят как растворимый белок). Таким образом, композиция может обладать «повышенной иммуногенностью», если, например, такая композиция вырабатывает более сильный иммунный ответ, или если для продуцирования иммунн