Антигенсвязывающие белки
Иллюстрации
Показать всеИзобретение относится к области иммунологии. Предложены способ получения антигенсвязывающего белка и клетка-хозяин для его получения. Антигенсвязывающий белок, получаемый способом по настоящему изобретению, содержит: а) две модифицированные тяжелые цепи антитела, в которых VH каждой тяжелой цепи заменен на VL указанного антитела и которые связаны друг с другом через свои СН3-домены Fc-части; и б) две модифицированные тяжелые цепи антитела, в которых СН1 каждой тяжелой цепи заменен на CL указанного антитела и которые связаны друг с другом через свои СН3-домены Fc-части; причем VL-домены тяжелых цепей а) связаны с VH-доменами тяжелых цепей б), а СН1-домены тяжелых цепей а) связаны с CL-доменами тяжелых цепей б). Получаемый антигенсвязывающий белок проявляет повышенную антителозависимую клеточноопосредованную цитотоксичность (ADCC). 2 н. и 12 з.п. ф-лы, 12 ил., 5 табл., 10 пр.
Реферат
Данное изобретение относится к антигенсвязывающим белкам, содержащим две Fc-части, к способам их получения, фармацевтическим композициям, содержащим указанные антигенсвязывающие белки, и к их применению.
Уровень техники
В последние два десятилетия были разработаны и оценены различные инженерные производные антител, моно- или полиспецифические, либо моно- или поливалентные (см., например, Holliger, P., et al., Nature Biotech. 23 (2005) 1126-1136; Fischer, N., and Leger O., Pathobiology 74 (2007) 3-14).
US 2004/0033561 относится к ДНК и производству одновалентных моноантител путем совместной экспрессии тяжелой цепи и модифицированной тяжелой цепи. Тем не менее, при экспрессии образуется значительное число нежелательных гомодимеров в качестве побочного продукта, который трудно отделить от нужных гетеродимерных моноантител, так как гомодимер и гетеродимер имеют такие же или аналогичные молекулярные массы. WO 2007/048037 относится к одновалентным IgG, что соответствует гетеродимерным моноантителам из US 2004/0033561, но может иметь меченую группировку, присоединенную к тяжелой цепи для облегчения очистки гетеродимера от трудного для отделения гомодимерного побочного продукта.
Сущность изобретения
Изобретение включает антигенсвязывающий белок, содержащий
а) две модифицированные тяжелые цепи антитела, которое специфически связывается с антигеном, где VH каждой тяжелой цепи заменен на VL указанного антитела, причем указанные модифицированные тяжелые цепи связаны друг с другом через свои СН-домены Fc-части;
б) две модифицированные тяжелые цепи указанного антитела, где СН1 каждой тяжелой цепи заменен на CL указанного антитела, причем указанные модифицированные тяжелые цепи связаны друг с другом через свои СН-домены Fc-части;
и где VL-домены тяжелых цепей а) связаны с VH-доменами тяжелых цепей б), и CH1-домены тяжелых цепей а) связаны с CL-доменами тяжелых цепей б).
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН3-домены Fc-части модифицированных тяжелых цепей а) и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют один и тот же изотип.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН2- и СН3-домены Fc-части модифицированных тяжелых цепей а) и СН2-и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют один и тот же изотип.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН2- и СН3-домены Fc-части модифицированных тяжелых цепей а) и СН2-и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют изотип IgG.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН2- и СН3-домены Fc-части модифицированных тяжелых цепей а) и СН2-и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют изотип IgG1.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что содержит
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №1; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №2;
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №3; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №4; или
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №5; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №6.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
либо две модифицированные тяжелые цепи а),
либо две модифицированные тяжелые цепи б)
также модифицированы путем аминокислотных замен S364G, L368F, D399K и K409D (где аминокислотные позиции нумеруются в соответствии с индексом ЕС Кабата).
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №1, и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №2;
где либо две модифицированные тяжелые цепи а),
либо две модифицированные тяжелые цепи б)
также модифицированы путем аминокислотных замен S364G, L368F, D399K и K409D (где аминокислотные позиции нумеруются в соответствии с индексом ЕС Кабата);
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №3; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №4;
где либо две модифицированные тяжелые цепи а),
либо две модифицированные тяжелые цепи б)
также модифицированы путем аминокислотных замен S364G, L368F, D399K и K409D (где аминокислотные позиции нумеруются в соответствии с индексом ЕС Кабата);
или
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №5; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №6,
где либо две модифицированные тяжелые цепи а),
либо две модифицированные тяжелые цепи б)
также модифицированы путем аминокислотных замен S364G, L368F, D399K и K409D (где аминокислотные позиции нумеруются в соответствии с индексом ЕС Кабата).
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН3-домены Fc-части модифицированных тяжелых цепей а) и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют различные изотипы.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН3-домены Fc-части модифицированных тяжелых цепей а) имеют изотип IgG1;
и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют изотип IgA.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что содержит
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №7; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №4.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что содержит
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №3; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №8.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН2- и СН3-домены Fc-части модифицированных тяжелых цепей а) имеют изотип IgG1;
СН2- и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют изотип IgA.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что СН2-домены Fc-частей а) и б) имеют изотип IgG1, а антигенсвязывающий белок является афукозилированным, где количество фукозы составляет 80% или менее (предпочтительно от 65% до 5%) от общего количества олигосахаридов (сахаров) на Asn297, и имеет человеческий изотип IgG1.
Кроме того, изобретение включает способ получения антигенсвязывающего белка в соответствии с изобретением,
включающий этапы
а) трансформации клетки-хозяина векторами, содержащими нуклеиновокислотные молекулы, кодирующие антигенсвязывающий белок в соответствии с изобретением;
б) культивирования клетки-хозяина в условиях, обеспечивающих синтез указанной антигенсвязывающей белковой молекулы; и
в) выделения указанной антигенсвязывающей белковой молекулы из указанной культуры.
Изобретение также включает нуклеиновую кислоту, кодирующую антигенсвязывающий белок в соответствии с изобретением.
Кроме того, изобретение включает векторы, содержащие нуклеиновую кислоту, кодирующую антигенсвязывающий белок в соответствии с изобретением.
Кроме того, изобретение включает клетку-хозяина, содержащую указанные векторы.
Кроме того, изобретение включает композицию, предпочтительно фармацевтическую или диагностическую композицию антигенсвязывающего белка в соответствии с изобретением.
Кроме того, изобретение включает фармацевтическую композицию, содержащую антигенсвязывающий белок в соответствии с изобретением.
Кроме того, изобретение включает способ лечения пациента, нуждающегося в терапии, который характеризуется введением пациенту терапевтически эффективного количества антигенсвязывающего белка в соответствии с изобретением.
Было обнаружено, что антигенсвязывающие белки в соответствии с изобретением обладают ценными характеристиками, такими как биологическая или фармакологическая активность (например, усиленная ADCC по сравнению с родительскими антителами). Они могут быть использованы, например, для лечения таких заболеваний как рак. Кроме того, антигенсвязывающие белки в соответствии с изобретением обладают высокоценными фармакокинетическими свойствами (такими как, например, AUC0-inf, Cmax или С0).
Описание графических материалов
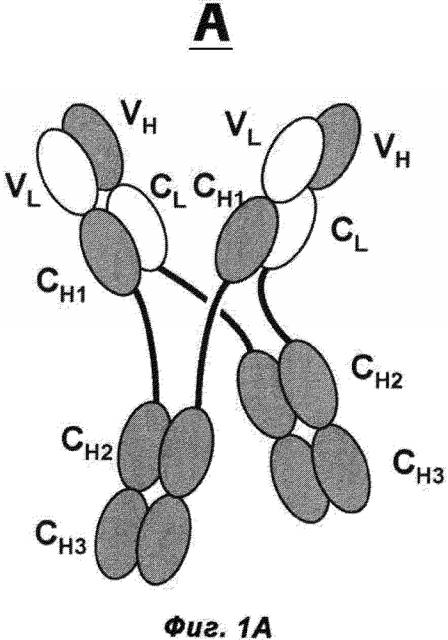
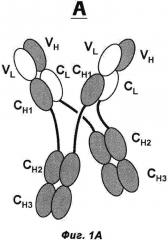
Фиг.1А и В: А) Схематическая структура антигенсвязывающего белка в соответствии с изобретением (сокращенно MoAb-димер) с CH1-CL-переключением. В) Схема основного побочного продукта - одновалентного мономера антитела (MoAb) с CH1-CL-переключением (сокращенно MoAb).
Фиг.1C: С) Ассоциация двух модифицированных тяжелых цепей а и b: гетеродимеризация двух различных цепей (а с b) непосредственно приводит к одновалентному антителу В (путь 2). Гомодимеризация двух идентичных цепей (а с а и b с b) приводит к предполагаемым промежуточным продуктам аа и bb (по пути 1), которые могут ассоциировать с формированием «MoAb-димера» А. Модификация контактов СН3-СН3 может влиять на распределение продуктов А (MoAb-димер) и В (MoAb). Модификации, которые способствуют гетеродимеризации (например, «ключи в замках»), будут увеличивать относительное количество соединения В по пути 2, в то время как модификации, которые поддерживают притягивающие взаимодействия между идентичными цепочками, но приводят к отталкиванию различных цепочек (например, СН3-доменов из а и b, взятых от разных изотипов), будут способствовать пути 1 и тем самым увеличивать количество А. Белые: домены легкой цепи. Пунктирные: домены тяжелой цепи.
Фиг.2: Биохимическая характеризация MoAb-димера c-Met (5D5 MoAb-димер («СН3-wt»)) (СН3-wt относится к неизмененному СН3-домену дикого типа). (А) Очищенное на белке А антитело разделяли на колонке Superdex 200 26/60. (В) Пиковые фракции (1, 2, 3) объединяли и подвергали SDS-PAGE в невосстанавливающих и восстанавливающих условиях. Полиакриламидные гели окрашивали красителем Кумасси синим. Индивидуальные пики соответствуют MoAb (3), MoAb-димеру (2) и более высокомолекулярному агрегату (1).
Фиг.3: Биохимическая характеризация MoAb-димера IGF-1R (IGF-1R AK18 MoAb-димер («СН3-wt»)) (СН3-wt относится к неизмененному СН3-домену дикого типа). (А) Очищенное на белке А антитело разделяли на колонке Superdex 200 26/60. (В) Пиковые фракции (1, 2) объединяли и подвергали SDS-PAGE в невосстанавливающих и восстанавливающих условиях. Полиакриламидные гели окрашивали красителем Кумасси синим. Индивидуальные пики соответствуют MoAb (2) и MoAb-димеру (1). (С) Молекулярную массу фракций пиков 1 и 2 исследовали путем SEC-MALLS.
Фиг.4: Биохимическая характеризация Her3 205 MoAb-димера («СН3-wt») (СН3-wt относится к неизмененному СН3-домену дикого типа). (А) Очищенное на белке А антитело разделяли на колонке Superdex 200 26/60. (В) Пиковые фракции (1, 2) объединяли и подвергали SDS-PAGE в невосстанавливающих и восстанавливающих условиях. Полиакриламидные гели окрашивали красителем Кумасси синим. Индивидуальные пики соответствуют MoAb (3), MoAb-димеру (2) и более высокомолекулярному агрегату (1).
Фиг.5: Схематическое изображение анализа поверхностного плазменного резонанса, применяемого для анализа аффинности связывания IGF-1R. Противочеловеческое IgG-антитело (JIR 109-005-098) иммобилизовали на поверхности биосенсорного чипа СМ5 и затем захватывали антитела MoAb или MoAb-димеры. Дальнейшее введение эктодомена рекомбинантного IGF-1R подтверждало функциональность антигенсвязывающих сайтов в молекулах MoAb и MoAb-димера.
Фиг.6. Клеточное связывание MoAb-димера (IGF-1R AK18 MoAb-димера («СН3-wt») (В) и родительского антитела Mab IGF-1R (А) с клетками А549 в анализе путем проточной цитометрии. Клетки А549 инкубировали с серией разведении указанных антител. Связанные антитела визуализировали с помощью Fc-связывающего вторичного антитела, связанного с флуорофором.
Фиг.7: ADCC-анализ негликоинженерного (не-GE) и гликоинженерного (GE) IGF1R-MKA и негликоинженерного IGF-1R-MoAb-димера (IGF1R AK18 MoAb-димер («СН3-wt»)). Полученные от доноров мононуклеарные клетки периферической крови (РВМС) инкубировали с клетками рака предстательной железы (DU145) в присутствии не-GE-IGF1R МКА (1), GE-IGF1R-MKA (2) и не-GE-IGF1R AK18 MoAb-димера («СН3-wt») (3).
Фиг.8: Интернализацию IGF-1R оценивали в клетках НТ29 после инкубации с антителом IGF-1R IgG1 (МКА IGF-1R) и IGF-1R MoAb-димером (IGF1R AK18 MoAb-димер («СН3-wt»)). На графике изображены общие уровни IGF-1R, на которых определяли воздействие антитела в анализе на основе ELISA.
Фиг.9: Аутофосфорилирование IGF-1R оценивали после инкубации клеток 3T3-IGF-1R с антителом IGF-1R IgG1 и IGF-1R MoAb-димером (IGF1R AK18 MoAb-димер («СН3-wt»)) в присутствии 10 нМ IGF-1. На графике изображены уровни фосфо-IGF-1R, на которых воздействие антитела определяли в анализе с установками на основе ELISA.
Фиг.10: Анализ соотношения полученного MoAb-димера (= антигенсвязывающего белка в соответствии с изобретением) и MoAb-мономера (= одновалентного побочного продукта), определенного с помощью ВЭЖХ. Различные антитела с СН3-доменами дикого типа (СН3-wt) и модифицированными СН3-доменами временно экспрессировали и определяли соотношение димера и мономера.
Фиг.11: ESI-MS-спектр IGF-1R-MoAb-димера (SEC-фракция 1) в невосстанавливающих условиях и после дегликозилирования.
Фиг.12: ESI-MS-спектр IGF-1R-MoAb-димера (SEC-фракция 1) после дегликозилирования и восстановления.
Подробное описание изобретения
Изобретение включает антигенсвязывающий белок, содержащий:
а) две модифицированные тяжелые цепи антитела, которое специфически связывается с антигеном, где VH каждой тяжелой цепи заменен на VL указанного антитела, причем указанные модифицированные тяжелые цепи связаны друг с другом через свои СН-домены Fc-части;
б) две модифицированные тяжелые цепи указанного антитела, где СН1 каждой тяжелой цепи заменен на CL указанного антитела, причем указанные модифицированные тяжелые цепи связаны друг с другом через свои СН-домены Fc-части;
и где VL-домены тяжелых цепей а) связаны с VH-доменами тяжелых цепей б), и СН1-домены тяжелых цепей а) связаны с CL-доменами тяжелых цепей б).
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН3-домены Fc-части модифицированных тяжелых цепей а) и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют один и тот же изотип.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН2- и СН3-домены Fc-части модифицированных тяжелых цепей а) и СН2-и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют один и тот же изотип.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН2- и СН3-домены Fc-части модифицированных тяжелых цепей а) и СН2-и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют изотип IgG.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН2- и СН3-домены Fc-части модифицированных тяжелых цепей а) и СН2-и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют изотип IgG1.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что содержит
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №1; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №2;
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №3; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №4; или
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №5; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №6.
Для улучшения выхода антигенсвязывающего белка в соответствии с изобретением (т.е. для повышения соотношения MoAb-димера и MoAb-мономера (см. пример 9)), СН3-домены IgG1 могут быть также модифицированы путем мутаций, вследствие чего СН3-домены IgG1 а) и природные (wt) СН3-домены IgG1 б) отличаются. Модификация/мутация должны осуществляться таким образом, чтобы поддерживать притягивающие взаимодействия между идентичными цепями, но приводить к отталкиванию различных цепей (см. также фиг.1C).
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
либо две модифицированные тяжелые цепи а),
либо две модифицированные тяжелые цепи б)
также модифицированы путем аминокислотных замен S364G, L368F, D399K и K409D (где аминокислотные позиции нумеруются в соответствии с индексом ЕС Кабата).
Система нумерации Кабата описана в Kabat, et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD(1991).
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №1; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №2;
где либо две модифицированные тяжелые цепи а),
либо две модифицированные тяжелые цепи б)
также модифицированы путем аминокислотных замен S364G, L368F, D399K и K409D (где аминокислотные позиции нумеруются в соответствии с индексом ЕС Кабата);
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №3; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №4;
где либо две модифицированные тяжелые цепи а),
либо две модифицированные тяжелые цепи б)
также модифицированы путем аминокислотных замен S364G, L368F, D399K и K409D (где аминокислотные позиции нумеруются в соответствии с индексом ЕС Кабата);
или
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №5; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №6,
где либо две модифицированные тяжелые цепи а),
либо две модифицированные тяжелые цепи б)
также модифицированы путем аминокислотных замен S364G, L368F, D399K и K409D (где аминокислотные позиции нумеруются в соответствии с индексом ЕС Кабата).
Другая возможность улучшить выход антигенсвязывающего белка в соответствии с изобретением (т.е. повысить соотношение MoAb-димера и MoAb-мономера (см. пример 9)), СН3-домены а) и б) берут от разных изотипов. Таким образом, притягивающие взаимодействия между идентичными цепями поддерживаются, а различные цепи отталкиваются (см. также фиг.1C).
Таким образом, в одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН3-домены Fc-части модифицированных тяжелых цепей а) и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют различные изотипы.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН3-домены Fc-части модифицированных тяжелых цепей а) имеют изотип IgG;
и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют изотип IgA.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что содержит
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №7; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №4.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что содержит
а) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №3; и
б) две модифицированные тяжелые цепи, содержащие аминокислотную последовательность SEQ ID №8.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что
СН2- и СН3-домены Fc-части модифицированных тяжелых цепей а) имеют изотип IgG1;
и СН2- и СН3-домены Fc-части модифицированных тяжелых цепей б) имеют изотип IgA1.
В одном воплощении антигенсвязывающий белок в соответствии с изобретением характеризуется тем, что СН2-домены Fc-частей а) и б) имеют изотип IgG1, а антигенсвязывающий белок афукозилирован с количеством фукозы 80% или менее от общего количества олигосахаридов (сахаров) на Asn297 и имеет человеческий изотип IgG1.
Термин «антитело», используемый в данном документе, означает антитело полной длины, состоящее из двух тяжелых цепей антитела и двух легких цепей антитела (см. фиг.1). Тяжелая цепь антитела полной длины представляет собой полипептид, содержащий в направлении от N-конца к C-концу вариабельный домен тяжелой цепи антитела (VH), константный домен 1 тяжелой цепи антитела (СН1), шарнирную область антитела (HR), константный домен 2 тяжелой цепи антитела (СН2) и константный домен 3 тяжелой цепи антитела (СН3), сокращенно VH-CH1-HR-CH2-CH3; и, возможно, константный домен 4 тяжелой цепи антитела (СН4) в случае антитела класса IgE. Предпочтительно тяжелая цепь антитела полной длины представляет собой полипептид, содержащий от N-конца по направлению к С-концу VH, СН1, HR, СН2 и СН3. Легкая цепь антитела полной длины представляет собой полипептид, содержащий в направлении от N-конца к С-концу вариабельный домен легкой цепи антитела (VL) и константный домен легкой цепи антитела (CL), сокращенно VL-CL. Константный домен легкой цепи антитела (CL) может быть κ (каппа) или λ (лямбда). Цепи антитела полной длины связаны друг с другом посредством межполипептидных дисульфидных связей между доменом CL и доменом СН1 (т.е. между легкой и тяжелой цепями) и между шарнирными областями тяжелых цепей антитела полной длины. Примерами типичных антител полной длины являются природные антитела, такие как IgG (например, IgG1 и IgG2), IgM, IgA, IgD и IgE. Антитела в соответствии с изобретением могут быть от одного вида, например, человека, либо они могут быть химерными или гуманизированными антителами. Антитела полной длины в соответствии с изобретением содержат два антигенсвязывающих сайта, каждый из которых образован парой VH и VL, которые специфически связываются с одним и тем же (первым) антигеном.
Из этих антител полной длины антигенсвязывающий белок в соответствии с изобретением получают путем:
а) модификации двух тяжелых цепей антитела, которое специфически связывается с антигеном, заменяя VH-домен каждой тяжелой цепи на VL-домен указанного антитела;
б) модификации двух тяжелых цепей указанного антитела, заменяя СН1-домен каждой тяжелой цепи на CL-домен указанного антитела.
«Fc-часть» антитела или антигенсвязывающего белка непосредственно не участвует в связывании антитела с антигеном, но отвечает а) за ассоциацию цепей (модифицированного) антитела друг с другом (например, через их СН3-домены) и б) за различные эффекторные функции. «Fc-часть антитела» является термином, хорошо известным специалистам, и определяется на основании расщепления антител папаином. В зависимости от аминокислотной последовательности константной области их тяжелых цепей антитела или иммуноглобулины делятся на классы: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3 и IgG4, IgA1 и IgA2. В соответствии с константными областями тяжелой цепи различные классы иммуноглобулинов называются α, δ, ε, γ и μ, соответственно.
Существуют пять видов тяжелых цепей антител млекопитающих, которые обозначаются греческими буквами: α, δ, ε, γ и μ (Janeway, С.A., Jr. et al., Immunobiology, 5th ed., Garland Publishing (2001)). Тип присутствующей тяжелой цепи определяет класс антитела; эти цепи находятся в антителах IgA, IgD, IgE, IgG и IgM, соответственно (Rhoades, R.A., and Pflanzer, R.G., Human Physiology, 4th ed., Thomson Learning (2002)). Отдельные тяжелые цепи отличаются по размеру и составу; α и γ содержат приблизительно 450 аминокислот, а μ и ε имеют примерно 550 аминокислот.
Каждая тяжелая цепь имеет две области: константную область и вариабельную область. Константная область одинакова во всех антителах одного и того же изотипа, но отличается в антителах различных изотипов. Тяжелые цепи γ, α и δ имеют константную область, состоящую из трех константных доменов СН1, СН2 и СН3 (в линии) и шарнирной области для дополнительной гибкости (Woof, J., and Burton, D., Nat. Rev. Immunol. 4 (2004) 89-99); тяжелые цепи μ и ε имеют константную область, состоящую из четырех константных доменов СН1, СН2, СН3 и СН4 (Janeway, C.A., Jr. et al., Immunobiology., 5th ed., Garland Publishing (2001)). Вариабельная область тяжелой цепи отличается в антителах, продуцируемых различными В-клетками, но является одинаковой для всех антител, продуцируемых одной В-клеткой или B-клеточным клоном. Вариабельная область каждой тяжелой цепи имеет примерно 110 аминокислот в длину и составляет один домен антитела.
«СН-домены Fc-части» представляют собой константный домен 2 тяжелой цепи антитела (СН2) и константный домен 3 тяжелой цепи антитела (СН3) и, возможно, константный домен 4 тяжелой цепи антитела (СН4) в случае антитела класса IgE.
Термин «указанные модифицированные тяжелые цепи, связанные друг с другом через их СН-домены Fc-частей» относится к межцепочечному доменному спариванию константных доменов тяжелой цепи антитела (СН) из двух модифицированных тяжелых цепей друг с другом, например двух СН3-доменов обеих цепей друг с другом, например, через межцепочечное ионное взаимодействие, взаимодействие Ван-Дер-Ваальса или водородные связи (см. фиг.1А). В одном воплощении указанные модифицированные тяжелые цепи связаны друг с другом посредством, по меньшей мере, их СН3-доменов Fc-части (и, возможно, посредством их СН2-доменов или, возможно, посредством их СН2-доменов и СН4-доменов (если они присутствуют)).
Термин «где VL-домены тяжелых цепей а) связаны с VH-доменами тяжелых цепей б), и СН1-домены тяжелых цепей а) связаны с CL-доменами тяжелых цепей б)» относится к доменному спариванию указанных доменов антител (всегда одного из а) и одного из б)), как они находятся, например, в природных антителах (VL/VH и CH1/CL), например, через межцепочечное ионное взаимодействие, взаимодействие Ван-Дер-Ваальса, водородные связи или дисульфидное взаимодействие (см. фиг.1А).
«Антигенсвязывающий белок» в соответствии с изобретением содержит два антигенсвязывающих сайта и является двухвалентным. Термины «сайт связывания» или «антигенсвязывающий сайт», используемые в данном документе, обозначают область(и) антигенсвязывающего белка в соответствии с изобретением, с которой обычно связывается лиганд (например, антиген или фрагмент антигена), и которая получена из молекулы антитела или ее фрагмента (например, Fab-фрагмента). Антигенсвязывающий сайт в соответствии с изобретением состоит из вариабельных доменов тяжелой цепи антитела (VH) и вариабельных доменов легкой цепи антитела (VL).
Антигенсвязывающие сайты (т.е. пары VH/VL), которые специфически связываются с нужным антигеном, могут быть получены а) из известных антител к антигену или б) из новых антител или фрагментов антител, полученных с помощью способов иммунизации de novo с использованием, помимо прочего, антигенного белка, или нуклеиновой кислоты, или их фрагментов, или с помощью фагового дисплея.
Антигенсвязывающий сайт антигенсвязывающего белка изобретения содержит шесть определяющих комплементарность областей (CDR), которые в разной степени способствуют аффинности сайта связывания к антигену. Существуют три CDR вариабельного домена тяжелой цепи (CDRH1, CDRH2 и CDRH3) и три CDR вариабельного домена легкой цепи (CDRL1, CDRL2 и CDRL3). Протяженность CDR и каркасных областей (FR) определяют путем сравнения с базой данных аминокислотных последовательностей, в которых эти области были определены в соответствии с вариабельностью среди последовательностей.
Специфичность антитела относится к селективному распознаванию антителом определенного эпитопа антигена. Природные антитела, например, являются моноспецифическими. Биспецифические антитела представляют собой антитела, которые имеют две различные антигенсвязывающие специфичности. Антигенсвязывающие белки в соответствии с изобретением являются по меньшей мере моноспецифическими и специфически связываются с эпитопом соответствующего антигена.
Термин «валентность», используемый в данной заявке, означает наличие определенного числа сайтов связывания в молекуле антитела. Природное антитело, например, имеет два сайта связывания и является двухвалентным. Также антигенсвязывающий белок в соответствии с изобретением является по меньшей мере двухвалентным.
Используемые в данном документе термины «моноклональное антитело» или «композиция с моноклональным антителом» относятся к препарату молекул антитела единого аминокислотного состава.
Термин «химерное антитело» относится к антителу, содержащему вариабельную область, т.е. связывающую область, из одного источника или вида, и по меньшей мере часть константной области, полученной из другого источника или вида, как правило полученному с помощью методик рекомбинантной ДНК. Предпочтительными являются химерные антитела, содержащие мышиную вариабельную область и человеческую константную область. Другими предпочтительными формами «химерных антител», охватываемыми данным изобретением, являются те, в которых константную область модифицировали или изменяли по сравнению с исходным антителом, создавая свойства в соответствии с изобретением, особенно в связи с C1q-связыванием и/или Fc-рецепторным (FcR) связыванием. Такие химерные антитела также называют «антителами с переключением класса». Химерные антитела являются продуктом экспрессированных иммуноглобулиновых генов, содержащих сегменты ДНК, кодирующие вариабельные области иммуноглобулинов, и сегменты ДНК, кодирующие константные области иммуноглобулинов. Способы получения химерных антител включают обычные методики рекомбинантной ДНК и генной трансфекции, в настоящее время хорошо известные в данной области. См., например, Morrison, S.L., et al., Proc. Natl. Acad Sci. USA 81 (1984) 6851-6855; патенты US 5202238 и 5204244.
Термин «гуманизированное антитело» относится к антителам, в которых каркасные области или «области, определяющие комплементарность» (CDR), были изменены так, чтобы они содержали CDR иммуноглобулина другой специфичности, отличной от родительского иммуноглобулина. В предпочтительном воплощении мышиный CDR прививают каркасной области человеческого антитела для получения «гуманизированного антитела». См., например, Riechmann, L., et al., Nature 332 (1988) 323-327; и Neuberger, M.S., et al., Nature 314 (1985) 268-270. Особенно предпочтительные CDR соответствуют тем, которые представляют последовательности, распознающие антигены, отмеченные выше для химерных антител. Другими формами «гуманизированных антител», предусмотренными данным изобретением, являются такие антитела, которые были дополнительно модифицированы или изменены в константной области по сравнению с исходным антителом для создания свойств в соответствии с изобретением, особенно в отношении C1q-связывания и/или Fc-рецепторного (FcR) связывания.
Термин «человеческое антитело», используемый в данном документе, включает антитела с вариабельными и константными областями, полученными из человеческих зародышевых последовательностей иммуноглобулина. Человеческие антитела хорошо известны в данной области (van Dijk, M.A., and van de Winkel, J.G., Curr. Opin. Pharmacol. 5 (2001) 368-374). Человеческие антитела могут быть также получены на трансгенных животных (например, мышах), которые способны после иммунизации продуцировать полный репертуар или выборку человеческих антител в отсутствие эндогенной продукции иммуноглобулина. Перенос совокупности человеческих зародышевых генов иммуноглобулинов в такую мышь, мутантную по зародышевой линии, приведет к продукции человеческих антител в ответ на введение антигена (см., например, Jakobovits, A., et al., Proc. Natl. Acad. Sci. USA 90 (1993) 2551-2555; Jakobovits, A., et al., Nature 362 (1993) 255-258; Brueggemann, M.D., et al., Year Immunol. 7 (1993) 33-40). Человеческие антитела могут быть также получены в библиотеках фагового дисплея (Hoogenboom, H.R., and Winter, G., J. Mol. Biol. 227 (1992) 381-388; Marks, J.D., et al., J. Mol. Biol. 222 (1991) 581-597). Методики Cole, et al. и Boerner, et al. также доступны для изготовления человеческих моноклональных антител (Cole, et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985); и Boerner, P., et al., J. Immunol. 147 (1991) 86-95). Как уже было упомянуто в отношении химерных и гуманизированных антител в соответствии с изобретением, термин «человеческое антитело», используемый в данном документе, включает также такие антитела, которые были модифицированы в константной области для создания свойств в соответствии с изобретением, особенно в отношении C1q-связывания и/или FcR-связывания, например, путем «переключения класса», т.е. путем изменения или мутации Fc-частей (например, из IgG1 в IgG4 и/или мутации IgG1/IgG4).
Термин «рекомбинантное человеческое антитело», используемый в данном документе, охватывает все человеческие антитела, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных средств, например антитела, выделенные из клетки-хозяина, такой как клетка NS0 или СНО, или животного (например, мыши), которое является трансгенным для человеческих генов иммуноглобулинов или антител, экспрессируемых с помощью рекомбинантного экспрессионного вектора, трансфицированного в клетку-хозяина. Такие рекомбинантные человеческие антитела имеют вариабельные и константные области в перегруппированной форме. Рекомбинантные человеческие антитела в соответствии с изобретением подвергали соматическому гипермутированию in vivo. Таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител являются последовательностями, которые, будучи полученными из и связанными с человеческими зародышевыми последовательностями VH и VL, не могут естественным образом существовать в репертуаре человеческих зародышевых антител in vivo.
Термин «вариабельный домен» (вариабельный домен легкой цепи (VL), вариабельный домен тяжелой цепи (VH)), используемый в данном документе, означает каждую пару легкой и тяжелой цепей, которые непосредственно участвуют в связывании антитела с антигеном. Вариабельные домены легкой и тяжелой цепей человека имеют одинаковую общую структуру и каждый домен содержит четыре каркасные области (framework region, FR), последовательности которых в значительной степени консервативны, соединенные тремя «гипервариабельными областями» (или областями, определяющими комплементарность, CDR). Каркасные области принимают конформацию β-складчатости, а CDR могут образовывать петли, связывающие β-складчатую структуру. CDR в каждой цепи удерживаются в их трехмерной структуре с помощью каркасных областей и образуют вместе с CDR из другой цепи антигенсвязывающий сайт. CDR3-области тяжелой и легкой цепей антитела играют особенно важную роль в специфичности/аффинности связывания антител в соответствии с изобретением и, следовательно, обеспечивают дальнейший предмет изобретения.
Термины «гипервариабельная область» или «антигенсвязывающая часть антитела», используемые в данном документе, относятся к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область содержит аминокислотные остатки из «областей, определяющих комплементарность», или «CDR». «Каркасные участки», или «FR-области», являются такими областями вариабельных доменов, которые отличаются от остатков гипервариабельных областей, определенных выше. Таким образом, легкая и тяжелая цепи антитела содержат от N-конца к С-концу домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. CDR в каждой цепи разделены такими аминокислотами каркасного участка. В частности, CDR3 тяжелой цепи является областью, которая вносит наибольший вклад в связывание антигена. CDR и FR-области определяют в соответствии со стандартным определением Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991).
Используемые в данном документе термины «связывающийся» или «специфически связывающийся» относятся к связыванию антигенсвязывающего белка с эпитопом антигена в анализе in vitro, предпочтительно в анализе плазмонного резонанса (BIAcore, GE-Healthcare, Упсала, Швеция) с очищенным антигеном дикого типа. Аффинность связывания определяется зн