Безопасные и функциональные гуманизированные антитела
Иллюстрации
Показать всеИзобретение относится к области биохимии. Предложен способ проверки безопасности исследуемого антитела, связывающегося с бета-амилоидом. Инкубируют глиальные макрофаги с олигомерами Аβ1-42: i) в присутствии исследуемого антитела, ii) в присутствии антитела IgG1 против бета-амилоида, включающего константную область IgG1 человека, и iii) без антитела. Затем измеряют активацию р38 МАР-киназы в глиальных макрофагах. Идентифицируют исследуемое антитело как безопасное, если оно индуцирует промежуточный уровень активации р38 МАР-киназы, т.е. уровень активации выше чем в присутствии олигомеров Аβ1-42 без антитела, но ниже чем в присутствии олигомеров Аβ1-42 и антитела IgG1. Также предложен способ контролирования безопасности курса лечения амилоидоза исследуемым антителом против бета-амилоида, включающий определение уровня активации р38 МАР-киназы в глиальных макрофагах, полученных от пациента, и, при необходимости, корректировку курса лечения так, чтобы активация р38 МАР-киназы была на промежуточных уровнях. Изобретение обеспечивает нейропротекцию, опосредуемую антителом против бета-амилоида, без вызова патогенетического воспалительного состояния. 2 н. и 57 з.п. ф-лы, 11 ил., 2 табл.
Реферат
Настоящая заявка испрашивает преимущества приоритета предварительной заявки на патент США с номером 61/400650, поданной 30 июля 2010 г., которая включена сюда посредством ссылки в ее полном объеме.
1. Введение
Настоящее изобретение относится к способам и композициям для безопасного и функционального лечения амилоидоза, группы нарушений и патологий, связанных с амилоидным белком, таких как болезнь Альцгеймера.
2. Предпосылки создания изобретения
Амилоидоз не является одной нозологической формой, а скорее представляет собой разнообразную группу прогрессирующих патологических процессов, характеризующихся экстраклеточными отложениями в тканях воскообразного, крахмалоподобного белка, называемого амилоидом, который накапливается в одном или нескольких органах или системах организма. По мере накопления амилоидных отложений они начинают препятствовать нормальному функционированию органа или системы организма. Существует по меньшей мере пятнадцать различных типов амилоидоза. Основными формами являются первичный амилоидоз без известного предшествующего заболевания, вторичный амилоидоз, возникающий после какого-либо другого заболевания, и наследственный амилоидоз.
Вторичный амилоидоз возникает во время хронического инфекционного или воспалительного заболевания, такого как туберкулез, бактериальной инфекции, которую называют семейной средиземноморской лихорадкой, костных инфекционных заболеваний (остеомиелита), ревматоидного артрита, воспаления тонкого кишечника (гранулематозного илеита), болезни Ходжкина и проказы.
Амилоидные отложения включают компонент, представляющий собой амилоид Р (пентагональный) (АР), гликопротеин, родственный обычному сывороточному амилоиду Р (амилоидному белку) (SAP), и сульфатированные гликозаминогликаны (GAG), сложные углеводы, присутствующие в соединительной ткани. Амилоидные белковые фибриллы, на долю которых приходится примерно 90% амилоидного материала, включают один из нескольких различных типов белков. Эти белки способны складываться в так называемые бета-складчато-листовые фибриллы, уникальную белковую конфигурацию, которая обладает сайтами связывания с красителем конго красным, что обусловливает уникальную способность амилоидного белка к окрашиванию.
Многие связанные с возрастом заболевания обусловлены или связаны с амилоидоподобными белками и характеризуются отчасти увеличением внеклеточных отложений амилоида или амилоидоподобного материала, которые вносят вклад в патогенез, а также в прогрессирование заболевания. Эти заболевания включают, но без ограничения, неврологические нарушения, такие как болезнь Альцгеймера (AD), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча); сочетанная деменция Гуама-Паркинсона. Другими заболеваниями, которые обусловлены или связаны с амилоидоподобными белками, являются прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых; старческий сердечный амилоидоз; эндокринные опухоли и другие, включающие офтальмологические нарушения, такие как дегенерация желтого пятна.
Хотя патогенез этих заболеваний может быть различным, характерные для них отложения часто содержат множество сходных молекулярных компонентов. В значительной степени это объясняться местной активацией провоспалительных путей, приводя тем самым к одновременному отложению компонентов активированного комплемента, реактантов острой фазы, иммуномодуляторов и других медиаторов воспаления (McGeer et al., 1994).
Болезнь Альцгеймера (AD) представляет собой неврологическое нарушение, которое, как полагают, вызывается прежде всего амилоидными бляшками, накоплением анормальных отложений белков в головном мозге. Наиболее часто встречающийся тип амилоида, выявляемый в головном мозге пораженных заболеванием индивидуумов, в основном состоит из Aβ фибрилл. Научно доказано, что увеличение продукции и накопления бета-амилоидного белка в бляшках приводит к гибели нервных клеток, что способствует развитию и прогрессированию AD. В свою очередь, утрата нервных клеток в стратегически важных областях головного мозга приводит к уменьшению уровня нейромедиаторов и ухудшению памяти. Белки, которые в первую очередь ответственны за образование бляшки, включают амилоидный белок-предшественник (АРР) и два пресенилина (пресенилин I и пресенилин II). Последовательное расщепление амилоидного белка-предшественника (АРР), который конститутивно экспрессируется и катаболизируется в большинстве клеток под действием ферментов β- и γ-секретаз, приводит к высвобождению состоящего из 39-43 аминокислот Aβ пептида. Деградация АРР, вероятно, приводит к увеличению их склонности к агрегации с образованием бляшек. Особенно фрагмент Aβ1-42 обладает большей склонностью к образованию агрегатов вследствие наличия двух очень гидрофобных аминокислотных остатков на своем С-конце. Поэтому полагают, что прежде всего фрагмент Aβ1-42 участвует и ответственен за инициацию образования нейритной бляшки при AD и, следовательно, обладает высоким патологическим потенциалом.
Следовательно, существует необходимость в терапевтических средствах, которые предотвращают образование амилоидных бляшек и/или диффузных имеющихся бляшек у пациентов с AD. В частности, существует необходимость в агентах, способных препятствовать физиологическим проявлениям болезни, таким как образование бляшек, связанное с агрегацией волокон амилоида или амилоидоподобного пептида.
Пассивная иммунизация против бета-амилоида становится все более и более желательной стратегией в качестве терапевтического лечения по поводу AD. Эффективность пассивной иммунизации была продемонстрирована в моделях AD с использованием трансгенных животных, лечения которых антителами, как установлено, уменьшало массу бляшек и отменяло расстройства поведения. Несмотря на преодоление гиперактивации цитотоксичных T-клеток, риска, который несет активная иммунизация с использованием Ат, пассивная иммунизации все же несет риск опосредованной Fcγ-рецепторами сверхактивации глиальных макрофагов (микроглии) и активации комплемента, которые могут вносить вклад в несоответствующую провоспалительную реакцию и вазогенный отек.
Антитела против бета-амилоида были описаны, например, в заявке WO 2007/068412, опубликованной 21 июня 2007 г.; WO 2008/060364, опубликованной 22 мая 2008 г.; WO 2007/068412, опубликованной 21 июня 2007 г.; WO 2007/068412, опубликованной 21 июня 2007 г.; WO 2007/068412, опубликованной 21 июня 2007 г.; WO 2007/068412, опубликованной 21 июня 2007 г.; WO 2008/156621, опубликованной 24 декабря 2008 г.; WO 2008/156621, опубликованной 24 декабря 2008 г.; WO 2008/156621, опубликованной 24 декабря 2008 г. (смотрите таблицу 2).
Побочные эффекты, отмечаемые во время лечения пациентов с амилоидозом, таким как AD, антителами против бета-амилоида, включают воспалительные побочные эффекты, такие как менингит и менингоэнцефалит, и скопление жидкости в головном мозге (отек мозга). Необходимы терапии, которые уменьшают или исключают осложнения, связанные с амилоидозом.
3. Краткое изложение сущности изобретения
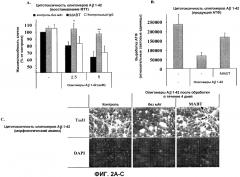
Новые композиции и способы настоящего изобретения обеспечивает альтернативное решение безопасного лечения - пассивной иммунизации по поводу амилоидоза, такого как болезнь Альцгеймера (AD). Настоящее изобретение основывается отчасти на обнаружении того, что антитело против Aβ, которое обладает эффективной нейтрализующей способностью, а также уменьшенной эффекторной функцией, уменьшает индуцируемую Aβ токсичность при избегании вредных побочных эффектов по сравнению с ранее известными терапиями с использованием моноклональных антител (мАт) против Aβ. В частности, авторы настоящего изобретения обнаружили, что гуманизированное моноклональное антитело (мАт) против Aβ изотипа IgG4, известное как MABT, как установлено, уменьшает риск опосредованной Fcγ-рецепторами сверхактивации глиальных макрофагов и аннулирует активацию комплемента. MABT связывается с высокой аффинностью с множеством форм Aβ1-42 и Aβ1-40, защищало от индуцируемой олигомерами Aβ1-42 цитотоксичности, опосредовало поглощение нейротоксичного Aβ глиальными макрофагами как in vitro, так и in vivo. По сравнению с Ат подкласса IgG1 человека дикого типа, содержащим те же антигенсвязывающие вариабельные домены и обладающим равной авидностью к Aβ, MABT продемонстрировало уменьшенную активацию стресс-активируемой, p38-митоген-активируемой протеинкиназы (p38 MAPK) в микроглии и вызывало меньший выброс провоспалительных медиаторов.
Настоящее изобретение также основывается отчасти на неожиданной роли активации p38 MAP-киназы в глиальных макрофагах в опосредуемой антителом против Аβ нейропротекции при AD. p38 MAP-киназная активность, как обычно считается, является провоспалительной и, как можно было бы полагать, вносит вклад в воспалительное состояние, относящееся к патогенезу амилоидоза, такого как AD. Однако как ни удивительно, промежуточная активация p38 MAP-киназы в глиальных макрофагах вносит вклад в опосредуемую антителом против Aβ нейропротекцию без вызова патогенетического воспалительного состояния.
Здесь предоставляются способы и композиции для безопасного лечения и/или предупреждения амилоидоза, в том числе, но без ограничения, болезни Альцгеймера. Амилоидоз включает, но без ограничения, неврологические нарушения, такие как болезнь Альцгеймера (AD), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча), сочетанная деменция Гуама-Паркинсона, а также другие заболевания, которые обусловлены или связаны с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз; болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), диабет взрослых, старческий сердечный амилоидоз, эндокринные опухоли и другие, включающие офтальмологические нарушения, такие как дегенерация желтого пятна, поражения зрительной коры, глаукома, друзы зрительного нерва, невропатия зрительного нерва, неврит зрительного нерва, катаракта, амилоидоз глаза и решетчатая дистрофия.
В частности здесь предоставляются антитела против Aβ с эффекторными областями, которые были отобраны или подвергнуты модификации с целью инициации промежуточной активации p38 MAP-киназы в глиальных макрофагах. Кроме того, здесь предоставляются способы лечения и предупреждения амилоидоза, в том числе, но без ограничения, болезни Альцгеймера, в которых доза и/или схема введения выбираются из условия, чтобы p38 MAP-киназа активировалась на промежуточном уровне в глиальных макрофагах. В конкретных вариантах осуществления безопасное и функциональное антитело против Aβ имеет эффекторную область антитела изотипа IgG4. В некоторых более конкретных вариантах осуществления безопасное и функциональное антитело против Аβ имеет CH2-область антитела изотипа IgG4. В некоторых конкретных вариантах осуществления промежуточным уровнем активации p38 MAP-киназы является уровень, который выше уровня активации p38 MAP-киназы с помощью только токсичных олигомеров бета-амилоида, но ниже уровня активации p38 MAP-киназы с помощью антитела против Aβ изотипа IgG1 в сочетании с токсичными олигомерами бета-амилоида. В некоторых вариантах осуществления эффекторную область антитела против Аβ модифицируют так, чтобы его эффекторная функция уменьшалась. В некоторых вариантах осуществления модификацией может быть любое генетическое изменение, приводящее к замене и/или делеции аминокислоты.
Кроме того, здесь предоставляются способы увеличения безопасности антитела против Aβ. В одном варианте осуществления предоставляется способ увеличения безопасности не относящегося к изотипу IgG4 антитела против Aβ, включающий замену константной области указанного, не относящегося к изотипу IgG4 антитела против Aβ константной областью, происходящей из антитела изотипа IgG4. В другом варианте осуществления предоставляется способ увеличения безопасности не относящегося к изотипу IgG4 антитела против Aβ, включающий замену константной области указанного, не относящегося к изотипу IgG4 антитела константной областью, происходящей из не относящегося к изотипу IgG1 антитела. В конкретном варианте осуществления способ увеличения безопасности не относящегося к подклассу IgG4 антитела против бета-амилоида служит для увеличения безопасности антитела против Aβ изотипа IgG1.
Кроме того, здесь предоставляется система для анализа на основе культуры клеток для проверки безопасности и функциональности антител против Aβ для осуществления лечения и/или предупреждения амилоидоза, в том числе, но без ограничения, болезни Альцгеймера. В некоторых вариантах осуществления глиальные макрофаги инкубируют с токсичными олигомерами бета-амилоида и исследуемым антителом против Aβ. Опосредуемое антителом против Aβ поглощение бета-амилоида глиальными макрофагами указывает на функциональность антитела, например, в опосредовании очищения от бета-амилоида. Опосредуемая антителом против Aβ активация p38 MAP-киназы на промежуточных уровнях в глиальных макрофагах указывает на то, что антитело является и функциональным, и безопасным. В некоторых вариантах осуществления промежуточным уровнем активации p38 MAP-киназы является уровень, который выше уровня активации p38 MAP-киназы с помощью только токсичных олигомеров бета-амилоида, но ниже уровня активации p38 MAP-киназы с помощью антитела против Аβ изотипа IgG1 с уровнем эффекторной функции дикого типа (т.е. немодифицированной константной областью IgG1). Эта система для анализа на основе культуры клеток может использоваться для проверки способности антител против Aβ к защите нейронов от нейротоксических действий Аβ. Кроме того, эта система для анализа на основе культуры клеток может использоваться для проверки способности антител против Аβ к инициированию активации р38 МАР-киназы на промежуточных уровнях.
В некоторых вариантах осуществления система для анализа на основе культуры клеток, кроме того, включает нейроны. Степень выживания нейронов после совместной инкубации с токсичными олигомерами бета-амилоида, исследуемым антителом против Аβ и глиальными макрофагами указывает на функциональность исследуемого антитела против Аβ.
В некоторых вариантах осуществления системой для анализа на основе культуры клеток является первичная клеточная культура коркового слоя. Первичную клеточную культуру коркового слоя инкубируют с токсичными бета-амилоидными олигомерами и исследуемым антителом против Аβ. Опосредуемое антителом против Аβ поглощение бета-амилоида глиальными макрофагами указывает на функциональность антитела, например, в опосредовании очищения от бета-амилоида. Опосредуемая антителом против Аβ активация р38 МАР-киназы на промежуточных уровнях в глиальных макрофагах указывает и на функциональность, и на безопасность антитела.
Кроме того, здесь предоставляются безопасные и функциональные антитела для лечения и/или предупреждения амилоидоза, в том числе, но без ограничения, болезни Альцгеймера. В некоторых вариантах осуществления вариабельную область не относящегося к изотипу IgG4 гуманизированного антитела, которое связывается с Aβ, объединяют с константной областью антитела человека изотипа IgG4. В других вариантах осуществления вариабельную область гуманизированного антитела подкласса IgG1, которое связывается с Aβ, объединяют с константной областью антитела человека изотипа IgG4. В некоторых вариантах осуществления CH2-домен не относящегося к изотипу IgG4 гуманизированного антитела, которое связывается с Aβ, заменяют CH2-доменом антитела человека изотипа IgG4. В других вариантах осуществления CH2-домен гуманизированного антитела изотипа IgG1, которое связывается с Aβ, заменяют CH2-доменом антитела человека изотипа IgG4. В некоторых вариантах осуществления константная область происходит из антитела изотипа IgG1, причем константную область антитела изотипа IgG1 модифицируют из условия, чтобы модифицированная константная область обладала уменьшенной или исключенной эффекторной функцией.
В других вариантах осуществления предоставляются способы лечения и/или предупреждения амилоидоза, в том числе, но без ограничения, болезни Альцгеймера, в которых вводят антитело против Aβ изотипа IgG1 в сочетании с противовоспалительным средством из условия, чтобы p38 MAP-киназа активировалась на промежуточном уровне в глиальных макрофагах. В некоторых конкретных вариантах осуществления промежуточными уровнями активации p38 MAP-киназы являются уровни, которые выше уровней активации p38 MAP-киназы с помощью только токсичных олигомеров бета-амилоида, но ниже уровней активации p38 MAP-киназы с помощью антитела против Aβ изотипа IgG1 с обычным уровнем эффекторной функции в присутствии только олигомеров без противовоспалительного средства.
3.1 Терминология
Используемые здесь термины «полипептид», «пептид» и «белок» являются взаимозаменяемыми и, как установлено, означают биомолекулу, состоящую из аминокислот, связанных пептидной связью.
Используемые здесь термины «a», «an» и «the», как установлено, означают «один или более» и включают множественное число кроме случаев, когда контекст не допускает это.
Термин «амилоидоз» относится к группе заболеваний и нарушений, вызванных амилоидными или амилоидоподобными белками или связанных с ними, и включают, но без ограничения, заболевания и нарушения, вызванные присутствием или активностью амилоидоподобных белков в мономерном, фибриллярном или полимерном состоянии, или любой их комбинации, в том числе амилоидными бляшками. Такие заболевания включают, но без ограничения, вторичный амилоидоз и старческий амилоидоз, такой как заболевания, включающие, но без ограничения, неврологические нарушения, такие как болезнь Альцгеймера (AD), заболевания или состояния, характеризующиеся уменьшением способности к познанию и запоминанию, такие как, например, умеренное когнитивное нарушение (MCI), деменция, связанная с тельцами Леви, синдром Дауна, наследственное церебральное кровоизлияние, сопровождающееся амилоидозом (типа Дутча), сочетанная деменция Гуама-Паркинсона и другие заболевания, которые обусловлены или связаны с амилоидоподобными белками, такие как прогрессирующий надъядерный паралич, рассеянный склероз, болезнь Крейцфельдта-Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, ALS (амиотрофический боковой склероз), миозит с тельцами включений (IBM), диабет взрослых, эндокринная опухоль и старческий сердечный амилоидоз, и различные заболевания глаз, включающие дегенерацию желтого пятна, связанную с друзами невропатию зрительного нерва и катаракту вследствие отложения бета-амилоида.
Используемые здесь термины «выявление (обнаружение)» или «выявленный (обнаруженный)» означают использование известных методов выявления биологических молекул, таких как иммунохимические или гистологические способы, и относятся к качественному или количественному определению присутствия или концентрации исследуемой биомолекулы.
«Амилоид β», «амилоид бета», «Aβ», «β-амилоид» или «бета-амилоид» является принятым в данной области техники термином и относится к β-амилоидным белкам и пептидам, а также их модификациям, фрагментам и любым функциональным эквивалентам, которые можно получить путем протеолитического расщепления амилоидного белка-предшественника (APP) и включают такие фрагменты APP, которые вовлечены в обусловленные амилоидом патологии или связаны с ними, в том числе, но без ограничения, Aβ1-38, Aβ1-39, Aβ1-40, Aβ1-41 Aβ1-42 и Aβ1-43.
Структура и последовательности вышеупомянутых β-амилоидных пептидов, упомянутых выше, хорошо известны специалисту со средним уровнем компетентности в данной области техники, и способы получения указанных пептидов или извлечения их из головного мозга и других тканей описаны, например, в Glenner and Wong, Biochem Biophys Res Comm 129, 885-890 (1984). Кроме того, β-амилоидные пептиды в различных формах также имеются в продаже.
Термин «выделенный» означает биологическую молекулу без по меньшей мере некоторых из компонентов, с которыми она встречается в природе.
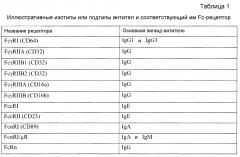
Используемые здесь термины «антитело» или «антитела» являются принятыми в данной области техники терминами и, как подразумевается, относятся к молекулам или активным фрагментам молекул, которые связываются с известными антигенами, и используются взаимозаменяемо с терминами «иммуноглобулин» или «молекулы иммуноглобулинов» и иммунологически активные части молекул иммуноглобулинов, т.е. части иммуноглобулина, которые содержат связывающий сайт, который специфически связывается с антигеном. Иммуноглобулин представляет собой белок, включающий один или более полипептидов, в основном кодируемыми генами константных областей каппа и лямбда, альфа, гамма, дельта, эпсилон и мю иммуноглобулинов, а также огромным количеством генов вариабельных областей иммуноглобулинов. Легкие цепи относят либо к каппа, либо к лямбда. Тяжелые цепи относят к гамма, мю, альфа, дельта или эпсилон, которые в свою очередь определяют классы иммуноглобулинов: IgG, IgM, IgA, IgD и IgE соответственно. Также известны подклассы тяжелой цепи. Например, тяжелые цепи IgG у людей могут быть любого из подклассов IgG1, IgG2, IgG3 и IgG4.
Как здесь используется, «специфически связывается» применительно к антителу означает, что антитело связывается с являющимся его мишенью антигеном с большей аффинностью, чем оно связывается со структурно отличным антигеном(ами).
Известно, что типичная структурная единица иммуноглобулина включает тетраметр. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, при этом каждая пара содержит одну «легкую» (приблизительно 25 кДа) и одну «тяжелую» цепь (приблизительно 50-70 кДа). N-конец каждой цепи определяет вариабельную область из приблизительно 100-110 или более аминокислот, в основном ответственную за распознавание антигена. Термины «вариабельная область легкой цепи» (VL) и «вариабельная область тяжелой цепи» (VH) относятся к этим частям легкой и тяжелой цепей соответственно.
Антитела существуют в виде полноразмерных интактных антител или в виде ряда хорошо изученных фрагментов, получаемых в результате расщепления различными пептидазами или химическими веществами. Таким образом, например, пепсин расщепляет антитело ниже дисульфидных связей в шарнирной области с порождением F(ab')2, димера Fab, который сам представляет собой легкую цепь, соединенную с VH-CH1 с помощью дисульфидной связи. F(ab')2 можно восстановить в мягких условиях для разрушения дисульфидной связи в шарнирной области, превращая тем самым F(ab')2-димер в Fab'-мономер. Fab'-мономер по существу представляет собой Fab-фрагмент с частью шарнирной области (смотрите Fundamental Immunology, W.E. Paul, ed., Raven Press, N.Y. (1993) для более подробного описания других фрагментов антител). Хотя различные фрагменты антител определяют по расщеплению интактного антитела, специалисту со средним уровнем компетентности в данной области техники будет понятно, что любой из множества фрагментов антител можно синтезировать de novo либо химически, либо используя методологию рекомбинантных ДНК. Таким образом, используемый здесь термин «антитело» также включает фрагменты антител, или полученные в результате модификации полных антител, или синтезированные de novo, или антитела и фрагменты, полученные с использованием методологий рекомбинантных ДНК.
Термин «антитела» включает моноклональные антитела, поликлональные антитела, химерные, одноцепочечные, биспецифические, подвергнутые включению элементов иммуноглобулинов обезьян, человеческие и гуманизированные антитела, а также их активные фрагменты. Примеры активных фрагментов молекул, которые связываются с известными антигенами, включают разделенные легкие и тяжелые цепи, Fab-, Fab/c-, Fv-, Fab'- и F(ab')2-фрагменты, в том числе продукты библиотеки экспрессируемых иммуноглобулинов в виде Fab-фрагментов и эпитопсвязывающие фрагменты любого из антител и фрагментов, упомянутых выше. Эти активные фрагменты можно получить множеством методов. Например, моноклональные антитела можно расщепить с помощью фермента, такого как пепсин, и подвергнуть HPLC гель-фильтрации. Соответствующую фракцию, содержащую Fab-фрагменты, можно затем собрать и сконцентрировать с помощью мембранной фильтрации и т.п. Ради дальнейшего описания общих способов выделения активных фрагментов антител смотрите, например, Khaw, B.A. et al. J. Nucl. Med. 23: 1011-1019 (1982); Rousseaux et al. Methods Enzymology, 121: 663-669, Academic Press, 1986.
Рекомбинантно созданные антитела могут быть обычными полноразмерными антителами, активными фрагментами антител, известными в результате протеолитического расщепления, уникальными активными фрагментами антител, такими как Fv или одноцепочечный Fv (scFv), антитела с исключением домена и т.п. Антитело в виде Fv имеет размер, составляющий приблизительно 50 кДа, и включает вариабельные области легкой и тяжелой цепей. Полипептид в виде одноцепочечного Fv («scFv») представляет собой ковалентно связанный гетеродимер VH::VL, который может экспрессироваться с нуклеиновой кислоты, включающей кодирующие VH и VL последовательности, которые соединены либо напрямую, либо с помощью кодирующего пептид линкера. Смотрите Huston, et al. (1988) Proc. Nat. Acad. Sci. USA, 85: 5879-5883. Известен ряд структур для превращения агрегированных в природе, но химически разделенных легкой и тяжелой полипептидных цепей из V-области антитела в молекулу scFv, которая будет принимать трехмерную структуру, в значительной степени схожую со структурой антигенсвязывающего сайта. Смотрите, например, патенты США с № 5091513, 5132405 и 4956778.
Паратоп (связывающий сайт) относится к части молекулы антитела, которая участвует в связывании антигена. Антигенсвязывающий сайт образуют аминокислотные остатки N-концевых вариабельных («V») областей тяжелой («H») и легкой («L») цепей. Вариабельные области антител включают три высокодивергентных участка, называемых «гипервариабельными участками» или «определяющими комплементарность участками» (CDR), которые помещены между более консервативными фланкирующими участками, известными как «каркасные области» (FR). В молекуле антитела три гипервариабельных участка легкой цепи (LCDR1, LCDR2 и LCDR3) и три гипервариабельных участка тяжелой цепи (HCDR1, HCDR2 и HCDR3) располагаются относительно друг друга в трехмерном пространстве с образованием антигенсвязывающей поверхности или кармана. Следовательно, паратоп антитела представляет собой аминокислоты, которые являются частью CDR антитела, и любые остатки каркасных областей, которые являются частью кармана в качестве связывающего сайта.
Идентификацию аминокислотных остатков в конкретном антителе, которые являются частью паратопа, можно осуществить, используя широко известные в данной области техники способы. Например, CDR антитела можно определить как гипервариабельные участки, первоначально определенные Kabat и др. (смотрите "Sequences of Proteins of Immunological Interest", E. Kabat et al., U.S. Department of Health and Human Services; Johnson, G and Wu, TT (2001) Kabat Database and its applications: future directions. Nucleic Acids Research, 29: 205-206; http://immuno.bme.nwa.edu). Положения CDR можно также определить как структурные петлевые структуры, первоначально описанные Chothia и другими (смотрите Chothia and Lesk, J. Mol. Biol. 196, 901 (1987), Chothia et al., Nature 342, 877 (1989) и Tramontano et al., J. Mol. Biol. 215, 175 (1990)). Другие способы включают «определение для IgM», которое является компромиссом между определениями по Kabat и Chothia и осуществляется с использованием программного обеспечения для моделирования IgM Oxford Molecular (сейчас Accelrys), или «определение путем анализа контактов» CDR по Macallum и др. ("Antibody-antigen interactions: contact analysis and binding site topography", J Mol Biol. 1996 Oct 11; 262(5): 732-745).
Химерные антитела являются антителами, которые содержат одну или более областей из антитела, происходящего от первого вида, и одну или более областей из антитела, происходящего от второго, отличного вида. В одном варианте осуществления химерным антителом является антитело, которое включает области из иммуноглобулина примата. Химерное антитело для клинического применения в случае человека, как обычно подразумевается, содержит вариабельные области из не являющегося человеком животного, например грызуна, вместе с константными областями из антитела человека. В отличие от этого в гуманизированном антителе используются CDR из нечеловеческого антитела с большей частью или всеми каркасными областями вариабельных областей и всеми константными областями из антитела человека. Человеческое химерное антитело, как обычно подразумевается, содержит вариабельные области из антитела грызуна. Типичное человеческое химерное антитело содержит константные области тяжелой цепи антитела человека и константные области легкой цепи антитела человека вместе с вариабельными областями и тяжелой, и легкой цепей, происходящими из антитела грызуна. Химерное антитело может включать некоторые изменения относительно встречающейся в природе аминокислотной последовательности константных областей человека и встречающейся в природе последовательности вариабельных областей грызуна. Химерные и гуманизированные антитела можно приготовить с помощью хорошо известных в данной области техники способов, включающих подходы к пересадке CDR (смотрите, например, патенты США с № 5843708, 6180370, 569376, 5585089, 5530101), стратегии перетасовки в цепях (смотрите, например, патент США с № 5565332; Rader et al., Proc. Natl. Acad. Sci. USA (1998) 95: 8910-8915), стратегии молекулярного моделирования (патент США с № 5639641) и т.п.
«Гуманизированное антитело», как здесь используется в случае антитела с двумя или более цепями, является антителом, в котором по меньшей мере одна цепь является гуманизированной. Гуманизированная цепь антитела имеет вариабельную область, в которой одна или более каркасных областей является человеческой. Гуманизированное антитело, которое является одноцепочечным, является антителом, в котором цепь имеет вариабельную область, в которой одна или более каркасных областей является человеческой. Нечеловеческие части вариабельной области гуманизированной цепи антитела или ее фрагмента происходят из не являющегося человеком источника, в частности нечеловеческого антитела, обычно происходящего от грызуна. Вклад частей нечеловеческого происхождения в гуманизированное антитело обычно предоставлен в форме по меньшей мере одного CDR-участка, который расположен среди каркасных областей, происходящих из одного (или более) иммуноглобулина(ов) человека. Кроме того, могут быть измены остатки каркасных областей для сохранения аффинности связывания.
«Гуманизированное антитело» может, кроме того, включать константные области (например, по меньшей мере одну константную область или ее часть в случае легкой цепи и в некоторых вариантах осуществления три константных области в случае тяжелой цепи). Константные области гуманизированного антитела, в случае их присутствия, обычно являются человеческими по происхождению. Способы получения гуманизированных антител хорошо известны специалистам со средним уровнем компетентности в данной области техники (смотрите, например, Queen et al., Proc. Natl Acad Sci USA, 86: 10029-10032 (1989), Hodgson et al., Bio/Technology, 9:421 (1991)). Гуманизированное антитело можно также получить с помощью нового способа генетической инженерии, который позволяет продуцировать поликлональные антитела с созревшей аффинностью, подобные человеческим антителам, в больших животных, таких как, например, кролики и мыши. Смотрите, например, патент США с № 6632976.
Используемый здесь термин «константная область» или сокращенно «CR» относится к генам константных областей иммуноглобулина. Гены константных областей кодируют часть молекулы антитела, которая придает эффекторные функции. В случае химерных человеческих антител и гуманизированных антител типично нечеловеческие (например, мышиные) константные области заменены константными областями человека. Константные области рассматриваемых химерных или гуманизированных антител типично происходят из иммуноглобулинов человека. Константная область тяжелой цепи может быть выбрана из любого из пяти изотипов: альфа, дельта, эпсилон, гамма или мю. Кроме того, тяжелые цепи различных подклассов (таких как подклассы тяжелых цепей IgG) ответственны за различные эффекторные функции, и, таким образом, посредством выбора желаемой константной области тяжелой цепи можно продуцировать антитела с желаемой эффекторной функцией. Константными областями, которые могут использоваться в пределах объема этого изобретения, являются гамма 1 (IgG1), в частности, Fc-область изотипа гамма 1 (IgG1), гамма 3 (IgG3) и особенно гамма 4 (IgG4). Типом константной области легкой цепи может быть каппа или лямбда, предпочтительно каппа. В одном варианте осуществления константной областью легкой цепи является константная область каппа человека (Heiter et al. (1980) Cell 22: 197-207), а константной областью тяжелой цепи является константная область IgG4 человека.
Термин «моноклональное антитело» также является принятым в данной области и относится к антителу, которое является продуктом одной клонированной, продуцирующей антитело клетки. Моноклональные антитела обычно создают посредством слияния обычно короткоживущей, продуцирующей антитело B-клетки с быстрорастущей клеткой, такой как раковая клетка (иногда называемой «иммортализованной» клеткой). Результирующая гибридная клетка, или гибридома, быстро размножается, создавая клон, который продуцирует антитело.
Должно быть понятно, что применительно к настоящему изобретению «моноклональное антитело» также включает антитела, которые продуцируются материнским клоном, который еще не достиг полной моноклональности.
Антителом в соответствии с настоящим изобретением может быть иммуноглобулин или антитело, в котором, как подразумевается, каждый из его связывающих сайтов является идентичным (в случае поливалентного антитела), или альтернативно которое может быть биспецифическим антителом или полиспецифическим антителом.
«Биспецифическое» или «бифункциональное антитело» представляет собой искусственное гибридное антитело, имеющее две различные пары тяжелая цепь/легкая цепь и два различных связывающих сайта. Биспецифические антитела можно создать с помощью ряда способов, включающих слияние гибридом или соединение Fab'-фрагментов. Смотрите, например, Songsivilai & Lachmann, Clin. Exp. Immunol. 79: 315-321 (1990); Kostelny et al., J. Immunol. 148, 1547-1553 (1992). «Полиспецифическое» или «полифункциональное антитело» представляет собой искусственное гибридное антитело, имеющее более чем две различные пары тяжелая цепь/легкая цепь и более чем два различных связывающих сайта. Полиспецифические антитела можно создать, используя тот же ряд способов, что и в случае биспецифических антител.
Термин «фрагмент» относится к части антитела или цепи антитела, включающей меньшее количество аминокислотных остатков, чем интактное или полное антитело или цепь антитела. Фрагменты можно получить благодаря химической или ферментативной обработке интактного или полного антитела или цепи антитела. Фрагмент можно также получить способом с использованием рекомбинантных ДНК. Приводимые в качестве примера фрагменты включают Fab-, Fab'-, F(ab')2-, Fabc и/или Fv-фрагменты. Термин «антигенсвязывающий фрагмент» относится к полипептидному фрагменту иммуноглобулина или антитела, который связывает антиген или конкурирует с интактным антителом (т.е. с интактным антителом, от которого он происходит) за связывание с антигеном (т.е. специфическое связывание). Связывающие фрагменты можно получить с помощью методов с использованием рекомбинантных ДНК или посредством ферментативного или химического расщепления интактных иммуноглобулинов. Связывающие фрагменты включают Fab, Fab', F(ab')2, Fabc, Fv, отдельные цепи и одноцепочечные антитела.
«Фрагмент» также относится к пептиду или полипептиду, включающему аминокислотную последовательность из по меньшей мере 5 следующих друг за другом аминокислотных остатков, по меньшей мере 10 следующих друг за другом аминокислотных остатков, по меньшей мере 15 следующих друг за другом аминокислотных остатков, по меньшей мере 20 следующих друг за другом аминокислотных остатков, по меньшей мере 25 следующих друг за другом аминокислотных остатков, по меньшей мере 40 следующих друг за другом аминок