Композиции и способы для лечения и диагностики астмы
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, иммунологии и медицины. Предложено применение антитела, которое связывается с IL-13, в качестве лекарственного средства для лечения астмы у человека. При этом у пациента повышены уровни экспрессии POSTN по отношению к среднему значению или медиане уровня экспрессии POSTN. Также описан способ лечения подтипа астмы с использованием такого антитела. Предложенная группа изобретений может быть использована в медицине. 3 н. и 20 з.п. ф-лы, 49 ил., 13 табл., 9 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет по предварительным заявкам США под номерами 61/072572, поданной 31 марта 2008 года, 61/041480, поданной 1 апреля 2008 года, 61/128383, поданной 20 мая 2008 года, и 61/205392, поданной 16 января 2009 года.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Предоставляются композиции и способы для лечения и диагностики подтипов астмы у пациентов. Также предоставляются способы идентификации эффективных лекарственных средств против астмы и предсказания способности отвечать на лекарственные средства против астмы.
УРОВЕНЬ ТЕХНИКИ
Традиционно полагают, что астма является следствием индуцированного аллергенами воздуха воспаления, запускаемого процессами T-хелперов 2 типа (Th2) и опосредуемого цитокинами, включающими интерлейкин (IL)-4, IL-5 и IL-13. IL-13 представляет собой плейотропный Th2-цитокин, продуцируемый активированными T-клетками, базофилами, эозинофилами и тучными клетками, и он строго вовлечен в патогенез астмы в доклинических моделях [2]. В дыхательных путях пациентов-людей с астмой были выявлены повышенные уровни IL-13; однако это повышение наблюдается только у подгруппы астматиков [3-6]. Недавние исследования были направлены на понимание того, как Th2-цитокины вызывают подобную астме патологию и физиологию [49, 50].
Хотя астма часто характеризуется эозинофильной инфильтрацией дыхательных путей, имеются накапливающиеся данные о том, что существуют другие подтипы этого заболевания, запускаемые альтернативными формами воспаления [1, 39, 48]. Например, исследования клеточных компонентов воспаления дыхательных путей при астме обеспечивают данные об отличающихся эозинофильном и неэозинофильном фенотипах астмы [1, 39, 48]. Неизвестно, отличаются ли молекулярные механизмы, лежащие в основе этих клинических и клеточных фенотипов астмы. Идентификация и изучение биомаркеров различных молекулярных фенотипов астмы может дать направление для фундаментального исследования и клинического применения развивающихся способов лечения астмы, которые специфично нацелены на Th2-ответы в легком.
Периостин представляет собой секретируемый белок, ассоциированный с фиброзом, экспрессия которого повышается рекомбинантным IL-4 и IL-13 в эпителиальных клетках бронхов [7, 8] и фибробластах бронхов [9]. Он экспрессируется на повышенных уровнях in vivo в эпителиальных клетках бронхов [8] и в субэпителиальном слое бронхов [9] людей с астмой, а также в модели астмы на мышах [10]. Также он на повышенных уровнях экспрессируется в эпителии пищевода пациентов с эозинофильным эзофагитом зависимым от IL-13 образом [11]. Повышенную экспрессию периостина наблюдали в нескольких типах происходящих из эпителия злокачественных опухолей [64-67], и в сыворотке некоторых пациентов со злокачественной опухолью наблюдали повышенные уровни растворимого периостина [64, 68-70].
Был проведен полногеномный анализ на микрочипах экспрессии эпителиальных клеток бронхов от 42 не принимавших стероиды астматиков с астмой от мягкой до умеренной, и от 28 здоровых контрольных субъектов [8]. В этих исследованиях тремя генами с наиболее отличающейся экспрессией между всеми астматиками и всеми здоровыми контролями были ген периостина, CLCA1 и serpinB2 [8]. Более того, эти гены значительно подавлялись в эпителиальных клетках бронхов астматиков после лечения в течение 7 суток ингалируемым кортикостероидом (ICS) [8]. Все три из этих генов индуцировались в эпителиальных клетках бронхов обработкой рекомбинантным IL-13 in vitro и их экспрессия значительно ослаблялась добавлением в культуральную среду кортикостероидов [8].
На сегодняшний день такие полногеномные анализы экспрессии не идентифицировали генетические биомаркеры, которые являются прогностическими или предсказывают терапевтический ответ на лечение отдельных пациентов с астмой, а также они не идентифицировали генетические маркеры, которые характеризуют подтипы пациентов с астмой. Кроме того, не было идентифицировано надежных негенетических биомаркеров с широкой клинической применимостью для прогноза или предсказания ответов на медикаментозное лечение, или для диагностики подтипов астмы. Таким образом, поскольку пациентам с астмой требуется лечение, поиск лекарственного средства(средств), эффективного для конкретного пациента, осуществляют по существу методом проб и ошибок. Такой метод проб и ошибок при поиске наиболее эффективного лекарственного средства часто вовлекает существенный риск и дискомфорт у пациента.
Таким образом, существует потребность в более эффективных средствах для определения того, какие пациенты будут отвечать на какое лечение, и во включении такого определения в более эффективные режимы лечения пациентов с астмой.
Изобретение, описанное в настоящем документе, удовлетворяет описанные выше потребности и обеспечивает другие преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
С использованием профилей экспрессии генов в эпителии бронхов, авторы настоящего изобретения определили молекулярные подтипы астмы. Удивительно, что координированная кластеризация данных на основе набора генов, экспрессия которых высоко коррелировала с генами, которые, как известно, активируются при стимуляции IL-4 или IL-13, выявила не один, а два различных кластера пациентов с астмой. Более того, анализ этих дихотомических подгрупп астматиков выявил значимые ассоциации между статусом "профиля IL-4/13" и уровнями общих IgE в сыворотке, уровнями CEA в сыворотке, уровнями периостина в сыворотке, эозинофилией периферической крови, эозинофилией BAL (бронхоальвеолярного лаважа), и способностью отвечать на ингалируемые кортикостероиды (в каждом случае p<0,05 при помощи критерия суммы рангов Вилкоксона).
Таким образом, настоящее изобретение относится к способам диагностики субпопуляции пациентов с астмой, включающим определение экспрессии любого или комбинации генов, выбранных из POSTN, CST1, CCL26, CLCA1, CST2, PRR4, SERPINB2, CEACAM5, iNOS, SERPINB4, CST4, PRB4, TPSD1, TPSG1, MFSD2, CPA3, GPR105, CDH26, GSN, C2ORF32, TRACH2000196 (TMEM71), DNAJC12, RGS13, SLC18A2, SERPINB10, SH3RF2, FCER1B, RUNX2, PTGS1 и ALOX15. В одном варианте осуществления, определяют экспрессию любого или комбинации генов, выбранных из группы, состоящей из POSTN, CST1, CST2, CCL26, CLCA1, PRR4, PRB4, SERPINB2, CEACAM5, iNOS, SERPINB4, CST4 и SERPINB10. Согласно одному варианту осуществления, экспрессию генов определяют с помощью микрочипа. Согласно другому варианту осуществления, экспрессию генов определяют путем определения уровней экспрессии белка указанного выше гена. Согласно другому варианту осуществления, экспрессию гена считают повышенной по сравнению со здоровым контролем, если относительный уровень мРНК представляющего интерес гена более чем в 2,5 раза превышает уровень мРНК контрольного гена. Согласно другому варианту осуществления, относительный уровень мРНК представляющего интерес гена более чем в 3 раза, 5 раз, 10 раз, 15 раз, 25 раз или 30 раз превышает уровень экспрессии гена здорового контроля. Согласно одному варианту осуществления, экспрессию гена определяют способом, выбранным из группы, состоящей из способа ПЦР, способа микрочипов или способа иммунологического анализа. В одном варианте осуществления, способ микрочипов включает применение микрочипа, имеющего одну или несколько молекул нуклеиновых кислот, которые могут гибридизоваться в строгих условиях с молекулой нуклеиновой кислоты, кодирующей ген, упомянутый выше, или имеющего один или несколько полипептидов (таких как пептиды или антитела), которые могут связываться с одним или несколькими из белков, кодируемых упомянутыми выше генами. В одном варианте осуществления, способ ПЦР представляет собой qPCR. Согласно одному варианту осуществления, способ иммунологического анализа включает стадии связывания антитела с белком, экспрессируемым с указанного выше гена, в образце указанного выше пациента и определения того, является ли уровень белка в образце от пациента повышенным. Согласно одному варианту осуществления, контрольный ген представляет собой ген домашнего хозяйства, выбранный из группы, состоящей из гена актина, GAPDH, GASB и GUSB.
Настоящее изобретение относится к микрочипу, содержащему последовательности нуклеиновых кислот, кодирующие следующие гены: POSTN, CST1, CST2, CCL26, CLCA1, PRR4, SERPINB2, CEACAM5, iNOS, SERPINB4, CST4 и SERPINB10 или их фрагменты. Настоящее изобретение относится к микрочипу, содержащему последовательности нуклеиновых кислот, кодирующие следующие гены: POSTN, CST1, CCL26, CLCA1, CST2, PRR4, SERPINB2, CEACAM5, iNOS, SERPINB4, CST4, PRB4, TPSD1, TPSG1, MFSD2, CPA3, GPR105, CDH26, GSN, C2ORF32, TRACH2000196 (TMEM71), DNAJC12, RGS13, SLC18A2, SERPINB10, SH3RF2, FCER1B, RUNX2, PTGS1 и ALOX1 или их фрагменты.
Настоящее изобретение относится к субпопуляции пациентов с астмой, подлежащих лечению лекарственными средствами по этому изобретению, где соотношение уровней белка или мРНК Muc5AC:MUC5B в эпителиальных клетках дыхательных путей пациентов с астмой превышает 25.
Настоящее изобретение также относится к способам диагностики субпопуляции пациентов с астмой путем проведения однократных или комбинированных измерений системных биомаркеров, выбранных из уровней CEA в сыворотке, уровней IgE в сыворотке, уровней периостина в сыворотке, количества эозинофилов в периферической крови и процента эозинофилов в жидкости бронхоальвеолярного лаважа (BAL). Системные биомаркеры, как правило, представляют собой негенетические биомаркеры и, как правило, их измеряют в образцах, полученных неинвазивными процедурами, например, но не ограничиваясь ими, взятием крови или компонентов крови, например, сыворотки или плазмы. Согласно одному варианту осуществления, уровни IgE более 100 МЕ/мл и/или эозинофилов более 0,14×10e9/л предсказывают группу пациентов, подлежащую лечению лекарственным средством по этому изобретению.
Настоящее изобретение относится к способам лечения астмы, включающим введение лекарственного средства пациенту с повышенными уровнями экспрессии одного или комбинации генов, выбранных из POSTN, CST1, CCL26, CLCA1, CST2, PRR4, SERPINB2, CEACAM5, iNOS, SERPINB4, CST4, PRB4, TPSD1, TPSG1, MFSD2, CPA3, GPR105, CDH26, GSN, C2ORF32, TRACH2000196 (TMEM71), DNAJC12, RGS13, SLC18A2, SERPINB10, SH3RF2, FCER1B, RUNX2, PTGS1, ALOX15. Согласно одному варианту осуществления, у пациента экспрессируются повышенные уровни одного или комбинации генов, выбранных из группы, состоящей из гена периостина, CST1, CST2, CCL26, CLCA1, PRR4, SerpinB2, CEACAM5, iNOS, PRB4, SerpinB4, SERPINB10 и CST4. Согласно одному варианту осуществления, пациент представляет собой стероид-наивного (никогда не подвергавшегося лечению стероидами) пациента с астмой от мягкой до умеренной. Согласно другому варианту осуществления, пациент, подлежащий лечению, представляет собой устойчивого к стероидам (не отвечающего на стероиды) пациента с астмой от мягкой до умеренной. Таких пациентов лечат терапевтически эффективным количеством лекарственного средства. В одном варианте осуществления, пациент имеет астму, индуцированную каскадом TH2.
Согласно одному варианту осуществления, лекарственное средство представляет собой ингибитор каскада IL13/IL4. Согласно другому варианту осуществления, лекарственное средство нацелено на индуцируемый TH2 каскад астмы. Иллюстративные мишени включают, но не ограничиваются ими, цитокины или лиганды, такие как: IL-9, IL-5, IL-13, IL-4, OX40L, TSLP, IL-25, IL-33 и IgE; и рецепторы, такие как: рецептор IL-9, рецептор IL-5, рецептор-альфа для IL-4, рецептор-альфа 1 для IL-13 и рецептор-альфа-2 для IL-13, OX40, TSLP-R, IL-7R-альфа (корецептор для TSLP), IL-17RB (рецептор для IL-25), ST2 (рецептор для IL-33), CCR3, CCR4, CRTH2, Fc-эпсилон-RI и Fc-эпсилон-RII/CD23 (рецепторы для IgE). Таким образом, лекарственное средство согласно этому изобретению включает средство, которое может связываться с указанной выше мишенью, такое как полипептид(ы) (например, антитело, иммуноадгезин или пептидное антитело), аптамер или низкомолекулярное соединение.
Согласно одному варианту осуществления, лекарственное средство представляет собой антитело против IL-13. Согласно другому варианту осуществления, антитело против IL-13 содержит последовательность VH, содержащую SEQ ID NO:193, и последовательность VL, содержащую SEQ ID NO:194. Согласно другому варианту осуществления, антитело против IL13 содержит: (a) HVR-L1, содержащую аминокислотную последовательность RASKSVDSYGNSFMH (SEQ ID NO:195); (b) HVR-L2, содержащую аминокислотную последовательность LASNLES (SEQ ID NO:196); (c) HVR-L3, содержащую аминокислотную последовательность QQNNEDPRT (SEQ ID NO:197); (d) HVR-H1, содержащую аминокислотную последовательность AYSVN (SEQ ID NO:198); (e) HVR-H2, содержащую аминокислотную последовательность MIWGDGKIVYNSALKS (SEQ ID NO:199); и (f) HVR-H3, содержащую аминокислотную последовательность DGYYPYAMDN (SEQ ID NO:200). Согласно другому варианту осуществления, лекарственное средство представляет собой антитело против лиганда OX40 (OX40L). Согласно другому варианту осуществления, лекарственное средство представляет собой биспецифическое антитело против IL13/против IL4. Согласно другому варианту осуществления, лекарственное средство представляет собой антитело против IgE. Согласно другому варианту осуществления, лекарственное средство представляет собой антитело, направленное против мембранной проксимальной М1'-области IgE, экспрессированного на поверхности B-клеток. Согласно другому варианту осуществления, лекарственное средство представляет собой ингалируемый кортикостероид. В определенных вариантах осуществления, ингалируемый кортикостероид выбран из беклометазона дипропионата, будезонида, флунизолида, флутиказона пропионата, мометазона и триамцинолона ацетонида.
Согласно одному варианту осуществления, антитело против OX40L содержит: (a) HVR-L1, содержащую последовательность RSSQSPVHSNGNTYLH (SEQ ID NO:201); (b) HVR-L2, содержащую последовательность KVSNRFS (SEQ ID NO:202); (c) HVR-L3, содержащую последовательность SQSTHIPWT (SEQ ID NO:203); (d) HVR-H1, содержащую последовательность SYWMH (SEQ ID NO:204); (e) HVR-H2, содержащую последовательность EIDPSNGRTNYNEKFKS (SEQ ID NO:205); и (f) HVR-H3, содержащую последовательность ERSPRYFDV (SEQ ID NO:206). Согласно другому варианту осуществления, антитело против OX40L содержит: (a) HVR-L1, содержащую последовательность RSSQSIVHGNGNTYLE (SEQ ID NO:207); (b) HVR-L2, содержащую последовательность RVSNRFS (SEQ ID NO:208); (c) HVR-L3, содержащую последовательность FQGSHVPYT (SEQ ID NO:209); (d) HVR-H1, содержащую последовательность SYWLN (SEQ ID NO:210); (e) HVR-H2, содержащую последовательность MIDPSDSETHYNQVFKD (SEQ ID NO:211); и (f) HVR-H3, содержащую последовательность GRGNFYGGSHAMEY (SEQ ID NO:212). Согласно другому варианту осуществления, антитело против OX40L содержит (a) HVR-H1, содержащую последовательность SYTMH (SEQ ID NO:215), SYAMS (SEQ ID NO:216), NFGMH (SEQ ID NO:217) или NYGMH (SEQ ID NO:218), (b) HVR-H2, содержащую последовательность IISGSGGFTYYADSVKG (SEQ ID NO:219), AIWYDGHDKYYSYYVKG (SEQ ID NO:220), AIWYDGHDKYYAYYVKG (SEQ ID NO:221), VIWYDGSNKYYVDSVKG (SEQ ID NO:222) или VIWNDGSNKYYVDSVKG (SEQ ID NO:223), (c) HVR-H3, содержащую последовательность DSSSWYRYFDY (SEQ ID NO:224), DRLVAPGTFDY (SEQ ID NO:225), KNWSFDF (SEQ ID NO:226) или DRMGIYYYGMDV (SEQ ID NO:227), (d) HVR-L1, содержащую последовательность RASQGISSWLA (SEQ ID NO:228), RASQSVSSSYLA (SEQ ID NO:229), RASQSVSSNYLA (SEQ ID NO:230), RASQGVSRYLA (SEQ ID NO:231) или RASQSVSSYLA (SEQ ID NO:232), (e) HVR-L2, содержащую последовательность GASSRAT (SEQ ID NO:233), AASSLQS (SEQ ID NO:234), MPPVWKV (SEQ ID NO:235), DASNRAT (SEQ ID NO:236) или LHPLCKV (SEQ ID NO:237); и (f) HVR-L3, содержащую последовательность NSLIVTLT (SEQ ID NO:238), QQYNSYPYT (SEQ ID NO:239), QQYGSSFT (SEQ ID NO:240), QQRSNWQYT (SEQ ID NO:241), QQRSNWT (SEQ ID NO:242) или NSIIVSLT (SEQ ID NO:243), где антитело против OX40L связывает OX40L. Согласно одному варианту осуществления, антитело против IgE содержит последовательность VL, содержащую SEQ ID NO:213, и последовательность VH, содержащую SEQ ID NO:214. Согласно другому варианту осуществления, антитело против IgE содержит: (a) HVR-L1, содержащую последовательность RSSQSLVHNNANTYLH (SEQ ID NO:244); (b) HVR-L2, содержащую последовательность KVSNRFS (SEQ ID NO:245); (c) HVR-L3, содержащую последовательность SQNTLVPWT (SEQ ID NO:246); (d) HVR-H1, содержащую последовательность GFTFSDYGIA (SEQ ID NO:247); (e) HVR-H2, содержащую последовательность AFISDLAYTIYYADTVTG (SEQ ID NO:248); и (f) HVR-H3, содержащую последовательность ARDNWDAMDY (SEQ ID NO:249). Согласно одному варианту осуществления, антитело против IgE содержит последовательность VH, содержащую SEQ ID NO:250, и последовательность VL, содержащую SEQ ID NO:251. Согласно одному варианту осуществления, антитело против IgE содержит последовательность VH, содержащую SEQ ID NO:252, и последовательность VL, содержащую SEQ ID NO:253. Согласно другому варианту осуществления, антитело против IgE содержит: (a) HVR-L1, содержащую последовательность RSSQDISNSLN (SEQ ID NO:254); (b) HVR-L2, содержащую последовательность STSRLHS (SEQ ID NO:255); (c) HVR-L3, содержащую последовательность QQGHTLPWT (SEQ ID NO:256); (d) HVR-H1, содержащую последовательность GYTFTDYYMM (SEQ ID NO:257); (e) HVR-H2, содержащую последовательность GDNIDPNNYDTSYNQKFKG (SEQ ID NO:258); и (f) HVR-H3, содержащую последовательность ASKAY (SEQ ID NO:259). Согласно другому варианту осуществления, антитело против IgE содержит: (a) HVR-L1, содержащую последовательность RSSQDISNALN (SEQ ID NO:260); (b) HVR-L2, содержащую последовательность STSRLHS (SEQ ID NO:255); (c) HVR-L3, содержащую последовательность QQGHTLPWT (SEQ ID NO:256); (d) HVR-H1, содержащую последовательность GYTFTDYYMM (SEQ ID NO:257); (e) HVR-H2, содержащую последовательность GDNIDPNNYDTSYNQKFKG (SEQ ID NO:258); и (f) HVR-H3, содержащую последовательность ASKAY (SEQ ID NO:259). Согласно другому варианту осуществления, антитело против IgE содержит: (a) HVR-L1, содержащую последовательность RSSQDISNALN (SEQ ID NO:260); (b) HVR-L2, содержащую последовательность STSRLHS (SEQ ID NO:255); (c) HVR-L3, содержащую последовательность QQGHTLPWT (SEQ ID NO:256); (d) HVR-H1, содержащую последовательность GYTFTDYYIM (SEQ ID NO:261); (e) HVR-H2, содержащую последовательность GDNIDPNNYDTSYNQKFKG (SEQ ID NO:258); и (f) HVR-H3, содержащую последовательность ASKAY (SEQ ID NO:259).
Согласно одному варианту осуществления, пациент имеет астму, которая не вовлекает каскад TH2 (не-TH2 астма). В одном варианте осуществления, лекарственное средство нацелено на не-TH2 астму. Согласно одному варианту осуществления, лекарственное средство представляет собой ингибитор каскада IL-17. В одном варианте осуществления, лекарственное средство представляет собой антитело против IL-17. В одном варианте осуществления, лекарственное средство представляет собой антитело, перекрестно реагирующее как с IL-17A, так и с IL-17F. В одном варианте осуществления, лекарственное средство представляет собой биспецифическое антитело, способное связываться как с IL-17A, так и с IL-17F. В одном варианте осуществления, лекарственное средство представляет собой антитело против IL-17A/F.
Настоящее изобретение относится к набору для диагностики подтипа астмы у пациента, содержащему (1) одну или несколько молекул нуклеиновых кислот, которые гибридизуются с геном, где ген выбран из группы, состоящей из POSTN, CST1, CST2, CCL26, CLCA1, PRR4, PRB4, SERPINB2, CEACAM5, iNOS, SERPINB4, CST4 и SERPINB10 и (2) инструкции по измерению уровней экспрессии гена в образце от пациента с астмой, где повышенные уровни экспрессии любого, комбинации или всех из указанных генов указывают на подтип астмы. Согласно одному варианту осуществления, набор дополнительно содержит ген, выбранный из группы, состоящей из: PRB4, TPSD1, TPSG1, MFSD2, CPA3, GPR105, CDH26, GSN, C2ORF32, TRACH2000196 (TMEM71), DNAJC12, RGS13, SLC18A2, SH3RF2, FCER1B, RUNX2, PTGS1 и ALOX15. В одном дополнительном варианте осуществления, уровень экспрессии гена измеряют путем анализа уровней мРНК. В другом дополнительном варианте осуществления, анализ включает способ ПЦР или применение микрочипа. В другом дополнительном варианте осуществления, способ ПЦР представляет собой qPCR. В одном варианте осуществления, уровни мРНК представляющего интерес гена, более чем в 2,5 раза превышающие уровни мРНК контрольного гена, указывают на подтип астмы.
Изобретение относится к набору для диагностики подтипа астмы у пациента, содержащему (1) одну или несколько молекул белка, которые связываются с белком, выбранным из группы, состоящей из POSTN, CST1, CST2, CCL26, CLCA1, PRR4, PRB4, SERPINB2, CEACAM5, iNOS, SERPINB4, CST4 и SERPINB10, и (2) инструкции по измерению уровней экспрессии белка в образце от пациента, где повышенные уровни экспрессии любого, комбинации или всех из указанных белков указывают на подтип астмы. В одном варианте осуществления, набор дополнительно содержит молекулу белка, которая связывается с белком, выбранным из группы, состоящей из: PRB4, TPSD1, TPSG1, MFSD2, CPA3, GPR105, CDH26, GSN, C2ORF32, TRACH2000196 (TMEM71), DNAJC12, RGS13, SLC18A2, SH3RF2, FCER1B, RUNX2, PTGS1 и ALOX15. В одном варианте осуществления молекула белка представляет собой антитело, пептид или пептидное антитело. В следующем варианте осуществления, набор содержит микрочип, содержащий молекулу(ы) белка.
Настоящее изобретение относится к набору для диагностики подтипа астмы у пациента, включающему инструкции по определению одного из биомаркеров в образце от пациента, выбранного из группы, состоящей из: уровней общих IgE в сыворотке, уровней CEA в сыворотке, уровней периостина в сыворотке, эозинофилов периферической крови и эозинофилов бронхоальвеолярного лаважа (BAL), где уровни CEA, периостина в сыворотке, эозинофилов периферической крови и эозинофилов бронхоальвеолярного лаважа (BAL) являются повышенными. Согласно одному варианту осуществления, в наборе предоставляются инструкции, где уровень IgE, превышающий 100 МЕ/мл, указывает на подтип астмы. Согласно другому варианту осуществления, в наборе предоставляются инструкции, где уровень эозинофилов в периферической крови, превышающий 0,14×10e9/л, указывает на подтип астмы.
Настоящее изобретение относится к набору для диагностики подтипа астмы у пациента, содержащему инструкции по определению соотношения мРНК или белка Muc5AC:MUC5B в образце от пациента с астмой, где соотношение более 25 указывает на подтип астмы. В одном варианте осуществления, образец получают из эпителиального соскоба. В другом варианте осуществления, образец содержит эпителиальные клетки дыхательных путей. В одном варианте осуществления, в наборе предоставляется молекула нуклеиновой кислоты, которая гибридизуется в строгих условиях с Muc5AC, и молекула нуклеиновой кислоты, которая гибридизуется в строгих условиях с MUC5B. В одном варианте осуществления, в наборе предоставляется молекула белка, которая связывается с Muc5AC, и молекула белка, которая связывается с MUC5B. В одном варианте осуществления, молекула белка представляет собой антитело.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фигуре 1 представлены уровни экспрессии генов в эпителии дыхательных путей, как описано в примерах 1 и 2. (A) Представлены относительные уровни экспрессии периостина (левая панель), CLCA1 (средняя панель) и serpinB2 (правая панель) у здоровых контролей (N=27) и у астматиков (N=42). На левой оси каждого графика указаны нормализованные единицы флуоресценции. (B) Представлены двухсторонние сравнения уровней экспрессии периостина и CLCA1 (левая панель), периостина и serpinB2 (средняя панель) и CLCA1 и serpinB2 (правая панель) у 42 астматиков. На каждой панели указаны коэффициент ранговой корреляции Спирмана (ρ) и значения p. (C) Анализ на микрочипах экспрессии генов у здоровых контролей и астматиков, идентифицирующий уровни экспрессии периостина и корегулируемых генов; кластер с профилем "IL-4/13 высокий" (кластер 1); кластер с профилем "IL-4/13 низкий" (кластер 2); здоровые контроли. (D) Теплокарта, на которой представлена неконтролируемая иерархическая кластеризация (евклидова полная) уровней экспрессии периостина, CLCA1 и serpinB2 в эпителии бронхов у всех субъектов на исходном уровне. (E) Средние (+SEM) уровни экспрессии IL-4, IL-5 и IL-13 в гомогенатах биоптатов бронхов, полученных одновременно с соскобами бронхов от подгруппы субъектов, представленных на фигурах 1A-D (кластер 1: 18 астматиков с "IL-13 высоким"; кластер 2: 16 здоровых контролей и 14 астматиков с "IL-13 низким"). Двухсторонние корреляции IL-4, IL-5 и IL-13 для всех субъектов, указанных справа (коэффициент ранговой корреляции Спирмана, ρ, и значения p).
На фигуре 2 представлены семейства генов для серпинов, цистатинов и PRR, и уровни экспрессии этих генов, как описано в примере 3. (A) Геномные локусы и организация серпинов (сверху), цистатинов (середина) и PRR (низ), как представлено на браузере для просмотра геномов University of California Santa Cruz, доступном на сайте http://genome.ucsc.edu. (B) Иерархическая кластеризация всех зондов, кодирующих гены цистатинов и серпинов, как представлено на панели A. (C) Представлены относительные уровни экспрессии генов в эпителии дыхательных путей PRR4 (левая панель), PRB4 (средняя панель) и CEACAM5 (правая панель) у здоровых контролей (N=27) и у астматиков (N=42). На левой оси каждого графика указаны нормализованные единицы флуоресценции.
На фигуре 3 представлен анализ на микрочипах соскобов эпителия бронхов на исходном уровне и после введения ингалируемого флукатизона пропионата (ICS) в течение одной недели, как описано в примере 6. (A) Экспрессия периостина; (B) экспрессия PRR4; (C) экспрессия RUNX2.
На фигуре 4 представлен объединенный график для IgE в сыворотке и эозинофилов периферической крови у пациентов с астмой, как описано в примерах 7 и 9.
На фигуре 5 представлены различные клинические признаки субфенотипов астмы "IL-13 высокий" и "IL-13 низкий", как описано в примере 8. (A) Объем воздуха, выдыхаемого за первую секунду форсированного выдоха (FEV1), показатель обструкции дыхательных путей. (B) Улучшение FEV1 после 4 вдыханий (360 мкг) альбутерола (тестирование обратимости с помощью бронхорасширяющего средства). (C) Провокационная концентрация метахолина, требуемая для индукции 20% снижения FEV1 (PC20), показатель гиперреактивности дыхательных путей.
На фигуре 6 представлены различные маркеры аллергии, эозинофильного воспаления и ремоделирования дыхательных путей для субфенотипов астмы "IL-13 высокий" и "IL-13 низкий", как описано в примере 8. (A) Результаты инъекционной кожной пробы с аллергенами (SPT) с использованием панели из 12 аллергенов воздуха. (B) Концентрация IgE в сыворотке. (C) Количество эозинофилов в периферической крови. (D) Эозинофилы в качестве процента от всех клеток жидкости бронхоальвеолярного лаважа (BAL). (E) Стереологическое измерение толщины ретикулярной базальной мембраны (RBM) в эндобронхиальном биоптате, показателя субэпителиального фиброза. (F) Соотношение экспрессии MUC5AC и MUC5B в эпителиальных соскобах при определении посредством qPCR.
На фигуре 7 представлены различные клинические признаки субфенотипов астмы "IL-13 высокий" и "IL-13 низкий", как описано в примере 8. (A) Процент субъектов, отвечающих на конкретные аллергены воздуха, как указано вдоль нижней оси. Субфенотип астмы "IL-13 низкий"; субфенотип астмы "IL-13 высокий" (*, p<0,05). (B) Количество положительных реакций SPT против процента эозинофилов BAL; субфенотип астмы по IL-13, как указано (высокий, незакрашенные квадраты; низкий, закрашенные круги). (C) Количество положительных реакций SPT против IgE в сыворотке; субфенотип астмы по IL-13, как указано (высокий, незакрашенные квадраты; низкий, закрашенные круги). (D) Количество положительных реакций SPT против количества эозинофилов периферической крови; субфенотип астмы IL-13, как указано (высокий, незакрашенные квадраты; низкий, закрашенные круги). Коэффициент ранговой корреляции Спирмана (ρ) и значения p указаны на каждом графике для B-D.
На фигуре 8 представлены содержание и состав муцина в эпителии дыхательных путей у субъектов с субфенотипами астмы "IL-13 высокий" и "IL-13 низкий" и у здоровых контролей, как описано в примере 8. (A) Объем муцина на объем эпителия, показатель содержания муцина в эпителии дыхательных путей. (B) Экспрессия муцина MUC2 при определении qPCR. (C) Экспрессия муцина MUC5AC при определении qPCR. (D) Экспрессия муцина MUC5B при определении qPCR.
На фигуре 9 представлены ответы субъектов с субфенотипами астмы "IL-13 высокий" и "IL-13 низкий" на ингалируемые кортикостероиды. (A) FEV1, измеренная на исходном уровне (0 неделя), после 4 и 8 недель введения флукатизона раз в сутки, и через одну неделю после прекращения введения флукатизона (неделя 9). (*): см. таблицу 5 для количества субъектов в каждой группе и значений p. (B) Теплокарта, на которой представлена неконтролируемая иерархическая кластеризация периостина, CLCA1 и serpinB2 (как на фиг. 1D) в эпителии бронхов астматиков через одну неделю после начала введения либо флукатизона (N=19), либо плацебо (N=13). Обозначение кластера на исходном уровне для отдельных субъектов и введение указаны ниже теплокарты (кластер 1: астматики с "IL-13 высоким"; кластер 2: астматики с "IL-13 низким").
На фигуре 10 представлена экспрессия генов альвеолярных макрофагов у субъектов с субфенотипами астмы "IL-13 высокий" и "IL-13 низкий", как описано в примере 8. Указаны здоровые контроли (N=15); субфенотип астмы "IL-13 низкий" (N=5); субфенотип астмы "IL-13 высокий" (N=9). На фигуре представлены средние (+SEM) уровни экспрессии 15-липоксигеназы (ALOX15) и фактора некроза опухоли-α (TNF-α) при определении посредством qPCR. (*): p<0,03.
На фигуре 11 представлен анализ на микрочипах экспрессии генов с использованием 35 зондов, охватывающих 28 генов, образцов от здоровых контролей и астматиков, как описано в примере 9.
На фигуре 12 представлен анализ на микрочипах экспрессии генов и анализ посредством qPCR периостина и CEACAM5, как описано в примере 9. (A) Экспрессия периостина у здоровых контролей, астматики с кластером 2 ("IL-13 низкий"), и астматики с кластером 1 ("IL-13 высокий"); (B) экспрессия CEACAM5 у здоровых контролей, астматики с кластером 2 ("IL-13 низкий"), и астматики с кластером 1 ("IL-13 высокий"); (C) объединенный график CEACAM5 и периостина у астматиков с "IL-13 высоким" (квадраты) и у астматиков с "IL-13 низким" (круги); (D) Анализ операционных характеристик приемника (ROC) в отношении оптимизированного алгоритма для уровней экспрессии периостина CEACAM5 на основе qPCR, показывающий чувствительность и специфичность для здоровых контролей, астматиков с "IL-13 высоким", и астматиков с "IL-13 низким".
На фигуре 13 представлены уровни в сыворотке сывороточных белков у астматиков и здоровых контролей, как описано в примере 9. (A) уровни IgE в сыворотке; (B) уровни периостина в сыворотке; (C) уровни CEA в сыворотке; (D) уровни YKL-40 в сыворотке; (E) уровни IgE в сыворотке у астматиков, которым вводили ингалируемые кортикостероиды (ICS) (+) или не вводили их (-); (F) уровни периостина в сыворотке у астматиков, которым вводили ингалируемые кортикостероиды (ICS) (+) или не вводили их (-); (G) уровни CEA в сыворотке у астматиков, которым вводили ингалируемые кортикостероиды (ICS) (+) или не вводили их (-); (H) уровни YKL-40 в сыворотке астматиков, которым вводили ингалируемые кортикостероиды (ICS) (+) или не вводили их (-); (I) объединенный график уровней периостина в сыворотке у астматиков, имеющих <100 МЕ/мл IgE в сыворотке (<100) и у астматиков, имеющих ≥100 МЕ/мл IgE в сыворотке (≥100); (J) объединенный график уровней CEA в сыворотке, имеющих <100 МЕ/мл IgE в сыворотке (<100) и у астматиков, имеющих ≥100 МЕ/мл IgE в сыворотке (≥100); (K) объединенный график уровней YKL-40 в сыворотке у астматиков, имеющих <100 МЕ/мл IgE в сыворотке (<100) и у астматиков, имеющих ≥100 МЕ/мл IgE в сыворотке (≥100); (L) объединенный график уровней периостина в сыворотке и CEA у астматиков, имеющих <100 МЕ/мл IgE в сыворотке (круги) и у астматиков, имеющих ≥100 МЕ/мл IgE в сыворотке (квадраты).
ПОДРОБНОЕ ОПИСАНИЕ
ОПРЕДЕЛЕНИЯ
Если не определено иначе, подразумевается, что все термины данной области, обозначения и другая научная терминология, используемые в настоящем документе, имеют значения, обычно понимаемые специалистами в области, к которой это изобретение относится. В некоторых случаях, термины с обычно понимаемыми значениями определены в настоящем документе для ясности и/или для простоты отсылки, и включение таких определений в настоящий документ не обязательно следует истолковывать как существенно отличающееся от того, что обычно понимают в данной области. Способы и процедуры, которые описаны и которые процитированы в настоящем документе, в общем, являются хорошо понятными и обычно применяемыми специалистами в данной области при использовании общепринятой методологии, например, такой как широко используемые методологии молекулярного клонирования, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 2nd. edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. В соответствующих случаях, способы, вовлекающие применение коммерчески доступных наборов и реагентов, обычно проводят согласно установленным изготовителями протоколам и/или параметрам, если нет иных указаний.
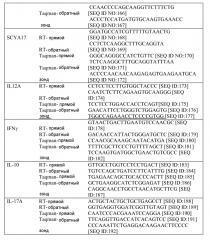
Термины "профиль генов IL-4/IL-13", "профиль IL-4/IL-13", "профиль генов IL-13" и "профиль IL-13" используют в настоящем документе взаимозаменяемо и они относятся к комбинации из 30 генов, как указано в таблице 4, или подкомбинации этих 30 генов, как указано в таблице 9, паттерн экспрессии которых коррелирует с определенными пациентами с астмой. Эти 30 генов включают POSTN, CST1, CCL26, CLCA1, CST2, PRR4, SERPINB2, CEACAM5, iNOS, SERPINB4, CST4, PRB4, TPSD1, TPSG1, MFSD2, CPA3, GPR105, CDH26, GSN, C2ORF32, TRACH2000196 (TMEM71), DNAJC12, RGS13, SLC18A2, SERPINB10, SH3RF2, FCER1B, RUNX2, PTGS1, ALOX15. Полипептиды профиля генов IL-4/IL13 представляют собой "полипептиды-мишени" по этому изобретению.
Термин "полипептид-мишень", когда его используют в настоящем документе, относится к полипептидам с "нативной последовательностью" и вариантам (которые определены в настоящем документе далее).
Полипептид с "нативной последовательностью" включает полипептид, имеющий ту же аминокислотную последовательность, что и соответствующий полипептид, встречающийся в природе. Таким образом, термин "полипептид с нативной последовательностью" включает встречающиеся в природе укороченные, удлиненные формы полипептида и формы полипептида со сдвигом рамки считывания, включая, но не ограничиваясь ими альтернативно сплайсированные формы, изоформы и полиморфизмы.
"Встречающийся в природе вариант" означает полипептид, имеющий по меньшей мере приблизительно 60% идентичность аминокислотной последовательности с эталонным полипептидом и сохраняющий по меньшей мере один вид биологической активности встречающегося в природе эталонного полипептида. Встречающиеся в природе варианты могут включать полипептидные варианты, обладающие по меньшей мере приблизительно 65% идентичностью аминокислотной последовательности, по меньшей мере приблизительно 70% идентичностью аминокислотной последовательности, по меньшей мере приблизительно 75% идентичностью аминокислотной последовательности, по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности, по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности, по меньшей мере приблизительно 85% идентичностью аминокислотной последовательности, по меньшей мере приблизительно 90% идентичностью аминокислотной последовательности, по меньшей мере приблизительно 95% идентичностью аминокислотной последовательности, по меньшей мере приблизительно 98% идентичностью аминокислотной последовательности или по меньшей мере приблизительно 99% идентичностью аминокислотной последовательности с эталонным полипептидом.
Примеры POSTN включают полипептид, содержащий SEQ ID NO:1, и другие полипептиды POSTN с нативной последовательностью, такие как встречающиеся в природе варианты и полипептиды с нативной последовательностью, кодируемые последовательностью нуклеиновой кислоты, которая может гибридизоваться в строгих условиях с SEQ ID NO:31 и/или 32.
Примеры CST1 включают полипептид, содержащий SEQ ID NO:2, и другие полипептиды CST1 с нативной последовательностью, такие как встречающиеся в природе варианты и полипептиды с нативной последовательностью, кодируемые последовательностью нуклеиновой кислоты, которая может гибридизоваться в строгих условиях с SEQ ID NO:33.
Примеры CCL26 включают полипептид, содержащий SEQ ID NO:3, и другие полипептиды CCL26 с нативной последовательностью, такие как встречающиеся в природе варианты и полипептиды с нативной последовательностью, кодируемые последовательностью нуклеиновой кислоты, которая может гибридизоваться в строгих условиях с SEQ ID NO:34.
Примеры CLCA1 включают полипептид, содержащий SEQ ID NO:4, и другие полипептиды CLCA1 с нативной последовательностью, такие как встречающиеся в природе варианты и полипептиды с нативной последовательностью, кодируемые последовательностью нуклеиновой кислоты, которая может гибридизоваться в строгих условиях с SEQ ID NO:35.
Примеры CST2 включают полипептид, содержащий SEQ ID NO:5, и другие полипептиды CST с нативной последовательностью, такие как встречающиеся в природе варианты и полипептиды с нативной последовательностью, кодируемые последовательностью нуклеиновой кислоты, которая может гибридизоваться в строгих условиях с SEQ ID NO:36.
Примеры PRR4 включают полипептид, содержащий SEQ ID NO:6, и другие полипептиды PRR4 с нативной последовательностью, такие как встречающиеся в природе варианты и полипептиды с нативной последовательностью, кодируемые последовательностью нуклеиновой кислоты, которая может гибридизоваться в строгих условиях с SEQ ID NO:37.
Примеры SERPINB2 включают полипептид, содержащий SEQ ID NO:7, и другие полипептиды SERPINB2 с нативной последовательностью, такие как встречающиеся в природе варианты и полипептиды с нативной последовательностью, кодируемые последовательностью нуклеиновой кислоты, которая может гибридизоваться в строгих условиях с SEQ ID NO:38.
Примеры CEACAM5 включают полипептид, содержащий SEQ ID NO:8, и другие полипептиды CEACAM5 с нативной последовательностью, такие как встречающиеся в природе варианты и полипептиды с нативной последовательностью, кодируемые последовательностью нуклеинов