Составы разагилина с пролонгированным высвобождением и их применение
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики. Описана пероральная фармацевтическая композиция в форме пролонгированного высвобождения для лечения нейродегенеративного заболевания или повреждения нервной системы. Указанная композиция включает R(+)-N-пропаpгил-1-аминоиндан (разагилин) в качестве активного вещества. Композиция содержит пеллеты с пролонгированным высвобождением и фармацевтически приемлемый носитель. Указанная пеллета содержит: i) инертное ядро пеллеты; ii) слой с активным веществом, поливинилпирролидоном и тальком; iii) необязательно, изолирующий слой с поливинилпирролидоном; iv) слой покрытия пролонгированного высвобождения с этилцеллюлозой и полиэтиленгликолем. Также описано применение и способ лечения указанной композицией нейродегенеративного заболевания или повреждения нервной системы. Изобретение обеспечивает усиленное действие на указанные заболевания. 3 н. и 13 з.п. ф-лы, 9 ил., 17 табл., 11 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к фармацевтическим композициям, приготовленным в форме для пролонгированного высвобождения активных соединений, подходящих для лечения нейродегенеративных заболеваний, в частности, болезни Паркинсона, и повреждений нервной системы.
УРОВЕНЬ ТЕХНИКИ
Было показано, что некоторые производные пропаргиламина селективно ингибируют активность моноаминоксидаз (МАО)-Б и/или МАО-А, которые инактивируют моноаминергические нейромедиаторы, такие как допамин, и, таким образом, подходят для лечения нейродегенеративных заболеваний, таких как болезнь Паркинсона (БП) и болезнь Альцгеймера (БА), которые характеризуются низкими уровнями допамина. Также было показано, что данные соединения защищают от нейродегенерации путем предотвращения апоптоза.
Первым соединением, которое, как было обнаружено, селективно ингибирует МАО-Б, был R-(-)-N-метил-N-(проп-2-инил)-2-аминофенилпропан, также известный как L-(-)-депренил, R-(-)-депренил или селегилин (selegiline). Помимо БП,, селегилин, как было показано, может применяться также при лечении, других заболеваний и патологических состояний, которые включают синдром отмены лекарственного средства (WO 92/21333, включая синдром отмены психостимуляторов, опиатов, наркотических средств и барбитуратов); депрессию (US 4861800); БА; дегенерацию желтого пятна (US 5242950); возрастные дегенерации, включая дегенерацию функции почек и дегенерацию когнитивной функции, на основании данных о способности к пространственному обучению (US 5151449); болезнь Кушинга гипофизарного происхождения у людей и животных (US 5192808); дисфункцию иммунной системы как у людей (US 5387615), так и у животных (US 5276057); возрастную потерю массы тела у млекопитающих (US 5225446); шизофрению (US 5151419); и различные неопластические состояния, включая раковые опухоли, такие как рак молочной железы и гипофиза. В WO 92/17169 описано применение селегилина для лечения нейромышечных и нейродегенеративных заболеваний и для лечения повреждений ЦНС вследствие гипоксии, гипогликемии, ишемического инсульта или травмы. Кроме того, было широко изучено биохимическое действие селегилина в отношении нервных клеток (см., например, Tatton, 1993; и Tatton and Greenwood, 1991). В US 6562365 описано применение десметилселегилина для лечения чувствительных к селегилину заболеваний и патологических состояний.
Разагилин (rasagiline), R(+)-N-пропаргил-1-аминоиндан, высокоактивный селективный необратимый ингибитор МАО-Б, был разрешен для лечения БП в Европе, Израиле и в США под торговым названием АЗИЛЕКТ® (AZILECT®) или АГИЛЕКТ® (AGILECT®) (Teva Pharmaceutical Industries Ltd., Петах-Тиква, Израиль). При исследованиях на культурах клеток и in vivo было показано, что разагилин обладает нейропротекторной активностью и антиапоптотическим действием в отношении различных поражений (Youdim and Weinstock, 2002а). Механизм, лежащий в основе нейрозащиты разагилином, был изучен на допаминергических клетках SH-SY5Y и PC12 в культуре в отношении апоптоза, индуцированного N-метил(R)салсолинолом, донором пероксинитрита N-морфолино-сиднонимином (SIN-1), 6-гидроксидопамином, и удалением сыворотки и фактора роста нервов (Youdim et al, 2001b; Akao et al, 1999,2002; Maruyama et al, 2001a, 2001b, 2002).
Разагилин и его фармацевтически приемлемые соли были впервые описаны в патентах США №5387612, 5453446, 5457133, 5576353, 5668181, 5786390, 5891923 и 6630514 в качестве подходящих для лечения БП, нарушений памяти, деменции альцгеймеровского типа, депрессии и синдрома гиперактивности. Производные 4-фтор-, 5-фтор- и 6-фтор-N-пропаргил-1-аминоиндана были описаны в US 5486541 для тех же целей. В патентах США №5519061, 5532415, 5599991, 5744500, 6277886, 6316504, 5576353, 5668181, 5786390, 5891923 и 6630514 описан разагилин и его фармацевтически приемлемые соли в качестве подходящих для лечения при дополнительных терапевтических показаниях, в частности, для лечения аффективного расстройства, неврологической гипоксии или аноксии, нейродегенеративных заболеваний, нейротоксического поражения, инсульта, ишемии головного мозга, повреждения при травме головы, повреждения при травме позвоночника, шизофрении, синдрома дефицита внимания, рассеянного склероза и синдромов отмены.
В US 6251938 описаны соединения N-пропаргилфенилэтиламина, а в патентах США №6303650, 6462222 и 6538025 описаны соединения N-пропаргил-1-аминоиндана и N-пропаргил-1-аминотетралина в качестве подходящих для лечения депрессии, синдрома дефицита внимания, синдрома дефицита внимания и гиперактивности, синдрома Туретта, БА и другой деменции, такой как сенильная деменция, деменция паркиксоновского типа, сосудистая деменция и деменция с тельцами Леви.
В предыдущей работе было сделано предположение, что разагилин и родственные производные пропаргиламина подавляют каскад апоптотической гибели, начинающийся в митохондриях, за счет предотвращения предапоптотического снижения мембранного потенциала митохондрий (Δψm) вследствие изменения проницаемости и активации каспазы 3, ядерную транслокацию глицеральдегид-3-фосфатдегидрогеназы и апоптотические процессы нуклеосомной фрагментации ДНК (Youdim and Weinstock, 2002b). При контролируемой монотерапии и в качестве вспомогательного средства к L-допе (L-dopa) разагилин продемонстрировал активность в отношении болезни Паркинсона.
Были синтезированы два аналога разагилина, содержащие карбаматную группу, в попытке комбинации ингибирующих свойств в отношении МАО и нейропротекторных свойств разагилина с ингибирующей холинэстеразу (ChE) активностью ривастигмина (rivastigmine), лекарственного средства с доказанной эффективностью у пациентов с БА. Данные аналоги представляют собой (N-пропаргил-(3R)-аминоиндан-5-ил)-этилметилкарбамат (TV3326), обладающий ингибирующей активностью в отношении как ChE, так и МАО-А и Б, и его S-изомер, TV3279, являющийся ингибитором ChE, но не МАО (Weinstock, 1999; Grossberg and Desai, 2001). Подобно разагилину, TV3326 и TV3279 обладают нейропротекторными свойствами в отношении различных поражений, которые не зависят от ингибирующей активности в отношении ChE и МАО, а могут возникать вследствие некоторой фармакологической активности, свойственной пропаргиламинному фрагменту (Youdim and Weinstock, 2002а). Кроме того, данные соединения стимулируют высвобождение нейротрофического/нейропротекторного неамилоидогенного растворимого белка-предшественника амилоида (sAPPβ) путем активации протеинкиназы С и путей митоген-активируемой протеинкиназы (Yogev-Falach, 2002). Таким образом, данные лекарственные средства могут влиять на образование потенциально амилоидогенных производных и могут иметь клиническое значение для лечения БА.
В US 5169868, US 5840979 и US 6251950 описаны алифатические пропаргиламины в качестве селективных ингибиторов МАО-Б, нейропротекторных агентов и агентов «спасения» клеток. Было показано, что основное соединение, (R)-N-(2-гептил)метилпропаргиламин, является мощным ингибитором МАО-Б и антиапоптотическим агентом (Durden et al., 2000).
Много лет тому назад сообщалось, что пропаргиламин является суицидным ингибитором медьсодержащей аминоксидазы бычьей плазмы (BPАО), хотя его активность была невысокой. В US 6395780 пропаргиламин описан в качестве слабого ингибитора системы расщепления глицина.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению было обнаружено, что введение разагилина с обеспечением его замедленного высвобождения, вследствие чего воздействие лекарственного средства заметно продлевается по сравнению с воздействием после разового введения, может иметь решающее значение для достижения оптимального нейропротекторного действия при различных поражениях ЦНС. В частности, в то время как разовое введение возрастающих доз разагилина (0,1, 0,12 или 0,15 мг/кг) в модели болезни Паркинсона (БП) у мышей, индуцированной N-метил-4-фенил-1,2,3,6-тетрагидропиридином (МРТР), оказывало практически сходное действие на уровни допамина у мышей, приводя к повышению содержания допамина до примерно 60% по сравнению с мышами, не получавшими лекарственное средство, введение таких же трех доз лекарственного средства с замедленным высвобождением в течение 24 часов приводило к значительному ответу на дозу, при котором уровни допамина составляли 57%, 74% и 88%, соответственно, по сравнению с мышами, не получавшими лекарственное средство, что указывает на выраженный благоприятный эффект введения с замедленным высвобождением по сравнению с немедленным высвобождением в отношении уровней допамина в головном мозге мышей, подвергнутых воздействию МРТР. Интересным является тот факт, что схожие результаты получали после введения метаболита разагилина, 1-аминоиндана, с замедленным высвобождением, что приводило к значительному восстановлению уровней допамина по сравнению с мышами, которым вводили такую же дозу лекарственного средства один раз в сутки в течение такого же периода времени.
Также, как было обнаружено в модели индуцированной 6-гидроксидопамином (6-OHDA) БП у крыс, заметно улучшенный эффект при чистом вращении, индуцированном амфетамином, наблюдали у крыс, получавших лечение разагилином, вводимым способом с замедленным высвобождением, по сравнению с крысами, получавшими лечение тем же лекарственным средством путем ежедневных инъекций.
Таким образом, в соответствии с одним из аспектов настоящего изобретения предложена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемую соль, приготовленная в форме для пролонгированного высвобождения указанного активного агента. В предпочтительном варианте реализации активный агент, содержащийся в указанной фармацевтической композиции, представляет собой R(+)-N-пропаргил-1-аминоиндан (разагилин) или его фармацевтически приемлемую соль.
В соответствии с другим аспектом настоящего изобретения предложена пеллета с пролонгированным высвобождением, содержащая:
(i) инертное ядро пеллеты;
(ii) слой лекарственного средства, покрывающий указанное ядро пеллеты, при этом указанный слой лекарственного средства содержит активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически 20 приемлемую соль, возможно подходящим образом смешанные со связующим веществом и/или пленкообразующим полимером, и возможно дополнительно смешанные с веществом, способствующим скольжению;
(iii) возможно, изолирующий/защитный подслой покрытия, покрывающий указанный слой лекарственного средства; и
(iv) слой покрытия с замедленным высвобождением, покрывающий указанный подслой покрытия (при его наличии) или указанный слой лекарственного средства.
В соответствии с еще одним аспектом настоящего изобретения предложена фармацевтическая композиция для перорального введения, содержащая пеллеты с 30 пролонгированным высвобождением, как определено выше.
Различные фармацевтические композиции согласно настоящему изобретению подходят для лечения нейродегенеративных заболеваний, предпочтительно болезни Паркинсона, и повреждений нервной системы.
Таким образом, в соответствии с другим аспектом настоящее изобретение 35 относится к способу лечения нейродегенеративного заболевания или повреждения нервной системы у нуждающегося в этом индивидуума, включающему введение указанному индивидууму фармацевтической композиции, определенной выше.
В соответствии с еще одним аспектом настоящее изобретение относится к способу получения состава в форме для пролонгированного высвобождения, содержащего активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемую соль, включающему этапы:
(i) растворения указанного активного агента, возможно подходящим образом смешанного со связующим веществом и/или веществом, способствующим скольжению, в подходящей системе растворителей с получением однородной суспензии;
(ii) нанесения слоя указанной суспензии, полученной на этапе (i), на инертные пеллеты, такие как инертные гранулы нонпарель (nonpareil seeds);
(iii) возможно, нанесения на пеллетысодержащие активный агент, полученные на этапе (ii), изолирующего/защитного подслоя покрытия;
(iv) нанесения на пеллеты, полученные на этапе (ii) или (iii), слоя покрытия с пролонгированным высвобождением, который обеспечивает пролонгированное высвобождение указанного активного агента, с получением тем самым указанного состава с пролонгированным высвобождением; и
(v) возможно, смешивания покрытых пеллет, полученных на этапе (iv), с подходящим наполнителем.
КРАТКОЕ ОПИСАНИЕ ФИГУР
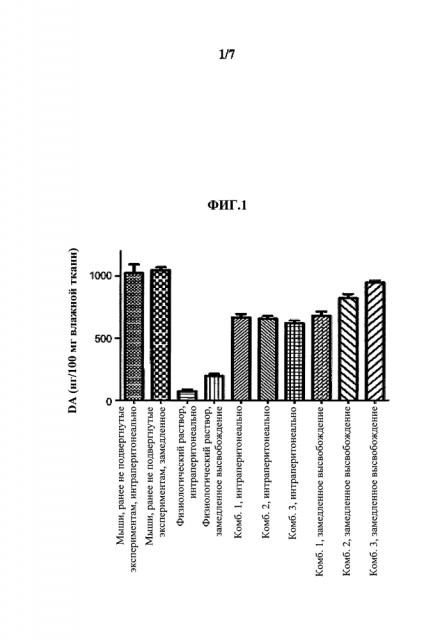
На Фиг.1 показано влияние комбинаций разагилин-прамипексол (pramipexole) (обозначенных Комб. 1, 2 и 3), в которых доза прамипексола является постоянной (0,5 мг/кг), а доза разагилина варьируется (0,1, 0,12 или 0,15 мг/кг, соответственно) на уровни допамина (DA) в головном мозге. В частности, как показано, введение МРТР без лекарственной терапии (физиологический раствор интраперитонеально и с замедленным высвобождением) вызывало снижение уровней допамина более чем на 80% по сравнению с уровнями у мышей, ранее не подвергнутых экспериментам (мыши, ранее не подвергнутые экспериментам, интраперитонеальное и введение способом с замедленным высвобождением). Лечение (интраперитонеальное введение) комбинациями разагилин-прамипексол вызывало восстановление уровней допамина до примерно 60% у мышей, ранее не подверженных экспериментам, - эффект, практически одинаковый для всех трех комбинаций; однако те же три комбинации при их введении способом с замедленным высвобождением (ЗВ) с использованием насоса Alzet, приводило к значительному дозозависимому повышению уровней допамина до 57%, 74% и 88% в соответствии с повышенными дозами разагилина.
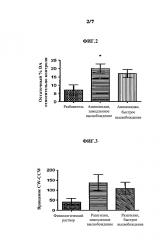
На Фиг.2 показано влияние метаболита разагилина, аминоиндана, при введении ЗВ на уровни допамина (DA) в головном мозге. В частности, воздействие МРТР вызывало снижение уровней допамина более чем на 90% по сравнению с уровнями у мышей, ранее не подвергнутых экспериментам. Лечение аминоинданом, введенным способом с медленным высвобождением (ЗВ), вызывало значительное восстановление уровней допамина по сравнению с уровнями у мышей, получавших лечение разбавителем или аминоинданом, вводимым путем ежедневных интраперитонеальных инъекций (IP).
На Фиг.3 показано чистое вращение, индуцированное амфетамином, которое представляет собой вращение по часовой стрелке за вычетом вращения против часовой стрелки (CW-CCW), измеренное у крыс, получавших лечение разагилином, как описано в Примере 3. Значительно улучшенный эффект в чистом вращении показан у крыс, получавших лечение разагилином с пролонгированным высвобождением (ЗВ) с использованием насоса Alzet, по сравнению с крысами, получавшими лечение разагилином с быстрым высвобождением (БВ) путем ежедневных интраперитонеальных инъекций.
На Фиг.4 приведены данные растворения in vitro для пеллет мезилата разагилина (1,0 мг) со слоем покрытия с пролонгированным высвобождением (ПВ) из Примеров 4-6 (15% ПВ, 22% ПВ и 28% ПВ, соответственно) в буферном растворе кишечной жидкости (IFS).
На Фиг.5 приведены данные растворения in vitro для пеллет мезилата разагилина (1,0 мг) со слоем покрытия с пролонгированным высвобождением (ПВ), содержащие подслой покрытия, из Примеров 7-8 (15% ПВ и 16% ПВ, соответственно) в буфере IFS.
На Фиг.6 приведены данные растворения in vitro для пеллет мезилата разагилина (1,0 мг) со слоем покрытия с пролонгированным высвобождением (ПВ), содержащие подслой покрытия, из Примера 7 (15% ПВ) в (i) буфере IFS (рН 6,8), имитирующем условия в кишечнике; (ii) буферном растворе желудочного сока (GFS) (рН 1,2), имитирующем условия в пустом желудке; (iii) буфере GFS в течение 2 часов, а затем буфере IFS в течение еще 20 часов; (iv) ацетатном буфере (рН 4,5), имитирующем условия в полном желудке; и (v) дистиллированной воде (DI).
На Фиг.7 приведены данные исследования стабильности in vitro в буфере IFS для пеллет мезилата разагилина (1,0 мг) со слоем покрытия с пролонгированным высвобождением (ПВ), содержащих подслой покрытия, из Примера 7 (15% ПВ) в нулевой момент времени (сразу после получения), через 1 месяц при 40°С и 75% влажности (1М Аcc.) и через 2 и 3 месяца при 40°С и 75% влажности (2М Аcc. и 3М Аcc., соответственно).
На Фиг.8 приведены данные растворения in vitro для пеллет мезилата разагилина со слоем покрытия с пролонгированным высвобождением (ПВ), содержащих подслой покрытия, из Примера 7 (27% ПВ) в буфере IFS.
На Фиг.9 показан график зависимости концентрации разагилина в плазме крови (нг/мл) от времени, вводимого способом внутривенного болюсного введения, дуоденального болюсного введения или болюсного введения в толстую кишку.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Основной причиной ингибирования моноаминоксидазы Б (МАО-Б) при болезни Паркинсона является повышение активности стриарного допамина, приводящее к симптоматическим полезным эффектам в отношении двигательной функции. Поскольку МАО-Б ответственна, среди прочего, за гидролиз допамина, ингибирование МАО-Б вызывает увеличение уровня допамина. Согласно описанному механизму действия, активность разагилина отделена от его фармакокинетики вследствие того, что ингибирование МАО-Б разагилином является необратимым и, таким образом, эффект, обусловленный указанным ингибированием, сохраняется до образования новой МАО-Б, т.е. в течение примерно 2-3 недель. Следовательно, можно предположить, что не будет никакого полезного эффекта от введения разагилина способом с замедленным высвобождением. Тем не менее, недавно полученные данные показывают, что разагилин может индуцировать нейропротективное действие по альтернативному механизму - через ингибирование апоптоза или других путей. Также известно, что разагилин подвергается значительному метаболизму, и его основной метаболит, 1-аминоиндан, обладает нейропротекторной активностью, не связанной с ингибированием МАО-Б (Bar-Am et al., 2007; Weinreb et al., 2010).
Разагилин, селегилин и другие структурно родственные производные пропаргиламина увеличивают выживаемость нейронов независимо от ингибирования МАО-Б, отчасти за счет уменьшения апоптоза (Tatton et al., 2002). Данный эффект наиболее вероятно модулируется за счет изменения уровней или субклеточной локализации белков, влияющих на проницаемость мембраны митохондрий, удаляющих окислительные радикалы или участвующих в конкретных сигнальных путях апоптоза. Было подтверждено, что как разагилин, так и селегилин, а также другие производные пропаргиламина защищают нейроны от клеточной гибели, индуцируемой различными поражениями в моделях нейродегенеративных нарушений в клетках и у животных, таких как болезнь Паркинсона и болезнь Альцгеймера. Цепь пропаргиламина придает дозозависимые антиоксидантные и антиапоптотические эффекты, которые ассоциировали с нейропротекторным действием во многих экспериментальных моделях. Согласно недавним публикациям, нейропротекторное действие разагилина может быть связано с действием, обусловленным комбинацией разагилина и его метаболита 1-аминоиндана (Tazik et al., 2009; Bar-Am, 2010).
В соответствии с одним из аспектов настоящего изобретения предложена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемую соль, приготовленная в форме для пролонгированного высвобождения указанного активного агента.
Идея, лежащая в основе настоящего изобретения, основана на результатах, приведенных в разделе Примеры далее. В Примере 1 показано, что в то время как однократное введение возрастающих доз разагилина (0,1, 0,12 или 0,15 мг/кг) в модели БП, индуцированной МРТР, у мышей оказывало практически схожее действие на уровни допамина, приводя к повышению содержания допамина до примерно 60% по сравнению с мышами, не получавшими лекарственное средство (подвергнутые воздействию МРТР), введение таких же трех доз разагилина способом с замедленным высвобождением в течение 24 часов приводило к значительному эффекту дозы, при котором уровни допамина составляли 57%, 74% и 88%, соответственно, по сравнению с мышами, не получавшими лекарственное средство, что указывает на высоко благоприятный эффект введения способом с замедленным высвобождением по сравнению со способом с быстрым высвобождением в отношении уровней допамина в головном мозге мышей, подвергнутых воздействию МРТР. В Примере 2 описано исследование с использованием такой же модели БП у мышей, в котором мышей лечили метаболитом разагилина - 1-аминоинданом, и показано, что лечение 1-аминоинданом, вводимым способом с замедленным высвобождением, вызывает значительное восстановление уровней допамина по сравнению с уровнями у мышей, получавшими лечение разбавителем (физиологическим раствором) или тем же лекарственным средством, вводимым путем ежедневных инъекций. Эти выводы также подтверждены исследованием, описанным в Примере 3, показывающим, что в модели БП, индуцированной 6-OHDA, у крыс наблюдают значительно улучшенный эффект при чистом вращении (CW-CCW), индуцированном амфетамином, у крыс, получавших лечение разагилином, вводимым способом с замедленным высвобождением, по сравнению с крысами, получавшими лечение тем же лекарственным средством путем ежедневных инъекций.
Как в действительности показано в настоящем описании в первый раз, когда разагилин вводят способом с пролонгированным высвобождением, воздействие указанного лекарственного средства или его активного метаболита, 1-аминоиндана, значительно продлевается, обеспечивая, таким образом, гораздо более эффективное нейропротективное действие, которое может заметно улучшать состояние пациента. В соответствии с данной идей, как разагилин, так и селегилин, являющиеся ингибиторами МАО-Б, показанными для лечения болезни Паркинсона, а также другие производные пропаргиламина, можно считать «пролекарствами», непрерывно высвобождающими активный агент, или «доставляющими разбавителями» пропаргиламина/аминоиндана. Данные пролекарства или доставляющие разбавители независимо от их ингибирующей активности в отношении МАО, защищают нервные клетки на разных стадиях процесса апоптоза за счет постоянного замедленного воздействия активного агента, определенного выше, т.е. активного агента, содержащего пропаргиламинный фрагмент, аминоиндановый фрагмент, или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемой соли.
Согласно настоящему изобретению можно использовать любую фармацевтически приемлемую соль активного агента. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими, мезилатную соль, эзилатную соль, тозилатную соль, сульфатную соль, сульфонатную соль, фосфатную соль, карбоксилатную соль, малеатную соль, фумаратную соль, тартратную соль, бензоатную соль, ацетатную соль, гидрохлоридную соль и гидробромидную соль.
В некоторых вариантах реализации активный агент, содержащийся в фармацевтической композиции согласно настоящему изобретению, представляет собой N-пропаргил-1-аминоиндан, его энантиомер, его метаболит, его аналог или фармацевтически приемлемую соль любого из вышеуказанных соединений.
В одном из конкретных вариантов реализации активный агент представляет собой N-пропаргил-1-аминоиндан в рацемической форме, как описано, например, в US 6630514, или его фармацевтически приемлемую соль.
В других конкретных вариантах реализации активный агент представляет собой R(+)-N-пропаргил-1-аминоиндан (разагилин), его S-энантиомер S-(-)-N-пропаргил-1-аминоиндан или его фармацевтически приемлемую соль. В более конкретных вариантах реализации активный агент представляет собой мезилатную соль, эзилатную соль, тозилатную соль, сульфатную соль, сульфонатную соль, фосфатную соль, карбоксилатную соль, малеатную соль, фумаратную соль, тартратную соль, бензоатную соль, ацетатную соль, гидрохлоридную соль или гидробромидную соль либо разагилина, либо S-(-)-N-пропаргил-1-аминоиндана. В предпочтительных вариантах реализации активный агент представляет собой мезилат разагилина, описанный, например, в US 5532415; эзилат разагилина или сульфат разагилина, описанные, например, в US 5599991; или гидрохлорид разагилина, описанный, например, в US 6630514, и, более предпочтительно, мезилат разагилина.
В другом конкретном варианте реализации активный агент представляет собой метаболит разагилина - 1-аминоиндан, или его фармацевтически приемлемую соль.
В еще других конкретных вариантах реализации активный агент представляет собой аналог N-пропаргил-1-аминоиндана, его энантиомера или его фармацевтически приемлемую соль. Примеры указанных аналогов включают соединения, описанные в US 5486541, такие как, без ограничения ими, 4-фтор-N-пропаргил-1-аминоиндан, 5-фтор-N-пропаргил-1-аминоиндан и 6-фтор-N-пропаргил-1-аминоиндан; соединения, описанные в US 6251938, такие как, без ограничения ими, 3-(N-метил-N-пропилкарбамилокси)-α-метил-N'-пропаргилфенэтиламин, 3-(N,N-диметилкарбамилокси)-α-метил-N'-метил-N'-пропаргилфенэтиламин; 3-(N-метил-N-гексилкарбшилокси)α-метил-N'-метил-N'-пропаргилфенэтиламин; 3-(N-метил-N-циклогексилкарбамилокси)-α-метил-N'-метил-N'-пропаргилфенэтиламин и 3-(N-метил-N-гексилкарбамилокси)-α-метил-N'-метил-N'-пропаргилфенэтиламин; соединения, описанные в US 6303650, такие как, без ограничения ими, 6-(N-метил-N-этилкарбамилокси)-N'-пропаргил-1-аминоиндан; 6-(N,N-диметилкарбамилокси)-N'-метил-N'-пропаргил-1-аминоиндан; 6-(N-метил-N-этилкарбамилокси-N'-пропаргил-1-аминотетралин; 6-(N,N-диметилтиокарбамилокси)-1-аминоиндан; 6-(N-пропилкарбамилокси)-N'-пропаргил-1-аминоиндан; 5-хлор-6-(N-метил-N-пропилкарбамилокси)-N'-пропаргил-1-аминоиндан и 6-(N-метил)-N-пропилкарбамилокси)-N'-пропаргил-1-аминоиндан; и соединения, описанные в US 6462222, такие как, без ограничения ими, 6-(N-метил-N-этилкарбамилокси)-N'-метил-N'-пропаргил-1-аминоиндан.
В некоторых других вариантах реализации активный агент, содержащийся в фармацевтической композиции согласно настоящему изобретению, представляет собой пропаргиламин, алифатический пропаргиламин или его фармацевтически приемлемую соль.
В одном из конкретных вариантов реализации активный агент представляет собой пропаргиламин или его фармацевтически приемлемую соль.
В других конкретных вариантах реализации активный агент представляет собой алифатический пропаргиламин, описанный в US 5169868, US 5840979 или US 6251950, такой как, не ограничиваясь ими, N-(1-гептил)пропаргиламин; N-(1-октил)пропаргиламин; N-(1-нонил)пропаргиламин; N-(1-децил)пропаргиламин; N-(1-ундецил)пропаргиламин; N-(1-додецил)пропаргиламин; N-(2-бутил)пропаргиламин; N-(2-пентил)пропаргиламин; N-(2-гексил)пропаргиламин; N-(2-гептил)пропаргиламин; N-(2-октил)пропаргиламин; N-(2-нонил)пропаргиламин; N-(2-децил)пропаргиламин; N-(2-ундецил)пропаргиламин; N-(2-додецил)пропаргиламин; N-(1-бутил)-N-метилпропаргиламин; N-(2-бутил)-N-метилпропаргиламин; N-(2-пентил)-N-метилпропаргиламин; (1-пентил)-N-метилпропаргиламин; N-(2-гексил)-N-метилпропаргиламин; (2-гептил)-N-метилпропаргиламин; N-(2-децил)-N-метилпропаргиламин; (2-додецил)-N-метилпропаргиламин; энантиомер указанных соединений; или фармацевтически приемлемую соль указанных соединений.
В некоторых других вариантах реализации активный агент, содержащийся в фармацевтической композиции согласно настоящему изобретению, представляет собой селегилин, десметилселегилин, паргилин или хлоргилин.
В другом варианте реализации активный агент, содержащийся в фармацевтической композиции согласно настоящему изобретению, представляет собой (N-метил-N-пропаргил)-10-аминометилдибензо[b,f]оксепин, также известный как: CGP 3466 и описанный в публикации Zimmermann et al. (1999).
Полное содержание всех патентов США и других публикаций, указанных выше, включено в настоящее описание посредством ссылки так, как если бы было полностью приведено в настоящем документе.
Термины «пролонгированное высвобождение» (ПВ), «контролируемое высвобождение» или «замедленное высвобождение» (ЗВ), являющиеся взаимозаменяемыми в настоящем описании, относятся к такому режиму высвобождения активного агента из его состава, при котором он всасывается в организме в течение определенного периода времени. Состав активного агента с пролонгированным высвобождением может быть получен, например, путем заключения указанного активного агента в каркас вещества, которое организм медленно растворяет, так, чтобы активный ингредиент медленно и постоянно «просачивался» из слоя покрытия, или за счет набухания активного агента с образованием геля с почти непроницаемой поверхностью, при этом лекарственное средство медленно выходит из полупроницаемого слоя.
Основные принципы получения продукта с контролируемым высвобождением заключаются в высвобождении вещества в определенном месте (прицельное воздействие); с постоянной скоростью; и в пределах необходимого терапевтического окна. Механизмы, основанные на принципе Системы контроля растворителями (Solvent Controlled System), такой как системы набухания и осмоса, поддерживающие постоянную концентрацию активного вещества в крови в течение длительных периодов времени, позволяют достигать более эффективных уровней лекарственного средства с меньшими побочными эффектами. Иными словами, терапевтическое окно представляет собой дозу лекарственного средства между количеством, оказывающим эффект (эффективная доза), и количеством, оказывающим больше побочных эффектов, чем желаемых эффектов. Поэтому, характеристики растворения каждого лекарственного средства должны быть соответствовать индивидуальной биодоступности, месту воздействия и всасываемости каждого соединения.
Фармацевтическая композиция согласно настоящему изобретению должна обеспечивать контролируемое высвобождение лекарственного средства, т.е. активного агента. В некоторых вариантах реализации лекарственное средство высвобождается из фармацевтической композиции способом с контролируемым высвобождением согласно кривой высвобождения нулевого, первого, второго или любого другого порядка (N порядка). Контролируемое высвобождение лекарственного средства предпочтительно должно быть медленными, и в некоторых вариантах реализации фармацевтическую композицию готовят в форме для непрерывного замедленного высвобождения лекарственного средства, пульсирующего высвобождения лекарственного средства, многоэтапного высвобождения лекарственного средства или их комбинацию.
Фармацевтические композиции согласно настоящему изобретению могут быть получены традиционными способами, например, описанными в Remington: The Science and Practice of Pharmacy, 19th Ed., 1995, могут находиться в любой традиционной форме и могут быть представлены в различных дозировках.
Композиции могут быть приготовлены в форме для любого подходящего способа введения, например, внутривенного, внутриартериального, внутримышечного, подкожного или интраперитонеального введения, но, предпочтительно, их готовят в форме для перорального введения.
Доза будет зависеть от состояния пациента и будет определяться по усмотрению лечащего врача. В конкретных вариантах реализации доза составляет 0,1-2,0, предпочтительно, 0,2-1,5, более предпочтительно, 0,5-1,0 мг в сутки для взрослого с массой тела 60 кг. Композиции согласно настоящему изобретению можно вводить, например, непрерывно, ежедневно, два раза в сутки, три раза в сутки или четыре раза в сутки, в течение периодов различной длительности, например, недель, месяцев, лет или десятилетий.
Фармацевтическая композиция согласно настоящему изобретению может, например, находиться в форме стерильной водной или масляной суспензии для инъекций, которая может быть приготовлена в соответствии с известными в данной области способами с применением подходящих диспергирующих, смачивающих или суспендирующих агентов. Стерильный лекарственный препарат для инъекций также может представлять собой стерильный раствор или суспензию для инъекций в приемлемом для парентерального введения нетоксичном разбавителе или растворителе. Приемлемые для использования разбавители и растворители включают, но не ограничиваются ими, воду, раствор Рингера и изотонический раствор хлорида натрия.
Фармацевтические композиции согласно настоящему изобретению, приготовленные для перорального введения, могут быть в форме таблеток, пастилок, леденцов, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, или сиропов или эликсиров. Фармацевтические композиции, предназначенные для перорального применения, могут быть приготовлены в соответствии с любым способом, известным в данной области техники для приготовления фармацевтических композиций, и могут дополнительно содержать один или более агентов, выбранных из подсластителей, ароматизаторов, красителей и консервантов, с целью получения фармацевтически привлекательных и приятных на вкус препаратов. Таблетки содержат активный агент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, подходящими для изготовления таблеток. Данные наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие агенты и вещества, улучшающие распадаемость таблеток, такие как кукурузный крахмал или альгиновая кислота; связующие вещества; и смазывающие вещества. На таблетки предпочтительно наносят покрытие с использованием известных способов для задерживания распада и всасывания в желудочно-кишечном тракте и, тем самым, обеспечения пролонгированного высвобождения лекарственного средства в течение более длительного периода времени. Например, может быть использовано вещество с замедленным распадом, такое как глицерилмоностеарат или глицерилдистеарат. На них также может быть нанесено покрытие с использование способов, описанных в патентах США US 4256108, US 4166452 и US 4265874, с получением осмотических терапевтических таблеток для контроля высвобождения. Фармацевтическая композиция согласно настоящему изобретению также может быть в форме двухслойных таблеток, в которых два или более различных слоев гранулята спрессованы вместе и отдельными слоями лежат один поверх другого, при этом каждый отдельный слой получен для обеспечения разных режимов высвобождения лекарственного средства. Фармацевтическая композиция для перорального применения согласно настоящему изобретению также может быть в форме эмульсии «масло-в-воде».
Фармацевтические композиции согласно настоящему изобретению также могут быть изготовлены в виде матрицы с контролируемым высвобождением, например, в виде матричных таблеток с контролируемым высвобождением, в которых высвобождение растворимого активного агента контролируется за счет наличия активной диффузии через гель, образованный после набухания гидрофильного полимера, приведенного в контакт с растворяющей жидкостью (in vitro) или желудочно-кишечной жидкостью (in vivo). Было описано множество полимеров, способных образовывать такой гель, например, производные целлюлозы, в частности, простые эфиры целлюлозы, такие как гидроксипропилцеллюлоза, гидроксиметилцеллюлоза, метилцеллюлоза или гидроксипропилметилцеллюлоза, и среди разных коммерческих доступных таких эфиров есть соединения с довольно высокой вязкостью. В других вариантах реализации указанные композиции содержат активный агент, негодящийся в микроинкапсулированной лекарственной форме с контролируемым высвобождением, представляющей собой мелкие вкрапления активного агента, покрытые оболочкой или мембраной с образованием частиц размером от нескольких микрометров до нескольких миллиметров.
Другая предполагаемая лекарственная форма представляет собой депо-системы на основе биоразлагаемых полимеров, в которых по мере распада полимера медленно высвобождается активный агент. Наиболее распространенной группой биоразлагаемых полимеров являются гидролитически лабильные полиэфиры, полученные из молочной кислоты, гликолевой кислоты или их комбинаций.
Фармацевтическая композиция согласно настоящему изобретению может содержать один или более фармацевтически приемлемых наполнителей. Например, таблетка может содержать по меньшей мере один наполнитель, например, лактозу, этилцеллюлозу, микрокристаллическую целлюлозу, силицированную микрокристаллическ