Комбинированная противораковая терапия
Иллюстрации
Показать всеДанное изобретение относится к комбинированной терапии {3-[5-(4-хлорфенил)-1Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфенил}амидом пропан-1-сульфокислоты (соединение 1) или его фармацевтически приемлемой солью и ингибитором EGFR, выбранный из эрлотиниба и цетуксимаба для лечения рака, содержащего b-Raf с мутацией V600, более конкретно колоректального рака, меланомы и рака щитовидной железы. Комбинация соединения 1 с ингибитором EGFR приводит к улучшенным противоопухолевым эффектам, которые значительно превосходят результаты, полученные для каждого соединения в отдельности без увеличения токсичности. 6 н. и 14 з.п. ф-лы,6 пр., 15 табл., 9 ил.
Реферат
Область изобретения
Данное изобретение относится к комбинированной терапии для лечения пациентов, страдающих от пролиферативного нарушения, в частности солидной опухоли, например от колоректального рака, меланомы и рака щитовидной железы, включающей введение пациенту {3-[5-(4-хлор-фенил)-1Н-пирроло[2,3-b]пиридин-3-карбонил-2,4-дифторфенил}амида пропан-1-сульфокислоты и ингибитора EGFR.
Уровень изобретения
Нормально функционирующая b-Raf представляет собой киназу, которая участвует в передаче сигналов от клеточной мембраны к ядру, и является активной только тогда, когда это необходимо для передачи таких сигналов. Тем не менее, мутантная b-Raf, имеющая мутацию V600E, постоянно активна и, таким образом, играет роль в развитии опухоли. Такая мутантная b-Raf была найдена при различных опухолях, например, колоректальном раке, меланоме и раке щитовидной железы.
Пропан-1-сульфокислоты {3-[5-(4-хлор-фенил)-1Н-пирроло[2,3-b]пиридин-3-карбонил-2,4-дифторфенил]амид} (далее также называемый «Соединение I») представляет собой ингибитор киназы b-Raf, который специфически нацелен на мутантную b-Raf с мутацией V600E. Это соединение описано в WO 2007/002325. Соответственно, такой ингибитор используется для ингибирования опухолей, особенно солидных опухолей, например, колоректального рака, меланомы и рака щитовидной железы, которые содержат b-Raf с мутацией V600, предпочтительно мутацией V600E.
Белковые тирозинкиназы (protein tyrosine kinases, PTK) катализируют фосфорилирование остатков тирозина в различных белках, участвующих в регуляции роста и дифференцировки клеток (Wilks et al., Progress in Growth Factor Research 97 (1990) 2; Chan, А.С., and Shaw, A.S., Curr. Opin. Immunol. 8 (1996) 394-401). Такие PTK можно разделить на рецепторные тирозинкиназы (например, EGFR/HER-1, c-erbB-2/HER-2, c-met, PDGFr, FGFr) и нерецепторные тирозинкиназы (например, src, Ick).
Известно, что рецепторные тирозинкиназы из HER-семейства, такие как HER-2 и EGFR (HER-1), часто аберрантно экспрессированы в распространенных человеческих раках, таких как рак молочной железы, рака желудочно-кишечного тракта (рак толстой кишки, прямой кишки и желудка), рака щитовидной железы, лейкемия, рак яичников, бронхов и поджелудочной железы и меланома. Высокие уровни этих рецепторов коррелируют с плохим прогнозом и ответом на лечение (Wright, С., et al., Br.J.Cancer 65 (1992) 118-121).
Ингибиторы РТК и, в частности, EGFR были разработаны. Тем не менее, также известно, что опухоли, содержащие b-Raf с мутацией V600E, устойчивы к лечению ингибиторами EGFR. См. Prewett et al., Clin. Cancer Res. (2002), 8:994-1003 и Ouchi et al., Cancer Chemother. Pharmacol. (2006), 57:693-702. Тем не менее, заявители неожиданно обнаружили, что комбинация соединения I с ингибитором EGFR не только способна снизить такую устойчивость, но также приводит к улучшенным противоопухолевым эффектам, которые значительно превосходят результаты, полученные для каждого соединения в отдельности, без значительного увеличения токсичности.
В дополнение к ингибиторам EGFR, ингибиторы топоизомеразы также являются антипролиферативными агентами. Тем не менее, также известно, что опухоли с мутацией V600E устойчивы к лечению ингибиторами топоизомеразы. См. Prewett et al., Clin. Cancer Res. (2002), 8:994-1003 и Abal et al., Oncogene (2004), 23:1737-44. Тем не менее, заявители неожиданно обнаружили, что комбинация соединения I с ингибитором EGFR и ингибитором топоизомеразы не только способна снизить такую устойчивость, но также приводит к улучшенным противоопухолевым эффектам, которые значительно превосходят результаты, полученные для каждого соединения в отдельности или для упомянутой выше комбинации соединения I с ингибитором EGFR, без значительного увеличения токсичности.
Сущность изобретения
Данное изобретение относится к фармацевтическому продукту;
включающему: (А) первый компонент, который содержит в качестве активного агента {3-[5-(4-хлор-фенил)-1Н-пирроло[2,3-b]пиридин-3-карбонил-2,4-дифторфенил}амид пропан-1-сульфокислоты или его фармацевтически приемлемую соль; и (В) второй компонент, который включает в качестве активного агента ингибитор EGFR; в виде комбинированного препарата для одновременного или последовательного применения в лечении пролиферативного нарушения, в частности, рака, более конкретно колоректального рака, меланомы и рака щитовидной железы, содержащего b-Raf с мутацией V600 и, в частности, с мутацией V600E.
Данное изобретение также относится к способу лечения пациента, страдающего от пролиферативного нарушения, который включает введение комбинации, упомянутой выше.
Данное изобретение также относится к набору, включающему: (А) первый компонент, который содержит в качестве активного агента соединение 1 или его фармацевтически приемлемую соль; и (В) второй компонент, который содержит в качестве активного агента ингибитор EGFR.
Данное изобретение также относится к набору, включающему: (А) первый компонент, который содержит в качестве активного агента соединение 1 или его фармацевтически приемлемую соль; и (В) второй компонент, который содержит в качестве активного агента ингибитор EGFR; и возможно (С) третий компонент, который содержит ингибитор топоизомеразы или его фармацевтически приемлемую соль; в виде комбинированного препарата для одновременного или последовательного применения в лечении пролиферативного нарушения, в частности, рака, более конкретно колоректального рака, меланомы и рака щитовидной железы, содержащего b-Raf с мутацией V600 и, в частности, с мутацией V600E.
Кроме того, данное изобретение относится к применению соединения 1 или его фармацевтически приемлемой соли и ингибитора EGFR для лечения пролиферативного нарушения.
Еще одним аспектом данного изобретения является применение соединения 1 или его фармацевтически приемлемой соли и ингибитора EGFR для изготовления лекарственного средства для лечения пролиферативного нарушения.
Краткое описание графических материалов
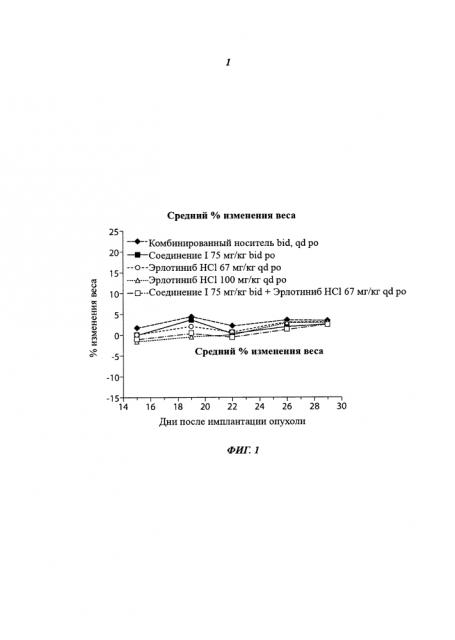
На фиг.1 приведена переносимость, показанная как % изменения массы тела при монотерапии соединением I в дозе 75 мг/кг 2 раза/день, при монотерапии эрлотиниба гидрохлоридом в дозе 67 мг/кг 1 раз/день, при монотерапии эрлотиниба гидрохлоридом в дозе 100 мг/кг 1 раз/день, и при комбинированной терапии соединением I в дозе 75 мг/кг 2 раза/день и эрлотиниба гидрохлоридом в дозе 67 мг/кг 1 раз/день.
На фиг.2 приведена противоопухолевая активность, показанная как изменение среднего объема опухоли с течением времени при монотерапии соединением I в дозе 75 мг/кг 2 раза/день, при монотерапии эрлотиниба гидрохлоридом в дозе 67 мг/кг 1 раз/день, при монотерапии эрлотиниба гидрохлоридом в дозе 100 мг/кг 1 раз/день, и при комбинированной терапии соединением I в дозе 75 мг/кг 2 раза/день и эрлотиниба гидрохлоридом в дозе 67 мг/кг 1 раз/день.
На фиг.3 приведено влияние на выживаемость, показанное как процент выживших мышей с течением времени при монотерапии соединением I в дозе 75 мг/кг 2 раза/день, при монотерапии эрлотиниба гидрохлоридом в дозе 67 мг/кг 1 раз/день, при монотерапии эрлотиниба гидрохлоридом в дозе 100 мг/кг 1 раз/день, и при комбинированной терапии соединением I в дозе 75 мг/кг 2 раза/день и эрлотиниба гидрохлоридом в дозе 67 мг/кг 1 раз/день.
На фиг.4 приведена переносимость, показанная как % изменения массы тела при монотерапии соединением I в дозе 75 мг/кг 2 раза/день, при монотерапии соединением I в дозе 25 мг/кг 2 раза/день, при монотерапии цетуксимабом в дозе 40 мг/кг 2 раза/нед, при комбинированной терапии соединением I в дозе 25 мг/кг 2 раза/день и цетуксимабом в дозе 40 мг/кг 2 раза/нед, и при комбинированной терапии соединением I в дозе 75 мг/кг 2 раза/день и цетуксимабом в дозе 40 мг/кг 2 раза/нед.
На фиг.5 приведена противоопухолевая активность, показанная как изменение среднего объема опухоли с течением времени при монотерапии соединением I в дозе 75 мг/кг 2 раза/день, при монотерапии соединением I в дозе 25 мг/кг 2 раза/день, при монотерапии цетуксимабом в дозе 40 мг/кг 2 раза/нед, при комбинированной терапии соединением I в дозе 25 мг/кг 2 раза/день и цетуксимабом в дозе 40 мг/кг 2 раза/нед, и при комбинированной терапии соединением I в дозе 75 мг/кг 2 раза/день и цетуксимабом в дозе 40 мг/кг 2 раза/нед.
На фиг.6 приведено влияние на выживаемость, показанное как процент выживших мышей с течением времени при монотерапии соединением I в дозе 75 мг/кг 2 раза/день, при монотерапии соединением I в дозе 25 мг/кг 2 раза/день, при монотерапии цетуксимабом в дозе 40 мг/кг 2 раза/нед, при комбинированной терапии соединением I в дозе 25 мг/кг 2 раза/день и цетуксимабом в дозе 40 мг/кг 2 раза/нед, и при комбинированной терапии соединением I в дозе 75 мг/кг 2 раза/день и цетуксимабом в дозе 40 мг/кг 2 раза/нед.
На фиг.7 приведена переносимость, показанная как % изменения массы тела при монотерапии соединением I в дозе 25 мг/кг 2 раза/день, при монотерапии цетуксимабом в дозе 40 мг/кг 2 раза/нед, при монотерапии иринотеканом HCl в дозе 40 мг/кг q4dx5, при комбинированной терапии соединением I в дозе 25 мг/кг 2 раза/день и иринотеканом HCl в дозе 40 мг/кг q4dx5, при комбинированной терапии цетуксимабом в дозе 40 мг/кг 2 раза/неделя и иринотеканом HCl в дозе 40 мг/кг q4dx5, при комбинированной терапии соединением 1 в дозе 25 мг/кг 2 раза/день и цетуксимабом в дозе 40 мг/кг 2 раза/нед, и при комбинированной терапии соединением 1 в дозе 25 мг/кг 2 раза/день, цетуксимабом в дозе 40 мг/кг 2 раза/нед и иринотеканом HCl в дозе 40 мг/кг q4dx5.
На фиг.8 приведена противоопухолевая активность, показанная как изменение среднего объема опухоли с течением времени при монотерапии соединением 1 в дозе 25 мг/кг 2 раза/день, при монотерапии цетуксимабом в дозе 40 мг/кг 2 раза/нед, при монотерапии иринотеканом HCl в дозе 40 мг/кг q4dx5, при комбинированной терапии соединением 1 в дозе 25 мг/кг 2 раза/день и иринотеканом HCl в дозе 40 мг/кг q4dx5, при комбинированной терапии цетуксимабом в дозе 40 мг/кг 2 раза/нед и иринотеканом HCl в дозе 40 мг/кг q4dx5, при комбинированной терапии соединением 1 в дозе 25 мг/кг 2 раза/день и цетуксимабом в дозе 40 мг/кг 2 раза/нед, и при комбинированной терапии соединением 1 в дозе 25 мг/кг 2 раза/день, цетуксимабом в дозе 40 мг/кг 2 раза/неделя и иринотеканом HCl в дозе 40 мг/кг q4dx5.
На фиг.9 приведено влияние на выживаемость, показанное как процент выживших мышей с течением времени при монотерапии соединением 1 в дозе 25 мг/кг 2 раза/день, при монотерапии цетуксимабом в дозе 40 мг/кг 2 раза/неделя, при монотерапии иринотеканом HCl в дозе 40 мг/кг q4dx5, при комбинированной терапии соединением 1 в дозе 25 мг/кг 2 раза/день и иринотеканом HCl в дозе 40 мг/кг q4dx5, при комбинированной терапии цетуксимабом в дозе 40 мг/кг 2 раза/нед и иринотеканом HCl в дозе 40 мг/кг q4dx5, при комбинированной терапии соединением 1 в дозе 25 мг/кг 2 раза/день и цетуксимабом в дозе 40 мг/кг 2 раза/нед, и при комбинированной терапии соединением 1 в дозе 25 мг/кг 2 раза/день, цетуксимабом в дозе 40 мг/кг 2 раза/нед и иринотеканом HCl в дозе 40 мг/кг q4dx5.
Подробное описание изобретения
Как определено выше, «Соединение I» в данном документе относится к {3-[5-(4-хлорфенил)-1Н-пирроло[2,3-b]пиридин-3-карбонил-2,4-дифторфенил]амиду}пропан-1-сульфокислоты. Это соединение имеет следующую структуру.
Соединение I представляет собой ингибитор киназы b-Raf, который специфически нацелен на b-Raf с мутацией V600E.
Понятие мутации «V600E» b-Raf, используемое в данном документе, относится к мутации в белке b-Raf, где остаток валина в позиции остатка 600 в b-Raf заменен глутаминовой кислотой.
Используемая в данном документе аббревиатура «HER», когда речь идет о рецепторных тирозинкиназах из HER-семейства, таких как HER-2 и EGFR (HER-1), относится к человеческому эпидермальному рецептору, а аббревиатура «EGFR» относится к рецептору эпидермального фактора роста.
Термин «комбинированный препарат», используемый в данном документе, означает одновременную или последовательную комбинацию. Активные агенты, используемые в данных комбинациях, например, соединение I или ингибитор топоизомеразы, такой как, например, иринотекан, или ингибитор EGFR, такой как эрлотиниб или его фармацевтически приемлемая соль или цетуксимаб, могут быть использованы в любой применимой лекарственной форме, такой как, например, таблетки, капсулы, растворы, суспензии и т.п., в зависимости от свойств выбранного активного ингредиента. Соединение I или его фармацевтически приемлемая соль могут быть введены, например, перорально. Эрлотиниб или его фармацевтически приемлемая соль могут быть введены, например, перорально. Цетуксимаб может быть введен, например, внутрибрюшинно или внутривенно. Иринотекан HCl или его фармацевтически приемлемая соль могут быть введены, например, внутрибрюшинно или внутривенно. Некоторые комбинации, описанные в данном документе, могут продемонстрировать терапевтический эффект, который является более чем аддитивным (синергетическим).
Используемый в данном документе термин «фармацевтически приемлемый носитель» означает, что указанный носитель не обладает свойствами, которые могут быть причиной того, что достаточно предусмотрительный врач будет избегать их введения пациенту с учетом заболевания или состояний, которые подвергают лечению, и соответствующих путей введения.
Используемый в данном документе термин «фармацевтически приемлемая соль» соединения относится к любой обычной соли или соли присоединения основания, которая сохраняет биологическую эффективность и свойства соединения и которая формируется из подходящей нетоксичной органической или неорганической кислоты, либо органического или неорганического основания. Используемый в данном документе термин «терапевтически эффективное» означает количество лекарственного средства или комбинации или композиции, которое является эффективным для получения желаемого терапевтического эффекта при введении пациенту, например, чтобы остановить рост или привести к сокращению раковой опухоли или увеличить продолжительность жизни пациента.
Термины «нарушение клеточной пролиферации» и «пролиферативное нарушение» относятся к нарушениям, связанным с некоторой степенью аномальной пролиферации клеток. В одном воплощении пролиферативное нарушение представляет собой рак.
Термины «рак» и «раковый» относятся к или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется неконтролируемым ростом/пролиферацией клеток. Примеры рака включают, но не ограничиваясь ими, колоректальный рак, меланому и рак щитовидной железы.
Термины «колоректальная опухоль» или «колоректальный рак» относятся к любой опухоли или раку толстого кишечника, который включает толстую кишку (толстый кишечник от слепой кишки до прямой кишки) и прямую кишку, в том числе, например, к аденокарциномам и менее распространенным формам, таким как лимфомы и плоскоклеточные карциномы.
«Ингибирование клеточного роста или пролиферации» означает уменьшение роста или пролиферации клеток по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100% и включает гибель клетки.
Фраза «существенно уменьшенный» или «существенно отличающийся», используемая в данном документе, относится к достаточно высокой степени различия между двумя числовыми значениями (как правило, одно связано с молекулой, а другое связано с референсной/сравниваемой молекулой), так что специалист в данной области будет рассматривать разницу между двумя значениями как статистически значимую в контексте биологической характеристики, измеряемой указанными значениями.
Термин «опухоль» относится к росту и пролиферации всех опухолевых клеток, независимо от того, злокачественные они или доброкачественные, и ко всем предраковым и раковым клеткам и тканям. Термины «рак», «раковый», «нарушение клеточной пролиферации», «пролиферативное нарушение» и «опухоль» не являются взаимоисключающими при упоминании в данном документе.
О «регрессии» опухоли говорят после лечения, когда объем указанной опухоли уменьшается. Если опухоль сохраняется (объем опухоли > 0 мм3), но ее объем уменьшается по сравнению с началом лечения, то говорят о «частичной регрессии» (partial регрессия, PR). Если после лечения опухоль пальпаторно не выявляется, то говорят о «полной регрессии» (complete регрессия,CR).
Термин «малая молекула», используемый в данном документе, представляет собой химическое соединение с молекулярной массой менее 1000 г/моль, предпочтительно менее 700 г/моль. Малые молекулы в соответствии с данным изобретением могут быть получены в результате химических реакций, известных специалистам в области органической химии и/или медицинской химии. Примерами малых молекул могут быть, но не ограничиваясь ими, соединение I или соединение, известное как эрлотиниб, предпочтительно эрлотиниба гидрохлорид.
Термин «большая молекула», используемый в данном документе, относится к химическим соединениям с молекулярной массой более 1000 г/моль. Предпочтительно «большие молекулы» представляют собой соединения, которые могут быть получены с помощью биотехнологических процессов производства, таких как ферментация. Более предпочтительно термин «большая молекула» относится к полипептидам, таким как, например, антитела, более конкретно моноклональные антитела. Одним из примеров такой большой молекулы в соответствии с данным изобретением является цетуксимаб.
Данное изобретение относится к фармацевтическому продукту, включающему: (А) первый компонент, который содержит в качестве активного агента соединение I или его фармацевтически приемлемую соль; и (В) второй компонент, который содержит в качестве активного агента ингибитор EGFR; при этом количества указанных активных агентов таковы, что их комбинация является терапевтически эффективной в лечении указанного пролиферативного нарушения. Данное изобретение также относится к упомянутому выше продукту в виде комбинированного препарата для одновременного или последовательного применения в лечении пролиферативного нарушения, в частности рака, более конкретно солидной опухоли, конкретно колоректального рака, меланомы и/или рака щитовидной железы, содержащего b-Raf с мутацией V600E.
Данное изобретение также относится к способу лечения пациента, страдающего от пролиферативного нарушения, который включает введение пациенту комбинации или фармацевтических препаратов, упомянутых выше.
Следует понимать, что «лечение пролиферативного нарушения» включает сохранение или уменьшение размера опухоли, индукцию регрессии опухоли (частичной или полной), ингибирование роста опухоли и/или увеличение продолжительности жизни пациента, страдающего от указанного нарушения.
Данное изобретение также относится к набору или композиции, содержащей: (А) первый компонент, который содержит в качестве активного агента соединение I или его фармацевтически приемлемую соль; и (В) второй компонент, который включает в качестве активного агента ингибитор EGFR. Набор или композиция могут быть использованы, например, для лечения пролиферативного нарушения.
В одном воплощении изобретения пролиферативным нарушением является солидная опухоль, в частности, колоректальный рак, меланома и/или рак щитовидной железы.
В другом воплощении изобретения пролиферативным нарушением является опухоль, содержащая b-Raf с мутацией V600, предпочтительно с мутацией V600E.
В еще одном воплощении изобретения пролиферативное нарушение выбрано из группы, состоящей из колоректального рака, меланомы и рака щитовидной железы, и рак включает опухоль, содержащую b-Raf с мутацией V600, предпочтительно с мутацией V600E.
В еще одном воплощении изобретения пролиферативным нарушением является солидная опухоль, содержащая b-Raf с мутацией V600, предпочтительно с мутацией V600E.
В еще одном воплощении изобретения пролиферативным нарушением является колоректальный рак.
В еще одном воплощении изобретения пролиферативным нарушением является колоректальный рак, включающий опухоль, содержащую b-Raf с мутацией V600, предпочтительно с мутацией V600E.
В еще одном воплощении изобретения ингибитор EGFR является малой молекулой ингибитором EGFR. В одном таком воплощении ингибитор EGFR представляет собой эрлотиниб или его фармацевтически приемлемую соль, например, эрлотиниба гидрохлорид (эрлотиниб HCl). Эрлотиниб HCl также известен под торговым названием Tarceva® и продается, например, в США компанией Genentech, Саут-Сан-Франциско, США.
В еще одном воплощении изобретения ингибитор EGFR является большой молекулой ингибитором EGFR, например, антителом, которое нацелено на EGFR. В одном таком воплощении ингибитор EGFR может быть моноклональным антителом, которое нацелено на EGFR, например, цетуксимабом. Цетуксимаб также известен под торговым названием Erbitux® и продается, например, в США компанией ImClone Systems, Inc., Нью-Йорк, США.
В некоторых воплощениях данное изобретение относится к фармацевтическому продукту для лечения колоректального рака, включающего опухоль, содержащую b-Raf с мутацией V600E, где указанный продукт включает: (А) первый компонент, который содержит в качестве активного агента соединение 1 или его фармацевтически приемлемую соль; и (В) второй компонент, который содержит в качестве активного агента эрлотиниб или его фармацевтически приемлемую соль; при этом количества указанных активных веществ таковы, что их комбинация является терапевтически эффективной в лечении указанного рака.
В другом воплощении данное изобретение относится к фармацевтическому продукту для лечения колоректального рака, включающего опухоль, содержащую b-Raf с мутацией V600E, где указанный продукт включает: (А) первый компонент, который содержит в качестве активного агента соединение 1 или его фармацевтически приемлемую соль; и (В) второй компонент, который содержит в качестве активного агента цетуксимаб; при этом количества указанных активных веществ таковы, что их комбинация является терапевтически эффективной в лечении указанного рака.
Количество каждого компонента, вводимого в данных комбинациях или композициях, может, но не должно быть терапевтически эффективно само по себе. Т.е. это изобретение, в частности, предусматривает комбинации, в которых количество соединения 1 или его фармацевтически приемлемой соли и/или количество ингибитора EGFR в комбинации могут быть меньше, чем сумма количеств, которые терапевтически эффективны для каждого активного агента, когда указанные агенты вводятся в виде монотерапии.
Первый компонент (А) и второй компонент (В) данного изобретения вводят в любом количестве и в течение любого периода времени, чтобы их комбинированное количество было терапевтически эффективным в лечении пролиферативного нарушения.
В некоторых воплощениях данного изобретения соединение 1 или его фармацевтически приемлемую соль вводят в дозировке от примерно 200 мг/сут до примерно 3000 мг/сут, от примерно 1000 мг/день до примерно 2500 мг/день, или от примерно 1700 мг/день до примерно 2100 мг/сут. В еще одном воплощении дозировка составляет примерно 1920 мг/сут.
В другом воплощении изобретения указанные выше количества соединения I или его фармацевтически приемлемой соли могут быть введены в виде разовой дозы ежедневно или разделены, например, на равные дозы (хотя это не обязательно) и введены дважды в день. Например, соединение I или его фармацевтически приемлемая соль могут быть введены в дозировке от примерно 100 мг до примерно 1500 мг 2 раза/день, от примерно 500 мг до примерно 1250 мг 2 раза/день, от примерно 850 мг до примерно 1050 мг 2 раза/день, или примерно 960 мг 2 раза/день.
В одном воплощении данного изобретения введение соединения I или его фармацевтически приемлемой соли осуществляют до прогрессирования заболевания или развития неприемлемой токсичности.
В некоторых воплощениях данного изобретения эрлотиниб или его фармацевтически приемлемую соль вводят в дозировке от примерно 20 мг/день до примерно 500 мг/день, от примерно 100 мг/день до примерно 400 мг/день, или от примерно 100 мг/день до примерно 200 мг/день.
В другом воплощении данного изобретения введение эрлотиниба или его фармацевтически приемлемой соли осуществляют до прогрессирования заболевания или развития неприемлемой токсичности.
В еще одном воплощении данного изобретения цетуксимаб вводят в дозировке от примерно от 50 мг/м2/нед до примерно 700 мг/м2/нед, от примерно 100 мг/м2/нед до примерно 600 мг/м2/нед, или от примерно 200 мг/м2/нед до примерно 500 мг/м2/нед.
В еще одном воплощении цетуксимаб вводят раз в неделю, при первом введении в количестве от примерно 400 мг/м2 до примерно 500 мг/м2, и при каждом последующем введении в количестве от примерно 200 мг/м2 до примерно 300 мг/м2.
В еще одном воплощении цетуксимаб вводят раз в неделю, при первом введении в количестве примерно 450 мг/м2, и при каждом последующем введении в количестве примерно 250 мг/м2.
В еще одном воплощении данного изобретения введение цетуксимаба осуществляют до прогрессирования заболевания или развития неприемлемой токсичности.
Таким образом, в другом воплощении данное изобретение предусматривает фармацевтической продукт, содержащий (А) первый компонент, который содержит в качестве активного агента соединение I или его фармацевтически приемлемую соль; и (В) второй компонент, который содержит в качестве активного агента эрлотиниб или его фармацевтически приемлемую соль, в виде комбинированного препарата для одновременного или последовательного применения в лечении пролиферативного нарушения, где
(A) вводят в количестве от примерно 200 мг/сут до примерно 3000 мг/сут, от примерно 1000 мг/сут до примерно 2500 мг/сут, от примерно 1700 мг/сут до примерно 2100 мг/сут, или примерно 1920 мг/сут, и
(B) вводят в количестве от примерно 20 до примерно 500 мг/день, от примерно 100 до примерно 400 мг/день, или от примерно 100 до примерно 200 мг/день.
В этом воплощении соединение I или его фармацевтически приемлемая соль могут быть введены два раза в день. Пролиферативное нарушение, которое лечат, представляет собой солидную опухоль, в частности, колоректальный рак, меланому и рак щитовидной железы, включающий опухоль, содержащую b-Raf с мутацией V600E. Более конкретно Пролиферативное нарушение представляет собой колоректальный рак с участием опухоли, содержащей b-Raf с мутацией V600E.
Также в этом воплощении продукт данного изобретения может содержать соединение I или его фармацевтически приемлемую соль, которую вводят перорально в дозировке от примерно 850 мг 2 раза/день до примерно 1050 мг 2 раза/день, или примерно 960 мг 2 раза/день, а эрлотиниб или его фармацевтически приемлемую соль вводят перорально в дозировке от примерно 100 мг/день до примерно 400 мг/день, или от примерно 100 мг/день до примерно 200 мг/день. Оба агента могут вводить, например, до прогрессирования заболевания или развития неприемлемой токсичности.
Данное изобретение также предусматривает фармацевтической продукт, содержащий (А) первый компонент, который содержит в качестве активного агента соединение I или его фармацевтически приемлемую соль; и (В) второй компонент, который содержит в качестве активного агента цетуксимаб; в виде комбинированного препарата для одновременного или последовательного применения в лечении пролиферативного нарушения, где
(A) вводят в количестве от примерно 200 мг/сут до примерно 3000 мг/сут, от примерно 1000 мг/сут до примерно 2500 мг/сут, от примерно 1700 мг/сут до примерно 2100 мг/сут, или примерно 1920 мг/сут, и
(B) вводят в количестве от 50 мг/м2/нед до примерно 700 мг/м2/нед, от примерно 100 мг/м2/нед до примерно 600 мг/м2/нед, или от примерно 200 мг/м2/нед до примерно 500 мг/м2/нед.
В этом воплощении Пролиферативное нарушение, которое лечат, представляет собой солидную опухоль, в частности, колоректальный рак, меланому и рак щитовидной железы, содержащий b-Raf с мутацией V600E. Более конкретно пролиферативное нарушение представляет собой колоректальный рак, включающий опухоль, содержащую b-Raf с мутацией V600E.
Также в этом воплощении продукт данного изобретения может содержать соединение 1 или его фармацевтически приемлемую соль, которую вводят перорально в дозировке от примерно 850 мг 2 раза/день до примерно 1050 мг 2 раза/день, или примерно 960 мг 2 раза/день; и цетуксимаб, который вводят внутривенно в дозировке от примерно 200 мг/м2/нед до примерно 500 мг/м2/нед. В одном воплощении цетуксимаб вводят вначале в дозировке 400 мг/м2 в виде 120-минутной внутривенной инфузии, а затем в дозировке 250 мг/м2 внутривенно в виде 60-минутной инфузии один раз в неделю. Оба агента могут вводиться, например, до прогрессирования заболевания или развития неприемлемой токсичности.
Данное изобретение также предусматривает набор или композицию, включающую: (А) первый компонент, который содержит в качестве активного агента соединение I или его фармацевтически приемлемую соль; и (В) второй компонент, который включает в качестве активного агента эрлотиниб или его фармацевтически приемлемую соль или пролекарство.
Данное изобретение также предусматривает набор или композицию, включающую: (А) первый компонент, который содержит в качестве активного агента соединение I или его фармацевтически приемлемую соль; и (В) второй компонент, который включает в качестве активного агента цетуксимаб.
В другом аспекте данного изобретения описанный выше фармацевтический продукт, включающий описанные выше компоненты (А) и (В), вводят в сочетании с лучевой терапией и/или в сочетании с другим активным агентом.
Таким образом, в некоторых воплощениях данное изобретение предусматривает фармацевтический продукт, включающий компоненты (А) и (В), описанные выше, и третий компонент (С), который содержит в качестве активного агента ингибитор типоизомеразы; в виде комбинированного препарата для одновременного или последовательного применения в лечении пролиферативного нарушения, такого как солидные опухоли, которые содержат b-Raf с мутацией V600, предпочтительно мутацией V600E. Как указывалось выше, количество каждого компонента, вводимого в соответствии с данным комбинированным продуктом, может, но не должно быть терапевтически эффективно само по себе, и это изобретение, в частности, предусматривает комбинации, в которых количества всех активных агентов в комбинации могут быть меньше, чем сумма количеств, которые терапевтически эффективны для каждого активного агента, когда указанные агенты вводятся в виде монотерапии.
В одном воплощении данного изобретения ингибитор топоизомеразы представляет собой ингибитор топоизомеразы 1 типа. В одном воплощении изобретения ингибитор топоизомеразы представляет собой иринотекан или его фармацевтически приемлемую соль, например, гидрохлорид иринотекана (иринотекан HCl). Иринотекан HCl коммерчески доступен как Camptosar® от компании Pfizer Inc, Нью-Йорк, США. Иринотекан или его фармацевтически приемлемая соль могут быть введены, например, внутрибрюшинно или внутривенно.
В одном воплощении данного изобретения иринотекан или его фармацевтически приемлемую соль вводят в дозировке от примерно 1 до примерно 400 мг/м2/нед или от примерно 1 до примерно 250 мг/м2/нед. В другом воплощении иринотекан или его фармацевтически приемлемую соль вводят в дозировке от примерно 50 до примерно 200 мг/м2/нед. В еще одном воплощении иринотекан или его фармацевтически приемлемую соль вводят в дозировке примерно 125 мг/м2/нед.
В еще одном воплощении дозировка иринотекана или его фармацевтически приемлемой соли составляет шестинедельный цикл от примерно 75 до примерно 175 мг/м2/нед, например, примерно 125 мг/м2/нед, в течение первых четырех недель, например, в 1, 8, 15 и 22 дни. В другом воплощении дозировка иринотекана составляет шестинедельный цикл от примерно 130 до примерно 230 мг/м2/нед, например, примерно 180 мг/м2/нед, раз в две недели, начиная с первой недели, например, в дни 1, 15 и 29. В еще одном воплощении дозировка составляет один раз в три недели от примерно 300 до примерно 400 мг/м2, например, примерно 350 мг/м2. В еще одном воплощении дозировка составляет раз в две недели от примерно 130 до примерно 230 мг/м2, например, примерно 180 мг/м2. Дозировка может осуществляться путем инфузии, например, в течение примерно 90 минут. Лечение может продолжаться до прогрессирования заболевания или до развития неприемлемой токсичности.
Уровни доз каждого из компонентов (А) и (В) и (С) могут быть изменены врачом до значения выше или ниже, чем было оговорено в данном документе, в зависимости от потребностей пациента и реакции пациента на лечение. Дозировки могут быть введены в соответствии с любым дозирующим графиком, определенным врачом в соответствии с потребностями пациента. Например, дозировки каждого из компонентов могут вводиться в одной или в отдельных дозах в течение нескольких дней или по графику с переменными днями.
Данное изобретение также предусматривает фармацевтический продукт, содержащий (А) первый компонент, который содержит в качестве активного агента соединение 1 или его фармацевтически приемлемую соль; (В) второй компонент, который содержит в качестве активного агента цетуксимаб; и (С) третий компонент, который содержит в качестве активного агента иринотекан или его фармацевтически приемлемую соль; в виде комбинированного препарата для одновременного или последовательного применения в лечении указанного пролиферативного нарушения, где
(A) вводят в количестве от примерно 200 мг/день до примерно 3000 мг/день, от примерно 1000 мг/день до примерно 2500 мг/день, от примерно 1700 мг/день до примерно 2100 мг/день, или примерно 1920 мг/день;
(B) вводят в количестве от примерно 50 мг/м2/нед до примерно 700 мг/м2/нед, от примерно 100 мг/м2/нед до примерно 600 мг/м2/нед, или от примерно 200 мг/м2/нед до примерно 500 мг/м2/нед; и
(C) вводят в количестве от примерно 1 до примерно 250 мг/м2/нед, от примерно 50 до примерно 200 мг/м2/нед, или примерно 125 мг/м2/нед.
В этом воплощении пролиферативное нарушение, которое подвергают лечению таким образом, представляет собой солидную опухоль, в частности, колоректальный рак, меланому и рак щитовидной железы, содержащий b-Raf с мутацией V600E. Более конкретно пролиферативное нарушение представляет собой колоректальный рак, который включает опухоль, содержащую b-Raf с мутацией V600E.
Также в этом воплощении продукт данного изобретения содержит соединение I или его фармацевтически приемлемую соль, которую вводят перорально в дозировке от примерно 850 мг до примерно 1050 мг 2 раза/день, или примерно 960 мг 2 раза/день; цетуксимаб, который вводят внутривенно в дозировке от примерно 200 мг/м2/нед до примерно 500 мг/м2/нед; и иринотекан, который вводят внутривенно в дозировке от примерно 50 до примерно 200 мг/м2/нед, или примерно 125 мг/м2/нед. Все агенты могут вводить, например, до прогрессирования заболевания или развития неприемлемой токсичности.
Данное изобретение также предусматривает набор или композицию, включающую: (А) первый компонент, который содержит в качестве активного агента соединение I или его фармацевтически приемлемую соль; (В) второй компонент, который содержит в качестве активного агента цетуксимаб; и (С) третий компонент, который содержит в качестве активного агента иринотекан или его фармацевтически приемлемую соль.
Соединение I существует в природном состоянии в кристаллической форме. Тем не менее, аморфная форма соединения имеет большую растворимость в воде по сравнению с кристаллической формой и, следовательно, имеет повышенную скорость растворения и, следовательно, повышенную биодоступность по сравнению с кристаллической формой. Таким образом, аморфная форма соединения является предпочтительной. Соответственно, в предпочтительных воплощениях способа и набора данного изобретения соединение I находится по существу в аморфной форме и более предпочтительно в аморфной форме. Используемый в данном документе термин «по существу аморфный материал» охватывает материал, который не более чем на 10% является кристаллическим; а термин «аморфный материал» охватывает материал, который является не более чем на 2% кристаллическим.
В одном воплощении данного изобретения соединение I содержится в твердом молекулярном комплексе, образованном гидроксипропилметилцеллюлозы ацетата сукцинатом (HPMC-AS). Используемый в данном документе термин «твердый молекулярный комплекс» означает композицию, в которой соединение I случайным образом распределено («молекулярно рассеяно») в матрице, образованной HPMC-AS. Предпочтительно такая композиция соединения I и HPMC-AS формируе