Синергические композиции ингибиторов pi3k и мек
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтике. Описана фармацевтическая композиция и комбинация ингибитора фосфатидилинозитол-3-киназы (PI3K) и ингибитора митоген-активируемой протеинкиназы (MEK) для лечения колоректального рака, имеющего BRAF мутацию, KRAS мутацию, PIK3CA мутацию или их сочетание и не имеющего PTEN мутацию; рака поджелудочной железы, имеющего KRAS мутацию; немелкоклеточного рака легких, имеющего KRAS мутацию; или меланомы, имеющей PTEN мутацию. В качестве ингибитора PI3K используется 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)-2-амид (S)-пирролидин-1,2-дикарбоновой кислоты или его фармацевтически приемлемую соль. В качестве ингибитора МЕК – (2-гидроксиэтокси)-амид (S)-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновую кислоту или его фармацевтически приемлемую соль. Также описан способ лечения указанных заболеваний комбинацией и применение указанной комбинации для получения лекарственного препарата для лечения указанных заболеваний. Применение двух указанных ингибиторов обеспечивает синергетический эффект от использования такой композиции или комбинации. 4 н. и 2 з.п. ф-лы, 2 ил., 3 пр.
Реферат
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Фармацевтическая комбинация, содержащая (a) соединение ингибитора фосфатидилинозитол-3-киназы (PI3K) 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты или его фармацевтически приемлемую соль, и (b) по меньшей мере одно соединение ингибитора митоген-активируемой протеинкиназы (MEK), выбранное из группы, включающей (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты, (S)-5-фтор-2-(2-фтор-4- (метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамид, PD0325901, PD-184352, RDEA119, GSK1120212, XL518, AS-701255, AS-701173, AS703026, RDEA436, E6201, R04987655, JTP-74057, RG7167, или RG7420, или их фармацевтически приемлемую соль, и, необязательно, по меньшей мере один фармацевтически приемлемый носитель; применения такой комбинации для лечения или предупреждение пролиферативных заболеваний, таких как рак; и способы лечения субъекта, страдающего пролиферативным заболеванием, таким как рак, включающим введение терапевтически эффективного количества такой комбинации.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Передача сигналов через путь миоген-активируемой протеинкиназы (MAP) и фосфатидилинозитол-3-киназы (PI3K)/AKT запускается внеклеточной стимуляцией и регулирует разнообразные биологические процессы, такие как пролиферация, дифференциация и гибель клеток. Оба пути часто активируются при многих формах рака мутациями или сверхэкспрессией молекул выше по ходу транскрипции. Эти пути взаимодействуют друг с другом для регуляции опухолевого роста и, таким образом, они являются потенциальными мишенями при лечении рака.
Фосфатидилинозитол-3-киназы (PI3K) включают семейство липидных киназ, которые катализируют перенос фосфата в положение D-3’ инозитол-содержащих липидов для получения фосфоинозитол-3-фосфат (PIP), фосфоинозитол-3,4-дифосфат (PIP2) и фосфоинозитол-3,4,5-трифосфат (PIP3), которые, в свою очередь, действуют в качестве вторых посредников при передаче каскадов сигналов докинг-белков, содержащих домен гомологии к плекстрину, FYVE, Phox и другие связывающие фосфолипиды домены, в разнообразные комплексы передачи сигналов, часто в плазматической мембране (Vanhaesebroeck et al., Annu. Rev. Biochem 70:535 (2001); Katso et al, Annu. Rev. Cell Dev. Biol. 17:615 (2001)). Из двух PI3Ks класса 1, PI3Ks класса 1A представляют собой гетеродимеры, составленные из каталитической субъединицы p110 (изоформы α, β, δ), конститутивно связанные с регуляторной субъединицей, которая может представлять собой p85α, p55α, p50α, ρ85β или ρ55γ. Подкласс IB класса имеет одного члена семейства, гетеродимер, составленный из каталитической субъединицы p110γ, связанной с одной из двух регуляторных субъединиц, p101 или p84 (Fruman et al, Annu Rev. Biochem. 67:481 (1998); Suire et al, Curr. Biol. 15:566 (2005)). Модулярные домены субъединиц p85/55/50 включают домены гомологии к Src (SH2), которые связывают остатки фосфотирозина в контексте специфической последовательности на активированных рецепторных и цитоплазматических тирозинкиназах, приводя к активации и локализации PI3Ks класса 1A. PI3K класса IB активируется непосредственно связанными с белком G рецепторами, которые связывают разнообразные репертуары пептидных и не пептидных лигандов (Stephens et al, Cell 89: 105 (1997)); Katso et al, Annu. Rev. Cell Dev. Biol. 17:615-675 (2001)). Следовательно, полученные в результате фосфолипидные продукты PI3K класса I связывают расположенные выше по ходу транскрипции рецепторы с расположенными ниже по ходу транскрипции видами клеточной активности, включая пролиферацию, выживание, хемотаксис, направленную миграцию клеток, подвижность, метаболизм, воспалительные и аллергические реакции, транскрипцию и трансляцию (Cantley et al., Cell 64:281 (1991); Escobedo и Williams, Nature 335:85 (1988); Fantl et al, Cell 69:413 (1992)).
PIP2 и PIP3 часто вовлекают Akt, продукт человеческого гомолога вирусного онкогена v-Akt, в плазматическую мембрану, где он действует в качестве узловой точки для многих внутриклеточных путей передачи сигналов, важных для роста и выживания (Fantl et al., Cell 69:413-423(1992); Bader et al, Nature Rev. Cancer 5:921 (2005); Vivanco и Sawyer, Nature Rev. Cancer 2:489 (2002)). Аберрантная регуляция PI3K, которая часто увеличивает выживание через активацию Akt, представляет собой одно из наиболее превалирующих явлений при злокачественных заболеваниях у людей, и, как было показано, происходящее на множественных уровнях. Ген-супрессор опухолей PTEN, который дефосфорилирует фосфоинозитиды в положении 3’ кольца инозитола, и при этом противодействует активности PI3K, функционально делетируется при разнообразных опухолях. При других опухолях гены для изоформы p110α, PIK3CA, и для Akt амплифицируются, и увеличенная экспрессия белков их генных продуктов была продемонстрирована при нескольких формах рака у людей. Кроме того, мутации и транслокации p85α, которые служат для стимуляции комплекса p85-p110, были описаны при онкологических заболеваниях у людей. Наконец, соматические бессмысленные мутации в PIK3CA, которые активируют пути передачи сигналов ниже по ходу транскрипции, были описаны как значительно часто наблюдавшиеся при широком разнообразии злокачественных заболеваний у людей (Kang at el, Proc. Natl. Acad. Sci. USA 102:802 (2005); Samuels et al, Science 304:554 (2004); Samuels et al, Cancer Cell 7:561-573 (2005)). Эти наблюдения показывают, что нарушение регуляции фосфоинозитол-3-киназы и находящихся выше и ниже по ходу транскрипции компонентов этого пути передачи сигналов представляет собой один из наиболее часто встречающихся видов нарушения регуляции, связанных с онкологическими и пролиферативными заболеваниями у людей (Parsons et al, Nature 436:792 (2005); Hennessey at el, Nature Rev. Drug Disc. 4:988-1004 (2005)).
Кроме того, известно, что избыточная активация каскада миоген-активируемой протеинкиназы (MAP) играет важную роль в клеточной пролиферации и дифференциации. Этот путь может активироваться, когда фактор роста связывается с тирозинкиназой его рецепторов. Это взаимодействие стимулирует ассоциацию RAS с RAF и инициирует каскад фосфорилирования через митоген-активируемую протеинкиназу (MEK) в ERK. Представляется, что фосфорилирование MEK увеличивает ее аффинитет и ее каталитическую активность в отношении ERK, а также ее аффинитет в отношении АТФ.
Регуляция пути MAP киназы нарушается, часто посредством мутаций, которые приводят к эктопической активации белка грубо при 1/3 форм рака у людей. Это нарушение регуляции в свою очередь приводит к широкому ряду клеточных изменений, которые составляют неотъемлемую часть этиологии и поддержания канкрозного фенотипа, включая без ограничения стимуляцию пролиферации и избегание апоптоза (Dhillon et al., Oncogene, 2007, 26: 3279-3290). Известно, что ингибирование этого пути благоприятно при пролиферативных заболеваниях. MEK представляет собой привлекательную терапевтическую мишень, поскольку единственными известными субстратами для фосфорилирования MEK являются MAP киназы, ERK1 и ERK2. MEK часто активируется в опухолях, которые имеют мутации в онкогенах RAS или RAF. Конститутивная активация MEK/ERK была обнаружена в образцах первичных опухолей поджелудочной железы, ободочной кишки, легких, почек и яичников.
Было показано, что ингибирование MEK имеет потенциальный благоприятный эффект при различных заболеваниях в нескольких исследованиях, таких как: (a) Tumor и Leukemia: Evidence of Efficacy in Tumor Models (Опухоль и лейкоз: доказательство эффективности на моделях опухолей) (Nature-Medicine 5(7): 810-816, 1999; Tracet et al, AACR April 6-10, 2002, Poster #5426; Tecle, H. IBC 2nd International Conference of Protein Kinases, September 9-10, 2002, J. Clin. Invest. 108(6), 851-859, 2001), (b) Pain: Evidence of Efficacy in Pain Models (Боль: доказательство эффективности на моделях боли) (J. Neurosci. 22:478, 2002; Acta Pharmacol Sin. 26:789 2005; Expert Opin Ther Targets. 9:699, 2005; Mol. Pain. 2:2, 2006), (c) Stroke: Evidence of Efficacy in Stroke Models Significant Neuroprotection against Ischemic Brain Injury by Inhibition of MEK (Инсульт: доказательство эффективности на моделях инсульта вследствие значимой нейропротекции против ишемического повреждения мозга ингибированием MEK) (J. Pharmacol. Exp. Ther. 304: 172, 2003; Brain Res. 996:55, 2004), (d) Diabetes: Evidence In Diabetic Complications. (Сахарный диабет: доказательство эффективности при осложнениях сахарного диабета) (Am. J. Physiol. Renal. 286, F120 2004), (e) Inflammation: Evidence of Efficacy in Inflammation Models. (Воспаление: доказательство эффективности на моделях воспаления.) (Biochem Biophys Res. Com. 268:647, 2000), и (f) Arthritis: Evidence of efficacy in experimental osteoarthritis. (Артрит: доказательство эффективности при экспериментальном остеоартрите) (Arthritis & (J. Clin. Invest. 116: 163. 2006).
Путь PI3K активно взаимодействует с путем MAPK. Эти пути разделяют общие активаторы выше по ходу транскрипции, и они оба активируются онкогенным RAS, и, как представляется, обеспечивают некоторую компенсаторную передачу сигналов, когда один или другой ингибируется.
Несмотря на многочисленные возможности лечения страдающих раком пациентов, сохраняется потребность в эффективных и безопасных терапевтических средствах и потребность в новых способах комбинированной терапии, которые может проводиться для эффективного долгосрочного лечения злокачественных заболеваний. К удивлению, было обнаружено, что комбинация эффективного количества ингибитора p110α-специфической фосфатидилинозитол-3-киназы (PI3K), соединения 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты, с эффективным количеством по меньшей мере одного ингибитора MEK, соединения по настоящему изобретению, в частности, (2-гидроксиэтокси)-амида 6-(4-бром-2- фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновойкислоты или (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамида, приводит к неожиданному улучшению при лечении пролиферативных заболеваний, в частности, рака. При одновременном введении, последовательно или раздельно, это соединение, специфический ингибитор фосфатидилинозитол-3-киназы (PI3K), и соединение ингибитор MEK по настоящему изобретению взаимодействуют синергическим образом для сильного ингибирования клеточной пролиферации. Эта неожиданная синергическая реакция обеспечивает возможность снижения дозы, требуемой для каждого соединения, приводящему к снижению побочных эффектов и повышению долгосрочной клинической эффективности соединений при лечении.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтической комбинации, содержащей: (a) соединение ингибитор фосфатидилинозитол-3-киназы (PI3K) 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (соединение A) или его фармацевтически приемлемую соль, и (b) по меньшей мере один ингибитор митоген-активируемой протеинкиназы (MEK), выбранный из группы, включающей (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединение B), (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамид (соединение C), PD0325901, PD-184352, RDEA119, GSK1120212, XL518, AS-701255, AS-701173, AS703026, RDEA436, E6201, R04987655, JTP-74057, RG7167 или RG7420 или их фармацевтически приемлемую соль, и, необязательно, по меньшей мере один фармацевтически приемлемый носитель для одновременного, раздельного или последовательного введения, в частности, для лечения или профилактики пролиферативного заболевания.
В предпочтительном варианте осуществления настоящего изобретения, ингредиентами комбинации являются (a) соединение ингибитор PI3K 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (соединение A) или его фармацевтически приемлемая соль, и (b) по меньшей мере одно соединение ингибитор MEK, выбранное из группы, состоящей из (2-гидроксиэтокси)-амида 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединения B) или (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамида (соединения C) или его фармацевтически приемлемой соли.
В другом предпочтительном варианте осуществления настоящего изобретения, ингредиентами комбинации являются (a) соединение ингибитор PI3K 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (соединение A) или его фармацевтически приемлемая соль, и (b) по меньшей мере одно соединение ингибитор MEK (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединение B) или его фармацевтически приемлемая соль.
Настоящее изобретение дополнительно относится к комбинированному препарату или фармацевтической композиции, содержащим (a) соединение ингибитор PI3K 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (соединение A) или его фармацевтически приемлемую соль, и (b) по меньшей мере один ингибитор MEK, выбранный из группы, включающей (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединение B), (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамид (соединение C), PD0325901, PD-184352, RDEA119, GSK1120212, XL518, AS-701255, AS-701173, AS703026, RDEA436, E6201, R04987655, JTP-74057, RG7167, или RG7420 или их фармацевтически приемлемую соль, и, необязательно, по меньшей мере один фармацевтически приемлемый носитель. В одном варианте осуществления, настоящее изобретение относится к комбинированному препарату, который содержит: (a) одну или несколько стандартных лекарственных форм ингредиента комбинации (a), и (b) одну или несколько стандартных лекарственных форм ингредиента комбинации (b).
Настоящее изобретение относится к фармацевтической комбинации, содержащей (a) соединение ингибитор PI3K 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (соединение A) или его фармацевтически приемлемую соль, и (b) по меньшей мере один ингибитор MEK, выбранный из группы, состоящей из (2-гидроксиэтокси)-амида 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединения B), (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамида (соединения C), PD0325901, PD-184352, RDEA119, GSK1120212, XL518, AS-701255, AS-701173, AS703026, RDEA436, E6201, R04987655, JTP-74057, RG7167 или RG7420 или их фармацевтически приемлемой соли, и, необязательно, по меньшей мере один фармацевтически приемлемый носитель, применяемой для лечения или профилактики пролиферативного заболевания у нуждающегося в этом индивида.
Настоящее изобретение также относится к фармацевтической комбинации, содержащей (a) соединение ингибитор PI3K 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (соединение A) или его фармацевтически приемлемую соль, и (b) по меньшей мере один ингибитор MEK, выбранный из группы, включающей (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединение B), (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамид (соединение C), PD0325901, PD-184352, RDEA119, GSK1120212, XL518, AS-701255, AS-701173, AS703026, RDEA436, E6201, R04987655, JTP-74057, RG7167, или RG7420 или их фармацевтически приемлемую соль, и необязательно, по меньшей мере один фармацевтически приемлемый носитель для применения при получении для применения при получении фармацевтической композиции или лекарственного препарата для лечения или профилактики пролиферативного заболевания у нуждающегося в этом индивида.
Настоящее изобретение дополнительно относится к применению соединения ингибитора PI3K 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (соединения A) или его фармацевтически приемлемой соли, в комбинации по меньшей мере с одним ингибитором MEK, выбранном из группы, включающей (2- гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединение B), (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамид (соединение C), PD0325901, PD-184352, RDEA119, GSK1120212, XL518, AS-701255, AS-701173, AS703026, RDEA436, E6201, R04987655, JTP-74057, RG7167, или RG7420 или их фармацевтически приемлемую соль, для получения фармацевтической композиции или лекарственного препарата для лечения или профилактики пролиферативного заболевания.
Настоящее изобретение относится к способу лечения индивида, имеющего пролиферативное заболевание, включающему введение указанному индивиду комбинации, содержащей (a) соединение ингибитор PI3K 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (соединение A) или его фармацевтически приемлемую соль, и (b) по меньшей мере один ингибитор MEK, выбранный из группы, включающей (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединение B), (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамид (соединение C), PD0325901, PD-184352, RDEA119, GSK1120212, XL518, AS-701255, AS-701173, AS703026, RDEA436, E6201, R04987655, JTP-74057, RG7167 или RG7420 или их фармацевтически приемлемую соль, и необязательно, по меньшей мере один фармацевтически приемлемый носитель в количестве, которое совместно терапевтически эффективно против пролиферативного заболевания.
Настоящее изобретение дополнительно относится к коммерческой упаковке, содержащей в качестве терапевтических средств комбинацию, содержащую (a) соединение ингибитор PI3K 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (соединение A) или его фармацевтически приемлемую соль и (b) по меньшей мере один ингибитор MEK, выбранный из группы, включающей (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединение B), (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамид (соединение C), PD0325901, PD-184352, RDEA119, GSK1120212, XL518, AS-701255, AS-701173, AS703026, RDEA436, E6201, R04987655, JTP-74057, RG7167, или RG7420 или их фармацевтически приемлемую соль, вместе с инструкциями по одновременному, раздельному или последовательному их введению для применения для задержки прогрессирования или для лечения пролиферативного заболевания.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг.1 показан контур изоболограммы при 50% ингибировании для комбинации с 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (соединением A) и (2-гидроксиэтокси)-амидом 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединением B) на линиях клеток немелкоклеточного рака легких NCI-H2122.
На Фиг.2 показан контур изоболограммы при 50% ингибировании для комбинации с 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (соединением A) и (2-гидроксиэтокси)-амидом 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединением B) на линиях клеток немелкоклеточного рака легких NCI-H2122 по данным с высоким разрешением, полученным в отдельном исследовании.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтической комбинации, содержащей: (a) соединение ингибитор фосфатидилинозитол-3-киназы (PI3K) 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (далее в настоящем описании именуемое «соединением A») или его фармацевтически приемлемую соль, и (b) по меньшей мере один ингибитор митоген-активируемой протеинкиназы (MEK), соединение, выбранное из группы, включающей (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты, (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамид, PD0325901, PD-184352, RDEA119, GSK1120212, XL518, AS-701255, AS-701173, AS703026, RDEA436, E6201, R04987655, JTP-74057, RG7167 или RG7420 или их фармацевтически приемлемую соль, и необязательно, по меньшей мере один фармацевтически приемлемый носитель для одновременного, раздельного или последовательного введения, в частности, для применения при лечении или профилактике пролиферативного заболевания.
Пока нет ясных иных указаний, общие термины, используемые в настоящем описании, определяются следующими значениями:
Пока не отмечено иным образом, термины «содержащие» и «включающие» используются в настоящем описании в их допускающем изменения и не ограничивающем смысле.
Пока в настоящем описании не указано иного или это ясно ни противоречит контексту, термины с неопределенными и определенными артиклями и подобными ссылками в контексте описания изобретения (в частности, в контексте слекдующей формулы изобретения) следует рассматривать как охватывающие формы и единственного, и множественного числа. Когда форма множественного числа используется для соединений, солей и тому подобного, это также предназначено для обозначения одного соединения, соли или тому подобного.
Термин «комбинация» или «фармацевтическая комбинация» определяется в настоящем описании как относящийся или к фиксированной комбинации в одной стандартной лекарственной форме, не фиксированной комбинации или набору частей для комбинированного введения, где соединение или его фармацевтически приемлемая соль и по меньшей мере одно соединение ингибитор MEK или его фармацевтически приемлемая соль могут вводиться одновременно, независимо в одно и то же время или раздельно в пределах интервалов времени, которые обеспечивают возможность компонентам комбинации проявить совместный, например, синергический эффект. Термин «фиксированная комбинация» означает, что активные ингредиенты, например, и соединение, и второй компонент комбинации вводятся пациенту одновременно в виде одной лекарственной формы или дозировки. Термин «не фиксированная комбинация» означает, что активные ингредиенты, например, и соединение по настоящему изобретению и второй компонент комбинации вводятся пациенту в виде отдельных лекарственных форм или одновременно, параллельно или последовательно без определенных ограничений времени, причем такое введение обеспечивает терапевтически эффективные уровни двух компонентов в организме пациента. Последнее также относится к смешанной терапии, например, введению трех или более активных ингредиентов.
Термин «ингибитор фосфатидилинозитол-3-киназы» определяется в настоящем описании как относящийся к соединению, которое нацелено, снижает уровень или ингибирует PI 3-киназу. Было показано, что активность PI 3-киназы увеличивается в ответ на ряд гормональных и ростовых факторных стимулов, включая инсулин, тромбоцитарный фактор роста, инсулиноподобный фактор роста, эпидермальный фактор роста, колониестимулирующий фактор и фактор роста гепатоцитов, и его связывали с процессами, относящимися к клеточному росту и трансформации.
Термин «ингибитор MEK» определяется здесь как относящийся к соединению, которое нацелено, уменьшает содержание или ингибирует киназную активность MAP киназы, MEK. Мишень ингибитора MEK включает без ограничения ERK. Косвенная мишень ингибитора MEK включает без ограничения циклин D1.
Термин «фармацевтическая композиция» определяется здесь как относящийся к смеси или раствору, содержащему по меньшей мере одно терапевтическое средство, подлежащее введению индивиду например, млекопитающему или человек, для профилактики или лечения определенного заболевания или состояния, поражающего млекопитающее.
Термин «фармацевтически приемлемые» определяется здесь как относящийся к тем соединениям, материалам, композициям и/или лекарственным формам, которые в пределах объема здравого медицинского суждения пригодны для контакта с тканями индивида, например, млекопитающего или человека, без избыточной токсичности, раздражения, аллергических реакций и других проблемных осложнений, соизмеримо с целесообразным отношением выгоды/риска.
Термины «совместное введение» или «комбинированное введение», используемые здесь, определяются, как охватывающие введение выбранных терапевтических средств одному пациенту и предназначены для включения схем лечения, в которых средства необязательно вводятся одним и тем же путем введения или в одно и то же время.
Используемый здесь термин «лечение» включает лечение, облегчающее, уменьшающее или облегчающее по меньшей мере один симптом у индивида, или осуществляющее задержку прогрессирования заболевания. Например, лечение может представлять собой уменьшение одного или нескольких симптомов расстройства или полное устранение расстройства, такого как рак. В пределах значения настоящего изобретения, термин «лечить» также обозначает остановку, задержку начала (т.е. период перед клиническим проявлением заболевания) и/или снижение риска развития или усугубления течения заболевания. Термин «защитить» используется здесь для обозначения предотвращения, задержки или лечения или при целесообразности для достижения всех этих эффектов, в отношении развития или продолжения или усугубления тяжести заболевания у индивида.
Используемый здесь термин «предотвращать», «предотвращение» или «профилактика» включает предотвращение по меньшей мере одного симптома, связанного или вызванного предотвращаемым состоянием, заболеванием или расстройством.
Используемый здесь термин «совместно терапевтически активные» или «совместный терапевтический эффект» означает, что терапевтические средства могут вводиться раздельно (хронологически отсроченным образом, в частности, в определенной последовательности) через предпочтительные интервалы времени подлежащему лечению теплокровному животному, в частности, человеку, но все же проявляют (предпочтительно, синергическое) взаимодействие (совместный терапевтический эффект). Так ли это, наряду с другими способами, может быть продемонстрировано следующими уровнями в крови, показывающими, что оба соединения присутствуют в крови подлежащего лечению человека по меньшей мере в течение определенных интервалов времени.
Термин «фармацевтически эффективное количество» или «клинически эффективное количество» комбинации терапевтических средств представляет собой количество, достаточное для обеспечения заметного улучшения относительно исходных клинически наблюдаемых признаков и симптомов расстройства, подвергаемого лечению комбинацией.
Используемый здесь термин «синергический эффект» относится к действию двух терапевтических средств, таких как, например, соединение формулы (I), например, соединения A, и по меньшей мере одного соединения ингибитора MEK по настоящему изобретению, обеспечивающему эффект, например, замедления прогрессирования симптомов пролиферативного заболевания, в частности, рака, или его симптома, причем достигнутый эффект больше, чем простое добавление эффектов каждого из лекарственных средств, введенных раздельно. Синергический эффект может быть рассчитан, например, с использованием пригодных способов, таких как уравнение сигмоидной функции Emax (Holford, N. H. G. and Scheiner, L. B., Clin. Pharmacokinet. 6: 429-453 (1981)), уравнение аддитивности Леве (Loewe, S. and Muischnek, H., Arch. Exp. Pathol Pharmacol. 114: 313-326 (1926)) и уравнение медианного эффекта (Chou, T. C. and Talalay, P., Adv. Enzyme Regul. 22: 27-55 (1984)). Каждое указанное выше уравнение может применяться к экспериментальным данным для построения соответствующего графика для содействия в оценке эффектов лекарственной комбинации. Соответствующие графики, связанные с указанными выше уравнениями, представляют собой кривую «концентрация-эффект», кривую изоболограммы и кривую комбинированного показателя, соответственно.
Используемый здесь термин «индивид» или «пациент» включает животных, которые могут страдать или поражаться онкологическими заболеваниями или любым расстройством, включающим, прямо или опосредованно, рак. Примеры индивидов включают млекопитающих, например, людей, собак, коров, лошадей, свиней, овец, коз, кошек, мышей, кроликов, крыс и трансгенных животных, кроме человека. В предпочтительном варианте осуществления, индивид представляет собой человека, например, человека, страдающего, имеющего риск развития или потенциально подверженного возникновению онкологических заболеваний.
Термин «примерно» или «приблизительно» должны иметь значение в пределах 10%, предпочтительнее, в пределах 5% данной величины или диапазона.
Фармацевтические комбинации по настоящему изобретению включают соединение ингибитор фосфатидилинозитол-3-киназы (PI3K) 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметилэтил)-пиридин-4-ил]-тиазол-2-ил}-амид)–2-амид (S)-пирролидин-1,2-дикарбоновой кислоты (далее именуемое («соединение A»). Соединение A представляет собой p110α-селективный ингибитор фосфатидилинозитол-3-киназы (PI3K), соединение формулы I
Соединение A было первоначально описано в заявке на Международный патент WO 2010/029082, где был описан синтез его формы свободного основания. Синтез соединения A описан, например, в заявке на Международный патент WO 2010/029082, которая полностью включена в настоящее описание путем ссылки в виде примера 15.
При ссылке на соединение A, термин «соль» или «соли» следует понимать как представляющий соль соединения A, которая может присутствовать отдельно или в смеси со свободным соединением формулы (I), и соли предпочтительно представляют собой фармацевтически приемлемые соли. Такие соли образуются, например, в виде кислотно-аддитивных солей, предпочтительно с органическими или неорганическими кислотами, из соединения формулы (I) с основным атомом азота, в частности, фармацевтически приемлемые соли. Пригодными неорганическими кислотами являются, например, галогеновые кислоты, такие как хлористоводородная кислота, серная кислота или фосфорная кислота. Пригодными органическими кислотами являются, например, карбоновые кислоты или сульфоновые кислоты, такие как фумаровая кислота или метансульфоновая кислота. В целях выделения или очистки, возможно также использование фармацевтически неприемлемых солей, например, пикратов или перхлоратов. Для терапевтического применения используются только фармацевтически приемлемые соли или свободные соединения (где применимо, в форме фармацевтических препаратов), и поэтому они предпочтительны. Ввиду тесной связи между новыми соединениями в свободной форме и соединениями в форме их солей, включая те соли, которые могут использоваться в качестве промежуточных соединений, например при очистке или идентификации новых соединений, любую ссылку в настоящем описании на свободное соединение следует понимать как относящуюся также к соответствующим солям в соответствии с пригодностью и целесообразностью. Соли соединения A представляют собой предпочтительно фармацевтически приемлемые соли; пригодные противоионы, образующие фармацевтически приемлемые соли, известны в данной области техники.
Фармацевтические комбинации по настоящему изобретению содержат по меньшей мере одно соединение ингибитор MEK, выбранное из группы, включающей (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты, (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамид, PD0325901, PD-184352, RDEA119, GSKl120212, XL518, AS-701255, AS-701173, AS703026, RDEA436, E6201, R04987655, JTP-74057, RG7167 или RG7420 или их фармацевтически приемлемую соль.
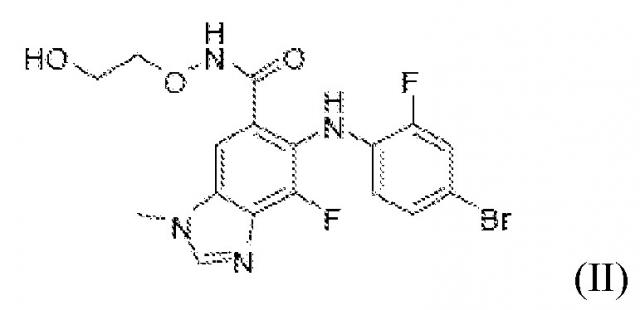
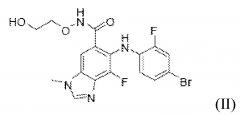
Соединение ингибитор MEK (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединение B) представляет собой соединение формулы (II)
Соединение ингибитор MEK (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединение B), описано в заявке PCT на Международный патент WO 03/077914, и способы его получения были описаны, например, в примере 18 настоящего описания.
Кроме того, что описано здесь, соединения, применяемые в настоящем изобретении, могут обладать одним или несколькими асимметричными центрами и могут быть получены в виде отдельных (R)- или (S)-стереоизомеров или в виде их смесей, как описано в заявке PCT на Международный патент № WO03/077914. Кроме указанного иным образом, описание или название конкретного соединения в описании и формуле изобретения предназначено для включения и отдельных энантиомеров, и диастереомерных смесей, рацемических или иных их смесей. Соответственно, настоящее изобретение также включает все такие изомеры, включая диастереомерные смеси и разделенные энантиомеры соединений по настоящему изобретению. Диастереомерные смеси могут быть разделены на их отдельные диастереомеры на основании их физико-химических различий способами, известными специалистам в данной области, например, хроматографией или фракционной кристаллизацией. Энантиомеры могут быть разделены превращением энантиомерной смеси в диастереомерную смесь реакцией с соответствующим оптически активным соединением (например, спиртом), разделением диастереомеров и превращением (например, гидролизом) отдельных диастереомеров в соответствующие чистые энантиомеры. Способы определения стереохимии и разделения стереоизомеров хорошо известны в данной области техники (см. обсуждение в главе 4 руководства «Advanced organic Chemistry» («Достижения органической химии»), 4th edition, J. March. John Wiley и Sons, New York, 1992).
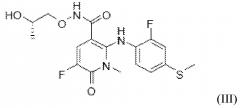
Соединение ингибитор MEK (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамид (соединение C) представляет собой соединение формулы (III)
Соединение ингибитор MEK (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамид (соединение C) описано в примере 25-BB заявки PCT на Международный патент № WO2007/044084, и способы его получения были описаны в ней.
Дополнительные ингибиторы MEK, которые могут использоваться в комбинации по настоящему изобретении, включают без ограничения PD0325901 (Pfizer) (см. опубликованную заявку PCT на Международный патент № WO02/06213), PD-184352 (Pfizer), RDEA119 (Ardea Biosciences), GSK1120212 (GlaxoSmithKline) (см. опубликованную заявку PCT на Международный патент № WO05/121142), XL518 (Exelexis), AS-701255 (Merck Serono), AS-701173 (Merck Serono), AS703026 (Merck Serono), RDEA436 (Ardea Biosciences, E6201 (Eisai) (см. публикацию Goto et al, Journal of Pharmacology и Experimental Therapeutics, 3331(2): 485-495 (2009)), R04987655 (Hoffmann-La Roche), JTP-74057, RG7167, и/или RG7420.
Предпочтительно соединение ингибитор MEK, применяемое в комбинации по настоящему изобретению, выбрано из группы, состоящей из (2-гидроксиэтокси)-амида 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3H-бензоимидазол-5-карбоновой кислоты (соединения B), (S)-5-фтор-2-(2-фтор-4-(метилтио)фениламино)-N-(2-гидроксипропокси)-1-метил-6-оксо-1,6-дигидропиридин-3-карбоксамида (соединения C) или его фармацевтически приемлемой соли.
В отношении ингибиторов MEK, пока нет иных указаний, термин «соль» или «соли» включает соли кислотных и основных групп, которые могут присутствовать в соединениях по настоящему изобретению. Соединения по настоящему изобретению, которые являются основными по природе, способны образовывать широкое разнообразие солей с различными неорганическими и органическими кислотами. Кислоты, которые могут использоваться для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений по настоящему изобретению, представляют собой те, которые образуют нетоксичные кислотно-аддитивные соли, т.е. соли, содержащие фармацевтически приемлемые анионы, такие как ацетат, бензоат, бромид, хлорид, цитрат, фумарат, гидробромид, гидрохлорид, йодид, лактат, малеат, манделат, нитрат, оксалат, салицилат, сукцинат и тартрат. Поскольку одно соединение по настоящему изобретению может включать несколько кислотных или основных составляющих, соединения по настоящему изобретению могут включать моно-, ди- или три-соли в одном в одном соединении.
В случае кислотной составляющей, в соединении по настоящему изобретению, соль может быть образована обработкой соединения по настоящему изобретению с основным соединением, в частности, неорганическим основанием. Предпочтительными неорганическими солями являются те, которые образованы со щелочными и щелочноземельными металлами, такими как литий, натрий, калий, барий и кальций. Предпочтительные соли органических оснований включают, например, аммоний, дибензиламмоний, бензиламмоний, 2- гидроксиэтиламмоний, бис(2-гидроксиэтил)аммоний, фенилэтилбензиламин, дибензилэтилендиамин и подобные соли. Другие соли кислотных составляющих могут включать, например, те соли, которые образованы с прокаином, хинином и N-метилглюкозамином, плюс соли, об