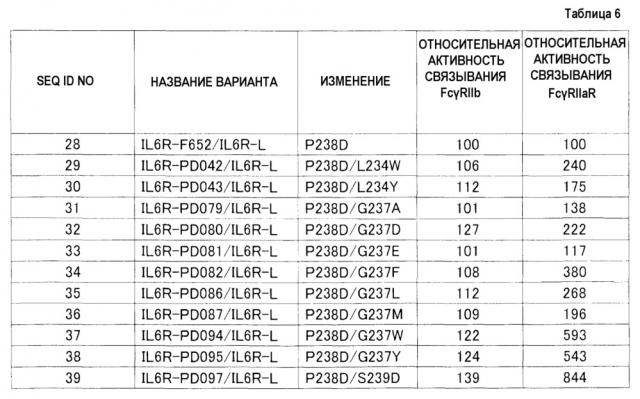
Fcγriib-специфичное fc-антитело
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан полипептид, содержащий Fc-область антитела по меньшей мере с одним аминокислотным изменением, который имеет повышенную активность связывания с FcγRIIb по сравнению с исходным полипептидом, где величина [величина KD полипептида, содержащего Fc-область антитела, в отношении FcγRIIa (тип R)]/[величина KD полипептида, содержащего Fc-область антитела, в отношении FcγRIIb] равна 1,2 или более, где величина [величина KD для более сильной из активностей связывания полипептида, содержащего Fc-область антитела, в отношении FcγRIIa (тип R) и FcγRIIa (тип Н)]/[величина KD для более сильной из активностей связывания исходного полипептида в отношении FcγRIIa (тип R) и FcγRIIa (тип Н)] составляет 0,7 или более, и где аминокислотное изменение представляет собой замену Pro в положении 238 (нумерация EU) на Asp или замену Leu в положении 328 (нумерация EU) на Glu. Описаны способы получения такого полипептида и его применение. Изобретение расширяет арсенал терапевтических и профилактических средств. 6 н. и 14 з.п. ф-лы, 16 ил., 12 табл., 9 пр.
Реферат
Техническая область
Настоящее изобретение относится к полипептидам, содержащим Fc-область IgG, которые имеют сохраненную или сниженную активность связывания с обоими аллотипами FcγRIIa: типом H и типом R, в которых аминокислота в положении 131 (нумерация по EU) FcγRIIa представляет собой His (тип H) или Arg (тип R), и которые имеют повышенную активность связывания с FcγRIIb по сравнению с исходным полипептидом из-за внесения аминокислотных замен в Fc-область IgG; к фармацевтическим композициям, содержащим полипептид; лекарственным средствам или профилактическим средствам, содержащим полипептид, при иммунологических воспалительных заболеваниях; и к способам их получения. Более того, настоящее изобретение относится к способам сохранения или снижения активности связывания с обоими аллотипами FcγRIIa: типом H и типом R, в которых аминокислота в положении 131 (нумерация по EU) FcγRIIa представляет собой His (тип H) или Arg (тип R), и повышения активности связывания с FcγRIIb по сравнению с исходным полипептидом; и к способам подавления продукции антител по сравнению с исходным полипептидом при введении in vivo. Также настоящее изобретение относится к способам получения полипептида, имеющего сохраненную или сниженную активность связывания в отношении обоих аллотипов FcγRIIa: типа H и типа R, в которых аминокислота в положении 131 (нумерация по EU) FcγRIIa представляет собой His (тип H) или Arg (тип R), и имеющего повышенную активность связывания с FcγRIIb по сравнению с исходным полипептидом; и к способам получения полипептида, который подавляет образование антител по сравнению с исходным полипептидом при введении in vivo.
Уровень техники
Интерес к антителам как к фармацевтическим средствам возник, поскольку они высоко стабильны в крови и вызывают мало побочных эффектов (непатентные документы - 1 и 2). Практически все фармацевтические препараты на основе антител, имеющиеся в настоящее время на рынке, представляют собой антитела подкласса IgG1 человека. Одной из известных функций антител класса IgG является антителозависимая клеточная цитотоксичность (далее обозначаемая как активность ADCC) (непатентный документ 3). Для того чтобы антитело проявляло активность ADCC, Fc-область антитела должна связываться с Fcγ-рецептором (далее обозначаемым как FcγR), который представляет собой связываемый антителом рецептор, находящийся на поверхности эффекторных клеток, таких как клетки-киллеры, натуральные клетки-киллеры и активированные макрофаги.
У человека семейство белков FcγR описано изоформами FcγRIa (CD64A), FcγRIIa (CD32A), FcγRIIb (CD32B), FcγRIIIa (CD16A) и FcγRIIIb (CD16B), а также описаны их соответствующие аллотипы (непатентный документ 7). FcγRIa, FcγRIIa и FcγRIIIa называют активирующими FcγR, поскольку они обладают иммунологически активными функциями, а FcγRIIb называют ингибиторным FcγR, поскольку он обладает иммунодепрессивными функциями (непатентный документ 8).
Было показано, что при связывании Fc-области и FcγR важны несколько аминокислотных остатков в шарнирной области и домене СН2 антитела, и цепь сахаров, связанная с Asn в положении 297 (нумерации по EU) домена СН2 (непатентные документы 4, 5 и 6). До настоящего времени исследованы различные варианты, имеющие свойства связывания FcγR, главным образом, антитела с мутациями, внесенные в эти области; и получены варианты Fc-области, имеющие более высокую активность связывания с активирующим FcγR (патентные документы 1, 2, 3 и 4).
Когда активирующий FcγR связывается с иммунным комплексом, он фосфорилирует иммунорецепторные тирозиновые активирующие мотивы (ITAM), содержащиеся во внутриклеточном домене или общей γ-цепи FcR (партнер по взаимодействию), активирует передатчик сигнала SYK, и запускает воспалительный иммунный ответ путем инициации каскада активирующего сигнала (непатентный документ 9).
FcγRIIb является единственным экспрессирующимся FcγR на B-клетках (непатентный документ 10). Описано, что взаимодействие Fc-области антитела с FcγRIIb подавляет первичный иммунный ответ B-клеток (непатентный документ 11). Более того, описано, что, когда FcγRIIb на B-клетках и B-клеточный рецептор (BCR) связываются через иммунный комплекс в крови, активация B-клеток подавляется и супрессирует продукцию антител B-клетками (непатентный документ 12). Для этой иммунодепрессивной передачи сигнала, опосредуемой BCR и FcγRIIb, необходим иммунорецепторный тирозиновый ингибирующий мотив (ITIM), содержащийся во внутриклеточном домене FcγRIIb (непатентные документы 13 и 14). Когда ITIM фосфорилируется при передаче сигнала, привлекается SH2-содержащая инозитолполифосфат-5-фосфатаза (SHIP), ингибируется передача других активирующих каскадов передачи сигнала FcγR и воспалительный иммунный ответ подавляется (непатентный документ 15). Более того, описано, что агрегация FcγRIIb отдельно временно подавляет вхождение кальция вследствие связывания BCR и пролиферации B-клеток BCR-независимым образом без индукции апоптоза продуцирующих IgM B-клеток (непатентный документ 16).
Более того, FcγRIIb также экспрессируется на дендритных клетках, макрофагах, активированных нейтрофилах, тучных клетках и базофилах. FcγRIIb ингибирует функции активирующего FcγR, такие как фагоцитоз, и высвобождает воспалительные цитокины в этих клетках и подавляет воспалительные иммунные ответы (непатентный документ 8).
Значение иммунодепрессивных функций FcγRIIb до настоящего времени устанавливали с помощью исследований с использованием мышей с нокаутом FcγRIIb. Существуют сообщения о том, что у мышей с нокаутом FcγRIIb гуморальный иммунитет не регулируется надлежащим образом (непатентный документ 17), чувствительность к индуцируемому коллагеном артриту (CIA) повышается (непатентный документ 18), присутствуют волчаноподобные симптомы, и имеются симптомы, подобные синдрому Гудпасчера (непатентный документ 19).
Более того, описано, что ненадлежащая регуляция FcγRIIb связана с аутоиммунными заболеваниями. Например, описана взаимосвязь между генетическим полиморфизмом в трансмембранной области и промоторной области FcγRIIb и частотой развития системной красной волчанки (SLE) (непатентные документы 20, 21, 22, 23 и 24), и снижением экспрессии FcγRIIb на поверхности B-клеток у пациентов с SLE (непатентный документ 25 и 26).
Исходя из моделей на мышах и собственно клинических данных, считается, что FcγRIIb играет роль в контроле аутоиммунных заболеваний и воспалительных заболеваний, главным образом, путем вовлечения B-клеток, и он является перспективной молекулой-мишенью для контроля аутоиммунных заболеваний и воспалительных заболеваний.
Известно, что IgG1, в основном используемый в качестве коммерчески доступного антительного фармацевтического средства, связывается не только с FcγRIIb, но также он сильно связывается с активирующим FcγR (непатентный документ 27). Является возможной разработка антительных фармацевтических средств, имеющих более существенные иммунодепрессивные свойства по сравнению с IgG1, путем использования Fc-области с усиленным связыванием FcγRIIb, или увеличенной селективностью связывания FcγRIIb по сравнению с активирующим FcγR. Например, было предположено, что применение антитела, имеющего вариабельную область, которая связывается с BCR, и Fc с усиленным связыванием FcγRIIb, может ингибировать активацию B-клеток (непатентный документ 28).
Описано, что связывание FcγRIIb на B-клетках и IgE, связанный с B-клеточным рецептором, подавляет дифференцировку B-клеток в плазматические клетки, что в результате вызывает подавление продуцирования IgE; и у мышей, которым трансплантировали PBMC человека, сохраняются концентрации IgG и IgM человека, в то время как концентрация IgE человека снижается (непатентный документ 29). Помимо IgE, было описано, что, когда FcγRIIb и CD79b, образующие рецепторный комплекс B-клеток, связываются антителом, пролиферация B-клеток подавляется in vitro и смягчаются симптомы в модели индуцированного коллагеном артрита (непатентный документ 30).
Помимо B-клеток, было описано, что связывание FcεRI и FcγRIIb на тучных клетках с использованием молекул, в которых Fc-часть IgG с усиленным связыванием FcγRIIb слита с Fc-частью IgE, которая связывается с IgE-рецептором FcεRI, вызывает фосфорилирование FcγRIIb посредством FcγRIIb, тем самым, подавляя зависимое от FcεRI вхождение кальция. Это указывает на то, что ингибирование дегрануляции через стимуляцию FcγRIIb возможно путем повышения связывания FcγRIIb (непатентный документ 31).
Таким образом, предполагают, что антитело, имеющее Fc с повышенной активностью связывания FcγRIIb, является перспективным в качестве лекарственного средства для лечения воспалительных заболеваний, таких как аутоиммунные заболевания.
Более того, было предположено, что мутанты с усиленным связыванием FcγRIIb являются перспективными лекарственными средствами для лечения злокачественных новообразований, а также лекарственными средствами для лечения воспалительных заболеваний, таких как аутоиммунные заболевания. На настоящий момент выявлено, что FcγRIIb играет важную роль в агонистической активности антител-агонистов против семейства рецепторов TNF. В частности, было предположено, для агонистической активности антител против CD40, DR4, DR5, CD30 и CD137, которые включены в семейство рецепторов TNF, требуется взаимодействие с FcγRIIb (непатентные документы 32, 33, 34, 35, 36 и 37). В непатентном документе 32 показано, что использование антител с усиленным связыванием FcγRIIb усиливает противоопухолевый эффект антител против CD40. Таким образом, ожидается, что антитела с усиленным связыванием FcγRIIb будут иметь эффект повышения агонистической активности антител-агонистов, включая антитела против семейства рецепторов TNF.
Описаны антитела с Fc с повышенной активностью связывания FcγRIIb (непатентный документ 28). В этом документе активность связывания FcγRIIb увеличивали путем внесения изменений, таких как S267E/L328F, G236D/S267E и S239D/S267E в Fc-область антитела. Среди них антитело, в которое внесена мутация S267E/L328F, более прочно связывается с FcγRIIb и сохраняет тот же уровень связывания с FcγRIa и FcγRIIa типа H, что и у встречающегося в природе IgG1. Однако в другом сообщении показано, что это изменение усиливает связывание с FcγRIIa типа R в несколько сот раз относительно указанного уровня связывания FcγRIIb, что означает, что селективность связывания FcγRIIb не повышается по сравнению с FcγRIIa типа R (патентный документ 5).
Даже если связывание FcγRIIb усиливается по сравнению со связыванием IgG1, считается, что только эффект усиления связывания FcγRIIa, но не усиления связывания FcγRIIb, влияет на клетки, такие как тромбоциты, которые экспрессируют FcγRIIa, но не экспрессируют FcγRIIb (непатентный документ 8). Например, известно, что группа пациентов, в которой вводили бевацизумаб, антитело против VEGF, имеет увеличенный риск тромбоэмболии (непатентный документ 38). Более того, тромбоэмболию аналогичным образом наблюдали в испытаниях по клинической разработке антител против CD40-лиганда, и клиническое испытание было прекращено (непатентный документ 39). В обоих случаях этих антител последние испытания с использованием моделей на животных и т.п. позволили предположить, что введенные антитела агрегируют тромбоциты через связывание FcγRIIa на тромбоцитах и образуют кровяные сгустки (непатентные документы 40 и 41). При системной красной волчанке, которая представляет собой аутоиммунное заболевание, тромбоциты активируются через зависимый от FcγRIIa механизм, и было описано, что активация тромбоцитов коррелирует с тяжестью симптомов (непатентный документ 42). Даже если связывание FcγRIIb усилить, введение антитела с усиленным связыванием FcγRIIa таким пациентам, которые уже имеют риск развития тромбоэмболии, увеличит риск развития тромбоэмболии и, таким образом, является чрезвычайно опасным.
Более того, описано, что антитела с усиленным связыванием FcγRIIa усиливают опосредуемый макрофагами антителозависимый фагоцитоз клеток (ADCP) (непатентный документ 43). Когда антигены антител фагоцитируются макрофагами, антитела сами по себе также фагоцитируются одновременно с ними. В этом случае пептидные фрагменты, происходящие из этих антител, также представляются в качестве антигена, и антигенность может увеличиться, тем самым, увеличивая риск продукции антител против антител (анти-антитела). Более конкретно, усиление связывания FcγRIIa увеличит риск продукции антител против антител, и это значительно снизит их ценность в качестве фармацевтических препаратов.
Более конкретно, ценность в качестве фармацевтических препаратов значительно снижается при усилении связывания FcγRIIa, что приводит к увеличенному риску образования тромбов через агрегацию тромбоцитов, более высокой антигенности и увеличенному риску продукции анти-антител.
С такой точки зрения вышеупомянутый Fc с усиленным связыванием FcγRIIb демонстрирует значительно усиленное связывание FcγRIIa типа R по сравнению со встречающимся в природе IgG1. Таким образом, его ценность в качестве фармацевтического средства для пациентов, имеющих FcγRIIa типа R, значительно снижается. Типы H и R FcγRIIa наблюдаются у европиоидов и афроамериканцев приблизительно с одной и той же частотой (непатентные документы 44 и 45). Таким образом, при использовании этого Fc для лечения аутоиммунных заболеваний количество пациентов, которые могут его безопасно использовать, одновременно получая их эффекты в качестве фармацевтического средства, будет ограничено.
Более того, описано, что в дендритных клетках с дефицитом FcγRIIb или дендритных клетках, в которых взаимодействие между FcγRIIb и Fc-частью антитела ингибируется антителом против FcγRIIb, дендритные клетки созревают самопроизвольно (непатентные документы 46 и 47). Это сообщение указывает на то, что FcγRIIb активно подавляет созревание дендритных клеток в стационарном состоянии, когда воспаление и т.п. не происходят. FcγRIIa экспрессируется на поверхности дендритных клеток в дополнение к FcγRIIb; таким образом, даже если связывание с ингибиторным FcγRIIb усиливается и если связывание с активирующим FcγR, таким как FcγRIIa, также усиливается, в результате может стимулироваться созревание дендритных клеток. Более конкретно, повышение не только активности связывания FcγRIIb, но также соотношения активности связывания FcγRIIb относительно активности связывания FcγRIIa считается важным для образования антител с иммунодепрессивным действием.
Таким образом, когда рассматривается получение фармацевтических средств, в которых используется опосредуемое связыванием FcγRIIb иммунодепрессивное действие, существует потребность в Fc, которая не только имеет повышенную активность связывания с FcγRIIb, но также имеет связывание с обоими аллотипами FcγRIIa: типом H и типом R, которое поддерживается на сходном уровне или является сниженным до более низкого уровня, чем у встречающегося в природе IgG1.
Между тем, на настоящее время описаны случаи, где аминокислотные изменения вносили в область Fc для увеличения селективности связывания FcγRIIb (непатентный документ 48). Однако все варианты, которые, как сообщалось, имеют увеличенную селективность к FcγRIIb, как описано в указанном документе, продемонстрировали сниженное связывание FcγRIIb по сравнению со связыванием встречающегося в природе IgG1. Таким образом, считается трудным для этих вариантов в действительности индуцировать опосредуемую FcγRIIb иммунодепрессивную реакцию в большей степени, чем в случае IgG1.
Более того, поскольку FcγRIIb играет важную роль в антителах-агонистах, упомянутых выше, ожидается, что повышение их активности связывания усилит агонистическую активность. Однако, когда аналогичным образом усиливается связывание FcγRIIa, проявляется непредусмотренная активность, такая как активность ADCC и активность ADCP, и это может вызвать побочные эффекты. Также, с такой точки зрения, является предпочтительным иметь возможность селективно повышать активность связывания FcγRIIb.
Исходя из этих результатов, при получении фармацевтических средств на основе антител, подлежащих применению для лечения аутоиммунных заболеваний и злокачественного новообразования с использованием FcγRIIb, важно, что по сравнению со встречающимися в природе IgG активность связывания обоих аллотипов FcγRIIa сохраняется или снижается и связывание FcγRIIb усиливается. Однако FcγRIIb обладает 93% идентичностью последовательности во внеклеточной области с FcγRIIa, который является одним из активирующих FcγR, и они являются в высокой степени структурно сходными. Существуют аллотипы FcγRIIa: тип H и тип R, в которых аминокислота в положении 131 представляет собой His (тип H) или Arg (тип R), и в то же время каждый из них реагирует по разному с антителами (непатентный документ 49). Таким образом, для получения Fc-области, которая селективно связывается с FcγRIIb, наиболее трудной проблемой может быть сообщение Fc-области антитела свойства селективного улучшения активности связывания FcγRIIb, что вовлекает различение этих гомологичных последовательностей, и снижения или не повышения активности связывания в отношении каждого аллотипа FcγRIIa, при повышении активности связывания с FcγRIIb. На настоящий момент не были получены варианты, имеющие достаточную селективность к FcγRIIb. В патентном документе 5 описаны варианты с повышенной активностью связывания FcγRIIb; однако степень усиления является низкой и существует потребность в разработке вариантов, имеющих свойства, сходные со свойствами, описанными выше.
Документы уровня техники
[Патентные документы]
[Патентный документ 1] WO 2000/42072
[Патентный документ 2] WO 2006/019447
[Патентный документ 3] WO 2004/99249
[Патентный документ 4] WO 2004/29207
[Патентный документ 5] US2009/0136485
[Непатентные документы]
[Непатентный документ 1] Nat Biotechnol, 23(9), 1073-1078, 2005
[Непатентный документ 2] Eur J Pharm Biopharm, 59(3), 389-96, 2005
[Непатентный документ 3] Chem Immunol, 65, 88-110, 1997
[Непатентный документ 4] J Biol Chem, 276(19), 16478-16483, 2001
[Непатентный документ 5] Eur J Immunol, 23(5), 1098-1104, 1993
[Непатентный документ 6] Immunology, 86(2), 319-324, 1995
[Непатентный документ 7] Immunol Lett, 82(1-2), 57-65, 2002
[Непатентный документ 8] Nat Rev Immunol, 10(5), 328-343, 2010
[Непатентный документ 9] Nat Rev Immunol, 8(1), 34-47, 2008
[Непатентный документ 10] Eur J Immunol, 19(8), 1379-1385, 1989
[Непатентный документ 11] J Exp Med, 129(6), 1183-1201, 1969
[Непатентный документ 12] Immunol Lett, 88(2), 157-161, 2003
[Непатентный документ 13] Science, 256(5065), 1808-1812, 1992
[Непатентный документ 14] Nature, 368(6466), 70-73, 1994
[Непатентный документ 15] Science, 290(5489), 84-89, 2000
[Непатентный документ 16] J Immunol, 181(8), 5350-5359 2008
[Непатентный документ 17] J Immunol, 163(2), 618-622, 1999
[Непатентный документ 18] J Exp Med, 189(1), 187-194, 1999
[Непатентный документ 19] J Exp Med, 191(5), 899-906, 2000
[Непатентный документ 20] Hum Genet, 117(2-3), 220-227, 2005
[Непатентный документ 21] J Biol Chem, 282(3), 1738-1746, 2007
[Непатентный документ 22] Arthritis Rheum, 54(12), 3908-3917, 2006
[Непатентный документ 23] Nat Med, 11(10), 1056-1058, 2005
[Непатентный документ 24] J Immunol, 176(9), 5321-5328, 2006
[Непатентный документ 25] J Exp Med, 203(9), 2157-2164, 2006
[Непатентный документ 26] J Immunol, 178(5), 3272-3280, 2007
[Непатентный документ 27] Blood, 113(16), 3716-3725, 2009
[Непатентный документ 28] Mol Immunol, 45(15), 3926-3933, 2008
[Непатентный документ 29] J Allergy Clin Immunol, 2012 Jan 16. в печати (PMID: 22257644)
[Непатентный документ 30] Arthritis Rheum, 62(7), 1933-1943, 2010
[Непатентный документ 31] Immunol Lett, 2012 Jan 25. в печати (PMID: 22305932)
[Непатентный документ 32] Science, 333(6045), 1030-1034, 2011
[Непатентный документ 33] Cancer Cell, 19(1), 101-113, 2011
[Непатентный документ 34] J Clin Invest, 2012 Feb 13. pii: 61226. doi: 10.1172/JCI61226. в печати (PMID: 22326955)
[Непатентный документ 35] J Immunol, 171(2), 562-568, 2003
[Непатентный документ 36] Blood, 108(2), 705-710, 2006
[Непатентный документ 37] J Immunol, 166(8), 4891-4898, 2001
[Непатентный документ 38] J Natl Cancer Inst, 99(16), 1232-1239, 2007
[Непатентный документ 39] Arthritis Rheum, 48(3), 719-727, 2003
[Непатентный документ 40] J Thromb Haemost, 7(1), 171-181, 2008
[Непатентный документ 41] J Immunol, 185(3), 1577-1583, 2010
[Непатентный документ 42] Sci Transl Med, 2(47), 47-63, 2010
[Непатентный документ 43] Mol Cancer Ther, 7(8), 2517-2527, 2008
[Непатентный документ 44] J Clin Invest, 97(5), 1348-1354, 1996
[Непатентный документ 45] Arthritis Rheum, 41(7), 1181-1189, 1998
[Непатентный документ 46] J Clin Invest, 115(10), 2914-2923, 2005
[Непатентный документ 47] Proc Natl Acad Sci USA, 102(8), 2910-2915, 2005
[Непатентный документ 48] Mol Immunol, 40(9), 585-593, 2003
[Непатентный документ 49] J Exp Med, 172, 19-25, 1990
Сущность изобретения
Проблемы, решаемые изобретением
Настоящее изобретение было осуществлено ввиду описанных выше обстоятельств. Задачей настоящего изобретения является предоставление полипептидов, содержащих Fc-область IgG, которые имеют сохраненную или сниженную активность связывания обоих аллотипов FcγRIIa: H-типа и R-типа, в которых аминокислота в положении 131 (нумерация по EU) FcγRIIa представляет собой His (тип H) или Arg (тип R), и имеющих повышенную активность связывания с FcγRIIb по сравнению с исходным полипептидом, путем внесения аминокислотных замен в Fc-область IgG; фармацевтических композиций, содержащих полипептид; терапевтических средств или профилактических средств, содержащих полипептид, против иммунологических воспалительных заболеваний; и способов их получения. Более того, задачей является предоставление способа сохранения или снижения активности связывания обоих аллотипов FcγRIIa: H-типа и R-типа, в которых аминокислота в положении 131 (нумерация по EU) FcγRIIa представляет собой His (тип H) или Arg (тип R), и повышения активности связывания с FcγRIIb по сравнению с исходным полипептидом; и способа подавления продукции антител по сравнению с исходным полипептидом при введении in vivo. Кроме того, задачей является предоставление способов продуцирования полипептида, имеющего сохраненную или сниженную активность связывания обоих аллотипов FcγRIIa: типа H и типа R, в которых аминокислота в положении 131 (нумерация по EU) FcγRIIa представляет собой His (тип H) или Arg (тип R), и имеющего повышенную активность связывания с FcγRIIb по сравнению с исходным полипептидом; и способов получения полипептида, подавляющего продукцию антител по сравнению с исходным полипептидом при введении in vivo.
Средства для решения проблем
Авторы настоящего изобретения провели целенаправленное исследование в отношении полипептида, содержащего Fc-область, имеющую сниженное опосредуемое Fc связывание с FcγRIIa, и увеличенное связывание с FcγRIIb по сравнению с исходным полипептидом. В результате авторы настоящего изобретения открыли, что полипептид, содержащий Fc-область антитела, которое содержит изменение, полученное путем заменой Pro в положении 238 (нумерация по EU) на Asp или Leu в положении 328 (нумерация по EU) на Glu, повышает активность связывания с FcγRIIb и снижает опосредуемую Fc-областью активность связывания обоих аллотипов FcγRIIa: типов H и R. Более того, авторы настоящего изобретения открыли, что полипептид, содержащий Fc-область антитела, которая содержит изменение, состоящее в замене Pro в положении 238 (нумерация по EU) на Asp и несколько других изменений, повышает активность связывания с FcγRIIb и сохраняет или снижает опосредуемую Fc-областью активность связывания обоих аллотипов cγRIIa, типов H и R.
Более конкретно, настоящее изобретение относится к следующему:
[1] вариант полипептида, содержащего Fc-область антитела по меньшей мере с одним аминокислотным изменением, который имеет сохраненную или сниженную активность связывания FcγRIIa (тип R) и FcγRIIa (тип H) и повышенную активность связывания с FcγRIIb по сравнению с исходным полипептидом, и где величина [величина KD варианта полипептида в отношении FcγRIIa (тип R)/[величина KD варианта полипептида в отношении FcγRIIb] составляет 1,2 или более;
[2] полипептид согласно [1], где величина [величина KD варианта полипептида в отношении FcγRIIa (тип H)]/[величина KD варианта полипептида в отношении FcγRIIb] составляет 4,2 или более;
[3] полипептид согласно [1] или [2], где величина [величина KD исходного полипептида в отношении FcγRIIb]/[величина KD варианта полипептида в отношении FcγRIIb] составляет 1,6 или более;
[4] полипептид согласно любому из [1]-[3], где величина [величина KD для более повышенной из активностей связывания варианта полипептида в отношении FcγRIIa (тип R) и FcγRIIa (тип H)]/[величина KD для более повышенной из активностей связывания исходного полипептида в отношении FcγRIIa (тип R) и FcγRIIa (тип H)] составляет 0,7 или более;
[5] полипептид согласно любому из [1]-[4], который имеет сохраненную или сниженную активность связывания FcγRIIIa по сравнению с исходным полипептидом;
[6] полипептид согласно любому из [1]-[5], который имеет сохраненную или сниженную активность связывания FcγRIa по сравнению с исходным полипептидом;
[7] полипептид согласно любому из [1]-[6], где аминокислотное изменение представляет собой замену Pro в положении 238 (нумерация по EU) на Asp или замену Leu в положении 328 (нумерация по EU) на Glu;
[8] полипептид согласно любому из [1]-[7], где аминокислотное изменение представляет собой по меньшей мере одну замену, выбранную из группы, состоящей из:
замены Pro в положении 238 (нумерация по EU) на Asp;
замены Gly в положении 237 (нумерация по EU) на Trp;
замены Gly в положении 237 (нумерация по EU) на Phe;
замены Ser в положении 267 (нумерация по EU) на Val;
замены Ser в положении 267 (нумерация по EU) на Gln;
замены His в положении 268 (нумерация по EU) на Asn;
замены Pro в положении 271 (нумерация по EU) на Gly;
замены Lys в положении 326 (нумерация по EU) на Leu;
замены Lys в положении 326 (нумерация по EU) на Gln;
замены Lys в положении 326 (нумерация по EU) на Glu;
замены Lys в положении 326 (нумерация по EU) на Met;
замены Ser в положении 239 (нумерация по EU) на Asp;
замены Ser в положении 267 (нумерация по EU) на Ala;
замены Leu в положении 234 (нумерация по EU) на Trp;
замены Leu в положении 234 (нумерация по EU) на Tyr;
замены Gly в положении 237 (нумерация по EU) на Ala;
замены Gly в положении 237 (нумерация по EU) на Asp;
замены Gly в положении 237 (нумерация по EU) на Glu;
замены Gly в положении 237 (нумерация по EU) на Leu;
замены Gly в положении 237 (нумерация по EU) на Met;
замены Gly в положении 237 (нумерация по EU) на Tyr;
замены Ala в положении 330 (нумерация по EU) на Lys;
замены Ala в положении 330 (нумерация по EU) на Arg;
замены Glu в положении 233 (нумерация по EU) на Asp;
замены His в положении 268 (нумерация по EU) на Asp;
замены His в положении 268 (нумерация по EU) на Glu;
замены Lys в положении 326 (нумерация по EU) на Asp;
замены Lys в положении 326 (нумерация по EU) на Ser;
замены Lys в положении 326 (нумерация по EU) на Thr;
замены Val в положении 323 (нумерация по EU) на Ile;
замены Val в положении 323 (нумерация по EU) на Leu;
замены Val в положении 323 (нумерация по EU) на Met;
замены Tyr в положении 296 (нумерация по EU) на Asp;
замены Lys в положении 326 (нумерация по EU) на Ala;
замены Lys в положении 326 (нумерация по EU) на Asn; и
замены Ala в положении 330 (нумерация по EU) на Met;
[9] полипептид согласно любому из [1]-[8], где полипептид, содержащий Fc-область антитела, представляет собой IgG-антитело;
[10] полипептид согласно любому из [1]-[8], где полипептид, содержащий Fc-область антитела, представляет собой молекулу слитого белка Fc;
[11] способ сохранения или снижения активности связывания в отношении FcγRIIa (тип R) и FcγRIIa (тип H) и повышения активности связывания FcγRIIb у полипептида по сравнению с исходным полипептидом, который включает внесение по меньшей мере одного аминокислотного изменения в Fc-область полипептида, содержащего Fc-область антитела, где аминокислотное изменение представляет собой замену Pro в положении 238 (нумерация по EU) на Asp или замену Leu в положении 328 (нумерация по EU) на Glu;
[12] способ подавления продукции антитела против полипептида, содержащего Fc-область антитела, по сравнению и исходным полипептидом при введении in vivo, где способ включает внесение по меньшей мере одного аминокислотного изменения в Fc-область полипептида, где аминокислотное изменение представляет собой замену Pro в положении 238 (нумерация по EU) на Asp или замену Leu в положении 328 (нумерация по EU) на Glu;
[13] способ согласно [11] или [12], где аминокислотное изменение представляет собой по меньшей мере одну замену, выбранную из группы, состоящей из:
замены Pro в положении 238 (нумерация по EU) на Asp;
замены Gly в положении 237 (нумерация по EU) на Trp;
замены Gly в положении 237 (нумерация по EU) на Phe;
замены Ser в положении 267 (нумерация по EU) на Val;
замены Ser в положении 267 (нумерация по EU) на Gln;
замены His в положении 268 (нумерация по EU) на Asn;
замены Pro в положении 271 (нумерация по EU) на Gly;
замены Lys в положении 326 (нумерация по EU) на Leu;
замены Lys в положении 326 (нумерация по EU) на Gln;
замены Lys в положении 326 (нумерация по EU) на Glu;
замены Lys в положении 326 (нумерация по EU) на Met;
замены Ser в положении 239 (нумерация по EU) на Asp;
замены Ser в положении 267 (нумерация по EU) на Ala;
замены Leu в положении 234 (нумерация по EU) на Trp;
замены Leu в положении 234 (нумерация по EU) на Tyr;
замены Gly в положении 237 (нумерация по EU) на Ala;
замены Gly в положении 237 (нумерация по EU) на Asp;
замены Gly в положении 237 (нумерация по EU) на Glu;
замены Gly в положении 237 (нумерация по EU) на Leu;
замены Gly в положении 237 (нумерация по EU) на Met;
замены Gly в положении 237 (нумерация по EU) на Tyr;
замены Ala в положении 330 (нумерация по EU) на Lys;
замены Ala в положении 330 (нумерация по EU) на Arg;
замены Glu в положении 233 (нумерация по EU) на Asp;
замены His в положении 268 (нумерация по EU) на Asp;
замены His в положении 268 (нумерация по EU) на Glu;
замены Lys в положении 326 (нумерация по EU) на Asp;
замены Lys в положении 326 (нумерация по EU) на Ser;
замены Lys в положении 326 (нумерация по EU) на Thr;
замены Val в положении 323 (нумерация по EU) на Ile;
замены Val в положении 323 (нумерация по EU) на Leu;
замены Val в положении 323 (нумерация по EU) на Met;
замены Tyr в положении 296 (нумерация по EU) на Asp;
замены Lys в положении 326 (нумерация по EU) на Ala;
замены Lys в положении 326 (нумерация по EU) на Asn; и
замены Ala в положении 330 (нумерация по EU) на Met;
[14] способ согласно любому из [11]-[13], где полипептид, содержащий Fc-область антитела, представляет собой IgG-антитело;
[15] способ согласно любому из [11]-[13], где полипептид, содержащий Fc-область антитела, представляет собой молекулу слитого белка Fc;
[16] способ получения полипептида, имеющего сохраненную или сниженную активность связывания FcγRIIa (тип R) и FcγRIIa (тип H) и имеющего повышенную активность связывания с FcγRIIb по сравнению с исходным полипептидом, где способ включает внесение по меньшей мере одного аминокислотного изменения в Fc-область полипептида, содержащего Fc-область антитела, где аминокислотное изменение представляет собой замену Pro в положении 238 (нумерация по EU) на Asp или замену Leu в положении 328 (нумерация по EU) на Glu;
[17] способ получения полипептида, подавляющего продукцию антител против полипептида по сравнению с исходным полипептидом при введении in vivo, где способ включает внесение по меньшей мере одного аминокислотного изменения в Fc-область полипептида, содержащего Fc-область антитела, где аминокислотное изменение представляет собой замену Pro в положении 238 (нумерация по EU) на Asp или замену Leu в положении 328 (нумерация по EU) на Glu;
[18] способ согласно [16] или [17], где аминокислотная замена представляет собой по меньшей мере одну замену, выбранную из группы, состоящей из:
замены Pro в положении 238 (нумерация по EU) на Asp;
замены Gly в положении 237 (нумерация по EU) на Trp;
замены Gly в положении 237 (нумерация по EU) на Phe;
замены Ser в положении 267 (нумерация по EU) на Val;
замены Ser в положении 267 (нумерация по EU) на Gln;
замены His в положении 268 (нумерация по EU) на Asn;
замены Pro в положении 271 (нумерация по EU) на Gly;
замены Lys в положении 326 (нумерация по EU) на Leu;
замены Lys в положении 326 (нумерация по EU) на Gln;
замены Lys в положении 326 (нумерация по EU) на Glu;
замены Lys в положении 326 (нумерация по EU) на Met;
замены Ser в положении 239 (нумерация по EU) на Asp;
замены Ser в положении 267 (нумерация по EU) на Ala;
замены Leu в положении 234 (нумерация по EU) на Trp;
замены Leu в положении 234 (нумерация по EU) на Tyr;
замены Gly в положении 237 (нумерация по EU) на Ala;
замены Gly в положении 237 (нумерация по EU) на Asp;
замены Gly в положении 237 (нумерация по EU) на Glu;
замены Gly в положении 237 (нумерация по EU) на Leu;
замены Gly в положении 237 (нумерация по EU) на Met;
замены Gly в положении 237 (нумерация по EU) на Tyr;
замены Ala в положении 330 (нумерация по EU) на Lys;
замены Ala в положении 330 (нумерация по EU) на Arg;
замены Glu в положении 233 (нумерация по EU) на Asp;
замены His в положении 268 (нумерация по EU) на Asp;
замены His в положении 268 (нумерация по EU) на Glu;
замены Lys в положении 326 (нумерация по EU) на Asp;
замены Lys в положении 326 (нумерация по EU) на Ser;
замены Lys в положении 326 (нумерация по EU) на Thr;
замены Val в положении 323 (нумерация по EU) на Ile;
замены Val в положении 323 (нумерация по EU) на Leu;
замены Val в положении 323 (нумерация по EU) на Met;
замены Tyr в положении 296 (нумерация по EU) на Asp;
замены Lys в положении 326 (нумерация по EU) на Ala;
замены Lys в положении 326 (нумерация по EU) на Asn; и
замены Ala в положении 330 (нумерация по EU) на Met;
[19] способ согласно любому из [16]-[18], где полипептид, содержащий Fc-область антитела, представляет собой IgG-антитело;
[20] способ согласно любому из [16]-[18], где полипептид, содержащий Fc-область антитела, представляет собой молекулу слитого белка Fc;
[21] полипептид, продуцируемый способом согласно любому из [16]-[20];
[22] фармацевтическая композиция, содержащая полипептид согласно любому из [1]-[10] и [21];
[23] средство для подавления активации B-клеток, тучных клеток, дендритных клеток и/или базофилов, которое содержит полипептид согласно любому из [1]-[10] и [21];
[24] средство для лечения или профилактики иммунологического воспалительного заболевания, которое содержит полипептид по любому из [1]-[10] и [21];
[25] терапевтическое средство или профилактическое средство по [24], где иммунологическое воспалительное заболевание представляет собой аутоиммунное заболевание и представляет собой заболевание, которое может быть вызвано образованием антитела против аутоантигена;
[26] средство для лечения заболевания, которое содержит полипептид согласно любому из [1]-[10] и [21], где заболевание представляет собой заболевание с дефицитом биологически необходимого белка; и
[27] противовирусное средство, содержащее полипептид согласно любому из [1]-[10] и [21].
Настоящее изобретение также относится к способам лечения или профилактики иммунологических воспалительных заболеваний, которые включают стадию введения индивидууму полипептида по настоящему изобретению или полипептида, полученного способами получения по настоящему изобретению. Более того, настоящее изобретение относится к наборам для применения в терапевтических способах или профилактических способах по настоящему изобретению, которые содержат полипептид по настоящему изобретению или полипептид, продуцируемый способами получения по настоящему изобретению, или фармацевтическую композицию по настоящему изобретению. Настоящее изобретение также относится к применению полипептида по настоящему изобретению или полипептида, продуцируемого способами получения по настоящему изобретению, для получения лекарственных средств или профилактических средств при иммунологических воспалительных заболеваниях. Кроме того, настоящее изобретение относится к полипептиду по настоящему изобретению или полипептиду, продуцируемому способами получения по настоящему изобретению, для применения в терапевтическом способе или профилактическом способе по настоящему изобретению. Настоящее изобретение также относится к способам подавления активации B-клеток, тучных клеток, дендритных клеток и/или базофилов, которые включают стадию введения индивидууму полипептида по настоящему изобретению или полипептида, продуцируемого способами получения по настоящему изобретению. Настоящее изобретение относится к наборам для применения в способе ингибирования по настоящему изобретению, которые содержат полипептид по настоящему изобретению или полипептид, продуцируемый способами получения по настоящему изобретению, или фармацевтическую композицию по настоящему изобретению. Настоящее изобретение относится к применению полипептида по настоящему изобретению или полипептида, продуцируемого способами получения по настоящему изобретению, для получения средств, которые подавляют активацию B-клеток, тучных клеток, дендритных клеток и/или базофилов. Настоящее изобретение относится к полипептидам по настоящему изобретению или полипептидам, продуцируемым способами получения по настоящему изобретению, для применения в способах ингибирования по настоящему изобретению. Настоящее изобретение относится к способам лечения заболеваний с дефицитом биологически необходимых белков, которые включают стадию введения индивидууму полипептида по настоящему изобретению или полипептида, продуцируемого способами получения по настоящему изобретению. Настоящее изобретение относится к наборам для применения в терапевтическом способе по настоящему изобретению, которые содержат полипептид по настоящему изобретению или пол