Высокоаффинные и агрегационно стабильные антитела на основе вариабельных доменов vl и производного vhh
Иллюстрации
Показать всеИзобретение относится к области биохимии. Предложено гуманизированное моноклональное антитело типа IgG, связывающееся с интерлейкином 17A человека. Антитело содержит вариабельные домены в виде комбинации производного VHH с вариабельным доменом легкой цепи VL. Указанное производное VHH содержит замены аминокислот в позициях 44 и 45 (по нумерации по Kabat). Также изобретение относится к ДНК, кодирующей указанное антитело, экспрессионному вектору, клеточной линии и способу получения указанного антитела. Кроме того, предложена фармацевтическая композиция для лечения опосредуемого IL-17A заболевания или нарушения, содержащая указанное антитело. Изобретение позволяет получить антитела с повышенной аффинностью и улучшенной агрегационной стабильностью. 7 н. и 18 з.п. ф-лы, 17 ил., 6 табл., 19 пр.
Реферат
Введение
Антитела, или иммуноглобулины (Ig), - это растворимые гликопротеины крови и тканевой жидкости, играющие центральную роль в системе гуморального иммунитета у позвоночных. Антитела синтезируются В-лимфоцитами в ответ на чужеродные биологические и химические вещества (антигены) самой разнообразной структуры с целью их нейтрализации. Благодаря высокой специфичности и высокой аффинности связывания с определенным антигеном, а также возможности возникновения антител к практически неограниченному репертуару антигенов антитела и их производные являются одними из наиболее важных реагентов для использования в фундаментальных, прикладных и медицинских исследованиях.
Классические антитела [1, 2] представляют собой крупные мультимерные белки (IgG ~150 кДа), объединяющие две идентичные тяжелые Н-цепи, которые, в свою очередь, состоят из вариабельного VH, трех константных CH1, СН2, СН3 доменов и шарнирного участка между СН1 и СН2 доменами, и две идентичные легкие L цепи, состоящие из вариабельного, VL, и константного, CL, доменов. Четырехцепочечная молекула объединена посредством нековалентных и ковалентных (дисульфидных) связей между цепями. При помощи протеазы папаина антитела можно расщепить на два фрагмента: Fab (Fragment antigen binding, антиген связывающий фрагмент) и Fc (Fragment crystallizable, фрагмент, способный к кристаллизации). Соответственно, одна область молекулы антител (Fab) определяет ее антигенную специфичность, а другая (Fc) осуществляет эффекторные функции, которые направлены на элиминацию антигена [3, 4]. Домены СН1 и СН2Н-цепи разделены шарнирной областью ("hinge region"), от которой зависит подвижность Fab-фрагмента и взаимодействие молекулы IgG с эффекторными рецепторами иммуноглобулинов, расположенными на клетках. СН2 домен содержит участки связывания как Fcϒ рецепторов, опосредующих клеточную активацию (ADCC и ADCP), так и молекул системы комплемента (CDC). Кроме того, в этом домене присутствует сайт, являющийся местом присоединения углеводов для всех изотипов иммуноглобулинов. СН3-домен в значительной степени определяет стабильность димера IgG, а также взаимодействует с FcRn рецептором на поверхности клеток, определяя фармакокинетические свойства антител и их распределение и метаболизм внутри организма. Комбинация антигенсвязывающих участков (CDR-Complementarity Determining Regions) вариабельного домена тяжелой цепи (VH) и вариабельного домена легкой цепи (VL) формирует участок связывания антигена, в то время как каркасные регионы вариабельных доменов (FR - Framework Regions) и константные домены антител непосредственно не участвуют в распознавании антигена. Минимизированной производной антиген-связывающего фрагмента классических антител является одноцепочечная конструкция, в которой вариабельные домены тяжелой и легкой цепей соединены линкерной последовательностью (scFv).
Важным открытием явилось обнаружение в крови представителей семейства Camelidae (верблюды, ламы, викуньи) в значительном количестве особых неканонических антител с упрощенной структурой [5]. Такие антитела ("heavy chain antibody", HCAb) состоят из димера только одной укороченной тяжелой цепи (без СН1-домена), а легкая цепь при этом отсутствует. Антиген-узнающий участок HCAb формируется лишь одним вариабельным доменом тяжелой цепи (VHH), который непосредственно связан через шарнирную область с Fc-доменом. Часто вместо VHH используют термин "однодоменное антитело", "nanobody" (нанотело), "мини-антитело" или "наноантитело". Как оказалось, такая монодоменная структура в изолированном виде, кроме малых размеров (12-15 кДа), обладает рядом преимуществ перед классическими IgG антителами, а именно агрегационной, химической и термостабильностью. Антитела VHH можно эффективно клонировать и экспрессировать в бактериях и дрожжах. Обладая такими свойствами, они получили технологическое развитие как в терапевтическом направлении, развиваемом компанией "Ablynx", так и области лабораторной и промышленной хроматографии с линейкой носителей CaptureSelect.
Неканонические антитела (HCAb), состоящие из димера только тяжелой цепи иммуноглобулина, впервые обнаружены при электрофоретическом анализе иммуноглобулинов в сыворотке крови различных представителей семейства верблюдовых [5]. Относительная доля HCAb варьирует от примерно 15-25% (всех IgG) у лам и викуний до примерно 60-80% у верблюдов [6].
Как предполагают, неканонические антитела (HCAb), по крайней мере, в случае верблюдовых, представляют собой результат относительно недавней эволюции генов канонических антител. Два константных домена тяжелых цепей, СН2 и СН3, в случае HCAb и классических антител высококонсервативны. В составе антител HCAb домен, соответствующий первому константному СН1-домену классических антител, отсутствует. Геном одногорбого верблюда (вид Dromedary) содержит кластер из примерно пятидесяти VH- и сорока VHH-генеративных генов, за которыми располагаются множественные гены D-сегментов, J-сегментов и гены константных участков (Cμ, Сγ, Сε, Сα). Очевидно, что некоторые из Сγ-генов предназначены для формирования HCAb (мутация приводит к потере СН1-домена), в то время как остальные - для формирования классических антител (с сохраняемым СН1-доменом). Одни и те же гены сегментов D и J могут случайным образом соединяться как с одним из VH-, так и с одним из VHH-генов. Это указывает на то, что гены VH и VHH находятся в одном и том же локусе [7-10].
Организация вариабельных доменов неканонических антител (VHH) и вариабельных доменов (VH) классических антител весьма сходна, т.к. у человека VH-домены подкласса IgG3 имеют особо выраженную гомологию с VH и VHH верблюдовых. В обоих случаях V-домены состоят из четырех консервативных каркасных участков FR, которые окружают три гипервариабельных участка, определяющих комплементарность, CDR. Также в обоих случаях формируется типичная для V-домена иммуноглобулина пространственная структура из двух β-слоев, один из которых состоит из четырех аминокислотных цепочек и второй - из пяти [11, 12]. В этой структуре все три гипервариабельных участка кластеризуются с одной стороны V-домена, где они участвуют в распознавании антигена и располагаются в петлях, соединяющих β-структуры. Однако имеются и важные отличия, связанные с функционированием VHH в формате одного домена. Так, гипервариабельные участки CDR1 и CDR3 VHH заметно увеличены. Часто в гипервариабельных участках VHH обнаруживаются цистеиновые остатки сразу в двух участках (чаще всего - в CDR1 и CDR3, реже - в CDR2 и CDR3). При исследовании кристаллических структур VHH показано, что эти цистеиновые остатки формируют дисульфидные связи, и это дополнительно стабилизирует структуру петель данного антитела [12]. Наиболее явный и воспроизводимый отличительный признак VHH - четыре замены гидрофобных аминокислотных остатков на гидрофильные во втором каркасном участке (Val37Phe, Gly44Glu, Leu45Arg, Trp47Gly, согласно нумерации Kabat и соавт. [13]). Этот каркасный участок у VH-домена высококонсервативен, обогащен гидрофобными аминокислотными остатками и особо важен при образовании связи с вариабельным доменом VL легкой цепи. В этом аспекте VHH-домен сильно отличается: указанные замены гидрофобных аминокислот на гидрофильные делают невозможной ассоциацию VHH и VL. Эти замены также объясняют обычно высокую растворимость VHH (наноантитела) при его получении в виде рекомбинантного белка [14].
Репертуары возможных паратопов (антиген-связывающих структур антитела) HCAb и классических антител, по-видимому, могут заметно отличаться. Так как эти два типа антител сосуществуют в одном организме, то можно предполагать, что они не конкурируют, а взаимно дополняют друг друга. Действительно, не раз отмечалось, что оба типа антител могут возникать параллельно, взаимоисключающе или в разных соотношениях, по отношению к разным эпитопам антигенного материала при иммунизации одного и того же животного. Несмотря на предполагаемое меньшее разнообразие возможных паратопов у однодоменных антител по сравнению с классическими двухдоменными антителами работы многих авторов убедительно продемонстрировали, что HCAb могут быть получены против самых разнообразных эпитопов весьма широкого спектра антигенов [15]. Очевидно, этому способствуют заметно увеличенные гипервариабельные участки CDR1 и CDR3. Следует также отметить удивительно большое (в сравнении с V-доменами классических антител) число соматических гипермутаций в VHH, накапливающихся, по-видимому, в процессе аффинного созревания антител в ходе иммунизации [16]. Рентгеноструктурный анализ показал, что антиген-связывающие петлевые участки VHH способны образовывать необычные для классических V-доменов структуры [12, 16]. Если в случае VH- и VL-доменов классических антител все шесть гипервариабельных участков вносят более или менее одинаковый вклад в связывание антигена, то в случае VHH обычно для формирования паратопа более важен CDR3-участок. Показано, что CDR3-участок в VHH (но не в VH или VL) может образовывать необычные длинные пальцеобразные выступающие структуры, которые могут углубляться в структуру антигена, в частности распознавать активные центры ферментов [12]. Малыми размерами антиген-связывающего участка (VHH) и его способностью формировать необычные выступающие паратопы объясняется возможность получения HCAb, способных распознавать недоступные для классических антител эпитопы, например, при образовании антител, являющихся эффективными ингибиторами ферментов [17].
При всем своем высоком потенциале уникальной в сравнении с классическими IgG антителами специфичности использование монодоменных VHH для терапевтического применения в ряде случаев ограничено из-за быстрого выведения этой малой молекулы из организма. Существует ряд решений по улучшению фармакокинетики VHH структур, которые включают использование химической конъюгации с ПЭГ (PEG) и ковалентное соединение с полипептидом, опосредующим уменьшенный клиренс из крови, такими как сывороточный альбумин человека (HSA) и Fc-фрагмент классического антитела человека, в виде гибридных белков, период полувыведения в крови которых составляет до трех недель [18, 19, 20]. Также показано успешное применение малых пептидов, присоединяемых с помощью методов генной инженерии к VHH и способных к высокоаффиному нековалентному взаимодействию с этими же компонентами (HSA и IgG) в крови человека [21]. Однако технологичность и иммуногенность этих подходов остается пока неясной и находится только на стадии проверки применимости как в клинических исследованиях так и на более ранних стадиях исследований.
Кроме того, наибольшее ограничение при применении антител в качестве препаратов для лечения различных заболеваний накладывает агрегационная и химическая стабильность, аффинность и иммуногенность. Т.к. большинство моноклональных антител в настоящее время получают на основе мышиных, применение таких антител у пациентов приводит к развитию иммунного ответа на терапию антителами, например аллергических реакций. Такие типы иммунного ответа могут повлечь за собой, в конечном итоге, потерю эффективности при лечении по меньшей мере и, в худшем случае, к возможным тяжелым анафилактическим реакциям. С другой стороны, агрегационно или химически нестабильные терапевтические антитела при хранении препарата ухудшают его терапевтические свойства и могут усиливать иммуногенность при введении в организм пациента.
В связи с вышесказанным, актуальным является создание антител на основе антител VHH, которые имели бы, по сравнению с известными ранее антителами, улучшенные функциональные и терапевтические свойства, в частности повышенную агрегационную, химическую и термостабильность, и улучшенную аффинность, и в то же время отличались бы легкостью и простотой получения, в т.ч. и в промышленно значимых масштабах.
Предшествующий уровень техники
Из предшествующего уровня техники известны различные конструкции антител, содержащие VHH домен в своем составе.
В публикации РСТ/ЕР 2008/066368 описаны антитела, которые содержат отдельные вариабельные домены, связанные с Fc-фрагментом. В качестве вариабельных доменов могут быть использованы «нанотела», при этом Fc- фрагмент получен из антитела типа IgE. Указанные Fc-фрагмент и домен могут соединяться через линкер, расположенный в шарнирной области.
В заявке на патент US 2009/0202979 раскрыты антитела, включающие полностью или часть антител VHH, непосредственно соединенные с константными частями человеческих антител.
Также известны аминокислотные замены, влияющие на физико-химические и биологические свойства антител.
Например, в заявке US 20110028348 описаны вариабельные домены тяжелых цепей антитела, в которых введены аминокислотные замены в позициях 35, 45, 47, 93-100 и 100а для повышения гидрофильности получаемого антитела.
К настоящему времени разработаны методы оптимизации структуры изолированных VHH и VH монодоменов, уменьшающие их иммуногенность и улучшающие агрегационную стабильность.
Так, Vincke и соавторы [22] обнаружили, что замены Glu-49→Gly и Arg-50→Leu в характерных аминокислотах приводят к получению отдельного домена, который является более стабильным, но при этом менее растворимым. Другие замены в каркасном участке FR-2 Phe-42→Val и Gly/Ala-52→Trp критично влияют на аффинность антитела к антигену вследствие переориентации петли Н3, повышая константу его кинетической диссоциации в 6-10 раз (6,85⋅10-3 1/с). При замене Phe-42→Vаl наблюдалось снижение стабильности получаемых антител. Замена Gly-49 и Leu-50 в VH последовательности приводила к снижению стабильности домена, в то время как гуманизация по Glu-49 и Arg-50 в VHH позволяла получить стабильные вариабельные домены.
Из литературы также известно, что при наличии коротких HCDR3 регионов, нивелирующих экранирующий эффект конформации классических VHH, и внесении VH-характерной замены Trp-47 на Gly-47 и замен Tyr-37 на Val-37, Glu-44 на Gly-44 и Arg-45 на Leu-45, изолированные VHH-домены могут восстанавливать способность к связыванию с VL-доменами [24].
Связь между повышением аггрегационной стабильности терапевтических антител классической IgG структуры и снижением их иммуногенности подкреплена результатами работ многих авторов и рассмотрена в обзоре Hermeling et al., 2004 [25]. Однако не было обнаружено антител, имеющих в своем составе производные VHH - доменов, но связанных с вариабельными доменами легких цепей в составе полноразмерных иммуноглобулинов человека класса IgG.
Таким образом, существует необходимость в создании нового формата антител, которые при этом обладали бы повышенной стабильностью и аффинностью, отличались хорошей экспрессией и имели бы низкую иммуногенность.
Кроме того, ранее не описано подходов к созданию подобных молекул с улучшенной агрегационной стабильностью и повышенной аффинностью, и высоким уровнем экспрессии в клеточных культурах млекопитающих и легкостью в получении.
В связи с вышесказанным, данное изобретение впервые описывает формат антител, включающих производные VHH-доменов, способных связываться с вариабельными доменами легких цепей в составе полноразмерных иммуноглобулинов человека класса IgG с образованием сходной с природной и, следовательно, обладающей низкой иммуногенностью, но в то же время улучшенной агрегационной стабильностью и повышенной аффинностью, и имеющих структуру терапевтического моноклонального антитела.
Описание фигур
Фиг. 1. Схема создания и оптимизации агрегационно стабильного антитела на основе VHH.
Фиг. 2. SDS-гель-электрофорез SDS-гель-электрофорез антител VHHIgG1c различными аминокислотными заменами.
Фиг. 3. Схема синтеза комбинаторной библиотеки Fab ламы.
Фиг. 4. Фагмида для клонирования Fab фаговых дисплейных библиотек.
Фиг. 5А-С. Сенсограммы проверки сравнительных кинетических характеристик VHHFab клонов по связыванию с IL-17A.
Фиг. 5А. Последовательности вариабельных доменов VHH ламы в составе Fab, специфичных против IL-17А человека.
Фиг. 5В. Последовательности вариабельных доменов легких цепей ламы в составе 3VHHFab, специфичных против IL-17A человека.
Фиг. 5С. Сенсограммы проверки сравнительных кинетических характеристик VHHFab клонов по связыванию с IL-17A.
Фиг. 6А. Аминокислотные последовательности 3 различных мутантов VHH.
Фиг. 6В. Агрегационная стабильность 3 мутантов VHH.
Фиг. 6С. Свойства аффиности 3 мутантов VHH.
Фиг. 7. Клеточный тест блокирования продукции IL-6 путем ингибирования IL-17A антагонистами VHHIgG1VK4B11, mut1 VHHIgG1 и mut4 VHHIgG1.
Фиг. 8. Выделение химерных вариантов mut4 VHHFab, содержащие легкие цепи человека.
Фиг. 9. Клеточный тест блокирования продукции IL-6 путем ингибирования IL-17A антагонистами mut4 VHHIgG1VK3c8, mut4 VHHIgG1VK1A7 и mut4 VHHIgG1VK4E12.
Фиг. 10. Белковый электрофорез в денатурирующих условиях препаратов, содержащие антитела с мутациями в позициях 44 и 45 m4 VHHc8.
Фиг. 11. Сравнительный клеточный тест блокирования продукции IL-6 путем ингибирования IL-17A антагонистами m4 VHHc8 с мутациями в позициях 44 и 45 в FR2.
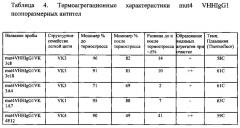
Фиг. 12. Диаграмма стабильности и функциональных свойств для различных мутаций 44 и 45 позиций в регионе FR2 m4 VHHc8, определяющих взаимодействия вариабельного домена тяжелой и легкой цепей.
Фиг. 13А. Определение кинетических параметров взаимодействия BCD 109 к IL-17A из различных видов организмов (на приборе Octet RED 96).
Фиг. 13В. Результаты по исследованию кинетических параметров взаимодействия BCD 109 к IL-17A из различных видов организмов (на приборе Octet RED 96).
Фиг. 14. Хроматограмма антитела BCD 109, полученная до и после проведения термостресса.
Определения
"Моноклональное антитело", как используется в данной заявке, относится к антителу ламы, химерному антителу, гуманизированному антителу или полностью человеческому антителу, если в данной заявке не указано иное. Моноклональные антитела по изобретению могут быть получены с использованием, например, рекомбинантных технологий, технологий фагового дисплея, синтетических технологий или комбинаций таких технологий или других технологий, хорошо известных из уровня техники.
"Моноклональное антитело" относится к антителу, полученному из единой копии или клона, включая, например, любой эукариотический, прокариотический или фаговый клон, а не к способу его получения. "Моноклональное антитело" может быть интактным антителом (содержащим полный или полноразмерный Fc-участок), по существу интактным антителом, частью или фрагментом антитела, содержащими антиген связующую часть, например Fab-фрагмент, Fab'-фрагмент или F(ab')2-фрагмент ламы или химерного, гуманизированного или человеческого антитела. "Fab''-фрагмент содержит вариабельный и константный домен легкой цепи и вариабельный домен и первый константный домен (СН1) тяжелой цепи. "F(ab')2"- фрагменты антитела содержат пару Fab-фрагментов, которые в основном ковалентно связаны возле их С-концов шарнирными цистеинами между ними. Другие химические связывания фрагментов антител также хорошо известны из уровня техники.
Кроме того, "моноклональное антитело", как используется в данной заявке, может быть одноцепочечным Fv-фрагментом, который может быть получен путем связывания ДНК, кодирующей VHH и VL, с линкерной последовательностью. До тех пор пока белок сохраняет способность специфического или предпочтительного связывания своей мишени (например, эпитопа или антигена), он относится к термину "антитело". Антитела могут быть гликозилированными, или не быть таковыми, и входят в рамки изобретения.
Термин "производное" или «вариант» антитела в контексте данной заявки относится к молекуле, аминокислотная последовательность которой отличается от аминокислотной последовательности "родительского" антитела путем добавления, делеции и/или замещения одного или более аминокислотных остатков в последовательности родительского антитела. В предпочтительном из вариантов осуществления вариантное антитело содержит по крайней мере одну аминокислотную (например, от одной до приблизительно десяти и предпочтительно 2, 3, 4, 5, 6, 7 или 8 замен) замену в FR- или CDR-участках родительского антитела. Идентичность или гомологичность относительно последовательности вариантного антитела определена в данной заявке как процент аминокислотных остатков в последовательности вариантного антитела, идентичный остаткам родительского антитела, после выравнивания последовательностей и введения разрывов, при необходимости, для достижения максимального процента идентичности последовательности.
Производное (от родительского) антитело сохраняет способность связывать антиген или предпочтительно эпитоп, с которым связывается родительское антитело или предпочтительно имеет по крайней мере одно свойство или биологическую активность, которая превосходит аналогичные свойства родительского антитела. Например, антитело предпочтительно обладает большей агрегационной стабильностью или сильной аффинностью связывания, улучшенными фармакокинетическими свойствами или повышенной способностью ингибировать биологическую активность антигена, чем родительское антитело.
Термин "VHH производное" в контексте данной заявки относится к производным VHH антител, чья аминокислотная последовательность отличается от аминокислотной последовательности "родительского" VHH антитела путем замещения одного или более аминокислотных остатков в последовательности родительского антитела. В предпочтительном из вариантов осуществления производное VHH антитело содержит по крайней мере одну аминокислотную (например, от одной до приблизительно двадцати и предпочтительно 2, 3, 4, 5, 6, 7 или 8) замену в FR- или CDR-участках родительского антитела.
Производное антитело сохраняет способность связывать антиген или предпочтительно эпитоп, с которым связывается родительское антитело или предпочтительно имеет по крайней мере одно свойство или биологическую активность, которая превосходит аналогичные свойства родительского антитела. Например, антитело предпочтительно обладает большей агрегационной стабильностью или сильной аффинностью связывания, улучшенными фармакокинетическими свойствами или повышенной способностью ингибировать биологическую активность антигена, чем родительское антитело.
"Родительское VHH антитело", или "исходное VHH антитело", или "дикое VHH антитело" в контексте данной заявки относится к VHH антителу, выделенному из иммунизированного или неиммунизированного животного семейства верблюдовых и кодированному аминокислотной последовательностью, которая используется для получения VHH производного. Родительское антитело может иметь каркасную последовательность происхождения из семейства верблюдовых в части вариабельного домена VHH, но предпочтительно каркасная последовательность вариабельного домена легкой цепи имеет полностью или по существу человеческое происхождение.
"Родительское", или "исходное", или "дикое" антитело в контексте данной заявки представляет собой антитело, кодированное аминокислотной последовательностью, которая используется для получения варианта. Родительское антитело может иметь каркасную последовательность происхождения из семейства верблюдовых в части вариабельного домена VHH, но предпочтительно каркасная последовательность вариабельного домена легкой цепи имеет полностью или по существу человеческое происхождение.
Термин "специфически связывает", как используется в данной заявке, относится к той ситуации, при которой один участник пары специфического связывания не связывает в значительной степени молекулы, отличные от его партнера (партнеров) по специфическому связыванию. Термин также применим, когда, например, антигенсвязывающий домен антитела по изобретению является специфическим для конкретного эпитопа, который переносится рядом антигенов, в таком случае специфическое антитело, имеющее антигенсвязывающий домен, будет способно к специфическому связыванию различных антигенов, несущих эпитоп. Соответственно, моноклональное антитело по изобретению специфически связывает IL-17 человека (т.е. IL-17A), в то время как оно специфически не связывает человеческие IL-17B, IL-17C, IL-17D, IL-17E. Более того, моноклональное антитело по изобретению специфически связывает IL-17 человека и IL-17 макаки-крабоеда, но специфически не связывает IL-17 крысы или IL-17 мыши.
Термин "предпочтительно связывает", как используется в данной заявке, относится к ситуации, в которой антитело связывает специфический антиген по крайней мере приблизительно на 20% больше, предпочтительно по крайней мере приблизительно на 50% и в 2, 20, 50 или 100 раз больше, чем оно связывает иной антиген в соответствии с измерениями, проведенными по методикам, известным из уровня техники, например, конкурентного анализа ELISA или KD измерений при помощи анализов Octet прибора. Антитело может предпочтительно связывать один эпитоп в пределах антигена, а не другой эпитоп в пределах того же самого антигена. Соответственно, антитело по изобретению предпочтительно связывает IL-17 человека, но не IL-17 кролика.
Термин "эпитоп" относится к той части молекулы, которая способна распознаваться и связываться с антителом в одном или более антигенсвязывающих участках антитела. Эпитопы часто состоят из химически активных поверхностных групп молекул, таких как аминокислоты или сахарные боковые цепи, и обладают определенными трехмерными структурными характеристиками. Под "ингибирующим эпитопом" и/или "нейтрализующим эпитопом" подразумевается эпитоп, который в контексте интактной антигенной молекулы и при связывании антителом, специфическим к эпитопу, приводит к утрате или к уменьшению биологической активности молекулы или организма, который содержит молекулу, in vivo или in vitro.
Термин "эпитоп", как используется в данной заявке, кроме того, относится к части полипептида, которая обладает антигенной и/или иммуногенной активностью у животного, предпочтительно млекопитающего, например мыши или человека. Термин "антигенный эпитоп", как используется в данной заявке, является частью полипептида, с которой может специфически связываться антитело, определенная любым способом, хорошо известным из уровня техники, например при помощи традиционного иммунного анализа. Антигенные эпитопы не обязательно должны быть иммуногенными, но могут также быть имуногенными. "Иммуногенный эпитоп", как используется в данной заявке, определяется как часть полипептида, который вызывает отклик антитела у животного, как устанавливается любым способом, известным из уровня техники. "Нелинейный эпитоп" или "конформационный эпитоп" содержат несмежные полипептиды (или аминокислоты) в пределах антигенного протеина, с которым антитело, специфическое к эпитопу, связывается.
Выражения "функциональная активность" или "функциональная характеристика" или термины "биологическая активность" или "биоактивность" по отношению к антителу по изобретению используются в данной заявке как взаимозаменяемые и включают, но не ограничиваются приведенными, эпитоп/антигенную аффинность и специфичность, способность нейтрализовать или быть антагонистом активности IL-17 in vivo или in vitro, IC50, стабильность антитела и иммуногенные свойства антитела in vivo. Остальные идентифицируемые из уровня техники биологические свойства или характеристики антитела включают, например, перекрестную реактивность (т.е. с нечеловеческими гомологами белка-мишени или с остальными белками или даже клетками, в общем) и способность сохранять высокие уровни экспрессии протеина в клетках млекопитающих. Вышеуказанные свойства или характеристики могут измеряться или оцениваться с использованием методик, включая, но не ограничиваясь приведенными, анализ ELISA, конкурентный анализ ELISA, Octet анализа, анализы нейтрализации in vitro или in vivo без ограничений, рецепторного связывания, продуцирования и/или секреции цитокина или фактора роста, сигнальную трансдукцию и иммуногистохимию срезов тканей, полученных из различных источников, включая человека, примата или любой другой источник.
Популяция "моноклональных антител" относится к гомогенной или по существу гомогенной популяции антител (т.е. по крайней мере приблизительно 85, 90, 91, 92, 93, 94, 95, 96%, более предпочтительно по крайней мере приблизительно 97 или 98% или еще более предпочтительно по крайней мере 99% антител в популяции будут конкурировать в анализе ELISA за тот же антиген или эпитоп, или более предпочтительно антитела являются идентичными в аминокислотной последовательности).
Полноразмерное антитело, существующее в природе, представляет собой молекулу иммуноглобулина, которая состоит из четырех пептидных цепей, две тяжелые (Н) цепи (приблизительно 50-70 кДа при полной длине) и две легкие (L) цепи (приблизительно 25 кДа при полной длине), взаимосвязанных дисульфидными мостиками. Аминоконцевая часть каждой цепи включает вариабельный домен из приблизительно 100-110 или более аминокислот, которые отвечают за связывание антигена. Карбоксиконцевая часть каждой цепи определяет константный участок, главным образом, отвечающий за функцию эффектора. Легкие цепи классифицируют как каппа или лямбда, и они характеризуются конкретным константным участком. Каждая легкая цепь состоит из вариабельного участка N-концевой легкой цепи (в данной заявке "VL" или "VK") и константного участка легкой цепи, состоящего из одного домена, CL или СК. Тяжелые цепи классифицируют как гамма, мю, альфа, дельта или эпсилон, и они определяют изотип антитела, такой как IgG, IgM, IgE IgA и IgD, соответственно, и несколько из них могут быть дополнительно разделены на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1. Каждый тип тяжелой цепи характеризуется конкретным константным участком. Каждая тяжелая цепь состоит из вариабельного участка N-концевой тяжелой цепи (в данной заявке "VH") и константного участка тяжелой цепи. Константный участок тяжелой цепи состоит из трех доменов (CH1, СН2 и СН3) для IgG, IgD и IgA и 4 доменов (CH1, СН2, СН3 и СН4) для IgM и IgE. Вариабельные домены VH, VHH и VL могут быть дополнительно разделены на участки гипервариабельности, названные гипервариабельными участками (CDR), чередующиеся с более консервативными участками, названными каркасными участками (FR). Каждый вариабельный домен состоит из трех CDR и четырех FR, расположенных в следующем порядке от N-конца к С-концу: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
В данной заявке 3 CDR тяжелых цепей обозначены как "HCDR1, HCDR2 и HCDR3", а 3 CDR легких цепей обозначены как "LCDR1, LCDR2 и LCDR3". CDR содержат большинство остатков, которые образуют специфические взаимодействия с антигеном. Нумерацию и позиционирование CDR-аминокислотных остатков осуществляют по Kabat номенклатуре.
Термин «антиген» относится к мишени антигена, против которой антитело может быть иммунореактивным, используется в контексте данной заявки в своем традиционном понятии, как его используют специалисты в данной области техники, и включает, среди прочих, полипептиды, пептиды, полисахариды, гликопротеины, полинуклеотиды (например, ДНК), или химические антигены, рецепторы, интерлейкины. Интерлейкины могут включать в себя интерлейкины разных групп, в т.ч. интерлейкин 1 (альфа и бета), интерлейкин 2, интерлейкин 3, интерлейкин 4, интерлейкин 5, интерлейкин 6, интерлейкин 7, интерлейкин 8, интерлейкин 9, интерлейкин 10, интерлейкин И, интерлейкин 17, интерлейкин 18, интерлейкин 33.
Термин «антиген» также может использоваться для описания материала, используемого для иммунизации животных (например, лам) при продуцировании антител согласно изобретению. В этом контексте «антиген» может иметь более широкое значение и может охватывать очищенные формы антигена и также неочищенные или не полностью выделенные или очищенные препараты антигена, такие как, например, клетки, лизаты клеток или супернатанты, фракции клеток, например клеточные мембраны и т.д. с добавлением гаптенов, конъюгированных с соответствующим носителем белка. Антиген, используемый в процессе иммунизации, не обязательно означает антиген, структурно идентичный мишени антигена, с которым в результате антитело согласно изобретению может связываться. Как правило, антиген, используемый для иммунизации, может представлять собой усеченный вариант мишени антигена, например фрагмент, содержащий иммуногенный эпитоп. Более подробные характеристики антигенов, используемых для иммунизации, описаны в литературе и могут быть хорошо известны специалисту в данной области техники.
Вариабельные участки каждой из пар легкая/тяжелая цепь образуют антигенсвязывающие сайты антитела. Таким образом, интактное IgG антитело имеет два сайта связывания. За исключением бифункциональных или биспецифических антител два сайта связывания являются одинаковыми. Как используется в данной заявке, "антигенсвязывающая часть", или "антигенсвязывающий участок", или "антигенсвязывающий домен" относятся, взаимозаменяемо, к такой части молекулы антитела, которая содержит аминокислотные остатки, взаимодействующие с антигеном и обуславаливающие специфичность и аффинность антитела по отношению к антигену. Такая часть антитела включает "каркасные" аминокислотные остатки, необходимые для поддержания надлежащей конформации антигенсвязывающих остатков.
Предпочтительно CDR антигенсвязывающего участка VHH или весь антигенсвязывающий участок антител по изобретению полностью происходит от семейства верблюдовых или по существу происходит от семейства верблюдовых, содержит определенные аминокислотные остатки, измененные, например замещенные разными аминокислотными остатками (см., например, табл. 6) с тем, чтобы оптимизировать конкретные свойства антитела, например KD, koff, IC50. Предпочтительно каркасные участки антитела по изобретению имеют происхождение от семейства верблюдовых или человека или по существу человеческое происхождение (по крайней мере на 80, 85, 90, 95, 96, 97, 98 или 99% человеческое происхождение) и соответствуют номенклатуре Kabat.
«Фрагмент антитела» может представлять собой фрагмент антитела или фрагмент антитела, имеющий активность полноразмерного антитела. Указанный фрагмент антитела может представлять собой F(ab')2, F(ab)2, Fab', Fab Fv и scFv.
"Интерлейкин 17", или также "IL-17" или "IL-17 А", является гомодимерным белком с массой 20-30 кДа. Ген IL-17A человека кодирует 155-аминокислотный протеин, который имеет 19-аминокислотную сигнальную последовательность и 136-аминокислотный зрелый сегмент. Аминокислотная последовательность IL-17A человека на 80%, 63% и 58% идентична аминокислотным последовательностям кролика, мыши и крысы, соответственно. Аминокислотная последовательность IL-17A человека на 97% идентична последовательности интерлейкина-17А макаки-крабоеда.
Термин "антитело" при употреблении в связи с анти-IL-17 моноклональным антителом по изобретению (либо упрощенно, "моноклональное антитело по изобретению"), как используется в данной заявке, относится к моноклональному антителу.
Термин "ингибировать" или "нейтрализовать", как используется в данной заявке, по отношению к функциональной активности антитела по изобретению, означает способность в значительной степени препятствовать, предотвращать, ограничивать, замедлять, прекращать, уменьшать или обращать, например, развитие или тяжесть того, что ингибируют, включая, но не ограничиваясь вышеприведенными, биологическую активность (например, активность IL-17) или свойство, заболевание или состояние. Ингибирование или нейтрализация активности IL-17 в результате связывания антитела по изобретению с IL-17 составляет предпочтительно по крайней мере приблизительно 20, 30, 40, 50, 60, 70, 80, 90, 95% или выше.
Термин "выделенный" или "изолированный" при использовании по отношению к нуклеиновой кислоте или белковому препарату (например, антителу) относится к молекуле нуклеиновой кислоты или белковой молекуле, которые идентифицируют и отделяют по крайней мере от одного контаминантного вещества, с которым она обычно связана в природном источнике. Предпочтительно "выделенное антитело" является антителом, которое по существу не содержит другие антитела, обладающие отличительной антигенной специфичностью (например, фармацевтические композиции согласно изобретению содержат выделенное антитело, которое специфически связывает IL-17 и по существу не содержит антитела, которые специфически связывают антигены, отличные от IL-17).
Термины "Kabat номенклатура" или «номенклатура по Kabat» применяются в данной заявке к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е. гипервариабельными), чем остальные аминокислотные остатки в вариабельных участках тяжелой и легкой цепи антитела (Kabat et al. Ann. NY Acad. Sci., 190:382-93 (1971); Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication №91-3242 (1991)).
Полину