Простатоассоциированные антигены и иммунотерапевтические схемы на основе вакцин
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению мультиантигенных ДНК-конструктов, векторов экспрессии, содержащих указанные конструкты, и фармацевтических композиций, что может быть использовано в медицине. Получают мультиантигенные ДНК-конструкты для экспрессии иммуногенных полипептидов простатоспецифических антигенов РSА, PSCA, PSMA, которые используют в составе композиции для ингибирования аномальной клеточной пролиферации или индуцирования иммунного ответа против простатоассоциированного антигена у млекопитающих. Изобретение позволяет с высокой эффективностью лечить рак предстательной железы у человека. 7 н. и 17 з.п. ф-лы, 43 ил., 33 табл., 20 пр.
Реферат
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка притязает на приоритет предварительной заявки США №61/642844, поданной 4 мая 2012, которая во всей полноте включена в данный документ путем ссылки.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Это заявка подается вместе с перечнем последовательностей в электронной форме. Перечень последовательностей предоставлен в виде файла в текстовом формате под названием «РС71854А SEQ LISTING_ST25.TXT», созданного 4 апреля 2013 года и имеющего размер 257Кб. Перечень последовательностей, содержащихся в текстовом формате, является частью заявки и включен в данное описание посредством ссылки во всей полноте.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к иммунотерапии и особенно к вакцинам и способам лечения и предотвращения неопластических нарушений.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Рак является ведущей причиной смертности во всем мире. Традиционные схемы лечения рака добились успеха в лечении селективной группы циркулирующих и солидных раков. Тем не менее, многие опухоли устойчивы к традиционным подходам. В последние годы была исследована иммунотерапия для лечения рака, которая включает генерацию активного системного опухолеспецифического иммунного ответа хозяина, возникающего вследствие введения вакцинной композиции в участок, удаленный от опухоли. Были предложены различные типы вакцин, в том числе те, которые содержат выделенные опухолевые антигены.
Рак предстательной железы является вторым, наиболее часто диагностируемым раком и четвертой по значимости причиной смерти вследствие рака у мужчин в развитых странах по всему миру. Различные ассоциированные с простатой антигены (РАА), такие как простатоспецифический антиген (PSA), простатоспецифический мембранный антиген (PSMA) и антиген стволовой клетки простаты (PSCA), как было показано, избыточно экспрессируются клетками рака простаты по сравнению с нормальными аналогами. Поэтому, эти антигены представляют собой возможные цели для индукции специфических иммунных ответов против раков, экспрессирующих антигены, посредством использования иммунотерапии, основанной на вакцинах, (смотри, например, Marrari, Α., M. lero, et al. (2007). "Vaccination therapy in prostate cancer." Cancer Immunol Immunother 56(4):429-45.)
PSCA является 123-аминокислотным мембранным белком. Аминокислотная последовательность непроцессированного человеческого PSCA состоит из аминокислот 4-123 SEQ ID №21. PSCA имеет высокую тканевую специфичность и экспрессируется более чем 85% образцами рака простаты при уровнях экспрессии, повышающихся с более высокими индексами Глиссона и андрогенной независимостью. Он экспрессируется в 80-100% костных метастазов у больных раком предстательной железы.
PSA является калликреиноподобной сериновой протеазой, которая продуцируется исключительно столбчатыми эпителиальными клетками, выстилающими ацинус и протоки предстательной железы. Матричная РНК PSA транслируется в виде 261-аминокислотного препроPSA предшественника. ПрепроРБА имеет 24 дополнительных остатков, которые составляют предварительную область (сигнальный полипептид) и прополипептид. Высвобождение прополипептида приводит к 237-аминокислоте, зрелой внеклеточной форме, которая является ферментативно активной. Аминокислотная последовательность человеческого непроцессированного PSA представлена в SEQ ID №15. PSA является органоспецифическим и, как результат, его продуцируют эпителиальные клетки доброкачественной гиперпластической (ВРН) ткани, ткани первичного рака простаты или ткани метастатического рака простаты.
PSMA, также известный как фолатгидролаза 1 (FOLH1), состоит из 750 аминокислот. Аминокислотная последовательность непроцессированного PSMA представлена в SEQ ID NO: 1. PSMA включает цитоплазматический домен (аминокислоты 1-19), трансмембранный домен (аминокислоты 20-43) и внеклеточный домен (аминокислоты 44-750). PSMA представляет собой тип II димерного трансмембранного белка, экспрессируемого на поверхности клеток рака простаты и на неоваскулатуре. Он также экспрессируется на нормальных клетках простаты, головного мозга, слюнной железы и панкреатическое дерево. Однако, было обнаружено, что в клетках рака простаты он экспрессируется при в 1000 раз высших уровнях, чем в нормальных тканях. Он с избытком экспрессируется на неоваскулатуре других разных солидных опухолей, таких как опухоли толстой кишки, молочной железы, печени, мочевого пузыря, поджелудочной железы, легких, почек, а также меланомы и саркомы. Таким образом, PSMA считается мишенью не только специфической для клеток рака простаты, но также панкарциномной мишенью для других видов рака. Экспрессирование PSMA является универсальной характеристикой карциномы простаты и его повышенная экспрессия коррелирует с агрессивностью опухоли. Экспрессия PSMA является повышенной при опухолях высокой степени злокачественности, метастатических поражениях и андрогенонезависимом заболевании.
Несмотря на то, что было выявлено большое количество опухолевых антигенов и многие из этих антигенов были изучены в качестве вакцин на основе белков или на основе ДНК для лечения или профилактики рака, большинство клинических испытаний до сих пор не привели к терапевтическому продукту. Одна из проблем при разработке вакцин рака состоит в том, что раковые антигены, как правило, получаются сами по себе и, следовательно, являются слабо иммуногенными, потому что иммунная система является саморегулируемой и не распознает собственные белки. Соответственно, существует потребность в способе повышения иммуногенности или терапевтического эффекта противораковых вакцин.
Для повышения иммуногенности или повышения противоопухолевой эффективности вакцин рака были исследованы многочисленные подходы. Один из таких подходов включает использование различных иммунных модуляторов, таких как агонисты TLR, агонисты TNFR, ингибиторы CTLA-4 и ингибиторы протеинкиназы.
Toll-подобные рецепторы (TLR) относятся к типу 1 мембранных рецепторов, которые экспрессируются на кроветворных и некроветворных клетках. По меньшей мере, 11 представителей были определены в семействе TLR. Эти рецепторы характеризуются по их способности распознавать патоген-ассоциированные молекулярные паттерны (РАМР), экспрессируемые патогенными организмами. Было обнаружено, что инициирование TLR вызывает серьезные воспалительные реакции путем повышения продукции цитокинов, экспрессии рецепторов хемокинов (CCR2, CCR5 и CCR7) и костимулирующей молекулярной экспрессии. Как таковые, эти рецепторы во врожденных иммунных системах осуществляют контроль над полярностью последующего приобретенного иммунного ответа. Среди TLR TLR9 широко исследуется по поводу его функций в иммунных реакциях. Стимуляция рецепторов TLR9 направляет антиген-представляющие клетки (АРС) в направлении примирующих высокоактивных ТН1-доминирующих Т-клеточных реакций, за счет увеличения продуцирования провоспалительных цитокинов и представления костимулирующих молекул к Т-клеткам. Было обнаружено, что олигонуклеотиды CpG, лиганды для TLR9, представляют класс сильнодействующих иммуностимулирующих факторов. CpG-терапия была испытана против широкого спектра моделей опухолей у мышей, и, как было показано, сообразно способствует ингибированию или регрессии опухоли.
Цитотоксический Т-лимфоцитарный антиген 4 (CTLA-4) является членом суперсемейства иммуноглобулинов и экспрессируется на поверхности Т-хелперов. CTLA-4 является негативным регулятором активации CD28, зависящим от активации Т-клеток, и действует в качестве контрольной точки для ингибирующего адаптивного иммунного ответа. Как и у костимулирующего белка CD28 Т-клеток, CTLA-4 связывается с CD80 и CD86 на антиген-представляющих клетках. CTLA-4 передает ингибирующий сигнал Т-клеток, в то время как CD28 передает стимулирующий сигнал. Человеческие антитела против человеческого CTLA-4 были описаны как иммуностимулирующие модуляторы в ряде болезненных состояний, таких как лечение или профилактика вирусной и бактериальной инфекции и для лечения рака (WO 01/14424 и WO 00/37504). Различные доклинические исследования показали, что блокада CTLA-4 моноклональными антителами усиливает иммунный ответ против иммуногенных опухолей и может даже отвергнуть раковые опухоли. Два полностью человеческие моноклональные антитела к человеческому CTLA-4 (mAb), ипилимумаб (MDX-010) и тремелимумаб (также известный как СР-675206), были исследованы в клинических испытаниях при лечении различных видов солидных опухолей.
Суперсемейство фактора некроза опухоли (TNF) представляет собой группу цитокинов, которые привлекают специфические родственные рецепторы клеточной поверхности, суперсемейство рецепторов TNF (TNFR) надсемейство. Члены суперсемейства факторов некроза опухоли действуют через лиганд-опосредованную тримеризацию, вызывая рекрутинг нескольких внутриклеточных адаптеров для активации нескольких путей сигнальной трансдукции, таких как апоптоз, путь NF-KB, путь JNK, а также иммунных и воспалительных реакций. Примеры суперсемейства TNF включают лиганды CD40, лиганды ОХ40, лиганды 4-1 ВВ, лиганды CD27, лиганд CD30 лиганд (CD153), лиганды TNF-альфа, TNF-бета, RANK, LT-альфа, LT-бета, GITR и LIGHT. Суперсемейство TNFR включает, например, CD40, ОХ40, 4-1 ВВ, CD70 (лиганд CD27), CD30, TNFR2, RANK, LT-бета R, HVEM, GITR, TROY и RELT. CD40 обнаруживается на поверхности В-лимфоцитов, дендритных клеток, фолликулярных дендритных клеток, гемопоэтических клеток-предшественников, эпителиальных клеток и карцином. CD40 связывается с лигандом (CD40-L), который представляет собой гликопротеин и экспрессируется на активированных Т-клетках, в основном CD4+, но и на некоторых CD8+, а также базофилах/тучных клетках. Из-за роли CD40 во врожденном и адаптивном иммунных ответах, агонисты CD40, включая различные агонистические антитела CD40, такие как полностью человеческое моноклональное антитело СР870893 к CD40, были изучены для использования в качестве адъювантов вакцин, а также в терапии.
Протеинкиназы представляют собой семейство ферментов, которые катализируют фосфорилирование специфических остатков в белках. Протеинкиназы являются ключевыми элементами в сигнальных путях, ответственных за трансдукцию внеклеточных сигналов, включая действие цитокинов на их рецепторы, к ядрам, вызывая различные биологические события. Многие роли протеинкиназ в нормальной физиологии клеток включают контроль клеточного цикла и рост клеток, дифференцировку, апоптоз клеток, подвижность и митогенез. Киназы, такие как C-Src, С-Аbl, митоген-активируемая протеинкиназа (MAP), фосфотидилинозитол-3-киназа (PI3K) АКТ и рецептор эпидермального фактора роста (EGF), как правило, активируются в раковых клетках, и, как известно, способствуют к туморогенезу. Логически, в настоящее время разрабатывается ряд ингибиторов киназ для противораковой терапии, в частности ингибиторы тирозинкиназы (TKI): циклин-зависимые ингибиторы киназы, ингибиторы киназы Аврора, ингибиторы контрольных точек клеточного цикла, рецептора эпидермального фактора роста (ингибиторы EGFR), FMS-подобные ингибиторы тирозинкиназы, рецептора тромбоцитарного фактор роста (PDGFR), ингибиторы киназы домена вставки, ингибиторы, ориентированные на путь PI3K/Akt/mTOR, ингибиторы, ориентированные на путь Ras-Raf-MEK-ERK (ERK), киназные ингибиторы рецептора фактора роста эндотелия сосудов (VEGFR), c-kit ингибиторы и киназные ингибиторы серина/треонина. Ряд ингибиторов киназы был исследован в клинических испытаниях по поводу использования в противораковых препаратах, которые включают, например, МК0457, VX-680, ZD6474, MLN8054, AZD2171, СНС-032, РТК787 / ZK222584, сорафениб (BAY43-9006), SU5416, SU6668 AMG706, зактима (ZD6474), МР-412, дазатиниб, КЭП-701, (лестауртиниб), XL647, XL999, тикерб (лапатиниб), MLN518 (ранее известный как СТ53518), РКС412, ST1571, AMN107, АЕЕ 788, OSI-930, OSI-817, сунитиниба малат (сутент; SU1 1248), ваталаниб (PTK787/ZK 222584), SNS-032, SNS-314 и акситиниб (AG-013736). Гефитиниб и эрлотиниб представляют собой перорально доступный EGFR-TKI.
Иммуномодуляторы, которые были изучены, как правило, вводят системно пациентам, например, путем перорального введения, внутривенных инъекций или вливаний, или внутримышечной инъекции. Одним из основных факторов, которые ограничивают эффективное применение некоторых иммунных модуляторов, является токсичность, вызванная высоким системным воздействием вводимых агентов. Например, относительно СО40-агонистов, сообщалось, что 0,3 мг/кг является максимально переносимой дозой для примера антитела к CD40 и что более высокие дозы могут вызывать побочные эффекты, включая тромбоэмболии, головные боли 3 степени, высвобождение цитокинов, вызывающее токсичные эффекты, такие как озноб и тому подобное, и переходящую токсичность печени. (Vanderheide et al., J Clin. Oncol. 25(7):876-8833 (March 2007)). В клиническом испытании для исследования комбинации внутривенного тремелимумаба (антитело к CTLA-4) с пероральным сунитинибом у пациентов с метастатической почечно-клеточной карциномой наблюдалось быстрое начало почечной недостаточности и, как следствие, не рекомендовалось дальнейшее исследование тремелимумаба в дозах более высоких, чем 6 мг/кг плюс сунитиниб в дозе 37,5 мг в день. Смотрите: Brian I. Rini et al.: Phase 1 Dose-Escalation Trial of Tremelimumab Plus Sunitinib in Patients With Metastatic Renal Cell Carcinoma. Cancer 117(4):758-767 (2011). Таким образом, существует потребность в иммунотерапевтических схемах на основе вакцин, где иммуномодуляторы вводят в эффективных дозах, которые не вызывают серьезных побочных эффектов, таких как токсичность печени или почечную недостаточность.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В некоторых аспектах настоящее изобретение предусматривает выделенные иммуногенные полипептиды PSMA и иммуногенные полипептиды PSA, которые являются полезными, например, для индукции иммунного ответа in vivo (например, у животных, включая человека) или in vitro, генерирования антител или для использования в качестве компонента в вакцинах для лечения рака, включая рак простаты. В одном аспекте, настоящее изобретение предусматривает выделенные иммуногенные полипептиды PSMA, которые имеют, по меньшей мере, 90% идентичность аминокислотам 15-11, 12, 13, 14, 15, 16, 17, 18, или 19 из консервативных Т-клеточных эпитопов человеческого PSMA в соответствующих положениях.
В других аспектах настоящее изобретение предусматривает молекулы нуклеиновых кислот, которые кодируют иммуногенные полипептды РАА. В некоторых вариантах осуществления настоящее изобретение предусматривает выделенные молекулы нуклеиновых кислот или их вырожденные варианты, которые содержат нуклеотидную последовательность, кодирующую иммуногенный полипептид PSMA или функциональный вариант указанного полипептида, предусмотренный данным описанием
В некоторых других аспектах настоящее изобретение предусматривает мультиантигенные конструкты нуклеиновых кислот, где каждый кодирует два или более иммуногенных полипептида РАА.
Описание также предусматривает векторы, содержащие одну или несколько молекул нуклеиновых кислот согласно изобретению. Векторы могут быть использованы для клонирования или экспрессии иммуногенных полипептидов РАА, кодируемых молекулами нуклеиновых кислот, или для доставки молекул нуклеиновых кислот в композиции, такой как вакцина, к клетке-хозяину или животному-хозяину, такому как человек.
В некоторых дополнительных аспектах настоящее изобретение предусматривает композиции, содержащие один или более иммуногенных полипептидов РАА, выделенные молекулы нуклеиновых кислот, кодирующие иммуногенные полипептиды РАА, или векторы, или плазмиды, содержащие молекулы нуклеиновых кислот, кодирующие иммуногенные полипептиды РАА. В некоторых вариантах осуществления композиция является иммуногенной композицией, полезной для индукции иммунного ответа против РАА в организме млекопитающего, такого как мышь, собака, обезьяна или человека. В некоторых вариантах осуществления композиция является вакцинной композицией, полезной для иммунизации млекопитающего, такого как человек, для ингибирования аномальной клеточной пролиферации, для обеспечения защиты против развития рака (используется в качестве профилактики) или для лечения нарушений (используется в качестве терапии), связанных с повышенной экспрессией РАА, таких как рак, особенно рак простаты.
В еще других аспектах настоящее изобретение предусматривает способы использования иммуногенных полипептидов РАА, выделенных молекул нуклеиновых кислот и композиций, содержащих иммуногенный полипептид РАА или выделенные молекулы нуклеиновых кислот, описанные в данном документе выше. В некоторых вариантах осуществления настоящее изобретение предусматривает способ индукции иммунного ответа против РАА в организме млекопитающего, в частности человека, включающий введение указанному млекопитающему эффективного количества полипептида, предусмотренного изобретением, который является иммуногенным по отношению к целевому РАА, эффективного количества выделенной молекулы нуклеиновой кислоты, кодирующей такой иммуногенный полипептид, или композиции, содержащей такой иммуногенный полипептид РАА. Вакцины полипептида или нуклеиновой кислоты могут быть использованы вместе с одним или несколькими адъювантами.
В еще других аспектах настоящее изобретение предусматривает схемы иммунотерапии на основе вакцины (или "VBIR"), которые включают совместное введение вакцины, доставляющей разные опухолеассоциированные антигены (ТАА) для индуцирования ТАА-специфических иммунных ответов для лечения разнообразных раков, в комбинации с, по меньшей мере, одним иммуноугнетающим клеточным ингибитором и, по меньшей мере, одним иммуноэффекторным клеточным энхансером. В частности, в некоторых аспектах изобретение предусматривает способ усиления иммуногенности или терапевтического эффекта вакцины для лечения опухолевого заболевания у млекопитающего, включающий введение млекопитающему, получающему вакцину, эффективного количества, по меньшей мере, одного иммунноугнетающего клеточного ингибитора и, по меньшей мере, одного иммунноэффекторного клеточного энхансера. В дополнительном аспекте изобретение предусматривает способ лечения опухолевого заболевания у млекопитающего, включающий введение млекопитающему вакцины, по меньшей мере, одного иммуноугнетающего клеточного ингибитора и, по меньшей мере, одного иммунноэффекторного клеточного энхансера.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1. Схематическая иллюстрация вектора PJV7563.
ФИГ. 2. Аминокислотное выравнивание пяти вирусных кассет 2А. Пропущенные глицин-пролиновые связи помечены звездочками.
ФИГ. 3. Последовательность предпочтительного EMCV IRES. Сайт инициации трансляции обозначен звездочкой. Минимальный элемент IRES исключает подчеркнутые первые 5 кодонов белка EMCV L.
ФИГ. 4. Точечные участки, показывающие экспрессию человеческого модифицированного антигена PSMA (аминокислоты 15-750) и непроцессированного человеческого PSCA на поверхности клеток НЕК293, трансфицированных двойными
ФИГ. 5. Изображение вестерн-блоттинга, показывающее экспрессию человеческого модифицированного антигена PSMA (аминокислоты 15-750) и непроцессированного человеческого PSCA в клетках НЕК293, трансфицированных двойными антигенными вакцинными конструктами, как измерено с помощью вестерн-блоттинга со специфическими моноклональными антителами к PSMA и PSCA.
ФИГ. 6. Изображение вестерн-блоттинга, показывающее экспрессию человеческого цитостатического антигена PSA (аминокислоты 25-261) в клетках НЕК293, трансфицированных двойными антигенными вакцинными конструктами, как измерено с помощью вестерн-блоттинга со специфическим моноклональным антителом к PSA. Дорожка 5300 демонстрирует относительно слабую полосу в приблизительно 2 кДа больше, чем PSA, в соответствии с С-концевым слиянием белка 2А.
ФИГУРЫ 7А, 7В. Точечная диаграмма, показывающая экспрессию человеческого модифицированного антигена PSMA (аминокислоты 15-750) и непроцессированного человеческого PSCA на поверхности клеток НЕК293, трансфицированных триплетноантигенным вакцинным конструктом, измеренную с помощью проточной цитометрии. (ФИГ. 7А. Одноантигенные контроли и однопромоторные трехантигенные конструкты. ФИГ. 7В. Двухпромоторные трехантигенные конструкты).
ФИГУРЫ 8А, 8В. Изображения вестерн-блоттинга, показывающие экспрессию человеческого PSA в клетках НЕК293, трансфицированных триплетноантигенными вакцинными конструктами, как измерено с помощью вестерн-блоттинга со специфическими моноклональными антителами PSA. Полосы на дорожках 5259 и 456 выходят за пределы дорожки 5297. Хотя это и не видно в сканированном геле, дорожки 456, 457 и 458 и выставили полосу в приблизительно 2 кДа больше, чем PSA, в соответствии с С-концевым слиянием пептида 2А. (ФИГ. 8А. Однопромоторные триплетноантигенные конструкты. ФИГ. 8В. Двухпромоторные трехантигенные конструкты)
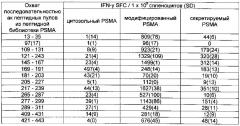
ФИГУРЫ 9A-9D. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность трехантигенных вакцин с помощью анализа IFN-γ ELISPOT.
ФИГУРЫ 10A-10D. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность трехантигенных вакцин с помощью анализа IFN-γ ELISPOT assay.
ФИГ. 11. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность трехантигенных вакцин с помощью титров антител к PSMA.
ФИГ. 12. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность трехантигенных вакцин с помощью титров антител к PSCA.
ФИГ. 13. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность трехантигенных вакцин с помощью поверхностноклеточного связывания антител к PSMA.
ФИГ. 14. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность трехантигенных вакцин с помощью поверхностноклеточного связывания антител к PSCA.
ФИГУРЫ 15А-15С. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность двухантигенных вакцин с помощью анализа IFN-γ ELISPOT.
ФИГУРЫ 16А-16С. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность двухантигенных вакцин с помощью анализа IFN-γ ELISPOT.
ФИГ. 17. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность двухантигенных вакцин с помощью титров антител к PSMA.
ФИГ. 18. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность двухантигенных вакцин с помощью титров антител к PSCA.
ФИГ. 19. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность двухантигенных вакцин с помощью поверхностноклеточного связывания антител к PSMA.
ФИГ. 20. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность двухантигенных вакцин с помощью поверхностноклеточного связывания антител к PSCA.
ФИГУРЫ 21А-21D. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность двухантигенных вакцин с помощью анализа IFN-γ ELISPOT.
ФИГ. 22. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность двухантигенных вакцин с помощью титров антител к PSMA.
ФИГ. 23. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность двухантигенных вакцин с помощью титров антител к PSCA.
ФИГ. 24. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность двухантигенных вакцин с помощью поверхностноклеточного связывания антител к PSMA.
ФИГ. 25. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность двухантигенных вакцин с помощью поверхностноклеточного связывания антител к PSCA.
ФИГ. 26. Графики, изображающие результаты репрезентативного исследования, которое оценивает Т-клеточный иммунный ответ, вызванный человеческим модифицированным антигеном PSMA (аа 15-750), по сравнению с непроцессированным PS MA (аа 1-750) у мышей C57BL/6.
ФИГУРЫ 27А, 27В. Графики, изображающие результаты репрезентативного исследования, которое оценивает Т-клеточный иммунный ответ, вызванный человеческим модифицированным антигеном PSMA (аа 15-750) по сравнению с непроцессированным антигеном PSMA (аа 1-750) у трансгенных мышей Пастера (HLA-А2/DR1) с помощью анализа IFN-Y ELISPOT.
ФИГ. 28. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность вакцин человеческого модифицированного и непроцессированного PSMA с помощью титров антител к PSMA.
ФИГ. 29. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуногенность вакцин человеческого модифицированного и непроцессированного PSMA с помощью поверхностноклеточного связывания антител к PSMA.
ФИГ. 30. Графики, изображающие результаты репрезентативного исследования, которое оценивает уровни моноклональных антител к CTLA-4 в крови, измеренные с помощью конкурентного ELISA у индийских макак-резус, инъецированных антителом к CTLA-4 (СР-675, 206) в дозе 10 мг/кг.
ФИГУРЫ 31А и 31В. Графики, изображающие результаты репрезентативного исследования, которое оценивает иммуномодулирующую активность моноклонального антитела к мышиному CTLA-4 (клон 9Н10) по количеству вакцины, вызывающей иммунные реакции, с помощью анализа окрашивания внутриклеточных цитокинов.
ФИГ. 32. Графики, изображающие результаты репрезентативного исследования, которое оценивает и сравнивает скорость роста подкожной опухоли при лечении малатом сунитиниба (Sutent) в качестве монотерапии или в комбинации с контролем (контроль) или вакциной против рака (rHER2).
ФИГУРЫ 33А-33D. Графики, показывающие индивидуальные темпы роста опухоли у мышей из репрезентативного исследования, оценивающего и сравнивающего противоопухолевую эффективность сунитиниба малата (Sutent) в дозе 20 мг/кг с контролем (контроль) или противораковой вакциной (rHER2).
ФИГ. 34. График, показывающий кривые выживаемости Каплана-Мейера групп мышей из исследования, описанного на Фигуре 33, которое оценивает противоопухолевую эффективность сунитиниба малата (Sutent) с контрольной (контроль) или противоопухолевой вакциной (rHER2), которых лечили малатом сунитиниба (Sutent) с контрольной (контроль) или противоопухолевой вакциной (рак).
ФИГУРЫ 35А, 35В. Графики, показывающие изменения в миелоидных супрессорных клетках (Gr1+CD11b+) и Treg-содержащих CD25+CD4+ клеток в периферической крови мышей, лечившихся как на Фигуре 33.
ФИГУРЫ 36А-36С. Графики, показывающие изменения общего количества миелоидных супрессорных клеток (Gr1+CD11b+), клеток Treg (CD4+CD25+Foxp3+) и PD-1+CD8 Т-клеток, выделенных из опухолей мышей.
ФИГ. 37. График, показывающий кривые выживаемости Каплана-Мейера групп мышей из исследования, которое оценивает противоопухолевую эффективность сунитиниба малата (Sutent), моноклонально антитела к мышиному CTLA-4 (клон 9D9), в комбинации с контрольной (контроль) или противораковой вакциной (вакцина) у мышей BALB/neuT, несущих подкожные опухоли TUBO.
ФИГ. 38. График, показывающий кинетику уровней сунитиниба в крови мышей BALB/neuT с подкожными опухолями TUBO.
ФИГ. 39. График, показывающий кривые выживаемости Каплана-Мейера групп мышей из исследования, которое оценивает противоопухолевую эффективность у мышей BALB/neuT с подкожными опухолями TUBO, лечившихся малатом сунитиниба (Sutent) и контрольной или противораковой вакциной.
ФИГ. 40. График, показывающий результаты репрезентативного исследования IFNy ELISPO, которое оценивает амплитуду антиген-специфических Т-клеточных реакций, вызванных вакциной rHER2 в группах мышей при введении с иммунными модуляторами.
ФИГУРЫ 41А, 41В. Графики, показывающие результаты репрезентативного исследования, которое оценивает иммуномодуляторную активность CpG7909 (PF-03512676) по качеству индуцированного вакциной иммунного ответа с помощью анализа внутриклеточного окрашивания от цитокинов.
ФИГУРЫ 42А, 42В. Графики, показывающие результаты репрезентативного исследования, которое оценивает иммуномодуляторную активность агонистического моноклонального антитела к мышиному CD40 по качеству индуцированного вакциной иммунного ответа с помощью анализа внутриклеточного окрашивания от цитокинов.
ФИГ. 43. График, показывающий кривые выживаемости Каплана-Мейера групп мышей из исследования, которое оценивает противоопухолевую эффективность низкой дозы малата сунитиниба (Sutent) и контрольной или противораковой вакцины у мышей BALB/neuT со спонтанными опухолями молочной железы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
А. ОПРЕДЕЛЕНИЯ
Термин "адъювант" относится к веществу, которое способно повысить, ускорить или продлить иммунный ответ при введении с вакцинным иммуногеном.
Термин "агонист" относится к веществу, которое способствует (индуцирует, вызывает, усиливает или повышает) активность другой молекулы или рецептора. Термин агонист охватывает вещества, которые связывают рецептор (например, антитело, гомолог природного лиганда из других видов), и вещества, которые способствуют рецепторной функции без вещества, которые способствуют функции рецептора без привязки к ней (например, путем активации связанного белка).
Термин "антагонист" или "ингибитор" относится к веществу, которое частично или полностью блокирует, ингибирует или нейтрализует биологическую активность другой молекулы или рецептора.
Термин "совместное введение" относится к введению двух или более средств одному и тому же субъекту в течение периода лечения. Два или более средств могут находиться в одной композиции и, следовательно, вводиться одновременно. Альтернативно, два или более средств могут находиться в разных физических композициях и вводиться раздельно, последовательно или одновременно субъекту. Термин "вводить одновременно" или "одновременное введение" означает, что введение первого средства и второго средства перекрываются по времени друг с другом, в то время как термин "вводить последовательно" или "последовательное введение" означает, что введение первого средства и второго средства не перекрываются по времени друг с другом.
Термин "консервативный Т-клеточный эпитоп" относится к одной из следующих аминокислотных последовательностей человеческого белка PSMA, в порядке, предусмотренном в SEQ ID NO. 1:
аминокислоты 168-176 (GMPEGDLVY),
аминокислоты 347-356 (HSTNGVTRIY),
аминокислоты 557-566 (ETYELVEKFY),
аминокислоты 207-215 (KVFRGNKVK),
аминокислоты 431-440 (STEWAEENSR),
аминокислоты 4-12 (LLHETDSAV),
аминокислоты 27-35 (VLAGGFFLL),
аминокислоты 168-177 (GMPEGDLVYV),
аминокислоты 441-450 (LLQERGVAYI),
аминокислоты 469-477 (LMYSLVHNL),
аминокислоты 711-719 (ALFDIESKV),
аминокислоты 663-671 (MNDQVMFL),
аминокислоты 178-186 (NYARTEDFF),
аминокислоты, 227-235 (LYSDPADYF),
аминокислоты 624-632 (TYSVSFDSL),
аминокислоты 334-348 (TGNFSTQKVKMHIHS),
аминокислоты 459-473 (NYTLRVDCTPLMYSL),
аминокислоты 687-701 (YRHVIYAPSSHNKYA), и
аминокислоты 730-744 (RQIYVAAFTVQAAAE).
Термин "цитозольный" означает, что после нуклеотидной последовательности, кодирующей конкретный полипептид, экспрессирующийся в клетке-хозяине, экспрессированный полипептид удерживается внутри клетки-хозяина.
Термин "вырожденный вариант" относится к последовательностям ДНК, которые имеют замещения оснований, но кодируют тот же самый полипептид.
Термин "эффективное количество" относится к количеству, введенному млекопитающему, которое является достаточным для того, чтобы вызвать требуемый эффект у млекопитающего.
Термин "фрагмент" данного полипептида относится к полипептиду, который короче, чем данный полипептид, и разделяет 100% идентичность с последовательностью данного полипептида.
Термин "идентичный" или процент "идентичности" в контексте двух или более последовательностей нуклеиновых кислот или полипептидов, относится к двум или более последовательностями или подпоследовательностям, которые одинаковы или имеют определенный процент аминокислотных остатков или нуклеотидов, которые одинаковы при сравнении и выровнены для максимального соответствия.
Термин "энхансер иммуноэффекторных клеток" или "IEC энхансер" относится к веществу, способному повышать или усиливать количество, качество или функцию одного или нескольких типов иммунных эффекторных клеток млекопитающего. Примеры иммунных эффекторных клеток включают цитолитические CD8 Т-клетки, CD40 Т-лимфоциты, NK-клетки и В-клетки.
Термин "иммунный модулятор" относится к веществу, способному изменять (например, ингибировать, снижать, повышать, усиливать или стимулировать) работу любого компонента врожденной, гуморальной или клеточный иммунной системы млекопитающих. Таким образом, термин "иммуномодулятор" охватывает "энхансер иммуноэффекторных клеток", как определено в данном документе, и "ингибитор иммуносупрессорных клеток", как определено в данном документе, а также вещество, которое влияет на другие компоненты иммунной системы млекопитающего.
Термин "иммунный ответ" относится к любому обнаруживаемому ответу на конкретное вещество (например, антиген или иммуноген) с помощью иммунной системы хозяина - позвоночного животного, включая врожденные иммунные реакции (например, активацию сигнального каскада Toll-рецептора), клеточноопосредованные иммунные реакции (например, реакции, опосредованные Т-клетками, такими как антигенспецифические Т-клетки, и неспецифическими клетками иммунной системы) и гуморальные иммунные реакции (например, реакции, опосредованные В-клетками, такие как продуцирование и секреция антител в плазме, лимфе и/или тканевых жидкостях), но не ограничиваются ими. Примеры иммунных реакций включают изменение (например, повышение) активации Toll-подобного рецептора, экспрессии или секреции лимфокина (например, цитокина (например, Th1, Th2 или Th17 типов цитокинов) или хемокина), активации макрофагов, активации дендритных клеток, активации Т-клеток (например, CD4+ или CD8+ Т-клеток), активации NK-клеток, активации В-клеток (например, продуцирование или секрецию антител), связывания иммуногена (например, антиген (например, иммуногенного полипептида)) с молекулой МНС, индуцирование реакции цитотоксического Т-лимфоцита ("CTL"), индуцирование реакции В-клеток (например, продуцирование антител), и, распространение (например, рост популяции клеток) клеток иммунной системы (например, Т-клеток или В-клеток), и повышенного процессинга и представления антиген представляющими клетками. Термин "иммунная реакция" также охватывает любой обнаруживаемый ответ на конкретное вещество (такое как антиген или иммуноген) одного или более компонентов иммунной системы позвоночного животного in vitro.
Термин "иммуногенность" относится к способности вещества порождать, вызывать, стимулировать или индуцировать иммунный ответ, либо улучшать, повышать, увеличивать или продлевать уже существующий иммунный ответ на конкретный антиген, самого по себе или когда связано с носителем, в присутствии или в отсутствие адъюванта.
Термин "иммуногенный полипептид PSA" относится к полипептиду, который является иммуногенным против человеческого белка PSA, или против клеток, экспрессирующих человеческий белок PSA.
Термин "иммуногенный полипептид PSCA" относится к полипептиду, который является иммуногенным против человеческого белка PSCA, или против клеток, экспрессирующих человеческий белок PSCA.
Термин "иммуногенный полипептид PSMA" относится к полипептиду, который является иммуногенным против человеческого белка PSMA, или против клеток, экспрессирующих человеческий белок PSMA. Термин "иммуногенный полипептид РАА" относится к "иммуногенному полипептиду PSA", "иммуногенному полипептиду PSCA" или "иммуногенному полипептиду PSMA", как определено в данном документе выше.
Термин "молекула нуклеиновой кислоты иммуногенного PSA" относится к молекуле нуклеиновой кислоты, которая кодирует иммуногенный полипептид PSA, как определено в данном документе.
Термин "молекула нуклеиновой кислоты иммуногенного PSCA" относится к молекуле нуклеиновой кислоты, которая кодирует "иммуногенный полипептид PSCA", как определено в данном документе.
Термин "молекула нуклеиновой кислоты иммуногенного PSMA" относится к молекуле нуклеиновой кислоты, которая кодирует "иммуногенный полипептид PSMA", как определено в данном документе.
Термин "молекула нуклеиновой кислоты иммуногенного РАА" относится к молекуле нуклеиновой кислоты, которая кодирует "иммуногенный полипептид PSA", "иммуногенный полипептид PSCA" или "иммуногенный полипептид PSMA", как определено в данном документе выше.
Термин "ингибитор иммуносупрессивных клеток" или "ингибитор ISC" относится к веществу, способному снижать или по