Вакцинные составы против вируса папилломы человека (hpv), содержащие алюминиевый адъювант, и способы их получения
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к иммунологии, и может быть использована для получения вакцины против вируса папилломы человека. Вакцинный состав против вируса папилломы человека включает: a) терапевтически эффективное количество вирусоподобных частиц (VLP) HPV, адсорбированных на алюминиевом адъюванте; b) маннит и сахарозу, c) необязательно соль. Причем состав включает: 1) вирусоподобные частицы HPV по меньшей мере одного типа, адсорбированные на алюминиевом адъюванте, которые присутствуют в концентрации, равной 10-200 мкг/мл, при этом вирусоподобные частицы выбирают из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82; и 2) от приблизительно 1% до приблизительно 10% масс./об. маннита; и 3) от приблизительно 0,5% до приблизительно 10% сахарозы. Состав является замороженным или лиофилизированным и состав является стабильным при хранении в течение 1 месяца при 25°С после стресса, вызванного процессом лиофилизации или замораживания-оттаивания. Группа изобретений относится также к способам получения вышеуказанной вакцины. Использование данных изобретений позволяет получить твердый препарат вакцины HPV (замороженный или лиофилизированный), содержащий комбинацию эксципиентов маннита и сахарозы, обеспечивающих сохранение антигенности лиофилизированного вакцинного препарата. 3 н. и 18 з.п. ф-лы, 9 пр., 3 табл., 15 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к составам на основе антигена вируса папилломы человека (HPV), характеризующимся повышенной стабильностью антигена после замораживания и/или лиофилизации. В частности, настоящее изобретение относится к стабильным вакцинным составам против HPV, содержащим вирусоподобные частицы (VLP) HPV, связанные с адъювантом на основе соли алюминия, и к способам получения указанных составов.
Перекрестная ссылка на родственные заявки
По этой заявке испрашивается приоритет временной заявки на патент США №61/500829, поданной 24 июня 2011 г., которая полностью включена в качестве ссылки в настоящее описание.
Уровень техники
Было проведено всестороннее исследование возможности совместного введения вакцин с соединениями, способными усиливать иммунную реакцию против представляющего интерес антигена, известными как адъюванты. Помимо усиления иммунного ответа на представляющий интерес антиген, некоторые адъюванты могут быть использованы для уменьшения количества антигена, требуемого для провокации желаемого иммунного ответа или для уменьшения числа инъекций, необходимых в клинической схеме введения антигена для индукции длительного иммунного ответа, и для защиты от возникновения заболевания.
Более 60 лет назад было установлено, что соединения алюминия обладают адъювантной активностью (см. публикации Lindblad, E.B., Immunol. and Cell Biol. 82: 497-505 (2004); Baylor et al., Vaccine 20: S18-S23 (2002)). Алюминиевые адъюванты обычно считаются безопасными при использовании в соответствующих дозах. Благодаря низкой стоимости и длительному применению в лечении людей адъюванты на основе солей алюминия являются наиболее предпочтительными адъювантами, используемыми в вакцинах, предназначенных для людей.
Вакцины, содержащие адъюванты на основе солей алюминия, обычно получают в виде жидкостей, которые чрезвычайно чувствительны к таким изменениям температуры как нагревание и замораживание. Замораживание вакцин, содержащих соли алюминия, вызывает необратимое повреждение физической структуры соли алюминия, в результате чего происходит агломерация частиц адъюванта. Вследствие этого снижается активность адъюванта, и в конечном счете утрачивается иммуногенность вакцины. По указанной причине такие вакцинные составы необходимо хранить в узком температурном диапазоне, предпочтительно от 2°С до 8°С, что требует надежного охлаждения во время транспортировки и хранения вакцины. Постоянное охлаждение не всегда является экономически возможным, особенно в развивающихся странах. Кроме того, случайное замораживание вакцин, содержащих адъюванты на основе солей алюминия, является общей проблемой как в развивающихся странах, так и в развитых странах (Clapp et al., J. Pharm. Sci. 100(2): 388-401 (2011); Matthias et al., Vaccine 25(20): 3980-86 (2007)). Транспортировка замороженной вакцины невозможна из-за непомерно высоких затрат. Проблема также состоит в том, что субъекту по неосторожности может быть введена ранее замороженная вакцина, обладающая более низкой иммуногенностью, что приведет к более низкой эффективности вакцинации.
Было предложено несколько методов решения проблем, связанных с сохранением необходимой температуры для вакцин, содержащих соль алюминия. Одним возможным решением является предотвращение замораживания путем добавления в состав таких компонентов как пропиленгликоль, полиэтиленгликоль или глицерин (Braun, L.J. et al., Vaccine 27: 4609-4614 (2009); Braun et al., Vaccine 27: 72-79 (2009)). В публикации Braun et al., см. выше, было показано, что пропиленгликоль может предотвращать вызываемую замораживанием агломерацию адъюванта в определенных вакцинах, даже в концентрациях, которые являются слишком низкими для предотвращения замораживания.
Использование лиофилизированных составов вместо жидких вакцинных составов позволяет решить некоторые вопросы, связанные с транспортировкой и хранением вакцины; однако процесс лиофилизации также связан с агрегацией частиц адъюванта и утратой иммуногенности (Маа et al., J. Pharm. Sci. 92(2): 319-332 (2003)). В публикациях Clausi et al. (J. Pharm. Sci. 97: 2049-61 (2008) и Randolph et al. (WO 2008/118691) показано, что агрегацию алюминиевого адъюванта во время замораживания и лиофилизации можно устранить, добавляя в состав трегалозу в больших концентрациях (например, 15%). В публикации Wolff et al. (Colloids & Surfaces A: Physiochem Eng. Aspects 330: 116-126 (2008)) также предложено использовать трегалозу в больших концентрациях для защиты вакин, содержащих алюминий, от холодового стресса. Кроме того, в публикации Wolff et al. предложено использовать PVP К 25, HES 450 и 200, сахарозу и сорбит в качестве компонентов состава для предотвращения агрегации алюминиевого адъюванта. Мизуно и др. (Mizuno et al., европейский патент №0130619 B1) предлагают использовать по меньшей мере одну аминокислоту или ее соль в комбинации по меньшей мере с одним сахаридом или по меньшей мере с одним коллоидным веществом.
Было бы желательно создать жидкие вакцинные составы, в которых антиген, используемый для приготовления вакцины, адсорбирован на алюминиевом адъюванте, и которые способны сохранять свои физические и иммунологические свойства при замораживании или лиофилизации.
Сущность изобретения
Настоящее изобретение относится к составам на основе антигена вируса папилломы человека (HPV), которые характеризуются более высокой стабильностью антигена. В частности, настоящее изобретение относится к стабильным вакцинным составам против HPV, содержащим вирусоподобные частицы (VLP) HPV по меньшей мере одного типа, которые адсорбированы на адъюванте на основе соли алюминия и далее включают комбинацию сахарозы и маннита и необязательно соль. Вакцинные составы по настоящему изобретению являются стабильными после замораживания-оттаивания и лиофилизации. Кроме того, настоящее изобретение относится к лиофилизированным и замороженным вакцинным составам против HPV, содержащим вирусоподобные частицы HPV по меньшей мере одного типа, адсорбированные на адъюванте на основе соли алюминия, сахарозу и маннит.
Настоящее изобретение также относится к вышеописанным составам против HPV, которые включают: (а) вирусоподобные частицы HPV по меньшей мере одного типа, адсорбированные на алюминиевом адъюванте, где вирусоподобные частицы HPV каждого типа присутствуют в концентрации 10-200 мкг/мл, при этом вирусоподобные частицы выбирают из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82; и (b) от примерно 1% до примерно 10% масс./об. маннита и от примерно 0,5% до примерно 10% сахарозы. Составы по настоящему изобретению могут также содержать дополнительные компоненты, которые включают, но не ограничиваясь ими, соль, гистридин и поверхностно-активное вещество. Настоящее изобретение также относится к замороженным или лиофилизированным вакцинным составам против HPV, рассмотренным в настоящем описании.
Настоящее изобретение также относится к способам получения стабильных вакцинных составов. В этой связи настоящее изобретение относится к способу получения стабильного замороженного вакцинного состава против HPV, который включает: (а) получение жидкого вакцинного состава против HPV, содержащего (i) вирусоподобные частицы HPV по меньшей мере одного типа, адсорбированные на адъюванте на основе соли алюминия, которые присутствуют в концентрации 10-200 мкг/мл, при этом вирусоподобные частицы выбирают из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82; (ii) от примерно 1% до примерно 10% масс./об. маннита и (iii) от примерно 0,5% до примерно 10% сахарозы; и (b) замораживание жидкого состава с получением замороженного вакцинного состава. Дополнительные варианты осуществления способов по настоящему изобретению относятся к сушке замороженного состава, в результате чего получают лиофилизированный состав.
В настоящем описании и прилагаемой формуле изобретения формы единственного числа включают формы множественного числа за исключением тех случаев, когда из контекста следует обратное.
В настоящем описании изобретения и прилагаемой формуле изобретения использованы следующие термины и аббревиатуры:
Термин "SWFI" означает стерильную воду для инъекций.
Термин "BWFI" означает бактериостатическую воду для инъекций, которая является стерильной водой, содержащей антимикробное средство.
Термин "API" означает активный фармацевтический ингредиент, например, вирусоподобные частицы HPV, который является биологически активным (то есть способным вызывать соответствующую иммунную реакцию) компонентом составов по настоящему изобретению и оказывает терапевтическое или профилактическое воздействие на человека или животное, нуждающееся в таком воздействии. В использованном здесь значении API является активными ингредиентом вакцины.
"Состав" относится к композиции, содержащей активный фармацевтический или биологический ингредиент наряду с одним или несколькими дополнительными компонентами. Термин "состав" имеет взаимозаменяемые значения с терминами "фармацевтическая композиция", "вакцинная композиция" и "вакцинный состав". Составы могут быть жидкими или твердыми (например, лиофилизированными). Дополнительные компоненты включают фармацевтически приемлемые наполнители, добавки, разбавители, буферы, сахара, аминокислоты (такие как глицин, глутамин, аспарагин, аргинин или лизин), хелатообразователи, поверхностно-активные вещества, полиолы, вещества, увеличивающие объем, стабилизаторы, вещества, защищающие от лиофилизации, солюбилизаторы, эмульгаторы, соли, адъюванты, вещества, повышающие тоничность (такие как галогениды щелочных металлов, предпочтительно хлорид натрия или калия, маннит, сорбит), носители и антимикробные средства.
Приемлемые компоненты для фармацевтических составов не должны быть токсичными для реципиентов в используемых дозах и концентрациях. "Состав" обычно содержит одну дозу API, которая может быть введена одному нуждающемуся в этом человеку или животному. Термин "состав для многократного введения" означает состав, содержащий несколько доз API, которые могут быть введены субъекту несколько раз. Состав для многократного введения обычно включает антимикробное средство. Термин "состав" имеет взаимозаменяемые значения с терминами "композиция", "биологическая композиция" и "фармацевтическая композиция".
Термин "лепешка" означает сухой осадок, образующийся в результате лиофилизации или сушки вымораживанием жидкого состава. Образование лепешки является показателем влияния процесса лиофилизации на свойства лиофилизированного состава. В использованном здесь значении "сухая лепешка" означает лепешку, содержащую примерно 20% или меньше остаточной влаги. В некоторых вариантах осуществления изобретения влажность сухой лепешки равна 15% или меньше, 10% или меньше или 5% или меньше. В альтернативных вариантах осуществления изобретения влажность сухой лепешки находится в пределах от примерно 0,1% до примерно 10%, от примерно 0,1% до примерно 6%, от примерно 0,5% до примерно 10% или от 0,5% до примерно 6%.
Термин "время восстановления" означает время, необходимое для повторной гидратации сухого, лиофилизированного состава (лепешки), в результате чего восстановленный жидкий состав становится прозрачным и лепешка растворяется.
Термин "терапевтически эффективное количество" означает количество активного ингредиента (то есть терапевтического белка или антитела), достаточное для достижения требуемого терапевтического эффекта у человека или животного, например, количество, необходимое для лечения, выздоровления, предотвращения или ингибирования развития и прогрессирования заболевания или его симптомов, и/или количество, необходимое для ослабления симптомов или регрессии заболевания. Такое терапевтически эффективное количество может изменяться в зависимости от структуры и эффективности активного ингредиента и способа введения. Специалист в данной области может легко определить терапевтически эффективное количество данного антитела или белка.
Термин "лечение" означает как терапевтическое лечение, так и профилактические или превентивные меры. Пациентами, нуждающимися в лечении, являются люди и животные, имеющие нарушение или состояние, подлежащее лечению, а также пациенты, предрасположенные к возникновению нарушения, и пациенты, у которых необходимо предотвратить возникновение нарушения. В использованном здесь значении термин "лечение" также означает снижение вероятности появления нарушения, уменьшение тяжести нарушения, возникшего у пациента, и регрессию нарушения или его симптомов.
Термин "фармацевтически приемлемый носитель" означает жидкий наполнитель, разбавитель или инкансулирующее вещество, которое может быть безопасно использовано при системном введении. В зависимости от конкретного способа введения могут быть использованы разные фармацевтически приемлемые носители, хорошо известные в данной области. Указанные носители могут быть выбраны из группы, включающей сахара, крахмалы, целлюлозу и ее производные, солод, желатин, тальк, сульфат кальция, растительные масла, синтетические масла, полиолы, аргининовую кислоту, растворы с фосфатным буфером, в том числе физиологический раствор с фосфатным буфером, эмульгаторы, изотонический раствор и апирогенную воду. В частности, фармацевтически приемлемые носители могут содержать разные компоненты, такие как буфер, стерильная вода для инъекций, нормальный физиологический раствор или физиологический раствор с фосфатным буфером, сахароза, гистидин, соли и полисорбат. Такие термины как "физиологически приемлемый", "разбавитель" или "наполнитель" имеют взаимозаменяемые значения.
В настоящем описании использованы следующие дополнительные аббревиатуры: FAP=замороженный водный продукт; form. = состав; F/T = замораживание-оттаивание; 1х нормальное F/T = однократное нормальное замораживание-оттаивание, описанное в примере 1; 3х нормальное F/T = трехкратное нормальное замораживание-оттаивание, описанное в примере 1; 1х быстрое F/T = однократное быстрое замораживание-оттаивание, описанное в примере 1 (также определяемое в настоящем описании как F/T FF 1×); His = гистидин; HPV=вирус папилломы человека; ч = часы; lyo = лиофилизация или лиофилизированный в зависимости от контекста; мин = минуты; мМ = миллимолярный; PS20 = полисорбат 20; PS80 = полисорбат 80; recon. = восстановление; сек = секунды; DLS = динамическое рассеяние света; NaCl = хлорид натрия; об. = объем; VLP = вирусоподобная частица; WF = вода для инъекций; масс./об. = отношение массы к объему.
Краткое описание чертежей
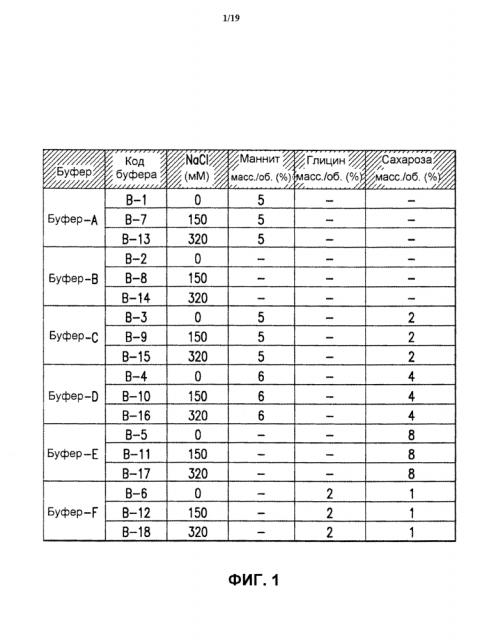
На фиг.1 показаны составы буферов, использованных в исследованиях по замораживанию-оттаиванию и лиофилизации, представленных в настоящем описании изобретения. Было использовано 6 буферов (буфер А - буфер F) и 3 варианта каждого буфера, включающих разные количества соли (0, 150 и 320 мМ хлорида натрия), в результате чего было получено 18 буферов разного состава (В-1 - В-18). Помимо указанных наполнителей, все буферы содержали 10 мМ гистидина и 0,01% полисорбата 80, рН 6,2.
На фиг.2 представлены графики данных антигенности in vitro 4-валентных экспериментальных составов в отношении HPV каждого типа в зависимости от концентрации хлорида натрия и условий замораживания-оттаивания при использовании разных испытуемых буферов (буфер А - буфер F). См. пример 2. Графики представлены для HPV типа 6 (блок А), HPV типа 11 (блок В), HPV типа 16 (блок С) и HPV типа 18 (блок D). Вакцинные составы против HPV подвергали либо однократному быстрому замораживанию в потоке жидкого азота ("F/T FF 1×"), либо нормальному замораживанию, осуществляемому один раз ("F/T 1×") или три раза ("F/T 3×"), как описано в примере 1.
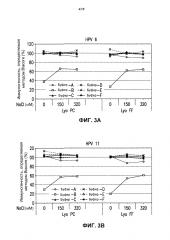
На фиг.3 представлены графики данных антигенности in vitro 4-валентных экспериментальных составов в отношении HPV каждого типа в зависимости от концентрации хлорида натрия после лиофилизации. См. пример 2. Результаты показаны для HPV типа 6 (блок А), HPV типа 11 (блок В), HPV типа 16 (блок С) и HPV типа 18 (блок D) при использовании 4-валентных составов против HPV, включающих буфер А - буфер F. Каждую из композиций лиофилизировали либо методом быстрого замораживания ("Lyo FF") в потоке жидкого азота, либо методом лиофилизации с предварительным охлаждением ("Lyo PC"), как описано в примере 1.
На фиг.4 представлены графики антигенности in vitro в отношении HPV каждого типа в зависимости от концентрации хлорида натрия и условий лиофилизации при использовании разных композиций буферов после хранения в течение 1 месяца при 45°С. На фиг.4 также показаны соответствующие нелиофилизированные жидкие составы, которые хранили в течение 1 месяца при 45°С. Данные представлены для тех же экспериментальных составов, которые испытывали в условиях, аналогичных показанных на фиг.2, после хранения в течение 1 месяца при 45°С.
На фиг.5 представлен график измерений осмолярности (мОсм/кг) для 4-валентных экспериментальных составов против HPV в разных буферах (буфер А-буфер F), содержащих 0, 150 или 320 мМ хлорида натрия. См. пример 3.
На фиг.6 представлены графики измерений размера частиц (Z-среднее, нм) для всех 4-валентных экспериментальных составов против HPV в разных буферах в зависимости от концентрации хлорида натрия после замораживания-оттаивания и лиофилизации. На всех графиках представлены результаты для буфера А (белый ромб), буфера В (белый квадрат), буфера С (черный треугольник), буфера D (черный крест), буфера Е (белый треугольник) и буфера F (черный кружок). На фиг.6 также показаны результаты для экспериментальных составов после однократного замораживания-оттаивания ("F/T 1×"), трехкратного замораживания-оттаивания ("F/T 3×"), быстрого замораживания ("F/T 1×FF"), лиофилизации методом быстрого замораживания ("Lyo FF") и лиофилизации с предварительным охлаждением ("Lyo PC"), Также представлены результаты для контрольных составов, которые не подвергали замораживанию-оттаиванию или лиофилизации. См. пример 4.
На фиг.7 показан внешний вид лепешки лиофилизированных 4-валентных составов против HPV в разных буферах (буфер А-буфер F), включающих 0, 150 или 320 мМ хлорида натрия. Составы лиофилизировали методом быстрого замораживания ("быстрое замораживание") или методом лиофилизации с предварительным охлаждением ("предварительное охлаждение"). Приведенные результаты представляют собой среднее значение для 3 образцов каждого экспериментального состава в период времени Т=0. На фиг.7 также показан внешний вид лепешки тех же составов после хранения в течение 1 месяца при 45°С. См. пример 1, таблица 2, для ознакомления с описанием показателей качества высушенных лепешек. См. пример 5.
На фиг.8 показано время восстановления лиофилизированных 4-валентных составов против HPV в разных буферах (буфер А-буфер F), включающих 0, 150 или 320 мМ хлорида натрия, после добавления стерильной воды для инъекций. Составы лиофилизировали методом быстрого замораживания ("быстрое замораживание") или методом лиофилизации с предварительным охлаждением ("предварительное охлаждение"). Результаты представлены для 2 образцов каждого экспериментального состава. Также показано время восстановления тех же составов после добавления стерильной воды для инъекций после хранения в течение 1 месяца при 45°С. См. пример 5.
На фиг.9 показано время испытания встряхиванием лиофилизированных 4-валентных составов против HPV в разных буферах (буфер А-буфер F), содержащих 0, 150 или 320 мМ хлорида натрия, после добавления стерильной воды для инъекций. Составы лиофилизировали методом быстрого замораживания ("быстрое замораживание") или лиофилизировали методом лиофилизации с предварительным охлаждением ("предварительное охлаждение"), Результаты представлены для 3 образцов каждого экспериментального состава. См. пример 5.
На фиг.10 представлены данные антигенности in vitro 4-валентных экспериментальных составов (буфер В-буфер D) в отношении HPV типов 16 (блок А) и 18 (блок В) после хранения в течение разных периодов времени при -70°С. Экспериментальные составы хранили после замораживания-оттаивания (F/T) или лиофилизации (LYO) в соответствии с описанием, приведенным в примере 1. На фиг.10 показана иммуногенность вакцины (%), измеренная методом Biacore, в зависимости от времени хранения. См. примеры 1 и 6.
На фиг.11 представлены данные антигенности in vitro 4-валентных экспериментальных составов (буфер В-буфер D) в отношении HPV типов 16 (блок А) и 18 (блок В) после хранения в течение разных периодов времени при 25°С. Экспериментальные составы хранили после замораживания-оттаивания или лиофилизации. См. пример 6.
На фиг.12 представлены данные антигенности in vitro 4-валентных экспериментальных составов (буфер В-буфер D) в
отношении HPV всех типов после хранения при 37°С в течение разных периодов времени. Экспериментальные составы хранили после замораживания-оттаивания или лиофилизации. См. пример 6. Графики представлены для HPV типа 6 (блок А), HPV типа 11 (блок В), HPV типа 16 (блок С) и HPV типа 18 (блок D).
На фиг.13 показан внешний вид лепешки лиофилизированных 4-валентных составов против HPV (буфер В-буфер D) после хранения в течение нескольких месяцев при разных температурах. Приведенные результаты представляют собой среднее значение для 3 образцов каждого экспериментального состава. См. пример 1, таблицу 2, для ознакомления с описанием показателей качества высушенных лепешек. См. пример 10. Данные относятся к хранению при 2-8°С (блок А), 25°С (блок В), 37°С (блок С) и -70°С (блок D).
На фиг.14 показан внешний вид лепешки лиофилизированных составов, содержащих 1-кратный алюминиевый адъювант Merck (МАА), (буфер В-буфер D) после хранения в течение нескольких месяцев при разных температурах. Приведенные результаты представляют собой среднее значение для 3 образцов каждого экспериментального состава. См. пример 1, таблицу 2, для ознакомления с описанием показателей качества высушенных лепешек. См. пример 10. Данные приведены для хранения при 2-8°С (блок А), 25°С (блок В), 37°С (блок С) и -70°С (блок D).
На фиг.15 показано время испытания встряхиванием лиофилизированных 4-валентных составов против HPV (буфер В буфер D) после хранения в течение нескольких месяцев при разных температурах. Результаты приведены для 3 образцов каждого экспериментального состава. См. пример 10. Данные приведены для хранения при 2-8°С (блок А), 25°С (блок В), 37°С (блок С) и -70°С (блок D).
Подробное описание изобретения
Вакцинные составы обычно содержат алюминиевые адъюванты, используемые для усиления иммунной реакции на антиген. Вакцины, содержащие алюминиевый адъювант, являются чрезвычайно чувствительными к изменениям температуры, таким как нагревание или замораживание. Необходимы методы получения термостойких вакцинных составов, содержащих адъювант на основе соли алюминия и являющихся иммунологически активными, которые позволяют избежать снижения иммуногенности и/или эффективности. Настоящее изобретение относится к стабильным жидким или твердым замороженным и лиофилизированным вакцинным составам, которые содержат по меньшей мере один антиген, адсорбированный на адъюванте на основе соли алюминия, и комбинацию маннита и сахарозы. В соответствии с предпочтительными аспектами изобретения антиген является вирусоподобной частицей (VLP) вируса папилломы человека (HPV).
Как было указано выше, настоящее изобретение относится к вакцинному составу против вируса папилломы человека, который включает (а) вирусоподобные частицы (VLP) HPV по меньшей мере одного типа, адсорбированные на алюминиевом адъюванте; и (b) буфер, содержащий маннит и сахарозу. Вакцинные составы необязательно содержат неионогенное поверхностно-активное вещество и/или соль, такую как NaCl.
Жидкие вакцинные составы против HPV по настоящему изобретению способны сохранять физические и иммунологические свойства при (1) замораживании и оттаивании; (2) лиофилизации жидкого состава; (3) восстановлении высушенного состава и (4) восстановлении высушенного состава после хранения в течение одного месяца или более при комнатной или более высокой температуре. Таким образом, настоящее изобретение относится к вакцинному составу против HPV, описанному в разных вариантах осуществления изобретения, который является замороженным, лиофилизированным или восстановленным.
В предпочтительных вариантах осуществления данного аспекта изобретения вакцинный состав против HPV включает (а) вирусоподобные частицы (VLP) HPV по меньшей мере одного типа, адсорбированные на алюминиевом адъюванте, которые присутствуют в концентрации 10-200 мкг/мл, при этом VLP выбирают из группы, состоящей из HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82; (b) от примерно 1% до примерно 10% масс./об. маннита и (с) от примерно 0,5% до примерно 10% сахарозы. В дополнительных вариантах осуществления изобретения вакцинный состав против HPV далее включает неионогенное поверхностно-активное вещество. В другом варианте осуществления изобретения вакцинный состав включает компоненты, указанные в любом предшествующем варианте осуществления изобретения, а также соль.
Дополнительные варианты осуществления изобретения относятся к вышеуказанному составу против HPV, в котором маннит присутствует в количестве от примерно 4% до примерно 10%, и сахароза присутствует в количестве от примерно 1% до примерно 5%.
Другие варианты осуществления данного аспекта изобретения относятся к составу, включающему компоненты, присутствующие в любом составе по настоящему изобретению, а также от примерно 5 мМ до примерно 100 мМ гистидина. В предпочтительных вариантах осуществления изобретения состав содержит 10 мМ гистидина.
Дополнительные варианты осуществления изобретения относятся к вакцинному составу против HPV по любому предшествующему варианту осуществления изобретения, который дополнительно включает поверхностно-активное вещество. В типичных вариантах осуществления изобретения вакцинный состав включает от примерно 0,001% до примерно 0,04% поверхностно-активного вещества. В некоторых вариантах осуществления изобретения поверхностно-активное вещество является PS20 или PS80.
В другом варианте осуществления изобретения вакцинный состав против HPV включает (а) вирусоподобные частицы HPV по меньшей мере одного типа, адсорбированные на адъюванте на основе соли алюминия, которые присутствуют в концентрации, равной 10-200 мкг/мл, при этом вирусоподобные частицы выбирают из группы, состоящей из HPV6, HPV11, HPV16, HPV18, HPV26, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV53, HPV55, HPV56, HPV58, HPV59, HPV66, HPV68, HPV73 и HPV82; (b) от примерно 5% до примерно 6% масс./об. маннита и (с) от примерно 2% до примерно 4% сахарозы. В другом варианте осуществления изобретения вакцинный состав далее включает примерно 10 мМ гистидина, от примерно 0,30 до примерно 0,35 М NaCl и/или 0,01% PS80.
Компоненты состава
Как было указано выше, комбинация маннита и сахарозы защищает вакцинные составы, содержащие алюминиевый адъювант, от стресса, вызванного замораживанием, оттаиванием или лиофилизацией. Таким образом, настоящее изобретение относится к вакционным составам, например, к вакционным составам, содержащим вирусоподобные частицы HPV, которые включают компоненты, указанные в любом предшествующем варианте осуществления изобретения, и манит в любом из следующих количеств: от примерно 1% до примерно 10% масс./об., от примерно 2% до примерно 10% масс./об., от примерно 3% до примерно 10% масс./об., от примерно 4% до примерно 10% масс./об., от примерно 5% до примерно 10% масс./об., от примерно 1% до примерно 9% масс./об., от примерно 2% до примерно 9% масс./об., от примерно 3% до примерно 9% масс./об., от примерно 4% до примерно 9% масс./об., от примерно 5% до примерно 9% масс./об., от примерно 1% до примерно 8% масс./об., от примерно 2% до примерно 8% масс./об., от примерно 3% до примерно 8% масс./об., от примерно 4% до примерно 8% масс./об., от примерно 5% до примерно 8% масс./об., от примерно 1% до примерно 7% масс./об., от примерно 2% до примерно 7% масс./об., от примерно 3% до примерно 7% масс./об., от примерно 4% до примерно 7% масс./об., от примерно 1% до примерно 6% масс./об., от примерно 2% до примерно 6% масс./об., от примерно 3% до примерно 6% масс./об. или от примерно 4% до примерно 6% масс./об. В альтернативных вариантах осуществления изобретения вакцинный состав содержит компоненты, указанные в любом варианте осуществления изобретения, и маннит в количестве 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10% масс./об. В предпочтительных вариантах осуществления изобретения композиции содержат 4%, 5% или 6% масс./об. маннита.
В других вариантах осуществления изобретения вакцинный состав против HPV содержит компоненты, указанные ва любом предшествующем варианте осуществления изобретения, и сахарозу в любых следующих количествах: от примерно 0,5% до примерно 10% масс./об., от примерно 1% до примерно 10% масс./об., от примерно 2% до примерно 10% масс./об., от примерно 3% до примерно 10% масс./об., от примерно 4% до примерно 10% масс./об., от примерно 0,5% до примерно 9% масс./об., от примерно 1% до примерно 9% масс./об., от примерно 2% до примерно 9% масс./об., от примерно 3% до примерно 9% масс./об., от примерно 4% до примерно 9% масс./об., от примерно 1% до примерно 8%, от примерно 2% до примерно 8%, от примерно 3% до примерно 8%, от примерно 4% до примерно 8%, от примерно 1% до примерно 7%, от примерно 2% до примерно 7%, от примерно 3% до примерно 7%, от примерно 4% до примерно 7%, от примерно 1% до примерно 6%, от примерно 2% до примерно 6%, от примерно 3% до примерно 6%, от примерно 4% до примерно 6% масс./об. сахарозы. В альтернативных вариантах осуществления изобретения вакцинная композиция содержит 0,5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10% масс./об. сахарозы. В предпочтительных вариантах осуществления изобретения композиции содержат 2%, 3%, 4% или 5% масс./об. сахарозы.
В конкретных вариантах осуществления изобретения вакцинные составы против HPV содержат компоненты, указанные в любом предшествующем или последующем варианте осуществления изобретения, и далее включают от примерно 5 мМ до примерно 10 мМ гистидина. В дополнительных вариантах осуществления изобретения концентрация гистидина в композиции равна от примерно 5 мМ до примерно 90 мМ, от примерно 5 мМ до примерно 80 мМ, от примерно 5 мМ до примерно 75 мМ, от примерно 5 мМ до примерно 60 мМ, от примерно 5 мМ до примерно 50 мМ, от примерно 10 мМ до примерно 90 мМ, от примерно 10 мМ до примерно 75 мМ, от примерно 10 до примерно 60 мМ, от примерно 10 мМ до примерно 50 мМ, от примерно 20 мМ до примерно 90 мМ, от примерно 20 мМ до примерно 75 мМ, от примерно 20 мМ до примерно 60 мМ или от примерно 20 мм до примерно 50 мМ. В альтернативных вариантах осуществления изобретения вакцинная композиция содержит примерно 5 мМ, примерно 10 мМ, примерно 20 мМ, примерно 30 мМ, примерно 40 мМ или примерно 50 мМ гистидина. В одном предпочтительном варианте осуществления изобретения вакцинный состав содержит примерно 10 мМ гистидина.
Любые вакцинные композиции по настоящему изобретению могут необязательно включать поверхностно-активное вещество. Поверхностно-активные вещества могут быть добавлены для уменьшения и/или предотвращения агрегации либо предотвращения и/или ингибирования разрушения белка в условиях обработки, такой как очистка, фильтрация, лиофилизация, транспортировка, хранение и доставка. Поверхностно-активные вещества, которые могут быть использованы в составах по настоящему изобретению, включают, но не ограничиваясь ими, неионогенные поверхностно-активные вещества, такие как сложные эфиры жирных кислот полиоксиэтиленсорбитана (полисорбаты, продаваемые под торговым названием твин® (Uniquema Americas LLC, Wilmington, DE)), в том числе полисорбат-20 (монолаурат полиоксиэтиленсорбитана), полисорбат-40 (монопальмитат полиоксиэтиленсорбитана), полисорбат-60 (моностеарат полиоксиэтиленсорбитана) и полисорбат-80 (моноолеат полиоксиэтиленсорбитана); полиоксиэтиленалкиловые эфиры, такие как Brij® 58 (Uniquema Americas LLC, Wilmington, DE) и Brij® 35; полоксамеры (например, полоксамер 188); тритон® Х-100 (Union Carbide Corp., Houston, ТХ) и тритон® Х-114; NP40; Span 20, Span 40, Span 60, Span 65, Span 80 и Span 85; сополимеры этилена и пропиленгликоля (например, серия плюроник® неионогенных поверхностно-активных веществ, таких как плюроник® F68, плюроник® 10R5, плюроник® F108, плюроник® F127, плюроник® F38, плюроник® L44, плюроник® L62 (BASF Corp., Ludwigshafen, Germany) и додецилсульфат натрия (SDS).
В типичных вариантах осуществления изобретения поверхностно-активное вещество является неионогенным поверхностно-активными веществом, выбираемым из группы, состоящей из полисорбата 20, полисорбата 80, Brij® 35, плюроника® F-68 и тритона®. В некоторых предпочтительных вариантах осуществления изобретения поверхностно-активное вещество является полисорбатом 20 или полисорбатом 80.
Количество поверхностно-активного вещества, вводимого в составы по настоящему изобретению, должно быть достаточным для выполнения требуемой функции, то есть должно представлять собой минимальное количество, необходимое для предотвращения агрегации белка, предотвращения или ингибирования образования частиц, уменьшения агрегации лиофилизированного или замороженного состава или восстановленного состава после добавления разбавителя, такого как BWFI, до приемлемого уровня, которое позволяет легко восстановить состав или обеспечить его стабильность во время транспортировки и/или обработки. Поверхностно-активное вещество обычно присутствует в концентрации от примерно 0,001% до примерно 0,5% (масс./об.). В предпочтительных вариантах осуществления изобретения поверхностно-активное вещество присутствует в составе (до лиофилизации) в количестве от примерно 0,005% до примерно 0,4%;
в более предпочтительных вариантах осуществления изобретения поверхностно-активное вещество присутствует в количестве от примерно 0,01% до примерно 0,3%. В особенно предпочтительных вариантах осуществления изобретения поверхностно-активное вещество присутствует в количестве примерно 0,01%.
В типичных вариантах осуществления изобретения поверхностно-активное вещество является неионогенным поверхностно-активным веществом, выбираемым из группы, состоящей из полисорбата 20, полисорбата 80, Brij® 35, плюроника® F-68 и тритона®. В некоторых предпочтительных вариантах осуществления изобретения поверхностно-активное вещество является полисорбатом 20 или полисорбатом 80. В особенно предпочтительных вариантах осуществления изобретения вакцинный состав против HPV содержит примерно 0,01% PS80.
Настоящее изобретение также относится к вакцинным составам, включающим компоненты, указанные в любом предшествующем варианте осуществления изобретения, а также соль, которая может регулировать ионную силу состава. Соли, которые могут быть использованы в вакцинных составах против HPV по настоящему изобретению, включают, но не ограничиваясь ими, NaCl, KCl, Na2SO4, (NH4)2SO4, фосфат натрия и цитрат натрия. Соль должна присутствовать в составе в концентрации от примерно 0,10 М до 1 М. Однако очень высокие концентрации являются недопустимыми из-за практических ограничений, связанных с парентеральным введением составов с высоким содержанием соли. Более предпочтительными являются средние концентрации соли, соответствующие физиологическим показателям, которые составляют от примерно 0,15 М до примерно 0,5 М при использовании 0,15 М-0,32 М NaCl. В альтернативных вариантах осуществления я вакцинные составы против HPV не содержат соли.
Значение рН вакцинных композиций по настоящему изобретению, описанных в любом предшествующем или последующем варианте осуществления, предпочтительно находится в пределах от примерно 5,5 до примерно 7,5. В конкретных вариантах осуществления изобретения значение рН композиции равно примерно 5,5, примерно 5,75, примерно 6,0, примерно 6,1, примерно 6,2, примерно 6,25, примерно 6,3, примерно 6,4, примерно 6,5, примерно 6,75, примерно 7,0, примерно 7,25 или примерно 7,5. В дополнительных вариантах осуществления изобретения значение рН находится в пределах от примерно 5,5 до примерно 7,0, от примерно 5,5 до примерно 6,5, от примерно 6,0 до примерно 7,5, от примерно 6,0 до примерно 7,0, от примерно 6,5 до примерно 7,0, от примерно 6,0 до 6,5, от примерно 6,0 до примерно 6,9, от примерно 6,2 до примерно 6,75 или от примерно 6,0 до примерно 6,75.
В некоторых обстоятельствах может быть желательно получить вакцинный состав против HPV для многократного введения, который включает несколько доз вакцины в одном флаконе. В составе для многократного введения должно быть использовано антимикробное средство, убивающее или предотвращающее рост микроорганизмов, таких как бактерии и грибы. Вакцинные составы для многократного введения, содержащие антимикробные средства, обладают несколькими преимуществами по сравнению с составами для однократного введения, выражающимися в том, что несколько доз вакцины