Способ первичной идентификации микобактерий комплекса m.tuberculosis от нетуберкулёзных микобактерий
Иллюстрации
Показать всеПредложен способ первичной идентификации микобактерий комплекса М. tuberculosis от нетуберкулезных микобактерий. Способ включает предпосевную обработку парных образцов патологического материала с последующей отмывкой стерильным изотоническим раствором хлорида натрия, посевом на плотную яичную среду, культивирование при температурном оптимуме и регистрацию результатов. Предпосевную обработку осуществляют дезинфекционным средством «Септустин», причем в объемном соотношении 1:2 первый образец заливают водным раствором дезинфекционного средства «Септустин» концентрацией 0,5% с экспозицией 30 минут, второй образец - водным раствором дезинфекционного средства «Септустин» концентрацией 5,0% с экспозицией 60 минут. При появлении роста в первом образце в течение 7 дней идентифицируют нетуберкулезные микобактерий, а при появлении роста во втором образце после 60 дней культивирования при отсутствии роста в первом образце в течение 7 дней - микобактерий комплекса М. tuberculosis. Способ позволяет выявить эпидемические штаммы с различной степенью вирулентности. 7 табл., 10 пр.
Реферат
Изобретение относится к ветеринарии, касается способа первичной идентификации микобактерий комплекса М.tuberculosis от нетуберкулезных микобактерий и может быть использовано в системе противотуберкулезных мероприятий для дифференциации туберкулеза от других микобактериозов.
В системе мер профилактики и ликвидации туберкулеза крупного рогатого скота большое значение имеет своевременная и эффективная диагностика болезни. С этой целью широко применяется внутрикожная туберкулиновая проба, по результатам которой судят о благополучии хозяйства по туберкулезу. Однако в последние годы в благополучных по туберкулезу стадах, количество которых увеличилось благодаря масштабному проведению противотуберкулезных мероприятий, нередко выявляют положительно реагирующих на туберкулин животных, в органах и тканях которых не обнаруживают характерных для туберкулеза изменений, и бактериологическим исследованием патологического материала возбудителя туберкулеза не выделяют, а выделяют нетуберкулезные микобактерий. По некоторым данным частота выделения культур нетуберкулезных микобактерий составила: из асептически отобранного молока - 20%, из биологического материала от реагирующих на микобактериальные аллергены животных - 19%, из проб объектов внешней среды - 66,6%. Подтверждена идентичность нетуберкулезных микобактерий, выделенных из проб объектов внешней среды и из биологического материала от крупного рогатого скота. Нетуберкулезные микобактерии не только обладают сенсибилизирующей способностью, но и определенной патогенностью - способностью приживаться в организме, вызывать изменения, специфичность которых невозможно определить при патоморфологическом исследовании [1, 2, 3]. Это в значительной мере затрудняет правильную оценку эпизоотической ситуации по туберкулезу в хозяйствах, что приводит к большим экономическим потерям в животноводстве из-за неоправданного убоя сенсибилизированного к туберкулину скота.
С учетом напряженности эпизоотической ситуации по туберкулезу крупного рогатого скота и масштабности проведения профилактических и оздоровительных мероприятий проблема неспецифического реагирования животных на туберкулин для млекопитающих приобретает особое значение.
Основой лабораторной диагностики туберкулеза остается выделение возбудителя на питательных средах. Бактериологический метод позволяет получать чистые культуры микобактерий туберкулеза и проводить их видовую идентификацию, определять биологические и биохимические свойства.
Обычные микробиологические методики не могут быть использованы при проведении исследований на туберкулез. Это связано с тем, что растут микобактерии туберкулеза очень медленно, а большинство проб клинического материала содержат быстрорастущие гноеродные и гнилостные микроорганизмы, грибы. Их бурный рост на богатых питательных средах мешает развитию микобактерий и не позволяет выделить возбудителя туберкулеза, поэтому перед посевом диагностический материал обязательно подвергают предварительной обработке. Все детергенты и деконтаминанты обладают более или менее выраженным токсическим действием на микобактерии. В результате обработки может гибнуть до 90% микобактерий. Чтобы сохранить достаточную часть микобактериальной популяции, необходимо использовать щадящие методы обработки, позволяющие, с одной стороны, подавить быстрорастущие гноеродные и гнилостные микроорганизмы, а с другой - максимально сохранить жизнеспособность присутствующих в материале микобактерий.
В зависимости от материала, степени его гомогенности и загрязненности для предпосевной обработки используют различные деконтаминанты: для мокроты - раствор гидроксида натрия 4%, растворы трехзамещенного фосфорнокислого натрия 10%, бензалкониума хлорида тринатрий фосфата, NALC-NaOH (N-ацетил-L-цистеин-гидроксид натрия) с конечной концентрацией NaOH 1%, для мочи и других жидких материалов - раствор серной кислоты 3%, для загрязненных проб, жиросодержащих материалов - раствор щавелевой кислоты до 5%. Для предпосевной обработки применяют дезин-фектанты, содержащие альдегиды («Лизоформин 3000», «Биодез-Р», «Септодор-форте», «Делаксон») и активный хлор («Хлорантоин», «Биохлор»). Кроме того, в некоторых случаях используют ферменты, поверхностно-активные вещества (детергенты). Применение твина и некоторых других детергентов сопровождается меньшей гибелью микобактериальных клеток (выживают 40-50%), однако использовать их можно только для жидких материалов. Деконтаминация тканесодержащих твердых материалов труднее, поскольку угадать степень дисперсности материала в процессе гомогенизации сложно. Например, обработка биоптатов лимфатических узлов нередко сопровождается повышенной частотой контаминации посторонней флорой. В этом случае можно использовать 1% этоний [4, 5].
Микобактерии различных видов имеют ряд морфологических, культурных, биохимических и биологических особенностей, которые позволяют дифференцировать их друг от друга. Практическое значение имеет дифференциация туберкулезных от нетуберкулезных микобактерий, которую осуществляют по следующим характеристикам: скорость роста на плотных питательных средах, пигментообразование, морфология колоний, наличие кислотоустойчивости и температурный оптимум роста. Для дифференциации туберкулезных от нетуберкулезных микобактерий применяют основные биохимические тесты, выявляющие наличие следующих признаков: способности продуцировать никотиновую кислоту (ниациновый тест): нитратредуктазной активности; термостабильной каталазы; роста на среде с натрием салициловокислым (1 мг/мл). В качестве дополнительных можно использовать также тесты роста на среде, содержащей 500 мкг/мл паранитробензойной кислоты или 5% хлорида натрия. В большинстве же случаев на практике для дифференциации М.tuberculosis и М.bovis бывает достаточно следующих тестов: ниацинового, на наличие нитратредуктазы, на наличие пиразинамидазы и регистрации роста на среде, содержащей 2 мкг/мл гидразида тиофен-2-карбоксиловой кислоты. При этом учитывают, что микобактерии комплекса М.tuberculosis характеризуются следующей совокупностью признаков: медленным ростом (более 3 недель); температурой роста в пределах 35-37°C; отсутствием пигментообразования (цвет слоновой кости); выраженной кислотоустойчивой окраской; положительным ниациновым тестом; положительным нитратредуктазным тестом; отсутствием термостабильной каталазы (68°C); отсутствием роста на среде Левенштейна-Йенсена, содержащей 1000 мкг/мл натрия салициловокислого, 500 мкг/мл паранитробензойной кислоты, 5% хлорида натрия; ростом в присутствии 1-5 мкг/мл тиофен-2-карбоксиловой кислот [6].
Цель изобретения - способ первичной идентификации микобактерий комплекса М.tuberculosis от нетуберкулезных микобактерий. Технический результат - повышение эффективности бактериологической диагностики туберкулеза крупного рогатого скота за счет оптимизации условий предпосевной обработки биологического материала.
Поставленная цель достигается оптимизацией предпосевной обработки парных образцов пробы патологического материала дезинфекционным средством «Септустин».
Дезинфекционное средство «Септустин» (изготовитель ООО «Урал-стинол БИО», Россия) рекомендован для дезинфекции объектов ветеринарного надзора. Данный препарат из группы катионных ПАВ содержит в качестве дезинфицирующего вещества катамин АБ, а также спирт изопропиловый, неионогенное ПАВ, гидрокарбонат натрия и бромфеноловый синий [7], обладает широким спектром действия в отношении возбудителей инфекционных болезней бактериальной (включая туберкулез), вирусной и грибковой этиологии.
Способ осуществляется следующим образом.
Из пробы патологического материала (лимфатические узлы, участки тощей и подвздошной кишок, печень, селезенка, легкие) готовят парные образцы. В объемном соотношении 1:2 первый образец заливают водным раствором дезинфекционного средства «Септустин» концентрацией 0,5% с экспозицией 30 минут, второй образец - водным раствором дезинфекционного средства «Септустин» концентрацией 5,0% с экспозицией 60 минут при комнатной температуре с последующим посевом отмытого дважды в течение 15 минут стерильным изотоническим раствором хлорида натрия патологического материала на плотные яичные среды, выращиванием при температуре +37°С, при появлении роста в первом образце в течение 7 дней идентифицируют нетуберкулезные микобактерий, а при появлении роста во втором образце после 60 дней культивирования при отсутствии роста в первом образце в течение 7 дней - микобактерий комплекса М. tuberculosis.
Сущность способа поясняется примерами.
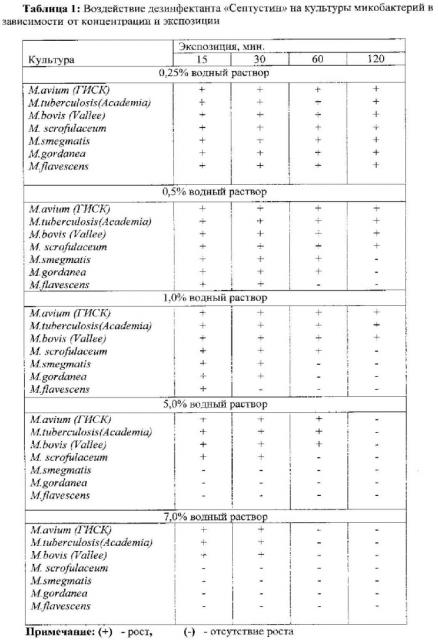
Пример 1. Воздействие дезинфекционного средства «Септустин» в зависимости от концентрации и экспозиции определяли на культурах микроорганизмов, полученных из ГИСК им. Л.А. Тарасевича. Результаты представлены в таблице 1.
Данные, приведенные в таблице 1, подтвердили обоснованность параметров способа, касающихся концентрации и экспозиции: увеличение заявленных значений не влияло на полученные результаты.
Пример 2. Из патологического материала (брыжеечные, заглоточные, подчелюстные лимфатические узлы, участки тощей и подвздошной кишок, печень, легкие) от белых мышей, зараженных культурой М.bovis (шт. Vallee), готовили парные образцы, которые измельчали в стерильной ступке стерильными ножницами, кусочки заливали растворами дезинфекционного средства «Септустин» концентрацией 0,5% и 5,0% при различной экспозиции в объемном соотношении 1:2 при комнатной температуре. Затем сливали надосадочную жидкость и промывали кусочки патологического материала стерильным изотоническим раствором хлорида натрия дважды в течение 15 минут, хорошо перемешивали и сливали, а кусочки растирали песком стерильным пестиком. Полученную суспензию засевали на питательную среду Левенштейна-Йенсена, посевы инкубировали при +37°C. Учет результатов проводили ежедневно. Результаты представлены в таблице 2.
Пример 3. Из патологического материала (брыжеечные, заглоточные, подчелюстные лимфатические узлы, участки тощей и подвздошной кишок, печень, легкие) от белых мышей, зараженных культурой M.tuberculosis (шт.Academia), готовили парные образцы, которые обрабатывали, как в примере 2. Результаты представлены в таблице 3.
Пример 4. Из патологического материала (брыжеечные, заглоточные, подчелюстные лимфатические узлы, участки тощей и подвздошной кишок, печень, легкие) от белых мышей, зараженных культурой М.avium (шт. ГИСК), готовили парные образцы, которые обрабатывали, как в примере 2. Результаты представлены в таблице 4.
Пример 5. Из пробы патологического материала (брыжеечные, заглоточные, подчелюстные лимфатические узлы, участки тощей и подвздошной кишок, печень, легкие) от белых мышей, зараженных культурой М.smegmatis, которые обрабатывали, как в примере 2. Результаты представлены в таблице 5.
Пример 6. Из пробы патологического материала (брыжеечные, заглоточные, подчелюстные лимфатические узлы, участки тощей и подвздошной кишок, печень, легкие) от белых мышей, зараженных культурой М.scrofulaceum, которые обрабатывали, как в примере 2. Результаты представлены в таблице 6.
Пример 7. Провели культуральное исследование патологического материала (кусочки органов без характерных для туберкулеза изменений) от коровы с положительной реакцией на ППД - туберкулин для млекопитающих из хозяйства, благополучного по туберкулезу, в соответствии с заявляемым способом. Через 7 дней выращивания в первом образце выросли мелкие колонии белого цвета, которые окрашивали по Цилю-Нильсену и по морфологическим признакам идентифицировали как нетуберкулезные микобактерии, что подтверждали исследованием жирно-кислотного спектра клеток методом газожидкостной хроматографии. По хемотаксономическим характеристикам (по соотношению на хроматограммах эфиров миколовых кислот с числом атомов углерода больше 20, пик С24:0 больше пика С22:0, пик С26:0 отсутствовал) микобактерий идентифицировали как М.scrofulaceum. В течение 60 дней выращивания во втором образце роста не наблюдали.
Пример 8. Провели культуральное исследование патологического материала (кусочки органов с характерными для туберкулеза изменениями) от коровы с положительной реакцией на ППД - туберкулин для млекопитающих из хозяйства, благополучного по туберкулезу, заявляемым способом. В первом образце в течение первых 7 дней выращивания рост колоний отсутствовал. Во втором образце через 60 дней выросли мелкие колонии белого цвета, которые окрашивали по Цилю-Нильсену и по морфологическим признакам идентифицировали как микобактерий комплекса M.tuberculosis, что подтверждали исследованием жирнокислотного спектра клеток методом газожидкостной хроматографии. По хемотаксономическим характеристикам (по соотношению на хроматограммах эфиров миколовых кислот с числом атомов углерода 22, 24, 15, 26) микобактерий идентифицировали как М.tuberculosisbovis.
Пример 9. Провели культуральное исследование патологического материала (брыжеечные, заглоточные, подчелюстные, лимфатические узлы, печень, легкие) от коровы с положительной реакцией на ППД - туберкулин для млекопитающих заявляемым способом. Через 7 дней в первой пробе выросли слизистые блестящие колонии желтого цвета. По результатам окраски по Цилю-Нильсену и по морфологическим признакам их идентифицировали как нетуберкулезные микобактерии, что подтверждали исследованием жирно-кислотного спектра клеток методом газожидкостной хроматографии. По хемотаксономическим характеристикам (четко выражены пики кислот с 17 и 19 атомами углерода и ненасыщенных жирных кислот с числом атомов углерода больше 20, преобладала бегеновая кислота С22:0 пик С26:0 - отсутствует) микобактерий идентифицировали как M. vaccae. В течение 60 дней во втором образце рост отсутствовал.
Пример 10. Проводили первичную идентификацию микобактерий комплекса М. tuberculosis от нетуберкулезных микобактерий в пробах патологического материала (подчелюстные, заглоточные, брыжеечные лимфатические узлы, участки тощей и подвздошной кишок, печень и селезенка) от павших и убитых животных с изменениями, характерными для туберкулеза, заявляемым способом с подтверждением полученных результатов анализом жирно-кислотного спектра клеток методом газожидкостной хроматографии (ГЖХ). Результаты представлены в таблице 7.
Как видно из таблицы 7, результаты первичной дифференциации микобактерий комплекса М. tuberculosis от нетуберкулезных микобактерий заявляемым способом полностью совпали с результатами газохроматографических исследований, что указывает на специфичность способа.
Проведенные исследования показали, что заявляемый способ первичной идентификации микобактерий комплекса М. tuberculosis от нетуберкулезных микобактерий позволяет выявлять эпидемические штаммы микобактерий с различной степенью вирулентности, эффективен при исследовании для выяснения причин сенсибилизации животных к туберкулину, соответствует требованиям при работе с патологическим материалом, безопасен и прост в осуществлении.
Источники информации
1. Толстенко Н.Г. Патогенные свойства некоторых видов микобактерий, выделенных от животных и объектов внешней среды: автореф. дис… канд. вет. наук: 16.00.03 - М., 2006. - 27 с.
2. Рабухин Е.А. Микобактериоз, вызываемый М. fortuitum II Проблемы туберкулеза. - 1972. - №10. - С. 58-60.
3. Колоскова Э. Л. Патоморфологические изменения у животных, зараженными разными видами микобактерий: автореф. дис… канд. вет. наук: 16.00.02 - М., 2007. - 22 с.
4. Режим доступа http://www. humbio.ru.
5. Режим доступа http://www. nbuv.ua.
6. Майорова А.А. Идентификация нетуберкулезных микобактерий и выбор оптимальной комбинации методов для их видовой дифференциации: автореф. дис… канд. биолог. наук: 03.00.07 - М., 2007. - 26 с.
7. Наставление по применению препарата «Септустин» для дезинфекции объектов ветнадзора. Уралстинол. - БИО. – 2002.
Способ первичной идентификации микобактерий комплекса М. tuberculosis от нетуберкулезных микобактерий, включающий предпосевную обработку парных образцов патологического материала с последующей отмывкой стерильным изотоническим раствором хлорида натрия, посевом на плотную яичную среду, культивирование при температурном оптимуме и регистрацию результатов, отличающийся тем, что предпосевную обработку осуществляют дезинфекционным средством «Септустин», причем в объемном соотношении 1:2 первый образец заливают водным раствором дезинфекционного средства «Септустин» концентрацией 0,5% с экспозицией 30 минут, второй образец - водным раствором дезинфекционного средства «Септустин» концентрацией 5,0% с экспозицией 60 минут, при появлении роста в первом образце в течение 7 дней идентифицируют нетуберкулезные микобактерий, а при появлении роста во втором образце после 60 дней культивирования при отсутствии роста в первом образце в течение 7 дней - микобактерий комплекса М. tuberculosis.