Способ и набор для определения продукции холерного токсина и дифференциации эпидемически значимых штаммов холерных вибрионов классического и эльтор биоваров
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается способа определения продукции холерного токсина и дифференциации эпидемически значимых штаммов холерных вибрионов, включающего подготовку исследуемого образца, выявление холерного токсина методом ИФА, предусматривающим внесение антигенов в лунки планшета, инкубацию и учет результатов. Группа изобретений также касается набора для определения продукции холерного токсина и дифференциации эпидемически значимых штаммов холерных вибрионов, осуществляющего указанный способ. Группа изобретений обеспечивает создание высокоспецифичного, чувствительного, простого и доступного для воспроизведения, без применения дополнительного оборудования, биологически безопасного, финансово не затратного (низкая себестоимость), выполняемого за малое количество времени способа для определения холерного токсина, продуцируемого штаммами возбудителя холеры классического и эльтор биоваров в условиях in vitro и in vivo, и дифференциации токсигенных (эпидемически значимых) штаммов V. cholerae. 2 н. и 2 з.п. ф-лы, 3 пр., 3 табл.
Реферат
Изобретение относится к медицинской микробиологии и может быть использовано в лабораторной диагностике для определения наличия у штаммов Vibrio cholerae классического и эльтор биоваров продукции холерного токсина и дифференциации их по эпидемической значимости, выявления токсигенных штаммов холерных вибрионов в клиническом материале от человека.
Одной из важнейших составных частей эпидемиологического надзора за холерой является своевременное выявление и идентификация токсигенных (эпидемически значимых) штаммов холерных вибрионов. Эффективность таких исследований зависит от наличия высокочувствительных и специфичных препаратов для лабораторной диагностики холеры.
Известен способ выявления эпидемически значимых культур V. cholerae eltor и V. cholerae 0139 по их адгезивной способности, включающий инкубирование исследуемой культуры с последующим приготовлением микроскопических препаратов и определением адгезивной способности по количеству приклеившихся вибрионов к субстрату, представленного II группой крови человека, проводят постановку реакцией на стекле. По результатам реакции осуществляют дифференциацию на токсигенные (эпидемически значимые) и атоксигенные, однако это можно осуществить только у выделенной чистой культуры, но не в биологическом материале [1].
Известен способ и набор для детекции и определения биотипа, серогруппы и токсигенности возбудителя холеры с использованием метода мультилокусной полимеразной цепной реакции, который обеспечивает определение серогруппы, биовара, а также токсигенности (эпидемической значимости) по выявлению генетического маркера токсина - ctxA гена, но не позволяет определить продукцию холерного токсина (XT) [2].
Известен сконструированный на основе моноклональных антител (МКА), специфических к XT, диагностикум «Тест-полоска V. cholerae tox+», предназначенный для обнаружения токсигенных штаммов V. cholerae. Чувствительность иммунохроматографических (ИХ) тест-полосок составляет - 108-109 м.к./мл и зависит от качества используемых антител и концентрации антигена в биоматериале. Однако предложенный подход не позволит определить токсигенные штаммы холерных вибрионов в клиническом материале от человека при их содержании ниже 108 м.к./мл (от вибрионосителей, после приема антибактериальных препаратов). Производство их полосок является экономически затратным, и их себестоимость в итоге получается достаточно высокой [3].
В литературе описана тест-система на основе специфичных к холерному токсину МКА в планшетном варианте иммуноферментного анализа (ИФА) и в формате гидрогелевые биочипы, изготовленные по технологии полимеризационной иммобилизации. Предел обнаружения токсина достигает 0,2 нг/мл в планшетном формате ИФА и 0,44 нг/мл в формате микрочипа. Представленная тест-система апробирована на пробах, содержащих коммерческий препарат холерного токсина (Sigma, США). Применение современной технологии биомикрочипов дает точные результаты в сжатые сроки. Однако сложная технология приготовления наряду с высокой себестоимостью анализа и применение специального программного обеспечения ограничивает возможность их использования практическими лабораториями. В качестве исследуемых образцов использованы молоко, мясной бульон, вода, содержащие чистый препарат XT, однако данные по изучению эффективности способа при исследовании штаммов V. cholerae, в особенности, биовара эльтор и клинического материала не представлены. Это важно, так как штаммы холерных вибрионов биовара эльтор при обычных условиях не индуцируют выход XT за пределы клетки [4].
Известен способ иммуноферментного определения продукции XT штаммами V. cholerae, который включает подготовку исследуемого образца, внесение в лунки планшета сенсибилизированного GM1 ганглиозидами, инкубацию образца при 37°C в течение 2 часов, отмывку буферным раствором, внесение конъюгата, с последующей инкубацией и учетом результатов по оптической плотности (ОП).
Подготовка образца заключается в индуцировании выхода холерного токсина из клеток вибрионов классического и эльтор биоваров. Культивирование осуществляют в разных средах, в зависимости от принадлежности биовара. Холерный вибрион классического биовара культивируют при постоянном помешивании в среде Крейга при температуре 30°C в течение 48 ч, а холерный вибрион биовара эльтор культивируют без встряхивания в среде AKI при температуре 37°C в течение 20 ч или среде Крейга при температуре 30°C в течение 48 ч [5]. Недостатком описанного способа является необходимость предварительного определения принадлежности к биовару и в зависимости от него применение разных сред и условий для индукции XT. Кроме того, при данном способе выявления XT необходимо использовать для проведения исследования дорогостоящих реагентов: GM1 ганглиозиды, поликлональная сыворотка против XT, длительность проведения этапа подготовки образца и постановки ИФА. Все это не позволяет рассматривать данный способ в качестве перспективного для использования в лабораториях территориального уровня (лаборатории особо опасных инфекций ФБУЗ Центров гигиены и эпидемиологии в субъектах Российской Федерации, Региональных центров по мониторингу за возбудителя II-IV групп патогенности).
В литературе описано культивирование холерного вибриона для индуцирования холерного токсина из клеток холерных вибрионов классического и эльтор биоваров. Для этого культуру патогена в объеме одной полной бактериальной петли №2 засевают в пробирку с 10 мл бульона AKI (бакто-пептон - 1,5%, дрожжевой экстракт - 0,4%, натрия бикарбонат - 0,3%, натрия хлорид - 0,5%) и выдерживают при температуре 30°C в течение 3,5-4 ч, а затем переносят содержимое пробирки в полном объеме во флакон с 250 мл бульона AKI и инкубируют при постоянном помешивании в течение 17-19 часов при температуре 30°C [6]. Однако культивирование вибрионов по представленной схеме трудоемко, происходит в большом объеме питательной среды с использованием дополнительного оборудования, которое обеспечивает постоянное покачивание в течение длительного времени, что сопряжено с высоким риском биологической опасности, так как в бульонной культуре уже через 5-6 ч содержится не менее 1×109 м.к./мл патогена.
Техническая задача предлагаемого изобретения заключается в разработке способа и иммуноферментной тест-системы для определения наличия у штаммов Vibrio cholerae классического, эльтор биоваров холерного токсина и дифференциации их по эпидемической значимости, определения токсигенных штаммов холерных вибрионов в нативном клиническом материале от человека.
Техническим результатом предлагаемого изобретения является создание высокоспецифичного, чувствительного, простого и доступного для воспроизведения, без применения дополнительного оборудования, биологически безопасного, финансово не затратного (низкая себестоимость), выполняемого за меньшее количество времени способа для определения холерного токсина, продуцируемого штаммами возбудителя холеры классического и эльтор биоваров в условиях in vitro и in vivo, и дифференциации токсигенных (эпидемически значимых) штаммов V. cholerae. Дополнительный технический результат заключается в возможности проведения исследований на разное количество проб.
Технический результат достигается способом, который включает подготовку исследуемого образца, выявление холерного токсина ИФА, предусматривающего внесение антигенов в лунки планшета, инкубацию и учет результатов, согласно изобретению индукцию холерного токсина штаммами холерных вибрионов осуществляют при культивировании первично в стеклянной пробирке в 10 мл бульона AKI при температуре (37±1)°C в течение 2,5 часов и вторично в 5-10 мл бульона AKI в пластиковой пробирке с максимальным наклоном для формирования тонкого слоя жидкой среды при температуре (37±1)°C в течение 14 часов с последующим выявлением холерного токсина «сэндвич»-вариантом ИФА, при котором в лунки планшета, сенсибилизированные моноклональными антителами, специфичными к В-субъединице холерного токсина изотипа G2a, вносят исследуемый образец и конъюгат, представляющий собой моноклональные антитела, специфичные к В-субъединице холерного токсина изотипа G1, меченные пероксидазой хрена и по ОП проводят дифференциацию штаммов, при этом, если величина ОПобр≥ОПср(К-)×2 - штамм продуцирует холерный токсин и относится к токсигенным, а при величине ОПобр<ОПср(К-)× - штамм не продуцирует холерный токсин и относится к нетоксигенным.
Выявление холерного токсина ИФА проводят с использованием компонентов набора, при этом сенсибизацию лунок планшета для ИФА и подготовку иммуноглобулинового конъюгата пероксидазного осуществляют с помощью MICA, специфичных к разным эпитопам холерного токсина. Моноклональные антитела, специфичные к В-субъединице холерного токсина изотипов G1 и G2a, продуцируются гибридомами Mus musculus XT 3Е5 и Mus musculus XT 2E5 соответственно, которые получены в Российском научно-исследовательском противочумном институте «Микроб» Роспотребнадзора и депонированы в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» под номером Н-43, под номером Н-44.
Технический результат достигается набором, представляющим собой комплект, содержащий, по крайней мере, один 96-луночный разборный стрипованный планшет с последовательно нанесенными на его поверхность МКА специфичными к В-субъединице холерного токсина изотипа G2a и лактальбумина; а также емкости, содержащие навеску среды AKI, конъюгат МКА, специфичных к В-субъединице холерного токсина изотипа G1 с пероксидазой хрена; реагенты для разведения конъюгата: глицерин, лактальбумин, Tween; реагенты для приготовления субстратной смеси: кислота лимонная, натрия цитрат, 2,2'-azino-bis-(3-ethylbenzthiazoline-6-sulfonic acid), мочевина пероксид; отрицательный контрольный образец, представляющий собой фосфатно-солевой буфер; положительный контрольный образец, представляющий собой лиофолизированный холерный токсин.
Некоторые компоненты набора, такие как - реагенты для приготовления рабочего раствора конъюгата, субстратной смеси, положительного контрольного образца, расфасованы в повторах, что позволяет провести исследование как на минимальном количестве стрипов - 3, так и на всем планшете - 12.
В состав набора входят 12 компонентов:
планшет 12 стрипов по 8 лунок полистироловый, для иммуноферментного анализа, однократного применения («Costar», США), сенсибилизированный моноклональными иммуноглобулинами к XT в концентрации 10 мкг/мл с последующей блокировкой лактальбумином. Лунки планшета прозрачные, без видимых следов вещества;
навеска среды AKI (порошок кремого цвета, после растворения - жидкость светло-желтого цвета) по 12,12 г в 2 пробирках;
фосфатно-солевой буфер (ФСБ) (таблетка белого цвета, после растворения - жидкость прозрачного цвета) по 1 таблетке в 5 пакетах;
молоко сухое обезжиренное (лактальбумин) (порошок кремового цвета, после растворения - жидкость белого цвета) по 0,0113 г в 4 пробирках;
конъюгат пероксидазный иммуноглобулиновый моноклональный (конъюгат МКАХТ) (аморфная масса белого цвета, представляющая собой высушенные моноклональные иммуноглобулины XT, конъюгированные с пероксидазой хрена, после растворения - жидкость желтого цвета) по 0,02 мл в 1 пробирке;
глицерин (вязкая прозрачная жидкость) по 0,025 мл в 1 пробирке;
Tween-20 (вязкая слегка желтоватая жидкость) по 0,002 мл в 4 пробирках;
кислота лимонная (порошок белого цвета, после растворения - прозрачная жидкость) по 0,0225 г в 4 пробирках;
натрия цитрат (порошок белого цвета, после растворения - прозрачная жидкость) по 0,025 г в 4 пробирках;
ABTS (2,2'-azino-bis-(3-ethylbenzthiazo-line-6-sulfonic acid), diammonium salt (порошок бледно-зеленого цвета, после растворения - жидкость бледно-зеленого цвета) по 0,001625 г в 4 пробирках;
гидроперит (порошок белого цвета, после растворения - прозрачная жидкость) по 0,067 г в 4 пробирках;
положительный контрольный образец (ПКО-ХТ) (аморфная масса белого цвета, представляющая собой высушенный холерный токсин в концентрации 200 нг, после растворения - жидкость прозрачного цвета) по 0,1 мл в 4 пробирках.
Способ осуществляется следующим образом.
Навеску среды AKI из одной пробирки растворяют в 500 мл дистиллированной воды и переносят в 50 стеклянных пробирок по 10 мл (используются для первичного подращивания). Навеску среды AKI из второй пробирки растворяют в 500 мл дистиллированной воды и разливают по 50 или 100 мл во флаконы. Пробирки и флаконы с бульоном AKI стерилизуют при 120°C в течение 30 мин. Подготовленные пробирки и флаконы с бульоном AKI хранят в полиэтиленовых пакетах в холодильнике при температуре от 6 до 8°C в течение всего срока годности тест-системы (6 месяцев).
Перед началом исследования извлекают необходимое количество стеклянных пробирок с 10 мл бульона AKI, соответствующее числу исследуемых штаммов холерных вибрионов или проб биологического материала. Готовят такое же количество одноразовых центрифужных пробирок типа Falcon объемом 15 мл или 50 мл для вторичного подращивания. Для этого из флаконов с бульоном AKI в центрифужные пробирки типа Falcon объемом 15 мл вносят 5 мл бульона или в центрифужные пробирки типа Falcon объемом 50 мл - 10 мл бульона.
Для подготовки исследуемого образца - индукции XT штаммами V. cholerae обоих биоваров в условиях in vitro исследуемые агаровые культуры вибрионов в объеме три колонии (диаметр 2-3 мм) или 1/2 петли (номер 2) засевают в стеклянную пробирку с 10 мл AKI для первичного подращивания и инкубируют в течение 2,5 часов при температуре (37±1)°C. Затем из подращенной культуры переносят по 1,0 мл - в центрифужные пробирки с крышкой объемом 15 мл, содержащие 5 мл бульона AKI, или по 2,0 мл - в центрифужные пробирки с крышкой объемом 50 мл, содержащие 10 мл бульона AKI. Подготовленные пробирки помещают в термостат так, чтобы они находились практически в горизонтальном положении, но без касания крышки пробирки культуральной жидкостью, и проводят вторичное подращивание при температуре (37±1)°C в течение 14 часов.
При исследовании клинического материала от человека суспендированные образцы из расчета 1 г пробы на 10 мл 0,9% раствора натрия хлористого могут быть исследованы сразу после их дополнительного разведения в 10 раз или после культивирования в среде AKI аналогично как при анализе культур патогена.
Перед началом исследования все компоненты, требующие растворения, разводят и хранят в течение всего срока годности тест-системы (6 месяцев) при соответствующих температурных условиях.
Для разведения компонентов готовят ФСБ. Для этого таблетку ФСБ растворяют в 100 мл воды очищенной. Раствор хранят в холодильнике при температуре (5±3)°C в течение 3 суток.
Для приготовления концентрированного раствора конъюгата в пробирку, содержащую лиофилизированные МКА 2Е5, меченные пероксидазой хрена, добавляют 20 мкл воды очищенной и полностью растворяют. Затем аккуратно перемешивают и переносят весь полученный объем в пробирку, содержащую глицерин, тщательно перемешивают. Полученный концентрированный раствор конъюгата хранят при температуре минус (18±2)°C в течение 6 месяцев.
Непосредственно перед проведением исследования готовят рабочие разведения конъюгата и субстратной смеси, а также положительного контрольного образца. Одна пробирка с каждым компонентом рассчитана на проведение исследований с 3 стрипами.
В пробирку с навеской сухого обезжиренного молока (лактальбумин) вносят 2,7 мл приготовленного ФСБ и тщательно перемешивают до получения однородной массы в течение 1-2 минут. Раствор хранят в холодильнике при температуре (5±3)°C в течение 3 суток.
В пробирку, содержащую Tween-20, добавляют 0,375 мл ФСБ и тщательно перемешивают, не допуская образования пузырей. Раствор хранят в холодильнике при температуре плюс (5±3)°C в течение 3 суток.
В пробирку с навеской лимонной кислоты вносят 2 мл воды очищенной. Раствор хранят при температуре плюс (5±3)°C в течение 3 суток.
В пробирку с навеской натрия цитрата вносят 1,7 мл воды очищенной. Раствор хранят в холодильнике при температуре (5±3)°C в течение 3 суток.
В пробирку, содержащую лиофилизированный ABTS (2,2'-azino-bis-(3-ethylbenzthiazo-line-6-sulfonic acid), вносят 0,15 мл воды очищенной. Раствор хранят в холодильнике при температуре (5±3)°C в течение 3 суток.
В пробирку с навеской гидроперит вносят 0,2 мл воды очищенной и тщательно перемешивают до полного растворения, получая 33% раствор перекиси водорода. Хранят в холодильнике при температуре (5±3)°C в течение 3 суток.
В пробирку с лиофилизированным положительным контрольным образцом вносят 0,1 мл воды очищенной и полностью растворяют сухое вещество. Раствор хранят в холодильнике при температуре (5±3)°C в течение 1 суток. При необходимости для более длительного хранения (до 6 месяцев) раствор может быть помещен в морозильную камеру при температуре (18±2)°C.
Подготовку рабочих растворов конъюгата и субстратной смеси на 3 стрипа осуществляют ex tempore. Полученные растворы не хранят.
Рабочий раствор конъюгата: в пробирку с раствором лактальбумина добавляют 0,3 мл раствора Tween-20 и тщательно перемешивают. Непосредственно перед внесением в лунки в подготовленный раствор добавляют 0,02 мл концентрированного раствора конъюгата и еще раз тщательно перемешивают.
Рабочий раствор субстратной смеси: субстратную смесь готовят сразу перед внесением в лунки. Для этого в пробирку с лимонной кислотой вносят в полном объеме содержимое пробирки с натрия цитрата, добавляют 0,1 мл раствора ABTS и 0,004 мл раствора гидроперита.
При необходимости исследования большего количества стрипов подготовку реагентов проводят аналогично, используя другие пробирки с лактальбумином, Tween-20, кислотой лимонной, натрия цитратом, ABTS, гидроперитом.
Отбирают необходимое количество стрипов для проведения исследований. В лунки стрипов последовательно вносят в дублях по 100 мкл из пробирок с культурами V. cholerae после вторичного подращивания или нативного материала, положительный и отрицательный контроли.
Планшет инкубируют при температуре (37±1)°C в течение (40±5) мин. По окончании инкубации планшет вынимают из термостата, содержимое из лунок отбирают с помощью многоканального дозатора и аккуратно сбрасывают в емкость для отработанных жидкостей с дезраствором, избегая образования капель (аэрозоля).
Лунки планшета промывают 3-кратно, для этого вносят 250 мкл ФСБ, затем содержимое из лунок извлекают с помощью многоканального дозатора и аккуратно сбрасывают в емкость для отработанных жидкостей с дезраствором, избегая образования капель (аэрозоля).
В лунки вносят по 100 мкл приготовленного рабочего раствора конъюгата. Планшет инкубируют при температуре (37±1)°C в течение (40±5) мин. Далее лунки планшета 6-кратно промывают, как описано выше.
Во все лунки вносят по 100 мкл рабочего раствора субстратной смеси и выдерживают при комнатной температуре от +18°C до +25°C в течение (12±2)°C мин, после чего производят учет результатов.
Дифференциацию токсигенных (эпидемически значимых) штаммов холерных вибрионов, а также оценку клинического материала проводят на основании положительного или отрицательного результата анализа. При положительном (ОПобр≥ОП(К-)×2) - в пробе обнаружен холерный токсин, исследованная культура холерного вибриона токсигенная (эпидемически значимая) или в образцах клинического материала выявлены токсигеные штаммы возбудителя холеры. При отрицательном (ОПобр<ОПср(К-)×2) - в пробе холерный токсин не обнаружен, исследованная культура холерного вибриона нетоксигенная (эпидемически безопасная) или в образцах клинического материала токсигеные штаммы возбудителя холеры не выявлены.
Таким образом, подобранная среда, условия индукции XT и постановка ИФА с моноклональными антителами к В-субъединице XT изотипа G2a, изотипа G1 позволяют выявлять продукцию XT обоих биоваров.
Пример 1. Определение наличия XT у штаммов холерных вибрионов с помощью заявленного набора на 3 стрипах.
Подготовку пробирок для индукции XT у штаммов холерных вибрионов проводили, как указано выше, используя для вторичного подращивания центрифужные пробирки объемом 15 мл.
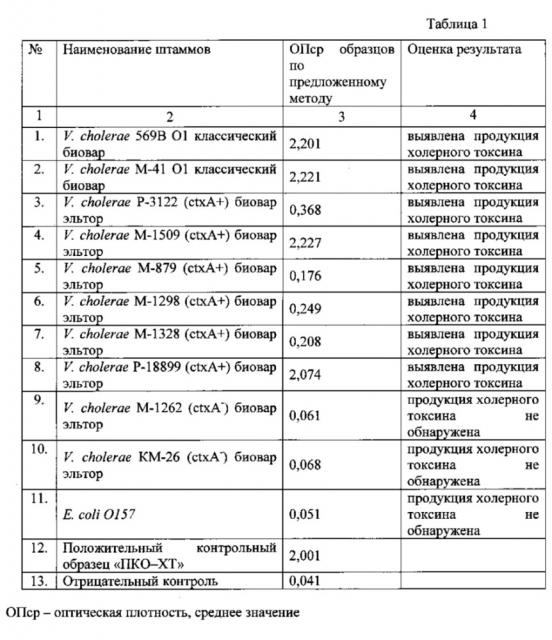
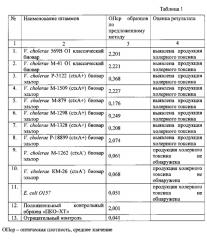
Материалом для исследования служили 11 штаммов холерных вибрионов, из них: 2 - токсигенные V. cholerae классического биовара, 6 - токсигенные V. cholerae биовара эльтор, 2 - нетоксигенные V. cholerae биовара эльтор, и 1 штамм Е. coli O157. Все культуры получены из Государственной коллекции патогенных бактерий ФКУЗ РосНИПЧИ "Микроб". Штаммы холерных вибрионов и кишечной палочки выращивали при температуре 37°C в LB бульоне в течение 4 ч с последующим высевом на LB-агар, pH 7,6 и инкубированием в термостате при температуре 37°C в течение 18-24 ч. Предварительное культивирование исследуемых культур проводили согласно описанию выше.
Дозатором полуавтоматическим последовательно вносили по 100 мкл в две лунки сенсибилизированного, блокированного планшета исследуемые образцы. В качестве положительного контроля вносили 100 мкл раствора XT в концентрации 200 нг, а в качестве отрицательного - 100 мкл ФСБ.
Планшет инкубировали при температуре (37±1)°C в течение (40±5) мин. По окончании инкубации планшет вынимали из термостата, содержимое из лунок отбирали с помощью многоканального дозатора и аккуратно сбрасывали в емкость для отработанных жидкостей с дезраствором, избегая образования капель (аэрозоля). Лунки планшета промывали 3-кратно, для этого вносили 200 мкл ФСБ, затем содержимое из лунок извлекали с помощью многоканального дозатора и аккуратно сбрасывали в емкость для отработанных жидкостей с дезраствором, избегая образования капель (аэрозоля).
Подготовку рабочих растворов субстратной смеси, конъюгата и положительного контрольного образца осуществляли на 3 стрипа, как указано ранее.
В лунки вносили по 100 мкл приготовленного рабочего раствора конъюгата. Планшет инкубировали при температуре (37±1)°C в течение (40±5) мин. Далее лунки планшета шестикратно промывали, как описано выше. Во все лунки вносили по 100 мкл субстратной смеси и выдерживали при комнатной температуре от +18°C до +25°C в течение (12±2) мин. Реакцию учитывали фотометрически при длине волны 405 нм по изменению окраски в лунках. Для этого рассчитывали среднее арифметическое значение в лунках с отрицательным контрольным образцом - ОПср(К-). Результат анализа считали положительным, если ОПобр≥ОПср(К-)×2. Результат анализа считали отрицательным, если ОПобр<ОПср(К-)×2 (ОПобр - оптическая плотность в лунке с анализируемым образцом).
При исследовании токсигенных изолятов V. cholerae cholerae 569 В, М-41, V. cholerae eltor Р-3122, М-1509, М-879, М-1298, М-1328, Р-18899 методом ИФА с применением заявленного набора во всех случаях получен положительный ответ, что указывает на наличие у данных штаммов холерного токсина. Тогда как, при изучении нетоксигенных культур V. cholerae eltor КМ-26, М-1262 и Е. coli O157 зарегистрирован отрицательный результат, что подтверждает отсутствие у данных штаммов холерного токсина. Результаты определения продукции XT штаммами V. cholerae в «сэндвич »-варианте иммуноферментного анализа с применением моноклональных антител приведены в таблице 1.
Таким образом, заявляемый способ обеспечивает определение продукции XT штаммами V. cholerae классического и эльтор биоваров.
Пример 2. Определение XT в клиническом материале. (Модельный эксперимент)
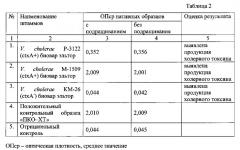
Исследовали пробы испражнений, искусственно контаминированные токсигенными штаммами V. cholerae Р-3122 (эльтор биовар) и М-1509 (биовар эльтор) в концентрации от 1×109 до 1×104 м.к./мл. Штаммы предварительно подращивали в среде AKI для индукции у них XT (имитация продукции XT вибрионами в условиях in vivo). Также готовили пробы испражнений, содержащие нетоксигенную культуру V. cholerae КМ-26.
В пробирки вносили 1 г фекалий и добавляли 0,1 мл культуральной жидкости после вторичного подращивания штаммов V.cholerae Р-3122, М-1509 и КМ-26 в концентрации от 1×109 до 1×104 м.к./мл. К подготовленным пробам добавляли 10 мл 0,9% раствора натрия хлористого и тщательно перемешивали, отстаивали в течение 10-15 мин для оседания крупных частиц. Отбирали надосадочную жидкость и разводили в 10 раз и сразу вносили по 100 мкл в лунки сенсибилизированного планшета, а также засевали по 100 мкл в стеклянную пробирку с 10 мл среды AKI для первичного подращивания, после чего подготовку исследуемого образца выполняют, как описано в примере 1.
ИФА проводили согласно примеру 1. Показано, что во всех случаях положительный ответ в ИФА выявлен только в пробах, содержащих токсигенные штаммы V. cholerae вне зависимости от их концентрации и принадлежности к классическому или эльтор биоварам. На результаты анализа не влияло дополнительное обогащение образцов в среде AKI, что указывает на возможность использования ИФА для исследования нативных проб испражнений на наличие XT. Результаты определения продукции XT в клиническом материале в «сэндвич »-варианте иммуноферментного анализа с применением моноклональных антител отражены в таблице 2.
Заявляемый набор скомпонован таким образом, что позволяет провести исследование как на минимальном количестве стрипов - 3, так и на планшете целиком - 12.
Пример 3. Определение наличия XT у штаммов холерных вибрионов с помощью заявленного набора на 6 стрипах.
Подготовку пробирок для индукции XT у штаммов холерных вибрионов проводили, как указано выше, используя для вторичного подращивания центрифужные пробирки объемом 15 мл.
Материалом для исследования служили 23 штамма холерных вибрионов, из них: 2 - токсигенные V. cholerae классического биовара, 10 - токсигенные V. cholerae биовара эльтор, 7 - нетоксигенные V. cholerae биовара эльтор, 1 штамм - V. cholerae O139 (ctx А+), 1 штамм - V. cholerae O139 (ctx А-), 1 штамм - V.cholerae не O1 не 0139 (ctx А+), 1 штамм - V.cholerae не O1 не O139 (ctx А-). Все культуры получены из Государственной коллекции патогенных бактерий ФКУЗ РосНИПЧИ "Микроб". Штаммы холерных вибрионов выращивали способом, описанном в примере 1. Предварительное культивирование исследуемых культур, сенсибилизацию, блокировку планшета для проведения ИФА проводили согласно описанию выше.
Внесение исследуемых образцов, инкубацию, промывку планшета выполняют, как описано в примере 1.
Подготовку рабочих растворов конъюгата и субстратной смеси на 6 стрипов осуществляют ex tempore. Полученные растворы не хранят.
Рабочий раствор конъюгата: 2 пробирки с раствором лактальбумина объединяют и добавляют 0,6 мл раствора Tween-20 и тщательно перемешивают. Непосредственно перед внесением в лунки в подготовленный раствор добавляют 0,04 мл концентрированного раствора конъюгата и еще раз тщательно перемешивают.
Рабочий раствор субстратной смеси: субстратную смесь готовят сразу перед внесением в лунки. Для этого 2 пробирки с лимонной кислотой вносят в полном объеме содержимое объединенных 2 пробирок, содержащих натрия цитрата, добавляют 0,2 мл раствора ABTS и 0,008 мл раствора гидроперита.
Дальнейшие этапы анализа проводили как описано в примере 1.
При исследовании токсигенных изолятов методом ИФА с применением заявленного набора во всех случаях получен положительный ответ, что указывает на наличие у данных штаммов холерного токсина. При изучении нетоксигенных культур зарегистрирован отрицательный результат, что подтверждает отсутствие у данных штаммов холерного токсина. Результаты определения продукции XT штаммами V. cholerae в «сэндвич»-варианте иммуноферментного анализа с применением моноклональных антител представлены в таблице 3.
Таким образом, заявляемый способ обеспечивает определение продукции холерного токсина штаммами V. cholerae классического и эльтор биоваров, а также в клиническом материале.
Литература
1. Патент RU 2332460. Способ выявления эпидемически значимых холерных вибрионов Vibrio eltor и Vibrio cholerae O139 по их адгезивной способности, опубл. 27.08.2008.
2. Патент RU 2360972. Способ детекции и определения биотипа, серогруппы и токсигенности возбудителя холеры и набор для его осуществления, опубл. 10.07.2009.
3. Баранова Е.В. Разработка иммунохроматографического теста для обнаружения токсигенных штаммов Vibrio cholerae / Е.В. Баранова, П.В.Соловьев, В.В. Агафонова и др. // Актуал. пробл. предупрежд. и ликвид. последствий чрезвыч. ситуаций в области сан.-эпид. благополучия.
4. Петрова Е.Э. Получение и характеристика моноклональных антител к холерному токсину / Е.Э. Петрова, Р.Л. Комалева, О.Е. Лахтина и др. // Биоорганическая химия. - 2009. - Т. 35, №3. - С. 357-367.
5. Detection of Cholera Toxin: Laboratory Methods for the Diagnosis of Vibrio cholerae Centers for Disease Control and Prevention Laboratory Methods for the Diagnosis of Vibrio cholerae Centers for Disease Control and Prevention. - Atlanta, JA, 1994. - P. 62-88.
6. G. Jonson, J. Holingren, A.M. Svennerholm Analisis of expression of toxin-coregulated pili in classical and eltor V. cholerae O1 in vivo and in vitro // Inf. Immun. - 1992 - V. 0160 №10 - P. 4278-4284.
1. Способ определения продукции холерного токсина и дифференциации эпидемически значимых штаммов холерных вибрионов, включающий подготовку исследуемого образца, выявление холерного токсина методом ИФА, предусматривающего внесение антигенов в лунки планшета, инкубацию и учет результатов, отличающийся тем, что индукцию холерного токсина штаммами холерных вибрионов осуществляют при культивировании первично в стеклянной пробирке в 10 мл бульона AKI при температуре (37±1)°C в течение 2,5 часов и вторично в 5-10 мл бульона AKI в пластиковой пробирке с максимальным наклоном для формирования тонкого слоя жидкой среды при температуре (37±1)°C в течение 14 часов с последующим выявлением холерного токсина «сэндвич»-вариантом иммуноферментного анализа, при котором в лунки планшета сенсибилизированные моноклональными антителами, специфичными к В-субъединице холерного токсина изотипа G2a, вносят исследуемый образец и конъюгат, который представляет собой моноклональные антитела, специфичные к В-субъединице холерного токсина изотипа G1, меченные пероксидазой хрена, и по оптической плотности проводят дифференциацию штаммов, при этом, если величина ОПобр≥ОПср(К-)×2 - штамм продуцирует холерный токсин и относится к токсигенным, а при величине ОПобр<ОПср(К-)×2 - штамм не продуцирует XT и относится к нетоксигенным.
2. Способ по п. 1, отличающийся тем, что исследуемый образец представляет собой штаммы холерных вибрионов или клинический материал от больных.
3. Набор для определения продукции холерного токсина и дифференциации эпидемически значимых штаммов холерных вибрионов, осуществляющий способ по п. 1, представляет собой комплект, содержащий, по крайней мере, один 96-луночный разборный стрипованный планшет с последовательно нанесенными на поверхность лунок моноклональными антителами, специфичными к В-субъединице холерного токсина изотипа G2a и лактальбумина; а также емкости, содержащие навеску среды AKI, конъюгат моноклональных антител, специфичных к В-субъединице холерного токсина изотипа G1 с пероксидазой хрена; реагенты для разведения конъюгата: глицерин, лактальбумин, Tween; реагенты для приготовления субстратной смеси: кислота лимонная, натрий цитрат, 2,2'-azino-bis-(3-ethylbenzthiazoline-6-sulfonic acid), мочевина пероксид; отрицательный контрольный образец, представляющий собой фосфатно-солевой буфер; положительный контрольный образец, представляющий собой лиофолизированный холерный токсин.
4. Набор по п. 3, отличающийся тем, что реагенты для приготовления рабочего раствора конъюгата, субстратной смеси, положительного контрольного образца расфасованы в повторах, что позволяет провести исследование как на минимальном количестве стрипов - 3, так и на планшета целиком - 12.