Быстрый способ клонирования и экспрессии сегментов гена родственной вариабельной области антитела
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан способ получения антитела, включающий выделение антитела из среды культивирования эукариотической клетки, содержащей нуклеиновую кислоту, кодирующую антитело, причем нуклеиновую кислоту, кодирующую антитело, получают путем амплификации нуклеиновых кислот, кодирующих родственный вариабельный домен, используя в качестве матрицы в полимеразной цепной реакции (ПЦР) одноцепочечные кДНК, полученные из РНК антитело-секретирующей В-клетки, и вставки нуклеиновых кислот, кодирующих вариабельный домен, в эукариотическую экспрессионную плазмиду путем безлигазного клонирования, в котором для вставки используют пул нуклеиновых кислот, кодирующих вариабельный домен соответственно легкой и тяжелой цепей антитела, где В-клетка является отдельной единичной В-клеткой, и где В-клетка и ее потомство за 7 дней их совместного культивирования с питающими клетками, начиная с одной клетки, производят более 20 нг/мл антител выделения сегментов нуклеиновых кислот, кодирующих вариабельные домены антител, и введение выделенных сегментов нуклеиновых кислот в эукариотические экспрессионные плазмиды осуществляется без промежуточного выделения и анализа клональных промежуточных плазмид. Таким образом, в способе согласно изобретению не требуется промежуточное клонирование, выделение и анализ промежуточных плазмид. 7 з.п. ф-лы, 3 табл., 4 пр.
Реферат
В изобретении предлагается способ выделения (клонирования, экспрессии и отбора) антитела, начиная с единичных В-клеток, продуцирующих антитела, в котором все отдельные стадии способа выполняют в растворе, позволяющем провести идентификацию антител с заданной специфичностью.
Предшествующий уровень техники
Для получения клеток, секретирующих моноклональные антитела, широко используется гибридомная технология, разработанная Келером и Мильштейном. Однако в гибридомной технологии только фракция В-клеток, полученных из иммунизированного экспериментального животного, может быть подвергнута слиянию и размножению. Источником В-клеток является, как правило, такой орган иммунизированного экспериментального животного, как селезенка.
В 1984 году Zubler и соавт. начали разработку другого подхода для получения клеток, секретирующих моноклональные антитела (см., например, Eur. J. Immunol. 14 (1984) 357-363, J. Exp. Med. 160 (1984) 1170-1183). В нем В-клетки получают из крови иммунизированного экспериментального животного и культивируют совместно с питающими клетками мышей EL-4 В5 в присутствии цитокина и питательной смеси. С помощью этой методики через 10-12 дней совместного культивирования может быть получено до 50 нг/мл антител.
Weitkamp J.-H. и соавт. (J. Immunol. Meth. 275 (2003) 223-237) описывают получение рекомбинантных человеческих моноклональных антител к ротавирусу из единичных антиген-специфических В-клеток, отобранных с помощью флуоресцентных вирусоподобных частиц. В патенте US 2006/0051348 излагается способ получения множества изолированных антител ко многим родственный антигенам. В патентах WO 2008/144763 и WO 2008/045140 сообщается об антителах к IL-6 и их применении и о способе культивирования с целью получения клональной популяции антиген-специфических В-клеток, соответственно. В патенте US 2007/0269868 описывается способ культивирования с целью получения клональной популяции антиген-специфических В-клеток. Masri и соавт. (в Mol. Immunol. 44 (2007) 2101-2106) сообщают о клонировании и экспрессии в E.coli функционального Fab-фрагмента, полученного из единичного человеческого лимфоцита против токсина сибирской язвы. В патенте WO 2007/031550 сообщается о способе производства иммуноглобулиновой библиотеки.
В патенте WO 2010/056898 описывается быстрая экспрессия и клонирование человеческих моноклональных антител из В-клеток памяти. Jin и соавт.(Jin, A., et al., Nature Medicine 15 (2009) 1088-1093) сообщают о быстром и эффективном способе манипуляции единичными клетками с целью скрининга антиген-специфических антителопродуцирующих клеток из периферической крови человека. Lightwood и соавт. (Lightwood D.J. et al. J. Immunol. Meth. 316 (2006) 133-143) описывают получение антител методом пэннинга В-клеток на антигене с последующим культивированием in situ и проведением прямой ПЦР с обратной транскрипцией (RT-PCR) клеток, полученных в массовом порядке из антиген-позитивных лунок.
Краткое описание изобретения
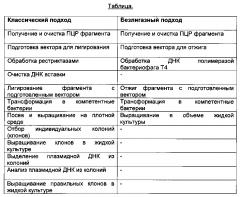
В способе по настоящему изобретению выделение фрагментов нуклеиновых кислот или сегментов, кодирующих вариабельные домены антител (легкой и тяжелой цепей), и вставка изолированных фрагментов нуклеиновых кислот или сегментов в эукариотические кассеты экспрессии (одна кассета для каждой из легких и тяжелых цепей, соответственно) осуществляется без промежуточного выделения и анализа клональных промежуточных плазмид/кассет. Следовательно, в способе согласно данному изобретению, не требуется промежуточное клонирование, выделение и анализ промежуточных плазмид/кассет, например, путем анализа изолированных трансформированных клеток E.coli, что приводит, таким образом, к более быстрому способу.
Один из аспектов настоящего изобретения представляет собой способ выделения нуклеиновых кислот, кодирующих родственные вариабельные домены антитела, включающий следующие стадии:
- синтез одноцепочечных кДНК с использованием РНК, полученной из антитело-секретирующей В-клетки в качестве матрицы в ПЦР с обратной транскрипцией,
- амплификация нуклеиновых кислот, кодирующих вариабельный домен, при помощи ПЦР и тем самым выделение фрагментов нуклеиновой кислоты, кодирующей родственные вариабельные домены антитела,
причем ПЦР-праймер удаляют после проведения ПЦР.
В одном воплощении изобретения способ выполняют без выделения и анализа промежуточных нуклеиновых кислот.
Один из аспектов настоящего изобретения представляет собой способ получения антитела, включающий следующие стадии:
- культивирование эукариотической клетки, содержащей нуклеиновую кислоту, кодирующую антитело, и
- выделение антитела из клетки или среды культивирования,
причем нуклеиновую кислоту, кодирующую антитело, получают путем
- синтеза одноцепочечных кДНК с использованием РНК, полученной из антитело-секретирующий В-клетки, в качестве матрицы в ПЦР с обратной транскрипцией,
- амплификации путем ПЦР нуклеиновой кислоты (кислот), кодирующей(их) вариабельный домен, и
- вставки нуклеиновой кислоты (кислот), кодирующей(их) вариабельный домен, в одну или несколько эукариотических экспрессионных плазмид. В одном воплощении изобретения ПЦР-праймер удаляют после проведения ПЦР.
В одном воплощении изобретения способ выполняется без выделения и анализа промежуточных нуклеиновых кислот.
Один из аспектов настоящего изобретения представляет собой способ получения антитела, включающий следующие стадии:
- культивирование эукариотических клеток, трансфецированных одной или более экспрессионных плазмид, кодирующих тяжелые и легкие цепи антитела, причем одна или более экспрессионных плазмид приготовляют из пула клеток E.coli, трансформированных этими плазмидами.
- выделение антитела из клетки или среды культивирования.
Одним из аспектов изобретения является способ получения антитела, включающий следующую стадию:
- выделение антитела из среды культивирования эукариотической клетки, содержащей нуклеиновую кислоту, кодирующую антитело,
причем нуклеиновую кислоту, кодирующую антитело, получают путем
- амплификации нуклеиновых кислот, кодирующих родственный вариабельный домен, с использованием в качестве матрицы в ПЦР одноцепочечной кДНК, полученной из РНК антитело-секретирующей В-клетки, и
- вставки нуклеиновых кислот, кодирующих вариабельный домен, в эукариотическую экспрессионную плазмиду путем безлигазного клонирования,
причем для вставки используют пул нуклеиновых кислот, кодирующих вариабельный домен, соответственно, легкой и тяжелой цепей антитела.
В одном воплощении изобретения способ включает в качестве первой стадии:
- синтез одноцепочечных кДНК с использованием в качестве матрицы РНК, полученной из антитело-секретирующей В-клетки.
В этом воплощении изобретения ПЦР-праймер удаляют после ПЦР.
В этом воплощении изобретения способ выполняется без выделения и анализа промежуточных нуклеиновых кислот.
Одним из аспектов изобретения является способ получения антитела, включающий следующие стадии:
- культивирование эукариотических клеток, трансфецированных экспрессионной плазмидой, кодирующей антитело, причем эту эукариотическую клетку трансфецируют пулом экспрессионных плазмид, который был подготовлен из пула клеток E.coli, трансформированных этими плазмидами.
- выделение антитела из клетки или среды культивирования.
В одном воплощении изобретения нуклеиновую кислоту, кодирующую антитело, получают путем
- амплификации нуклеиновых кислот, кодирующих родственный вариабельный домен, с использованием в качестве матрицы в ПЦР одноцепочечных кДНК, полученных из РНК антитело-секретирующей В-клетки, и
- вставки нуклеиновых кислот, кодирующих вариабельный домен, в эукариотическую экспрессионную плазмиду путем безлигазного клонирования.
В одном воплощении изобретения способ включает в качестве первой стадии:
- синтез одноцепочечных кДНК с использованием РНК, полученной
из антитело-секретирующей В-клетки в качестве матрицы.
В одном воплощении изобретения ПЦР-праймер удаляют после ПЦР.
В одном воплощении изобретения способ выполняется без выделения и анализа промежуточных нуклеиновых кислот.
В одном воплощения изобретения, во всех его аспектах В-клетка представляет собой В-клетку кролика.
В одном воплощения изобретения, во всех его аспектах В-клетка представляет собой отдельную единичную В-клетку.
В одном воплощения изобретения, во всех его аспектах В-клетку культивируют в течение 7 дней.
В одном воплощения изобретения, во всех его аспектах В-клетка и ее потомки производят более 20 нг/мл антитела за 7 дней совместного культивирования с питающими клетками, начиная с единичной клетки.
В одном воплощения изобретения, во всех его аспектах ПЦР-праймер имеет нуклеотидные последовательности SEQ ID NO: 5 и SEQ ID NO: 6 или SEQ ID NO: 7 или SEQ ID NO: 8.
В одном воплощения изобретения, во всех его аспектах фрагменты нуклеиновой кислоты вводят в экспрессирующую плазмиду путем сиквенс-независимого безлигазного клонирования (SLIC).
В одном воплощения изобретения, во всех его аспектах для реакции вставки используют примерно 300 нг нуклеиновой кислоты.
В одном воплощения изобретения, во всех его аспектах для вставки используют пул нуклеиновых кислот.
В одном воплощения изобретения, во всех его аспектах экспрессионную плазмиду получают путем сиквенс-независимого безлигазного клонирования (SLIC) нуклеиновой кислоты, кодирующей вариабельный домен, в аплифицированную экспрессионную плазмиду, не содержащую вариабельный домен.
В одном воплощения изобретения, во всех его аспектах плазмиду линеаризуют перед амплификацией.
Подробное описание изобретения
ОПРЕДЕЛЕНИЯ.
Термин "аффинность" относится к силе общей суммы нековалентных взаимодействий между одним сайтом связывания какой-либо молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). Если не указано иное, используемый здесь термин "аффинность связывания" относится к истинной аффинности связывания, которая отражает взаимодействие между членами пары связывания (например, антителом и антигеном), находящимися в соотношении 1:1. Аффинность молекулы X по отношению к ее партнеру Y в общем случае может быть представлена константой диссоциации (Ко). Аффинность можно измерить с помощью обычных методов, известных в данной области, в том числе тех, которые описаны в настоящем изобретении. Конкретные наглядные примеры и воплощения изобретения, иллюстрирующие измерение аффинности связывания, приведены ниже.
Термин "аминокислота" в том значении, в каком он используется в данном изобретении, означает группу карбокси а-аминокислот, которые непосрественно или в форме предшественника могут кодироваться нуклеиновой кислотой. Индивидуальные аминокислоты кодируются нуклеиновыми кислотами, состоящими из трех нуклеотидов, так называемых кодонов или троек нуклеотидных остатков. Каждая аминокислота кодируется, по крайней мере, одним кодоном. Кодирование одной и той же аминокислоты разными кодонами известно как "вырождение генетического кода". Термин "аминокислота" в том значении, в каком он используется в данном изобретении, означает природные карбокси α-аминокислоты и содержит аланин (в трехбуквенном коде: ala, в однобуквенном коде: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновую кислоту (asp, D), цистеин (cys, С), глютамин (gin, Q), глютаминовую кислоту (glu, Е), глицин (gly, G), гистидин (his, Н), изолейцин (ile, I), лейцин (leu, L), лизин (lys, К), метионин (met, М), фенилаланин (phe, F), пролин (pro, Р), серии (ser, S), треонин (thr, Т), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V).
Термин "антитело" используется в данном описании в самом широком смысле и охватывает антитела с различной структурой, в том числе, без ограничений, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, проявляющие заданную антиген-связывающую активность.
Термин "фрагмент антитела" относится к отличной от интактного антитела молекуле, которая содержит часть интактного антитела, связывающую тот антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают, без ограничений, Fv, Fab, Fabʹ, Fabʹ-SH, F(abʹ)2; диатела; линейные антитела; одноцепочечные молекулы антител (например, scFv); одиночные домены антител и мультиспецифические антитела, образованные из фрагментов антител.
Термин "класс" антитела относится к типу константного домена или константной области, которыми обладает его тяжелая цепь. Например, существует пять основных классов антител человека: IgA, IgD, IgE, IgG и IgM, причем некоторые из них могут быть разделены на подклассы (изотипы), например, lgG1, lgG2, lgG3 lgG4, lgA1 и lgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ, соответственно.
Термин "родственная пара вариабельных доменов антитела" обозначает пару вариабельных доменов антитела, получаемых из единичной антитело-секретирующей В-клетки; то есть, таких, которые были произведены в виде пары в процессе иммунного ответа у млекопитающего вследствие его контакта с иммуногенной молекулой или таких, которые были собраны случайно при использовании подхода фагового дисплея.
Термин "эффективное количество" агента, например, фармацевтического препарата, относится к такому его количеству, которое способно в применямой дозировке и в течение необходимых периодов времени достичь желаемого терапевтического или профилактического результата.
Термин "экспрессия", в значении, используемом в настоящем изобретении, относится к процессам транскрипции и/или трансляции и секреции, происходящим в клетке. Уровень транскрипции последовательности целевой нуклеиновой кислоты в клетке может быть определен на основе соответствующего количества мРНК, присутствующей в клетке. Например, мРНК, которая транскрибировалась с целевой последовательности, может быть количественно определена путем количественной ПЦР или ПЦР с обратной транскрипцией или при помощи нозерн-блот-гибридизации (см. Sambrook et al. Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)). Полипептиды, кодируемые нуклеиновой кислотой, могут быть количественно определены с помощью различных методов, например, при помощи ИФА, путем анализа биологической активности полипептида или с использованием методов, не зависящих от такой активности; таких как вестерн-блоттинг или радиоиммунный анализ с применением иммуноглобулинов, распознающих полипептид и связывающихся с ним (см. Sambrook et al., (1989) выше).
Термин "экспрессионная кассета" означает конструкт, содержащий регуляторные элементы, такие как промотор и сайт полиаденилирования, необходимые для экспрессии, по меньшей мере, нуклеиновой кислоты, содержащейся в клетке.
Термин "механизмы экспрессии" обозначает сумму ферментов, кофакторов и т.д. клетки, которые участвуют на разных этапах экспрессии генов, начиная с этапа транскрипции нуклеиновой кислоты или гена (т.е. известны также под названием "механизмы экспрессии генов") до этапа посттрансляционной модификации полипептида, кодируемого нуклеиновой кислотой. Механизмы экспрессии включают, например, этапы транскрипции ДНК в пре-мРНК, сплайсинга пре-мРНК в зрелую мРНК, трансляции мРНК в полипептид и посттрансляционной модификации полипептида.
"Экспрессионная плазмида" представляет собой нуклеиновую кислоту, обеспечивающую все необходимые элементы для экспрессии структурного гена (генов), содержащегося (содержащихся) в клетке-хозяине. Как правило, это экспрессионная плазмида содержит прокариотической устройство для размножения плазмиды (например, E.coli содержит сайт инициации репликации и селективный маркер), эукариотической селективный маркер и одну или несколько экспрессионных кассет для экспрессии целевого структурного гена (ов), каждая из которых содержит промотор, структурный ген и терминатор транскрипции, включающий сигнал полиаденилирования. Экспрессия гена, как правило, происходит под контролем промотора, поэтому такой структурный ген называется "функционально связанным с промотором". Аналогично, регулирующий элемент и кор-промотор являются функционально связанными, если регулирующий элемент модулирует активность кор-промотора.
Термины "клетка-хозяин", "линия клетки-хозяина" и "культура клетки-хозяина" используются взаимозаменяемо и относятся к клеткам, включая потомство таких клеток, в которые была введена экзогенная нуклеиновая кислота. Клетки-хозяева включают "трансформанты" или "трансфектанты", а также "трансформированные клетки" и "трансфецированные клетки", которые включают первично трансформированную клетку и полученное из нее потомство, независимо от количества пассажей. Потомство может содержать мутации, а не быть полностью идентично родительской клетке по содержанию нуклеиновых кислот. В настоящем изобретении упоминается то мутантное потомство, которое имеет ту же функцию или биологическую активность, что и клетка, выбранная путем скрининга или селекции, в качестве первоначально трансформированной клетки.
Термин "клетка" включает как прокариотические клетки, которые используются для размножения плазмид, так и эукариотические клетки, которые используются для экспрессии нуклеиновой кислоты. В одном воплощении изобретения эукариотическая клетка является клеткой млекопитающего. В одном воплощении изобретения клетку млекопитающего выбирают из группы клеток млекопитающих, содержащих клетки яичников китайского хомячка (СНО) (например, СНО K1, СНО DG44), клетки почек новорожденного хомячка ВНК, клетки миеломы мыши (NS0), клетки мышиной миеломы (Sp2/0), человеческие эмбриональные клетки почек (НЕК 293), человеческие эмбриональные клетки почек с ядерным антигеном EBNA (НЕК 293 EBNA), клетки человека линии PER.C6 ® и клетки африканской зеленой мартышки (COS).
Термин "антитело человека", представляет собой антитело, которое обладает аминокислотной последовательностью, соответствующей антителу, продуцируемому человеком или клеткой человека или полученному из не являющимся человеком источника, в котором используется набор антител человека или других последовательностей, кодирующих антитела человека. Это определение антитела человека специфически исключает гуманизированное антитело, содержащее антигенсвязывающие аминокислотные остатки, не принадлежащие человеку.
"Особь" или "субъект" предствляет собой позвоночное животное. В одном воплощении изобретения позвоночное животное является млекопитающим. Млекопитающие включают, без ограничений, домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и таких приматов, как обезьяны), кроликов и грызунов (например, мышей и крыс). В некоторых воплощениях изобретения, особью или субъектом является человек. В других воплощениях изобретения особью или субъектом является кролик.
Термин "функционально связанный" относится к смежному положению двух или более компонентов, которые находятся в отношениях, позволяющих этим компонентам функционировать присущим им способом. Например, промотер и/или энхансер являются функционально связанными в кодирующую последовательность, если оба находятся в цис-положении и контролируют или модулируют транскрипцию связанной с ними последовательности. В общем случае, но не обязательно, ДНК последовательности, которые являются "функционально связанными", представляют собой две соприкасающиеся, а если необходимо, то и соединенные связями кодирующие белок области, такие как секреторный лидер и полипептид, смежный с рамкой считывания и включенный в нее. Однако, хотя функционально связанный промотор, как правило, расположен выше кодирующей последовательности, он не является обязательно смежным с ней. Энхансеры не должны быть смежными. Энхансер функционально связан с кодирующей последовательностью в том случае, если он увеличивает транскрипцию кодирующей последовательности. Функционально связанные энхансеры могут быть расположены выше, в пределах или ниже кодирующих последовательностей и на значительном расстоянии от промотора. Сайт полиаденилирования функционально связан с кодирующей последовательностью в том случае, если он расположен на выходном конце кодирующей последовательности таким образом, что транскрипция идет вдоль кодирующей последовательности в направлении сиквенса полиаденилирования. Трансляционный стоп-кодон является функционально связанным с экзонной нуклеотидной последовательностью, если он находится на нижерасположенном конце кодирующей последовательности (то есть, 3ʹ-конце) таким образом, что трансляция осуществляется вдоль кодирующей последовательности по направлению к стоп-кодону и заканчивается на нем. Связывание осуществляют при помощи методов рекомбинации, известных их уровня техники, например, при помощи ПЦР методологии и/или при помощи лигирования по месту подходящих сайтов рестрикции. Если подходящих сайтов рестрикции не существует, то используют синтетические олигонуклеотидные адапторы или линкеры в соответствии с общепринятой практикой.
Термин "пептидный линкер" обозначает аминокислотные последовательности природного и/или синтетического происхождения. Они состоят из линейной аминокислотной цепи, в которой мономерными строительными блоками являются 20 природных аминокислот. Пептидный линкер имеет длину от 1 до 50 аминокислот, в одном воплощении изобретения от 1 до 28 аминокислот, в еще одном воплощении изобретения от 2 до 25 аминокислот. Пептидный линкер может содержать повторяющиеся аминокислотные последовательности или последовательности природных полипептидов. Функция линкера состоит в том, чтобы способствуя правильному сворачиванию и надлежащей структуре полипептидов, сопряженных друг с другом, обеспечивать осуществление биологической активности этих полипептидов. В одном воплощении изобретения пептидный линкер богат аминокислотными остатками глицина, глутамина, и/или серина. Эти остатки организованы, например, в небольшие повторяющиеся последовательности длиной до пяти аминокислот, такие как GS (SEQ ID NO: 1), GGS (SEQ ID NO: 2), GGGS (SEQ ID NO: 3), и GGGGS (SEQ ID NO: 4). Такая малая повторяющаяся последовательность может повторяться от одного до пяти раз. На амино- и/или карбокси-концевом участках такой мультимерной последовательности могут быть добавлены до шести любых дополнительных природных аминокислот. Другие синтетические пептидные линкеры состоят из одной аминокислоты, которая повторяется от 10 до 20 раз и могут содержать в амино- и/или карбокси-концевом участке до шести любых дополнительных природных аминокислот. Все пептидные линкеры могут кодироваться молекулой нуклеиновой кислоты, и, следовательно, могут быть рекомбинантно экспрессированы. Поскольку сами линкерные пептиды являются полипептидами, то полипептид, соединенный с линкером, присоединяется к последнему посредством пептидной связи, образованной двумя аминокислотами.
"Процент (%) идентичности аминокислотной последовательности" по отношению к последовательности эталонного полипептида определяется как процент аминокислотных остатков в исследуемой последовательности, которые идентичны аминокислотным остаткам в последовательности эталонного полипептида, после выравнивания последовательностей и введения, при необходимости, гэпов с целью достижения максимального процента идентичности последовательностей и без учета любых консервативных замен как части идентичности последовательности. Выравнивание в целях определения процента идентичности аминокислотных последовательностей может быть достигнуто различными способами, которые известны специалистам в данной области техники, например, с использованием общедоступного программного обеспечения, такого как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить соответствующие параметры для выравнивания последовательностей, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего изобретения значения процента идентичности аминокислотной последовательности генерируются с использованием компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа сравнения последовательностей ALIGN-2 разработана Genentech, Inc, и ее исходный код зарегистрирован в U.S. Copyright Office, Washington D.C., 20559 под номером U.S. Copyright Registration No. TXU510087. Программа ALIGN-2 находится в открытом доступе в компании Genentech, Inc. (South San Francisco, California) или может быть скомпилирована из исходного кода. С целью использования программы ALIGN-2, ее компилируют на операционной системе UNIX, в том числе цифровой UNIX V4.0D. Все параметры сравнения последовательностей установлены самой программой ALIGN-2 и не изменяются.
В ситуациях, когда ALIGN-2 используется для сравнения аминокислотной последовательности, % идентичности аминокислотной последовательности для данной аминокислотной последовательности А по сравнению с или против данной аминокислотной последовательности В (которая альтернативно может быть выражена как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности по сравнению с или против данной аминокислотной последовательности В) рассчитывают следующим образом:
где X обозначает число аминокислотных остатков, оцененных как идентичные совпадения программой выравнивания последовательностей ALIGN-2 в программном выравнивании последовательностей А и В, и где Y представляет общее количество аминокислотных остатков в последовательности В. Следует понимать, что там, где длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, % идентичности аминокислотной последовательности А по отношению к последовательности В не будет равен % идентичности аминокислотной последовательности В по отношению к последовательности А. Если специально не указано иное, все значения % идентичности аминокислотной последовательности, используемые в настоящем изобретении, получены, как описано в предыдущем параграфе, с использованием компьютерной программы ALIGN-2.
Термин "полипептид" представляет собой полимер, состоящий из аминокислот, соединенных пептидными связями, и производящийся природным путем или синтетически. Полипептиды, содержащие менее чем примерно 25 аминокислотных остатков, могут упоминаться как "пептиды", тогда как молекулы, состоящие из двух или более полипептидов или содержащие один полипептид, имеющий более 100 аминокислотных остатков, могут относиться к "белкам". Полипептид может также содержать компоненты, не принадлежащие к аминокислотам, такие как углеводные группы, ионы металлов или эфиры карбоновых кислот. Компоненты, не являющиеся аминокислотами, могут быть добавлены из клетки, в которой экспрессируется полипептид, и могут меняться в зависимости от типа этой клетки. В настоящем изобретении полипептиды определяют в терминах структуры их основной аминокислотной цепи или кодирующей ее нуклеиновой кислоты. Добавочные группы, такие как углеводные группы, как правило, не указываются, но, тем не менее, могут присутствовать.
Термин "структурный ген" обозначает участок гена без сигнальной последовательности, т.е. кодирующей области.
Термин "вариабельный участок" или "вариабельный домен" относится к домену антитела тяжелой или легкой цепей, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой и легкой цепей (VH и VL соответственно) нативного антитела, как правило, имеют аналогичные структуры, при этом каждый домен содержит четыре консервативные каркасные области (FR) и три гипервариабельные области (HVRs). (См., например, Kindt T.J. et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., N.Y. (2007), page 91) Одного VH или VL домена может быть достаточно для того, чтобы придать антигенсвязывающую специфичность. Кроме того, антитела, которые связываются со специфическим антигеном, могут быть выделены с помощью VH или VL домена из множества антител, связанных с этим антигеном, с целью скрининга библиотеки дополнительных VL или VH доменов, соответственно (см., например, Portolano S. et al. J. Immunol. 150 (1993) 880-887; Clackson Т. et al. Nature 352 (1991) 624-628).
Термин "вариант" означает варианты родительской аминокислотной последовательности, которые содержат одну или более аминокислотную замену, вставку или делецию.
Термин "вектор" означает молекулу нуклеиновой кислоты, способную размножать другую нуклеиновую кислоту, с которой она связана. Этот термин включает вектор как самореплицирующуюся нуклеиновую структуру, а также вектор, включенный в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны направлять экспрессию нуклеиновых кислот, с которыми они функционально связаны. В контексте данного изобретения такие векторы называют "векторы экспрессии".
ОСНОВНЫЕ СТАДИИ СПОСОБА СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ.
Иммунизация
Для оценки лечебных подходов на основе антител часто в качестве животной модели используют животных, не являющихся человеком, таких как мыши, кролики, хомячки и крысы. Также возможно использовать В-клетки человека, перенесщего определенную болезнь, страдающего от хронического заболевания или недавно вакцинированного против определенной болезни.
В способе согласно настоящему изобретению могут быть использованы В-клетки, полученные, например, от мыши, крысы, хомяка, кролика, овцы, ламы или человека. В одном воплощении изобретения мышь представляет собой мышей линий NMRI или BALB/c. В другом воплощении изобретения хомячков выбирают из серых (Cricetulus migratorius), китайских (Cricetulus griseus) и сирийских хомячков (Mesocricetulus auratus). В конкретном воплощении изобретения хомячок является серым хомячком. В одном воплощении изобретения кролика выбирают из кроликов породы новозеландский белый (NZW), ZIKA-гибридный (ZIKA), мутантный Alicia (Alicia-mutant), мутантный Basilea (Basilea), трансгенный кролик с локусом человеческого иммуноглобулина, кролик нокаутный по иммуноглобулину IgM, а также полученных от их скрещивания.
В одном воплощении изобретения выбрают для иммунизации экспериментальных животных, например мышей, хомячков, крыс и кроликов, не старше 12 недель.
Источники и выделение В-клеток
Кровь экспериментального животного или человека обеспечивает большое разнообразие антитело-продуцирующих В-клеток. Полученные из нее В-клетки секретируют антитела, которые почти не имеют идентичных или перекрывающихся аминокислотных последовательностней в пределах гипервариабельных участков, показывая, таким образом, большое разнообразие.
В одном воплощении изобретения В-клетки из экспериментального животного или человека, например, из крови, получают от 4 дней после иммунизации, по крайней мере, до 9 дней после иммунизации или в наиболее ранний срок после повторной иммунизации. Этот промежуток времени обеспечивает высокую гибкость способу по настоящему изобретению. При таком временном промежутке высока вероятность, что В-клетки, продуцирующие наиболее аффинные антитела, мигрируют из селезенки в кровь (см., например, Paus D. et al. JEM 203 (2006) 1081-1091; Smith K.G.S. et al. The EMBO J. 16 (1997) 2996-3006; Wrammert J. et al. Nature 453 (2008) 667-672).
В-клетки из крови экспериментальных животных или человека, могут быть получены любым способом, известным специалисту в данной области. Например, может быть использовано центрифугирование в градиенте плотности или лизис эритроцитов. Центрифугирование в градиенте плотности по сравнению с лизисом обеспечивает более высокий общий выход, т.е. количество клонов В-клеток. Кроме того, из клеток, полученных путем центрифугирования в градиенте плотности большее число клеток делится и растет на стадии сокультивирования. Концентрации секретируемых также антител выше по сравнению с клетками, полученными с другим способом. Таким образом, в одном воплощении изобретения получение В-клеток производится путем центрифугирования в градиенте плотности.
Выделение мРНК, клонирование и сиквенирование
Суммарная мРНК может быть выделена из В-клеток и транскрибирована в кДНК. Нуклеиновые кислоты, кодирующие родственные VH- и VL-области могут быть амплифицированы со специфическим праймером. С помощью способа по настоящему изобретению практически исключено получение идентичных последовательностей. Таким образом, способ обеспечивает высокое разнообразие антител, связывающихся с одним и тем же антигеном.
В одном воплощении изобретения способ по настоящему изобретению предназначен для получения антитела, включая родственные вариабельные домены антител. В одном воплощении изобретения родственные вариабельные домены антител получают из одной В-клетки.
Для амплификации VH-кодирующей нуклеиновой кислоты, полученной из В-клеток мыши линии NMRI, серого хомячка, мыши линии BALB/c, сирийского хомячка, кролика, крысы, овцы, ламы, и человека могут быть предусмотрены праймеры.
Один из аспектов настоящего изобретения относится к способу получения антитела, включающему следующие стадии:
а) сохранение единичных (зрелых) В-клеток (полученных из крови или лимфатического органа экспериментального животного или человека) из окрашенной популяции В-клеток (в одном воплощении изобретения В-клетки окрашивали флуоресцентными красителями в соотношении один к трем или два к трем) в отдельных контейнерах (в одном воплощении изобретения такой контейнер представляет собой лунку многолуночного планшета),
б) культивирование отдельных единичных В-клеток в присутствии питающих клеток и питательной смеси (в одном воплощении изобретения питающими клетками являются клетки EL-4 В5, в одном воплощении изобретения питательной смесью является культуральный супернатант тимоцитов (TSN, супернатант из клеточной культуры тимоцитов экспериментального животного того же вида, из которого получают В-клетки), в еще одном воплощении изобретения питательная смесь представляет собой синтетическую питательную смесь),
в) определение аминокислотной последовательности вариабельных доменов легкой и тяжелой цепи, специфически связывающихся с антителом, при помощи ПЦР с обратной транскрипцией (RT-PCR) и секвенирование нуклеотидной последовательности, и, тем самым, получение нуклеиновой кислоты, кодирующей вариабельный домен легкой и тяжелой цепи моноклонального антитела,
г) культивирование клетки, содержащей нуклеиновую кислоту, кодирующую вариабельную область легкой и тяжелой цепей, в отдельных НС и LC экспрессионных кассетах и выделение антитела из клетки или супернатанта клеточной культуры и, тем самым получение антитела.
В одном воплощении изобретения способ включает следующие стадии:
а) заготовку популяции (зрелых) В-клеток (полученных из крови или лимфатического органа экспериментального животного или человека),
б) окрашивание этой популяции В-клеток, по крайней мере, одним флуоресцентным красителем (в одном воплощении изобретения флуоресцентными красителями в соотношении один к трем или два к трем),
в) сохранение единичных клеток из окрашенной популяции В-клеток в отдельных контейнерах (в одном воплощении изобретения контейнером является лунка многолуночного планшета),
г) культивирование отдельных единичных В-клеток в присутствии питающих клеток и питательной смеси (в одном воплощении изобретения питающими клетками являются клетки EL-4 В5, в одном воплощении изобретения питательной смесью является культуральный супернатант тимоцитов (TSN, супернатант из клеточной культуры тимоцитов экспериментального животного того же вида, из которого получают В-клетки), в одном воплощении изобретения питательная смесь представляет собой синтетическую питательную смесь),
д) определение специфичности связывания антител, секретируемых в культуре из единичных В-клеток,
е) выделение суммарной РНК из В-клеток, секретирующих антитела с заданной специфичностью связывания,
ж) проведение ПЦР с обратной транскрипцией при помощи выделенных поли(А)+-мРНК и специфичного для вариабельных доменов легкой и тяжелой цепей праймера,
з) определение аминокислотной последовательности вариабельных доменов легкой и тяжелой цепи, специфично связывающихся с антителами,
и) введение нуклеиновых кислот, кодирующих вариабельный домен легкой и тяжелой цепи моноклонального антитела в соответствующ