Изопренсинтаза и кодирующий ее ген, способ получения мономера изопрена
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии. Предложен полинуклеотид, кодирующий белок, обладающий активностью изопренсинтазы. Предложен белок, обладающий активностью изопренсинтазы. Также предложен экспрессирующий вектор, содержащий указанный полинуклеотид или полинуклеотид, кодирующий указанный белок. Предложена клетка-хозяин для получения изопренсинтазы, содержащая указанный вектор. Предложен способ получения белка, обладающего активностью изопренсинтазы, с использованием указанной клетки-хозяина. Предложен способ получения мономера изопрена из диметилаллилдифосфата в присутствии указанного белка или с использованием указанной клетки-хозяина в среде с диметилаллилдифосфатом. Предложен способ получения изопренового полимера, включающий стадию получения мономера изопрена указанным способом. Группа изобретений позволяет повысить продукцию изопрена в несколько раз по сравнению с продукцией изопрена с использованием изопренсинтазы, полученной из пуэрарии волосистой или из тополя. 8 н. и 6 з.п. ф-лы, 4 ил., 33 табл., 16 пр.
Реферат
Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к изопренсинтазе и кодирующему ее гену, и т.п.
Предшествующий уровень техники
[0002] Природный каучук представляет собой очень важное сырье для шинной и каучуковой промышленности. Несмотря на то что в будущем его потребности увеличатся вследствие моторизации в основном в странах с переходной экономикой, нелегкой задачей является увеличение сельскохозяйственных ферм, принимая во внимание обезлесивание и конкуренцию с пальмами, и едва ли ожидается повышение выхода природного каучука. Таким образом, прогнозируют, что баланс спроса и предложения станет напряженным. Синтезированный полиизопрен является доступным в качестве материала вместо природного каучука. Его исходный мономер (изопрен (2-метил-1,3-бутадиен)) в основном получают экстракцией из C5-фракции, получаемой крекингом нефти. Однако в последние годы с использованием установок для крекинга легкой фракции количество получаемого изопрена, как правило, уменьшается, и его поставка вызывает беспокойство. Также в последние годы вследствие того, что изменения цен на нефть оказывает значительное влияние, необходимо разработать систему, в которой изопрен, получаемый из ненефтяных источников, получают при низких затратах для стабильного обеспечения поставки изопренового мономера.
[0003] Касательно такой потребности, был описан способ, в котором мономер изопрена получают с использованием трансформанта, получаемого введением гена изопренсинтазы и соответствующего мутанта, получаемого из выделенных пуэрарии волосистой или тополя, в микроорганизм для ферментативной продукции (см. патентную литературу 1 и 2).
Ссылки на известный уровень техники
Патентная литература
[0004]
Патентная литература 1: JP публикация №2011-505841
Патентная литература 2: JP публикация №2011-518564
Непатентная литература
[0005]
Непатентная литература 1: Kesselmeier J. et al., Journal of Atmospheric Chemistry, vol.33, pp.23-88, 1999.
Непатентная литература 2: Monson R.K. et al., Plant Physiol., vol. 98, pp.117 5-1180, 1992.
Непатентная литература 3: Kuzma J. et al., Plant Physiol., vol. 101, pp.435-440, 1993.
Описание изобретения
Задача, подлежащая решению посредством изобретения
[0006] Однако ферментативная активность изопренсинтазы, описанной в патентной литературе 1 и 2, являлась низкой, и все еще существовали возможности для улучшения продукции изопрена с высокой продуктивностью, когда использовали такие гены изопренсинтазы.
[0007] Настоящее изобретение было создано исходя из указанных выше обстоятельств, и задачей настоящего изобретения является предоставление средств, пригодных для разработки превосходной системы, продуцирующей мономер изопрена.
Средства решения проблемы
[0008] В результате тщательного исследования для решения указанной выше проблемы авторы настоящего изобретения обнаружили, что изопренсинтаза, получаемая из мукуны (Mucuna pruriens), обладает превосходной способностью продуцировать мономер изопрена, и осуществили настоящее изобретение.
[0009] Таким образом, настоящее изобретение составляет следующее.
[1] Полинуклеотид из указанных ниже (a), (b) или (c):
(a) полинуклеотида, содержащего (i) нуклеотидную последовательность, представленную SEQ ID NO: 1, или (ii) нуклеотидную последовательность, состоящую из нуклеотидных остатков в положениях 133-1785 в нуклеотидной последовательности, представленной SEQ ID NO: 1;
(b) полинуклеотида, который содержит нуклеотидную последовательность, обладающую 90% или более идентичностью нуклеотидной последовательности (i) или (ii), и кодирует белок, обладающей активностью изопренсинтазы, или
(c) полинуклеотида, который гибридизуется в жестких условиях с полинуклеотидом, состоящим из нуклеотидной последовательности комплементарной нуклеотидной последовательности (i) или (ii), и кодирует белок, обладающий активностью изопренсинтазы.
[2] Полинуклеотид по пункту [1], где полинуклеотид получают из мукуны.
[3] Белок из указанных ниже (A), (B) или (C):
(A) белка, содержащего (i') полноразмерную аминокислотную последовательность, представленную SEQ ID NO: 2, или (ii') аминокислотную последовательность, состоящую из аминокислотных остатков в положениях 45-594 в аминокислотной последовательности, представленной SEQ ID NO: 2;
(B) белка, который содержит аминокислотную последовательность, обладающую 90% или более идентичностью аминокислотной последовательности (i') или (ii'), и обладает активностью изопренсинтазы, или
(C) белка, который содержит аминокислотную последовательность, содержащую делецию, замену, добавление или вставку одной или более аминокислот в аминокислотной последовательности (i') или (ii'), и обладает активностью изопренсинтазы.
[4] Экспрессирующий вектор, содержащий полинуклеотид по пункту [1] или [2], или полинуклеотид, кодирующий белок по пункту [3].
[5] Трансформант, полученный введением экспрессирующего вектора по пункту [4] в хозяина.
[6] Трансформант по пункту [5], где хозяин обладает способностью синтезировать диметилаллилдифосфат метилэритриолфосфатным путем.
[7] Трансформант по пункту [6], где хозяин представляет собой Escherichia coli.
[8] Трансформант по любому из пунктов [5]-[7], где трансформант обладает способностью синтезировать диметилаллилдифосфат как мевалонатному пути, так и по метилэритриолфосфатному пути.
[9] Трансформант по пункту [5], где хозяином является микроорганизм, принадлежащий роду Corynebacterium, роду Pantoea, роду Enterobacter или роду Saccharomyces.
[10] Способ получения белка по пункту [3], включающий получение белка по пункту [3] с использованием трансформанта по любому из пунктов [5]-[9].
[11] Способ получения изопренового мономера, включающий получение изопренового мономера из диметилаллилдифосфата в присутствии белка по пункту [3].
[12] Способ по пункту [11], где мономер изопрена получают культивированием трансформанта по любому из пунктов [5]-[9].
[13] Способ по пункту [12], где обеспечивают поступление диметилаллилдифосфата из источника углерода в среде посредством культивирования трансформанта.
[14] Способ получения полимера изопрена, включающий (I) и (II):
(I) получение изопренового мономера способом по любому из пунктов [11]-[13], и
(II) полимеризацию изопренового мономера с образованием изопренового полимера.
Эффект изобретения
[0010] В соответствии с настоящим изобретением возможна разработка превосходной продуцирующей мономер изопрена системы.
Краткое описание фигур
[0011] На фиг. 1 представлен график, демонстрирующий количество изопрена, продуцируемого на единицу массы сухих листьев различных растений;
на фиг. 2 представлен график, демонстрирующий количество изопрена, продуцируемого относительно количества общего белка, экстрагируемого из листьев различных растений;
на фиг. 3 представлено изображение, на котором представлена схема правого элемента оперона и его проксимальной области мевалонатного пути на фиксированной хромосоме, и
на фиг. 4 представлено изображение, на котором представлены правый элемент оперона и его проксимальная область мевалонатного пути, регулируемая промотором tac, на хромосоме.
Варианты осуществления для реализации изобретения
[0012] Полинуклеотид, кодирующий изопренсинтазы
Настоящее изобретение относится к полинуклеотиду, кодирующему изопренсинтазу.
Изопренсинтаза представляет собой фермент, который преобразует диметилаллилдифосфат в изопрен. Авторы настоящего изобретения, во-первых, оценили способность продукции изопрена в различных растениях при одинаковых условиях при высокой температуре. В результате чего, было обнаружено, что способность мукуны (Mucuna bracteata) продуцировать изопрен являлась в несколько раз, в несколько десятков раз больше по сравнению со способностью продуцировать изопрен тополем (Populus nigra var. italic) и пуэрарии волосистой (Pueraria lobata). Однако не ясно, относится ли такая высокая способность продуцировать изопрен к высокой способности растения продуцировать диметилаллилдифосфат, высокой продукции изопренсинтазы растением или к высокой специфической ферментативной активности изопренсинтазы, которой обладает растение. В частности, исследовали зависимость от pH и т.п. активности изопренсинтазы в мукуне с использованием фермента, частично очищенного фракционированием сульфатом аммония согласно Monson and Kuzma et al., в непатентной литературе 2 и 3, но оставалось неясным, являлась ли специфическая активность в мукуне выше, чем в пуэрарии волосистой и тополе или не являлась. Таким образом, авторы настоящего изобретения частично очищали изопренсинтазу из листьев мукуны и пуэрарии волосистой фракционированием сульфатом аммония и исследовали специфическую активность раствора неочищенного экстракта. В результате было обнаружено, что специфическая активность изопренсинтазы, полученной из мукуны, являлась в несколько раз, несколько десятков раз выше, чем у изопренсинтазы, полученной из пуэрарии волосистой. Также было продемонстрировано, что измеряемая специфическая активность изопренсинтазы из мукуны являлась в несколько раз, несколько десятков раз выше, чем специфическая активность изопренсинтазы в неочищенном ферменте из тополя, опубликованная в патентной литературе 1 и 2. На основании указанного выше было сделано предположение, что мукуна потенциально содержит высокофункциональную изопренсинтазу.
[0013] Затем анализировали нуклеотидную последовательность гена изопренсинтазы из мукуны. Один из примеров способов анализа будет описан ниже.
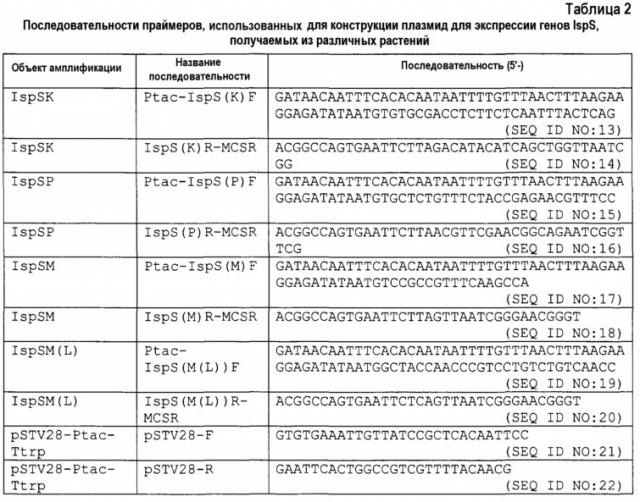
Известно, что изопренсинтаза экспрессируется только в листьях растения, и уровень ее экспрессии повышается при высоком освещении и высокой температуре. Таким образом, сначала экстрагировали общую РНК из листьев мукуны, где индуцировали транскрипцию мРНК изопренсинтазы в условиях освещения при температуре 40°C. Подтверждали, что экстрагированная общая РНК не разрушалась и не являлась загрязненной геномной ДНК. Затем общую РНК преобразовывали в двойную цепь и фрагментировали, и анализировали только нуклеотидные последовательности, содержащие последовательность поли-A на 3'-конце с использованием высокопроизводительного секвенатора. Перекрывающиеся последовательности объединяли с получением совокупности последовательностей контига. Для таких последовательностей контига проводили поиск в программе BLAST, и детектировали последовательность контига с гомологией (идентичностью нуклеотидных последовательностей) с регистрируемыми последовательностями известных генов изопренсинтазы пуэрарии волосистой и тополя, и получали неполную последовательность гена изопренсинтазы мукуны. На основании такой частичной последовательности проводили 5' RACE (быструю амплификацию концов кДНК) стандартными способами анализа полноразмерной нуклеотидной последовательности гена изопренсинтазы мукуны, которая представлена SEQ ID NO: 1.
кДНК изопренсинтазы из мукуны можно получать, например, RT-ПЦР общей РНК, полученной, как указано выше, в качестве матрицы с использованием праймеров, сконструированных на основании информации об анализируемой нуклеотидной последовательности гена изопренсинтазы мукуны.
[0014] В одном из вариантов осуществления полинуклеотид по настоящему изобретению представляет собой полинуклеотид, содержащий (i) нуклеотидную последовательность, представленную SEQ ID NO: 1, или (ii) нуклеотидную последовательность, состоящую из нуклеотидных остатков в положениях 133-1785 в нуклеотидной последовательности, представленной SEQ ID NO: 1. Нуклеотидная последовательность, представленная SEQ ID NO: 1, может кодировать аминокислотную последовательность, представленную SEQ ID NO: 2, нуклеотидная последовательность, состоящая из нуклеотидных остатков в положениях 1-132, может кодировать предполагаемый сигнал локализации хлоропласта, и нуклеотидная последовательность, состоящая из нуклеотидных остатков в положениях 133-1785, может кодировать аминокислотную последовательность зрелой изопренсинтазы.
[0015] В другом варианте осуществления полинуклеотид по настоящему изобретению представляет собой полинуклеотид, который содержит нуклеотидную последовательность, обладающую 90% или более идентичностью с нуклеотидной последовательностью (i) или (ii), как указано выше, и кодирует белок, обладающий активностью изопренсинтазы. Процентная идентичность с нуклеотидной последовательностью может составлять 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, или более. Активность изопренсинтазы относится к активности в отношении образования изопрена из диметилаллилдифосфата (DMAPP) (это же обозначение будет применяться далее в настоящем описании).
[0016] Процентная идентичность нуклеотидных последовательностей и процентная идентичность аминокислотных последовательностей, как описано ниже, можно определять с использованием алгоритма BLAST (Pro. Natl. Acad. Sci. USA, 90, 5873 (1993)) согласно Karlin and Altschul и FASTA (Methods Enzymol., 183, 63 (1990)) согласно Pearson. Программы, обозначаемые как BLASTP и BLASTN, были разработаны на основе такого алгоритма BLAST (см. http://www.ncbi.nlm.nih.gov). Таким образом, процентную идентичность нуклеотидных последовательностей и аминокислотных последовательностей можно рассчитывать с использованием этих программ с настройками по умолчанию. Также в отношении гомологии аминокислотных последовательностей можно использовать, например, числовое значение, полученное вычислением сходства в виде процента при настройках "размер единицы для сравнения=2" с использованием полной длины участка полипептида, кодируемого в ORF, с использованием программного обеспечения GENETYX Ver. 7.0.9 от Genetyx Corporation, в котором применяют способ Липмана-Пирсона. Наименьшее значение среди значений, полученных в таких вычислениях, можно использовать качестве процентной идентичности нуклеотидных последовательностей и аминокислотных последовательностей.
[0017] В еще одном другом варианте осуществления полинуклеотид по настоящему изобретению представляет собой полинуклеотид, который гибридизуется в жестких условиях с полинуклеотидом, состоящим из нуклеотидной последовательности комплементарной нуклеотидной последовательности (i) или (ii), как указано выше, и кодирует белок, обладающий активностью изопренсинтазы.
[0018] "Жесткие условия" относятся к условиям, когда образуется так называемый специфический гибрид, при этом неспецифический гибрид не образуется. Четкое количественное определение таких условий вызывает затруднение. Тем не менее, ссылаясь на конкретный случай, такие условия представляют собой условия, когда по существу одинаковые полинуклеотиды с высокой идентичностью, например, полинуклеотиды с описанной выше процентной идентичностью гибридизуются друг с другом, тогда как полинуклеотиды с более низкой идентичностью по сравнению с указанными выше не гибридизуются друг с другом. В частности, такие условия могут включать гибридизацию в 6×SCC (хлорид натрия/цитрат натрия) приблизительно при 45°C с последующим одним или двумя, или более промываниями в 0,2×SCC и 0,1% SDS при 50-65°C.
[0019] Полинуклеотид по настоящему изобретению может представлять собой ДНК или РНК и предпочтительно представляет собой ДНК. Полинуклеотид по настоящему изобретению можно получать из мукуны. Полинуклеотид по настоящему изобретению также может представлять собой полинуклеотид, кодирующий белок по настоящему изобретению, описанный ниже.
[0020] Изопренсинтаза
Настоящее изобретение также относится к белку, обладающему активностью изопренсинтазы. Активность изопренсинтазы является такой, как описано выше.
[0021] В одном из вариантов осуществления белок по настоящему изобретению представляет собой белок, содержащий (i') полноразмерную аминокислотную последовательность, представленную SEQ ID NO: 2, или (ii') аминокислотную последовательность, состоящую из аминокислотных остатков в положениях 45-594 в аминокислотной последовательности, представленной SEQ ID NO: 2. Аминокислотная последовательность, состоящая из аминокислотных остатков в положениях 1-44 в аминокислотной последовательности, представленной SEQ ID NO: 2, может кодировать предполагаемый сигнал локализации хлоропласта, и аминокислотная последовательность, состоящая из аминокислотных остатков в положениях 45-594 в аминокислотной последовательности, представленной SEQ ID NO: 2, может кодировать зрелую изопренсинтазу.
[0022] В другом варианте осуществления белок по настоящему изобретению представляет собой белок, который содержит аминокислотную последовательность, обладающую 90% или более идентичностью с аминокислотной последовательностью (i') или (ii'), как указано выше, и обладает активностью изопренсинтазы. Процент идентичности с аминокислотной последовательностью может составлять 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, или более.
[0023] В еще одном другом варианте осуществления белок по настоящему изобретению представляет собой белок, который содержит аминокислотную последовательность, содержащую мутацию одной или более аминокислот в аминокислотной последовательности (i') или (ii'), как указано выше, и обладает активностью изопренсинтазы. Примеры мутации аминокислотных остатков может включать делецию, замену, добавление и вставку аминокислотных остатков. Мутацию одной или более аминокислот можно вводить в одну область или многие различные области в аминокислотной последовательности. Термин "один или более" указывает на диапазон, в котором трехмерная структура и активность белка существенно не ухудшается. В случае белка, число, представленное фразой "один или более" равно, например, 1-100, предпочтительно 1-80, более предпочтительно 1-50, 1-30, 1-20, 1-10 или 1-5. Белок по настоящему изобретению может содержать метку для очистки, такую как гистидиновая метка.
[0024] Белок по настоящему изобретению предпочтительно обладает активностью изопренсинтазы, которая составляет 50% или более, 60% или более, 70% или более, 80% или более, 90% или более или 95% или более активности изопренсинтазы белка, содержащего аминокислотную последовательность любой из (i') или (ii'), как указано выше, при измерении в одинаковых условиях. Касательно стабильности также предпочтительно, чтобы белок по настоящему изобретению обладал остаточной активностью, которая составляет 30% или более, 40% или более, 50% или более, 60% или более, или 65% или более исходной активности при хранении белка в определенном буфере [например, растворе 50 мМ Tris-HCl (pH 8,0) и 0,15 мМ MgCl2] при 4°C в течение 48 часов.
[0025] В белке по настоящему изобретению мутацию можно вводить в участки в каталитическом домене и в участки, отличные от каталитического домена, при условии, что сохраняется целевая активность. Положения аминокислотных остатков, которые необходимо подвергать мутации, которые способны сохранять целевую активность, известны специалисту в данной области. В частности, специалист в данной области может проводить корреляцию между структурой и функцией, т.к. специалист в данной области может 1) сравнивать аминокислотные последовательности многих белков, обладающих одним и тем же типом активности (например, аминокислотную последовательность, представленную SEQ ID NO: 2, и аминокислотные последовательности отличные от изопренсинтаз), 2) выяснять области, которые являются относительно консервативными, и области, которые не являются относительно консервативными, и затем 3) прогнозировать области, которые могут играть функционально важную роль, и области, которые не могут играть функционально важную роль, из областей, которые являются относительно консервативными, и областей, которые не являются относительно консервативными, соответственно. Таким образом, специалист в данной области может идентифицировать положения аминокислотных остатков, которые необходимо подвергнуть мутации, в аминокислотной последовательности изопренсинтазы.
[0026] Когда аминокислотный остаток подвергают мутации посредством замены, замена аминокислотного остатка может представлять собой консервативную замену. Как используют в настоящем описании, термин "консервативная замена" относится к замене определенного аминокислотного остатка на аминокислотный остаток со сходной боковой цепью. Семейства аминокислотных остатков со сходной боковой цепью хорошо известны в данной области. Примеры таких семейств могут включать аминокислоты, содержащие основную боковую цепь (например, лизин, аргинин, гистидин), аминокислоты, содержащие кислотную боковую цепь (например, аспарагиновая кислота, глутаминовая кислота), аминокислоты, содержащие с незаряженную полярную боковую цепь (например, аспарагин, глутамин, серин, треонин, тирозин, цистеин), аминокислоты, содержащие неполярную боковую цепь (например, глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), аминокислоты, содержащие разветвленную боковую цепь в положении β (например, треонин, валин, изолейцин), аминокислоты, содержащие ароматическую боковую цепь (например, тирозин, фенилаланин, триптофан, гистидин), аминокислоты, содержащие боковую цепь, содержащую гидроксильную группу (например, спиртовую, фенольную) (например, серин, треонин, тирозин), и аминокислоты, содержащие боковую цепь, содержащую серу (например, цистеин, метионин). Предпочтительно консервативная замена аминокислот может представлять собой замену между аспарагиновой кислотой и глутаминовой кислотой, замену среди аргинина, лизина и гистидина, замену между триптофаном и фенилаланином, замену между фенилаланином и валином, замену между лейцином, изолейцином и аланином и замену между глицином и аланином.
[0027] Экспрессирующий вектор
Настоящее изобретение относится к экспрессирующему вектору. Экспрессирующий вектор по настоящему изобретению содержит полинуклеотид по настоящему изобретению или полинуклеотид, кодирующий белок по настоящему изобретению.
[0028] Примеры экспрессирующего вектора по настоящему изобретению могут включать вектор на основе клеточных систем, которые экспрессирует белок в клетке-хозяине, и вектор на основе бесклеточных систем, в котором используют систему трансляции белка. Экспрессирующий вектор также может представлять собой плазмиду или интегрирующий вектор. Экспрессирующий вектор может дополнительно представлять собой вектор на основе ДНК или вектор на основе РНК.
Известный вектор, подходящий для клетки-хозяина, используют в качестве вектора на основе клеточной системы. Примеры экспрессирующего вектора могут включать плазмиды на основе ColE, типичными представителями которых являются производные pBR322, плазмиды на основе pACYC с происхождением p15A, плазмиды на основе pSC и миниплазмиды F, полученные из фактора F Вас и т.п. в Escherichia coli. Кроме того, также можно использовать экспрессирующие векторы, содержащие триптофановый промотор, такой как trc и tac, промотор lac, промотор T7, промотор T5, промотор T3, промотор SP6, индуцируемый арабинозой промотор, промотор холодового шока, индуцируемый тетрациклином промотор и т.п.
Примеры вектора на основе бесклеточной системы могут включать экспрессирующие векторы, содержащие промотор T7, или содержащие промотор T3 в качестве примера вектора на основе клеточных систем, и векторы для синтеза белков в бесклеточной системе из зародышей пшеницы, такой как плазмиды на основе pEU, содержащие промотор SP6 или промотор T7.
[0029] При синтезе белка с использованием вектора на основе бесклеточных систем кДНК для целевого белка сначала транскрибируют для синтеза мРНК с использованием системы транскрипции. Такая система транскрипции может содержать системы, общеизвестные и опубликованные, в которых кДНК транскрибируется РНК-полимеразой. Примеры РНК-полимеразы могут включать РНК-полимеразу T7.
Затем, мРНК подвергается трансляции с синтезом белок с использованием бесклеточной системы синтеза белка, которая представляет собой систему трансляции. В эту систему входят факторы, такие как рибосома, фактор инициации трансляции, фактор элонгации трансляции, фактор диссоциации и аминоацил-тРНК-синтетаза, которые необходимы для трансляции. Примеры такой системы трансляции белка могут включать экстракт E. coli, экстракт ретикулоцитов кролика и экстракт зародышей пшеницы.
Кроме того, также может быть включена восстановленная бесклеточная система синтеза белка, состоящая из факторов, необходимых для указанной выше трансляции, которые независимо очищают.
Синтез белка с использованием вектора на основе клеточной системы описан ниже в разделе "Трансформанты".
Белок, синтезируемый с использованием вектора на основе клеточной системы или вектора на основе бесклеточной системы, можно подвергать очистке. Примеры способов очистки могут включать способы с использованием метода высаливания и различных хроматографических методов. Когда экспрессирующий вектор конструируют для экспрессии последовательности метки, такой как гистидиновая метка на N-конце или С-конце целевого белка, можно применять способ очистки с использованием аффинной хроматографии с использованием вещества, такого как никель или кобальт с аффинностью в отношении такой метки. Кроме того, чистоту белка по настоящему изобретению можно увеличивать подходящим методом очистки в комбинации с ионообменной хроматографией, гель-фильтрационной хроматографией или т.п.
[0030] Трансформанты
Настоящее изобретение относится к трансформанту, содержащему экспрессирующий вектор по настоящему изобретению. Трансформант по настоящему изобретению представляет собой трансформант, полученный введением экспрессирующего вектора по настоящему изобретению в хозяина. Хозяин, используемый для настоящего изобретения, предпочтительно представляет собой бактерию или гриб. Бактерия может представлять собой грамположительную бактерию или грамотрицательную бактерию.
[0031] Примеры грамположительных бактерий могут включать бактерии, принадлежащие роду Bacillus, Listeria, Staphylococcus, Streptococcus, Enterococcus, Clostridium, Corynebacterium и Streptomyces. Предпочтительными являются бактерии, принадлежащие роду Bacillus и Corynebacterium.
Примеры бактерий, принадлежащих роду Bacillus, могут включать Bacillus subtilis, Bacillus anthracis и Bacillus cereus. Bacillus subtilis является наиболее предпочтительной.
Примеры бактерий, принадлежащие роду Corynebacterium, могут включать Corynebacterium glutamicum, Corynebacterium efficiens и Corynebacterium callunae. Corynebacterium glutamicum является наиболее предпочтительной.
[0032] Примеры грамотрицательных бактерий могут включать бактерии, принадлежащие роду Escherichia, Pantoea, Salmonella, Vivrio, Serratia и Enterobacter. Предпочтительными являются бактерии, принадлежащие роду Escherichia, Pantoea и Enterobacter.
Escherichia coli является предпочтительной в качестве бактерий, принадлежащих роду Escherichia.
Примеры бактерий, принадлежащих роду Pantoea, могут включать Pantoea ananatis, Pantoea stewartii, Pantoea agglomerans и Pantoea citrea. Предпочтительными являются Pantoea ananatis и Pantoea citrea. В качестве бактерий, принадлежащих роду Pantoea, можно использовать штаммы, проиллюстрированные в публикации европейской патентной заявки 0952221. Примеры характерных штаммов бактерий, принадлежащих роду Pantoea, могут включать штамм AJ13355 Pantoea ananatis (FERM BP-6614) и штамм AJ13356 Pantoea ananatis (FERM BP-6615), описанные в публикации европейской патентной заявки 0952221.
Примеры бактерий, принадлежащих роду Enterobacter, могут включать Enterobacter agglomerans и Enterobacter aerogenes. Предпочтительным является Enterobacter aerogenes. Бактериальные штаммы, проиллюстрированные в публикации европейской патентной заявки 0952221, можно использовать в качестве бактерий, принадлежащих роду Enterobacter. Примеры характерных штаммов бактерий, принадлежащих роду Enterobacter, могут включать штамм ATCC12287 Enterobacter agglomerans, штамм TACC13048 Enterobacter aerogenes, штамм NBRC12010 Enterobacter aerogenes (Biotechnol. Bioeng., 2007, Mar. 27; 98 (2):340-348) и AJ110637 Enterobacter aerogenes (FERM BP-10955). Штамм AJ110637 Enterobacter aerogenes был депонирован в Международном депозитарии патентуемых микроорганизмов (IPOD), Национального института новых промышленных исследований и технологий (AIST) (Chuo № 6, Higashi 1-1-1, Tsukuba City, Ibaraki Pref., JP, Postal code 305-8566) 22 августа 2007 года, и перенесен в международный депозитарий на основании Будапештского договора 13 марта 2008 года, и ему был присвоен номер доступа FERM BP-10955.
[0033] Примеры гриба могут включать микроорганизмы, принадлежащие родам Saccharomyces, Schizosaccharomyces, Yarrowia, Trichoderma, Aspergillus, Fusarium и Mucor. Предпочтительными являются микроорганизмы, принадлежащие родам Saccharomyces, Schizosaccharomyces, Yarrowia или Trichoderma.
Примеры микроорганизмов, принадлежащих роду Saccharomyces, могут включать Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis и Saccharomyces oviformis. Предпочтительным является Saccharomyces cerevisiae.
Schizosaccharomyces pombe является предпочтительным в качестве микроорганизмов, принадлежащих роду Schizosaccharomyces.
Yarrowia lypolytica является предпочтительной в качестве микроорганизмов, принадлежащих роду Yarrowia.
Примеры микроорганизмов, принадлежащих роду Trichoderma, могут включать Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei и Trichoderma viride. Trichoderma reesei является предпочтительным.
Кроме того, хозяин, используемый для настоящего изобретения, конкретно не ограничен, при условии, что хозяин обладает способностью синтезировать диметилаллилдифосфат (DMAPP) через путь мевалоновой кислоты (MVA) и/или метилэритриолфосфатный (МЕР) путь, которые вовлечены в синтез диметилаллилдифосфата, который представляет собой субстрат изопренсинтазы и может являться клеткой насекомого, клеткой животного, растительной клеткой и т.п.
[0034] В трансформанте по настоящему изобретению можно активировать путь синтеза диметилаллилдифосфата (DMAPP), который является субстратом изопренсинтазы. Для такой активации в трансформант по настоящему изобретению можно вводить экспрессирующий вектор, который экспрессирует изопентенилдифосфат-дельта-изомеразу, обладающую способностью преобразовывать изопентенилдифосфат (IPP) в диметилаллилдифосфат (DMAPP). В трансформант по настоящему изобретению также можно вводить экспрессирующий вектор, который экспрессирует один или более ферментов, участвующих в мевалонатном пути и/или метилэритриолфосфатном пути, связанных с образованием IPP и/или DMAPP. Экспрессирующий вектор для такого фермента может представлять собой плазмиду или интегрирующий вектор. Экспрессирующий вектор для такого фермента также может представлять собой вектор на основе ДНК или вектор на основе РНК. Экспрессирующий вектор для такого фермента может дополнительно экспрессировать ряд ферментов (например, один, два, три или четыре, или более), участвующих в мевалонатном пути и/или метилэритриолфосфатном пути, и может представлять собой, например, экспрессирующий вектор для полицистронной мРНК. Происхождение одного или более ферментов, участвующих в мевалонатном путем и/или метилэритриолфосфатном пути, может быть гомологичное или гетерологичное по отношению к хозяину. Когда происхождение фермента, участвующего в мевалонатном пути и/или метилэритриолфосфатном пути, является гомологичным по отношению к хозяину, например, может представлять собой бактерию, как описано выше (например, Escherichia coli), и фермент, участвующий в мевалонатном пути, можно получать из гриба (например, Saccharomyces cerevisiae). Кроме того, когда хозяин по своей природе продуцирует фермент, участвующий в метилэритриолфосфатном пути, экспрессирующий вектор, который следует вводить хозяину, может экспрессировать фермент, участвующий в мевалонатном пути.
[0035] Примеры изопентенилдифосфат-дельта-изомеразы (EC:5.3.3.2) могут включать Idi1p (номер доступа NP_015208), AT3G02780 (номер доступа NP_186927), AT5G16440 (номер доступа NP_19714 8) и Idi (номер доступа NP_417365).
[0036] Примеры ферментов, участвующих в мевалонатном (MVA) пути, могут включать мевалонаткиназу (EC: 2.7.1.36; пример 1, Erg12p номер доступа NP_013935; пример 2, AT5G27450 номер доступа NP_001190411), фосфомевалонаткиназу (EC: 2.7.4.2; пример 1, Erg8p номер доступа NP_013947; пример 2, AT1G31910 номер доступа NP_001185124), дифосфомевалонатдекарбоксилазу (EC: 4.1.1.33; пример 1, Mvd1p номер доступа NP_014441; пример 2, AT2G38700 номер доступа NP_181404; пример 3, AT3G54250 номер доступа NP_566995), ацетил-CoA-C-ацетилтрансферазу (EC: 2.3.1.9; пример 1, Erg10p номер доступа NP_015297; пример 2, AT5G47720 номер доступа NP_001032028; пример 3, AT5G48230 номер доступа ID NP_568694), гидроксиметилглутарил-CoA-синтазу (EC: 2.3.3.10; пример 1, Erg13p номер доступа NP_013580; пример 2, AT4G11820 номер доступа NP_192919; пример 3, MvaS номер доступа AAG02438), гидроксиметилглутарил-CoA-редуктазу (EC: 1.1.1.34; пример 1, Hmg2p номер доступа NP_013555; пример 2, Hmg1p номер доступа NP_013636; пример 3, AT1G76490 номер доступа NP_177775; пример 4, AT2G17370 номер доступа NP_179329, EC: 1.1.1.88, пример, MvaA номер доступа P13702) и ацетил-CoA-C-ацетилтрансферазу/гидроксиметилглутарил-CoA-редуктазу (EC: 2.3.1.9/1.1.1.34, пример, MvaE номер доступа AAG02439).
[0037] Примеры ферментов, участвующих в метилэритриолфосфатном (МЕР) пути, могут включать 1-дезокси-D-ксилулоза-5-фосфатсинтетазу (EC: 2.2.1.7, пример 1, Dxs номер доступа NP_414954; пример 2, AT3G21500 номер доступа NP_5 66686; пример 3, AT4G15560 номер доступа NP_193291; пример 4, AT5G11380 номер доступа NP_001078570), 1-дезокси-D-ксилулоза-5-фосфатредкутоизомеразу (EC: 1.1.1.267; пример 1, Dxr номер доступа NP_414715; пример 2, AT5G62790 номер доступа NP_001190600), 4-дифосфоуитидил-2-C-метил-D-эритритолсинтазу (EC: 2.7.7.60; пример 1, IspD номер доступа NP_417227; пример 2, AT2G02500 номер доступа NP_565286), 4-дифосфоцитидил-2-C-метил-D-эритритолкиназу (EC: 2.7.1.148; пример 1, IspE номер доступа NP_415726; пример 2, AT2G26930 номер доступа NP_1802 61), 2-C-метил-D-эритритол-2,4-cуциклодифосфатсинтетазу (EC: 4.6.1,12; пример 1, IspF номер доступа NP_41722 6; пример 2, AT1G63970 номер доступа NP_564819), 1-гидрокси-2-метил-2-(E)-бутенил-4-дифосфатсинтетазу (EC: 1,17.7.1; пример 1, IspG номер доступа NP_417010; пример 2, AT5G60600 номер доступа NP_001119467) и 4-гидрокси-3-метил-2-бутенилдифосфатредуктазу (EC: 1.17.1.2; пример 1, IspH номер доступа NP_414570; пример 2, AT4G34350 номер доступа NP_567965).
[0038] Введение содержащего ген экспрессирующего вектора хозяину (трансформацию) можно проводить с применением известных способов. Примеры такого способа могут включать способ компетентных клеток с использованием микробной клетки, обработанной кальцием, и способ электропорации. Ген можно вводить путем инфекции микробной клетки с использованием фагового вектора, а не плазмидного вектора.
[0039] Кроме того, в трансформант по настоящему изобретению также можно вводить ген, кодирующий фермент, участвующий в мевалонатном пути или метилэритриолфосфатном пути, который синтезирует диметилаллилдифосфат, который является субстратом изопренсинтазы.
Такой фермент может включать 1-дезокси-D-ксилоза-5-фосфатсинтетазу, которая преобразует пируват и D-глицеральдегид-3-фосфат в 1-дезокси-D-ксилоза-5-фосфат, и изопентилдифосфатизомеразу, которая преобразует изопентенилдифосфат в диметилаллилдифосфат.
[0040] Белок по настоящему изобретению можно экстрагировать или выделять из трансформанта по настоящему изобретению, и изопрен можно получать культивированием трансформанта, который экспрессирует белок по настоящему изобретению.
[0041] Способы получения мономера изопрена и изопренового полимера
Настоящее изобретение относится к способу получения мономера изопрена. Способ получения мономера изопрена по настоящему изобретению включает получение мономера изопрена из диметилаллилдифосфата в присутствии белка по настоящему изобретению.
[0042] Способ получения мономера изопрена по настоящему изобретению конкретно не ограничен, при условии, что способ проводят в присутствии белка по настоящему изобретению, и его можно проводить с применением системы ферментативных реакций с самим белком (например, очищенным белком) по настоящему изобретению или культивированием трансформанта по настоящему изобретению, который продуцирует белок по настоящему изобретению. Предпочтительно его проводят культивированием трансформанта по настоящему изобретению. Когда трансформант по настоящему изобретению используют в способе получения мономера изопрена по настоящему изобретению, диметилаллилдифосфат, который является сырьем мономера изопрена, эффективно поставляется из источника углерода в среду для культивирования трансформантом по настоящему изобретению. Трансформант по настоящему изобретению продуцирует мономер изопрена в основном в результате дегазации источника углерода в среде для культивирования. Таким образом, мономер изопрена собирают путем сбора газа, продуцируемого трансформантом. Диметилаллилдифосфат, который является субстратом изопренсинтазы, синтезируется из источника углерода в среду для культивирования мевалонатным путем или метилэритриолфосфатным путем в хозяине.
Культуральная среда для культивирования трансформанта по настоящему изобретению предпочтительно содержит источник углерода, который преобразуется в изопрен. Источник углерода может содержать углеводы, такие как моносахариды, дисахариды, олигосахариды и полисахариды;