Способ диагностики раннего неонатального сепсиса у новорожденных первых суток жизни по профилю экспрессии мрнк в клетках буккального соскоба
Иллюстрации
Показать всеИзобретение относится к области медицины и предназначено для диагностики раннего неонатального сепсиса (РНС) у новорожденных первых суток жизни. В клетках буккального соскоба измеряют уровни экспрессии генов IL12A и CD68 относительно представленности мРНК референсных генов В2М, GUS, ТВР или HPRT. На основании полученных уровней экспрессии вычисляют значение канонической линейной дискриминантной функции (КЛДФ) по формуле. Если значение КЛДФ<0,45, делают заключение об отсутствии инфекционно-воспалительных заболеваний. Если значения КЛДФ>0,45, определяют РНС. Изобретение обеспечивает эффективную неинвазивную диагностику РНС. 3 табл., 2 пр.
Реферат
Изобретение относится к области медицины и предназначено для диагностики раннего неонатального сепсиса (РНС) у новорожденных первых суток жизни. В клетках буккального соскоба измеряют уровни экспрессии генов IL12A и CD68 относительно представленности мРНК референсных генов В2М, GUS, TBP или HPRT; на основании полученных уровней экспрессии вычисляют значение канонической линейной дискриминантной функции (КЛДФ) следующим образом:
уравнение функции имеет вид:
КЛДФ=-20,48*[IL12A]+0,22*[CD68]+0,40, где
[IL12A] - относительный уровень экспрессии IL12A,
[CD68] - относительный уровень экспрессии CD68.
Относительный уровень экспрессии исследуемых генов определяют по формулам:
[IL12A]=2^(NF-Ср IL12A),
[CD68]=2^(NF-Ср CD68),
где Ср - значение порогового цикла соответствующего маркера в образце, определяемое автоматически;
NF - фактор нормировки вычисляют как среднее геометрическое 4 референсных генов (GUS, HPRT, В2М, TBP) по формуле:
Ср GUS, Ср HPRT, Ср В2М, Ср TBP - значения пороговых циклов соответствующих маркеров в образце, определяемые автоматически.
Если значение КЛДФ<0,45, делают заключение об отсутствии инфекционно-воспалительных заболеваний, значения КЛДФ>0,45 соответствуют РНС. Изобретение обеспечивает эффективную диагностику РНС у новорожденных детей первых суток жизни.
1. Область техники
Изобретение относится к области медицины, неонатологии, иммунологии и молекулярной биологии и может быть использовано для диагностики РНС у новорожденных.
2. Уровень техники
Ежегодно около 1,6 миллионов новорожденных погибают от явлений сепсиса [10]. Бактериальные инфекции являются одной из основных причин смертности новорожденных на первой неделе жизни [7]. Сепсис, пневмония и менингит, являясь главными формами проявления РНС, ответственны за 23,4% всех случаев смерти новорожденных [11], при этом сепсис является основной нозологией среди детей с гестационным возрастом менее 34 недель и составляет 46.94% [14].
Высокая смертность новорожденных от инфекционных причин обусловлена как сложностью профилактики и лечения инфекционных заболеваний, так и трудностями их ранней диагностики в неонатальном периоде, в особенности среди недоношенных и глубоко недоношенных новорожденных с очень низкой и экстремально низкой массой тела (ОНМТ и ЭНМТ) [1].
Клинические проявления РНС развиваются у новорожденных в первые трое суток. Основными «причинными» микроорганизмами, вызывающими РНС, являются E.coli, Str. agalactiae, Staph. aureus, Listeria spp. [9, 16].
Инфицирование плода бактериальными патогенами происходит антенатально восходящим путем вследствие проникновения микроорганизмов из цервикального канала с последующим развитием хориоамнионита, а также при внутриутробном заглатывании амниотической жидкости или в результате аспирации околоплодных вод во время родов [8].
Наличие патогенных и условно-патогенных микроорганизмов приводит к стимуляции иммунокомпетентных клеток, в том числе и клеток эпителия, что влечет за собой изменение уровня экспрессии ряда молекул, экспрессируемых данными клетками. Взаимодействие высококонсервативных структур микроорганизмов с паттерн-распознающими рецепторами, прежде всего толл-подобными рецепторами ТЛР-2, ТЛР-4 на поверхности дендритных клеток, макрофагов, эпителиальных клеток приводит к изменению синтеза ряда молекул (ФНО-а, ИЛ-1в, ИЛ-6, IL-8, IL-12) [2, 12].
Преобразование транскрипционной активности одних клеток приводит к направленной миграции других и, как следствие, к изменению локального клеточного состава. Все эти события предшествуют развитию РНС и происходят в процессе антенатального или интранатального инфицирования плода.
Диагностика септического процесса у новорожденных зачастую сложна ввиду неспецифического характера выявляемых симптомов, отсутствия универсальных диагностических маркеров, инвазивного характера применяемых методик и высокого процента ложноотрицательных результатов при обследовании новорожденных, а также влияния временного фактора от момента рождения ребенка до получения результатов анализа гемокультуры. В связи с этим особенно актуальной становится необходимость поиска новых ранних неинвазивных биомаркеров неонатального сепсиса.
Наиболее частым проявлением РНС является врожденная пневмония, которая требует проведения дифференциального диагноза с респираторным дистресс-синдромом у недоношенных детей с целью решения вопроса о необходимости назначении антимикробной терапии [9]. Выделение группы детей высокого инфекционного риска является крайне важным для принятия максимально быстрых, эффективных профилактических и терапевтических мер.
Основными методами исследования при постановке диагноза РНС являются микробиологические (посев крови на стерильность), лабораторные (клинический анализ крови с определением ряда гематологических показателей - количество лейкоцитов, нейтрофилов периферической крови, подсчет нейтрофильного индекса, а также определение белков острой фазы воспаления - СРБ, ПКТ) и инструментальные (рентгенологическое исследование органов грудной полости).
Микробиологические методы далеко не всегда позволяют выявить возбудитель заболевания, а в случае его выявления, как правило, требуют не менее 48-72 часов от момента сбора биологического материала до момента получения результатов культивирования и идентификации микроорганизмов.
Исследование культуры крови у новорожденных осуществляется в условиях микробиологической лаборатории с использованием современных автоматических геманализаторов ВАСТЕС, BACT/Alert или же VERSATrec. Используются стандартные флаконы для культивирования как аэробных, так и анаэробных микроорганизмов. Видовая идентификация микроорганизмов производится с применением современных протеометрических методов - методом MALDI TOF масс-спектрометрии (MS) на масс-спектрометре AutoflexIII (Brucker Daltoniks, Германия) с параллельной видовой идентификацией и определением чувствительности на автоматическом анализаторе «Vitek2Compact». Однако частота обнаружения возбудителя в крови у больных с сепсисом по данным различных авторов не превышает 45%, в то же время отсутствие бактериемии не исключает развития сепсиса или врожденной пневмонии при наличии основных критериев этого заболевания [3].
Следует также отметить, что определение количества лейкоцитов в периферической крови имеет ограниченное значение в постановке диагноза РНС и обладает сравнительно невысокой положительной прогностической ценностью. Это связано с особенностями временного фактора при сборе крови на исследование. Время сбора крови и подсчета количества лейкоцитов имеет важное значение для ранней диагностики неонатального сепсиса. Так, результаты, полученные в возрасте от 6 до 12 ч жизни, будут с большей вероятностью отличаться от нормы, чем полученные непосредственно при рождении вследствие того, что абсолютное количество зрелых и незрелых форм нейтрофилов и величина их соотношения зависят от фазы воспалительного ответа.
Лейкоцитарные индексы (отношение незрелых форм нейтрофилов к их общему количеству) в большей степени позволяют точно исключить инфекционный процесс у новорожденных, нежели выявить детей с наличием инфекции. Абсолютное число незрелых форм нейтрофилов, в свою очередь, обладает низкой чувствительностью и положительной прогностической ценностью в отношении РНС. Нейтропения может являться одним из наиболее значимых диагностических признаков в отношении сепсиса новорожденных и обладает большей специфичностью в сравнении с повышенным количеством нейтрофилов. Вместе с тем следует помнить о том, что гипертензивные состояния во время беременности у матери, асфиксия и гемолитическая болезнь новорожденных также могут приводить к снижению абсолютного числа нейтрофилов в крови ребенка. Следует учитывать также, что количество нейтрофилов у здоровых детей увеличивается с момента рождения, достигая пика в возрасте 6-8 часов жизни.
Среди всех показателей, характеризующих реакцию нейтрофильных гранулоцитов, нейтрофильный индекс обладает наибольшей чувствительностью. Что касается тромбоцитопении, то данный признак неспецифичен и характеризует, как правило, уже развернутую картину течения септического процесса. В то же время тромбоцитопения может сопутствовать таким состояниям, как тяжелая преэклампсия и эклампсия во время беременности, задержка внутриутробного развития плода.
Уровень C-реактивного белка (СРБ) увеличивается в течение 6-8 ч от начала инфекционного процесса у новорожденного, достигая максимума через 24 ч. Непосредственно на момент родов определение СРБ характеризуется низкой чувствительностью, так как для увеличения концентрации СРБ необходим запуск системного воспалительного ответа (с высвобождением IL-6 и TNF-a). Чувствительность метода значительно увеличивается, если первое определение СРБ выполнено в период от 6 до 12 часов после рождения [1]. Концентрация белка прокальцитонина (ПКТ) повышается в течение 2 часов от начала инфекционного процесса, достигая максимальных значений через 12 ч. В нормальных условиях у новорожденных отмечается физиологическое повышение концентрации ПКТ в течение первых 72 ч после родов, причем повышение уровня данного белка в сыворотке крови может отмечаться не только при инфекционных процессах (например, уровень ПКТ повышается при респираторном дистресс-синдроме у недоношенных детей, рожденных путем операции кесарево сечение). Andres Camacho-Gonzalez, Paul W. Spearman и Barbara J. Stoll по результатам метаанализа 16 исследований, включавших в себя 1959 новорожденных детей, делают вывод о том, что чувствительность ПКТ в диагностике инфекционно-воспалительных заболеваний у новорожденных составляет 81%, а его специфичность - 79% [6]. Оценка концентрации ПКТ характеризуется несколько большей чувствительностью в сравнении с СРБ, но меньшей специфичностью. Группа ученых во главе с М. Oberhoffer, изучив выборку из 242 обследованных пациентов с признаками инфекции, обнаружили, что предиктивные возможности маркеров инфекции в отношении отдаленного прогноза течения заболевания были максимально высоки у сывороточного ПКТ (88% чувствительность и 57% положительная предиктивная ценность), несколько ниже, но достаточно высокими у СРБ (66% чувствительность и 51% положительная предиктивная ценность) и низкими для числа лейкоцитов и температуры тела больного [13, 15].
На сегодняшний день описано более 180 потенциальных биологических маркеров сепсиса. Этот перечень включает в себя и белки острой фазы воспаления (C-реактивный белок (СРБ), прокальцитонин (ПКТ)), и некоторые цитокины (IL-1b, IL-6, IL-8, IL-10, TGF-b, TNF-a и др.), а также поверхностные клеточные структуры (CD64 и др.), но только около 20% из них в настоящее время потенциально могут быть использованы для диагностики септических состояний [5]. Все эти белки определяются в крови новорожденного, что ограничивает применение данного метода.
Таким образом, при проведении диагностического поиска показатели формулы периферической крови, нейтрофильный и лейкоцитарный индексы, уровни белков острой фазы воспаления должны анализироваться в совокупности, так как в качестве маркеров не всегда демонстрируют высокую чувствительность и специфичность, особенно в отношении недоношенных новорожденных с ОНМТ и ЭНМТ при рождении.
Выявляемые нередко на рентгенограммах недоношенных новорожденных снижение пневматизации легочной ткани и усиление бронхо-сосудистого рисунка также не могут быть убедительно трактованы в пользу течения инфекционного процесса. О течении пневмонии у новорожденных рентгенологически может свидетельствовать двусторонний инфильтративный процесс наряду с признаками воздушной бронхограммы [4, 9].
В данном патенте предложен метод неинвазивной диагностики, необходимой для верификации РНС. К преимуществам предложенного способа диагностики ИВЗ новорожденных с ЭНМТ и ОНМТ с помощью определения экспрессии мРНК генов IL12A и CD68 можно отнести неинвазивный характер применяемой методики, а также возможность одновременного исследования полученного биоматериала на наличие абсолютно и условно-патогенных микроорганизмов с помощью метода полимеразной цепной реакции. Предложенный метод может быть полностью автоматизирован.
Предложенный способ диагностики РНС может способствовать снижению частоты использования антибактериальной терапии у новорожденных в первые сутки жизни; а также является дополнительным критерием постановки инфекционного диагноза в тех случаях, когда этиологический агент заболевания остается неустановленным.
Из данных зарубежной литературы патентов и патентных заявок на использование измерения уровня мРНК цитокинов в клетках буккального соскоба для диагностики РНС неизвестно. Наиболее близкими аналогами в зарубежной литературе является следующий патент:
«Использование липокина, ассоциированного с желатиназой нейтрофилов в моче, для диагностики сепсиса у детей с очень низкой массой тела при рождении» (Use of urinary ngal to diagnose sepsis in very low birth weight infants. WO 2011053832 A1). Данный метод позволяет диагностировать поздний неонатальный сепсис на основании определения количества липокина, ассоциированного с желатиназой нейтрофилов в моче при превышении определенного порогового уровня. С помощью данного изобретения можно оценить прогрессирование сепсиса, контроль лечения сепсиса, разделить истинно-позитивные и ложные культуро-позитивные случаи сепсиса.
Наиболее близкими аналогами в русскоязычной литературе является следующий патент:
Способ диагностики гнойно-септических заболеваний у новорожденных детей (RU 2484479). Изобретение относится к области медицины, а именно к педиатрии, и может быть использовано для диагностики гнойно-септических заболеваний у новорожденных детей, т.е. неонатального сепсиса. Для этого определяют одномоментную экспрессию рецепторов CD64(+) CD32(+) CD11b(+) в периферической крови у новорожденных. За норму принимают значение 1,63±0,68%, а при условии увеличения значения экспрессии CD64(+) CD32(+) CD11b(+) не менее чем в 5 раз относительно нормы, выявляют наличие гнойно-септического заболевания у ребенка. Использование данного способа позволяет проводить диагностику гнойно-септических заболеваний у детей на раннем этапе заболевания.
Основными недостатками обоих изобретений является диагностика позднего неонатального сепсиса, а во втором случае методика является инвазивной (материалом для исследования служит периферическая кровь).
Описание изобретения
Предложен способ диагностики РНС путем оценки уровня мРНК определенных генов в клетках буккальных соскобов.
В частности, предложен способ диагностики РНС у новорожденных с ЭНМТ и ОНМТ путем определения относительных уровней экспрессии генов IL12A и CD68.
В клетках буккальных соскобов новорожденных с проявлениями РНС по сравнению с группой новорожденных без врожденных ИВЗ существенно возрастает относительное количество мРНК гена CD68 и снижается относительное количество IL12A.
Для оценки уровня представленности мРНК исследуемых генов в мазках используются методы обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) с регистрацией накопления продуктов реакции в режиме «реального времени».
На основании экспериментальных данных при сравнении новорожденных с диагностированным РНС и новорожденных без признаков ИВЗ были получены и проанализированы результаты с применением методов математической статистики (бинарная логистическая регрессия), выбрана КЛДФ, позволяющая вычислить вероятность наличия заболевания.
Уравнение функции имеет вид:
Y=-20,48*[IL12A]+0,22*[CD68]+0,40, где
[IL12A] - относительный уровень экспрессии IL12A,
[CD68] - относительный уровень экспрессии CD68.
Относительный уровень экспрессии исследуемых генов определяют по формулам:
[IL12A]=2^(NF-Ср IL12A),
[CD68]=2^(NF-Ср CD68),
где Ср - значение порогового цикла соответствующего маркера в образце, определяемое автоматически;
NF - фактор нормировки вычисляется как среднее геометрическое 4 референсных генов (GUS, HPRT, В2М, TBP) по формуле:
Ср GUS, Ср HPRT, Ср В2М, Ср TBP - значения пороговых циклов соответствующих маркеров в образце, определяемые автоматически.
Для определения возможности диагностики РНС среди новорожденных с гестационным возрастом 29-32 недели гестации с использованием КЛДФ был выполнен ROC-анализ. Площадь под ROC-кривой составила AUC=0,83 (0,72-0,94, p<0.05), что согласно экспертной шкале для оценки предсказательной способности модели позволило классифицировать ее как «очень хорошую». В качестве порогового значения (точка cut-off) выбрано значение, соответствующее максимальной сумме чувствительности и специфичности предложенной модели. Пороговое значение вероятности РНС составило 0,45. Значения показателей КЛДФ выше 0,45 следует классифицировать как маркер РНС. Чувствительность и специфичность предложенной модели в области порогового значения составила 81% и 74% соответственно.
Ограничение метода - применение антибиотиков и антимикотических препаратов, а также грудное кормление до проведения исследования.
4. Реализация изобретения
4.1. Взятие материала
Взятие буккальных соскобов осуществляют с помощью специальных зондов. Во избежание деградации сразу после взятия материала зонд погружают в пластиковую пробирку объемом 1,5 мл, в которую предварительно внесено 500 мкл транспортной среды для РНК. В качестве транспортной среды используется лизирующий раствор (Комплект реагентов "Проба НК", регистрационное удостоверение № ФСР 2008/02938 от 4 мая 2010 г., ДНК-Технология, Россия). Зонд вращают в течение 10-15 секунд, избегая разбрызгивания раствора. Вынимают зонд из раствора, отжав избыток жидкости, прижимая зонд к стенке пробирки, удаляют зонд, закрывают пробирку. Пробирку доставляют в лабораторию в течение 2 часов либо хранят при температуре 4-8°C в течение 1 суток.
Образцы можно хранить при температуре -20°C в течение 3 месяцев или при температуре -70°C в течение 1 года.
4.2. Выделение нуклеиновых кислот
Выделение РНК производят с использованием комплекта реагентов "Проба НК" или другим любым сопоставимым методом (с использованием колонок, магнитных частиц, сорбентов).
На этапе выделения РНК можно использовать только наконечники с маркировкой «RNAase-free, DNAase-free».
4.2.1. Пробирки, содержащие анализируемый материал в транспортной среде для РНК, разморозить при комнатной температуре. Осадить капли со стенок пробирок путем центрифугирования при 13000 об/мин в течение 15 сек. Довести объем образца до 500 мкл, добавив лизирующий раствор (комплект реагентов "Проба НК"). Встряхнуть пробирки на вортексе в течение 30 сек.
4.2.2. Прогреть пробирки при 65°C в течение 10 мин. Осадить капли со стенок путем центрифугирования при 13000 об/мин в течение 15 сек.
4.2.3. Добавить 500 мкл реагента для преципитации и встряхнуть пробирки на вортексе в течение 3-5 с.
4.2.4. Центрифугировать пробирки при 13000 об/мин в течение 15 мин.
4.2.5. Не задевая осадок, полностью удалить надосадочную жидкость из каждой пробирки отдельным наконечником.
4.2.6. Добавить к осадку 500 мкл промывочного раствора №1, закрыть крышки пробирок и перемешать, 3-5 раз аккуратно перевернув пробирки.
4.2.7. Центрифугировать пробирки при 13000 об/мин в течение 5 мин.
4.2.8. Не задевая осадок, полностью удалить надосадочную жидкость из каждой пробирки отдельным наконечником.
4.2.9. Добавить к осадку 300 мкл промывочного раствора №2, закрыть крышки пробирок и перемешать, 3-5 раз аккуратно перевернув пробирки.
4.2.10. Центрифугировать пробирки при 13000 об/мин в течение 5 мин.
4.2.11. Не задевая осадок, полностью удалить надосадочную жидкость из каждой пробирки отдельным наконечником.
4.2.12. Открыть крышки пробирок и высушить осадок при 65°C в течение 5 мин.
4.2.13. Добавить к осадку 100 мкл буфера для растворения и прогреть пробирки при 65°C в течение 10 мин, осадить конденсат центрифугированием при 13000 об/мин в течение 30 с.
Полученный препарат РНК/ДНК сразу использовать для постановки реакции обратной транскрипции. Оставшийся материал хранить при минус 70°C в течение 1 года, а также можно использовать для выявления ДНК/РНС патогенных и УПМ.
Для исключения коамплификации геномной ДНК желательно расположить праймеры на стыках экзонов. Тогда перед проведением обратной транскрипции не требуется обработка образцов ДНК-азой, т.к. при постановке ПЦР используются праймеры, не отжигающиеся на геномной ДНК.
4.3. Проведение реакции обратной транскрипции
4.3.1. Промаркировать необходимое количество новых пластиковых пробирок объемом 0,5 мл с учетом пробирок для отрицательного контрольного образца «К-».
4.3.2. Разморозить ОТ-буфер (4-кратный) и смесь дНТФ (концентрация 2,5 мМ каждого) и праймеров для обратной транскрипции (специфические олигонуклеотиды) при комнатной температуре (18-25°C), затем встряхнуть пробирки на вортексе в течение 3-5 с и осадить капли центрифугированием при 1000 об/мин в течение 3-5 с.
4.3.3. В отдельной пластиковой пробирке приготовить ОТ-смесь путем смешивания ОТ-буфера, смеси праймеров + дНТФ и обратной транскриптазы:
4,0×(N+1) мкл «ОТ-буфера»,
2,0×(N+1) мкл «смеси праймеров и дНТФ,
1,0×(N+1) мкл обратной транскриптазы,
где (N+1) - количество анализируемых образцов с учетом «К-» (N) с запасом на 1 образец.
4.3.4. По 7 мкл ОТ-смеси внести в промаркированные пробирки.
4.3.5. В пробирки с ОТ-смесью внести по 33 мкл соответствующего образца РНК (или образца «К-»), используя отдельные наконечники для каждого образца.
4.3.6. Пробирки встряхнуть на вортексе в течение 3-5 с и осадить капли центрифугированием при 1000 об/мин в течение 3-5 с.
4.3.7. Пробирки поместить в термостат и инкубировать при температуре 40°C в течение 30 мин, затем при температуре 95°C в течение 5 мин.
4.3.8. Осадить конденсат центрифугированием при 13000 об/мин в течение 30 с.
Полученный препарат кДНК готов для проведения ПЦР.
Хранить кДНК можно при температуре минус 20°C в течение 1 года.
Перед постановкой ПЦР необходимо развести препарат кДНК, добавив 40 мкл ТЕ-буфера.
4.4.Проведение ПЦР
Для проведения ПЦР одновременно в постановке исследовать все изучаемые гены.
4.4.1. Разморозить при комнатной температуре (18-25 С) ПЦР-буфер, затем тщательно перемешать на вортексе и осадить капли центрифугированием при 1000 об/мин в течение 3-5 с.
4.4.2. Для каждого образца кДНК промаркировать по 2 пробирки с запечатанной парафином реакционной смесью * прим. по 2 пробирки на каждый онкомаркер и каждый референсный ген.
*Реакционная смесь объемом 20 мкл содержит ПЦР-буфер, дНТФ, специфические праймеры (прямой и обратный), специфические олигонуклеотиды, несущие флуоресцентную метку. Для обеспечения горячего старта реакционная смесь запечатывается под парафин.
4.4.3. В отдельной пластиковой пробирке, предварительно перемешав реагенты, приготовить смесь ПЦР-буфера с Taq-полимеразой:
10×(N+1) мкл ПЦР-буфера,
0,5×(N+1) мкл Taq-полимеразы,
где N+1 - количество анализируемых образцов с учетом (К-) и (К+), кДНК-СТ (N) с запасом на 1 образец.
Смесь можно хранить при комнатной температуре (18-25°C) не более 1 ч.
4.4.4. Перемешать приготовленную смесь ПЦР буфера с Taq-полимеразой на вортексе и осадить капли центрифугированием при 1000 об/мин в течение 3-5 с.
4.4.5. Во все амплификационные пробирки, не повреждая слой парафина, добавить по 10 мкл тщательно перемешанной смеси ПЦР-буфера с Taq-полимеразой.
4.4.6. В каждую пробирку добавить по 1 капле (20 мкл) минерального масла, закрыть пробирки.
4.4.7. Внести в амплификационные пробирки, не повреждая слой парафина, по 5,0 мкл препарата кДНК.
4.4.8. В пробирки, промаркированные (К-), внести по 5,0 мкл отрицательного контрольного образца.
4.4.9. Закрыть крышки пробирок.
4.4.10. Осадить капли со стенок пробирок. Для этого провести центрифигирование при 1000 об/мин в течение 3-5 с.
4.4.11. Установить все пробирки в блок амплификатора и провести ПЦР в режиме, приведенном в таблице, с учетом объема реакционной смеси, равного 35 мкл.
4.5. Регистрация, учет, обработка и представление результатов
Регистрация и учет результатов амплификации проводится с помощью детектирующего амплификатора DTprime (ДНК-Технология, Россия), осуществляется прибором автоматически во время амплификации. Оформление протокола (тип анализа «Качественный», метод определения «Геометрический») и анализ результатов проводится в соответствии с инструкцией к прибору («Руководство по эксплуатации»).
Полученные автоматически в ходе реакции значения пороговых циклов генов IL12A и CD68 (Ср) позволяют определить относительный уровень экспрессии соответствующих генов (формулы 2 и 3). На основании полученных уровней экспрессии вычисляется значение КЛДФ (формула 1). Если значение КЛДФ<0,45 делается заключение об отсутствии РНС. Значения КЛДФ>0,45 соответствуют наличию РНС.
Примеры использования изобретения
Проведено клинико-лабораторное обследование 23 новорожденных первых суток жизни без признаков инфекционно-воспалительных заболеваний. Из них согласно предложенной методике вероятность отсутствия РНС КЛДФ<0,45 определена у 19 детей. У 4 новорожденных получен ложноположительный результат (КЛДФ>0,45).
Проведено клинико-лабораторное обследование 31 новорожденного с наличием подтвержденного РНС (врожденный сепсис, врожденная пневмония). В 23 случаях подтверждено наличие РНС (КЛДФ>0.45).
Пример №1
Ребенок Г. (образец №31) - недоношенный мальчик массой 1340 г, длиной 39 см у матери 23 лет с отягощенным соматическим (хронический цистит, хронический пиелонефрит) и акушерско-гинекологическим анамнезом (порок развития матки - двурогая матка), от 2 беременности, наступившей самопроизвольно (1-я в 2010 г. закончилась интранатальной гибелью плода в связи с разрывом правого рога матки) и протекавшей в 1 триместре на фоне токсикоза легкой степени, угрозы прерывания беременности в 7-8 нед., стационарного лечения (утрожестан), во 2 триместре - отмечалось обострение хрон. пиелонефрита (а/б терапия), угроза преждевременных родов в 27 нед, проведены стационарное лечение в ФГБУ «НЦАГиП им. В.И. Кулакова» с положительным эффектом, профилактика РДС. Роды вторые, преждевременные оперативные путем операции кесарева сечения на сроке 29 недель беременности в связи с ухудшением состояния плода по данным допплерометрии. Оценка состояния ребенка по шкале Апгар составила 6/8 баллов. Состояние ребенка с рождения было тяжелым за счет развития дыхательных нарушений (оценка по шкале Сильверман составила 5 баллов), потребовавших налаживания СРАР маской в родильном блоке, с заместительной целью был введен куросурф.
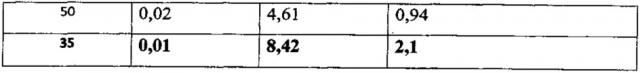
При поступлении в отделении реанимации и интенсивной терапии новорожденных (ОРИТН) ребенку был взят буккальный соскоб для проведения скринингового исследования для определения инфекционного статуса. Было получено значение КЛДФ равное -0,66, что соответствует отсутствию РНС (таблица 1).
Y=-20,48*[IL12A]+0,22*[CD68]+0,40;
Y=-20,48*0,06+0,22*1,09+0,40;
Y=-0,66.
В ОРИТН в течение двух суток ребенку продолжалась респираторная терапия: неинвазивная ИВЛ методом Biphasic и в течение суток NCPAP. В дальнейшем мальчик находился без респираторной поддержки. С рождения у ребенка отмечались кровоизлияния в кожу, проводилась гемостатическая терапия (викасол, дицинон). На 3-и сутки жизни, учитывая проявление ДВС-синдрома (кровоточивость из мест инъекций на фоне значительных по площади кровоизлияний в кожу) была выполнена трансфузия свежезамороженной плазмы с положительным эффектом.
В возрасте 3 суток жизни ребенку было проведено клинико-лабораторное обследование с целью уточнения основного диагноза. По данным УЗИ головного мозга, внутренних органов и сердца - патологических изменений выявлено не было. По данным рентгенологического исследования органов грудной полости отмечена рентгенологическая картина умеренной диффузной гипопневматизации легких, что может соответствовать течению РДС.
Учитывая положительную динамику в клинической картине, данные клинико-лабораторного обследования (лейкоциты - 4,5×109/л, общее число нейтрофилов - 1935, НИ-0,02, C-реактивный белок - 0,85 мг/л, отсутствие инфильтративных теней по данным рентгенологического исследования) выставлен диагноз: Респираторный дистресс синдром.
В возрасте 10 с/ж ребенок был консультирован неврологом, по заключению: неврологический статус соответствует гестационному возрасту. На 12 с/ж, учитывая отсутствие потребности в реанимационных мероприятиях, ребенок был переведен на 2 этап выхаживания.
Диагноз при переводе на второй этап выхаживания:
Основной: Респираторный дистресс синдром. Анемия недоношенных. Гипербилирубинемия недоношенных. ДВС-синдром (кровоизлияния в кожу). ОНМТ. Недоношенность.
Дальнейшее лечение и выхаживание ребенка осуществлялось в отделении патологии новорожденных и недоношенных детей (ОПН и НД). В удовлетворительном состоянии на 45 сутки жизни ребенок был выписан домой под наблюдение участкового педиатра. Вес ребенка при выписке составил 2416 г.
Пример №2.
Ребенок С. (образец №35) - глубоконедоношенная девочка, 1 из двойни, массой 890 г, длиной 34 см у матери 27 лет с отягощенным акушерским анамнезом (первичное бесплодие, мужской фактор), от 1 беременности, наступившей после 4-й попытки ЭКО и ИКСИ и протекавшей в 1 триместре - на фоне артериальной гипертензии у матери, проводилась антигипертензивная терапия, во 2 триместре - отмечалась угроза прерывания с 18-19 недель, с 22 недель беременности - эпизоды формирования и опорожнения ретрохориальной гематомы, анемия, высев Е. faecalis в моче и в отделяемом из цервикального канала, проводились повторные курсы антибактериальной терапии, профилактика РДС плодов. Роды первые, преждевременные оперативные путем операции кесарева сечения на сроке 26 недель беременности. Ребенок извлечен в асфиксии средней степени тяжести. Оценка состояния по шкале Апгар составила 5/7 баллов. Состояние ребенка с рождения было тяжелым за счет развития дыхательных нарушений, на фоне перенесенной в родах асфиксии средней степени тяжести и глубокой недоношенности. В родильном блоке была налажена респираторная поддержка СРАР, с заместительной целью введен куросурф.
При поступлении в ОРИТН ребенку был взят буквальный соскоб для проведения скринингового исследования для определения инфекционного статуса. Было получено значение КЛДФ равное 2,1, что соответствует наличию РНС (таблица 2).
Y=-20,48*[IL12A]+0,22*[CD68]+0,40;
Y=-20,48*0,01+0,22*8,42+0,40;
Y=2,l.
В ОРИТН в первые трое суток ребенку продолжалась респираторная терапия: неинвазивная ИВЛ методом Biphasic, NCPAP и в связи с усугублением дыхательных расстройств - ИВЛ. С первых суток жизни у ребенка отмечались проявления врожденной анемии, с целью ее коррекции была проведена трансфузия отмытых эритроцитов с положительным эффектом.
В возрасте 3 суток жизни ребенку было проведено клинико-лабораторное обследование с целью уточнения основного диагноза. По данным УЗИ головного мозга - очаговых изменений не выявлено, по данным УЗИ внутренних органов - отмечается неоднородность паренхимы печени, по эхокардиографическим данным - функционирует гемодинамически значимый артериальный проток (ГЗФАП), проведено успешное медикаментозное закрытие протока. По данным рентгенологического исследования органов грудной полости отмечена рентгенологическая картина двустороннего инфильтративного процесса в легких. Учитывая осложненное течение беременности (явления угрозы прерывания с 18 недель беременности), результаты микроскопического исследования последа (острый очаговый базальный децидуит), наличие воспалительного очага (пневмония) в сочетании с явлениями полиорганной недостаточности (дыхательная, сердечно-сосудистая, почечная, недостаточность системы пищеварения и системы гемостаза), а также признаки системного воспалительного ответа (лейкоцитоз 45,5×109/л, нейтрофилез 31380, повышение уровня ПКТ до 3,83 нг/мл, метаболические нарушения) - выставлен диагноз: Врожденный сепсис.
В возрасте 3 суток жизни ребенок был первично консультирован неврологом, по заключению: очаговой неврологической симптоматики выявлено не было. В ОРИТН ребенку проводилась комплексная терапия: инфузионная, антибактериальная, респираторная, антианемическая, эубиотическая, парентеральное питание.
На 50 с/ж, учитывая отсутствие потребности в реанимационных мероприятиях, ребенок был переведен на 2 этап выхаживания.
Диагноз при переводе на второй этап выхаживания:
Основной: Врожденный сепсис. ДВС-синдром (желудочное кровотечение, макрогематурия, ВЖК 1 степени справа). НК 2 степени. Асфиксия средней степени тяжести при рождении. Врожденная анемия. ЭНМТ. Недоношенность.
Дальнейшее лечение и выхаживание ребенка осуществлялось в отделении патологии новорожденных и недоношенных детей (ОПН и НД). В удовлетворительном состоянии на 87 сутки жизни ребенок был выписан домой под наблюдение участкового педиатра. Вес ребенка при выписке составил 2545 г.
Заключения, сделанные на основании предложенного метода, подтверждены клиническими и лабораторными данными.
СПИСОК ЛИТЕРАТУРЫ
1. Голубцова Ю.М., Дегтярев Д.Н. Современные подходы к профилактике, диагностике и лечению раннего неонатального сепсиса. Неонатология: новости, мнения, обучение. 2014. №2. С. 15-25.
2. Долгушина В.Ф., Долгушин И.И., Телешова Л.Ф. Местный иммунитет половой системы у беременных с генитальной инфекцией. Журнал микробиологии, эпидемиологии и иммунобиологии. 2000. №2. С. 92-95.
3. Хаертынов Х.С., Анохин В.А., Бойчук С.В. Патофизиология неонатального сепсиса. Вестник современной клинической медицины. №6. Том 7. 2014. С. 97-104.
4. Baltimore R.S. Consequences of prophylaxis for group В Streptococcal infections of the neonate. Seminars in Perinatology. 31 (2007), pp. 33-38.
5. Burillo A., Bouza E. Use of rapid diagnostic techniques in ICU patients with infections. BMC Infect Dis. 2014 Nov 28, 14:593.
6. Camacho-Gonzalez A., Spearman P.W., Stoll B.J. Neonatal Infectious Diseases Evaluation of Neonatal Sepsis. Pediatric Clinics of North America. 60 (2013), pp. 367-389.
7. Grace J. Chan, Anne Lee C.C., Abdullah H. Baqui et al. Risk of Early-Onset Neonatal Infection with Maternal Infection or Colonization: A Global Systematic Review and Meta-Analysis. PLoS Med. 2013 Aug. №10. pp. 1-20.
8. Groer M.W., Gregory K.E., Louis-Jacques A., Thibeau S., Walker W.A. The very low birth weight infant microbiome and childhood health. Birth Defects Research Part C: Embryo Today: Reviews. 2015 Dec; 105(4):252-64.
9. Huang F.K., Chen H.L., Yang P.H., Lin H.C. Bird's Eye View of a Neonatologist: Clinical Approach to Emergency Neonatal Infection. Pediatrics & Neonatology. 2015 Oct, pp. 1-7.
10. Lawn J.E., Wilczynska-Ketende K, Cousens SN. Et al (2006). Estimating the cause of 4 million neonatal deaths in the year 2000. Int J Epidemiol; 35:706-718.
11. Liu L., Johnson H.L., Cousens S. et al. Global, regional, and national causes of child mortality: an updated systematic analysis for 2010 with time trends since 2000 // Lancet. - 2012. - Vol. 379. - P. 2151-2161.
12. Medzhitov R, Janeway CA. Innate immunity: the virtues of a nonclonal system of recognition. Cell. 1997. Vol. 31, №91(3), pp. 295-298.
13. Oberhoffer M. et al. Outcome prediction by traditional and new markers of inflammation in patients with sepsis. Clin Chem Lab Med 1999; 37:363-8.
14. Shariat M.K., Karimi Z., Rezaienejad M., Basiri A., Torkestani F., Gargar S.S. Perinatal complications associated with preterm deliveries at 24 to 33 weeks and 6 days gestation (2011-2012): A hospital-based retrospective study. Iran J Reprod Med. 2015 Nov; 13(11): 697-702.
15. Ugarte H. et al. Procalcitonin use as a marker of infection in the medical intensive care unit. Crit. Care Med 2000; 28:977-83.
16. Wang X., Wang X., Liu X., et al. MiR-15a/16 are upreuglated in the serum of neonatal sepsis patients and inhibit the LPS-induced inflammatory pathway. Int J Clin Exp Med. 2015; 8(4): 5683-5690.
Способ диагностики раннего неонатального сепсиса у новорожденных первых суток жизни по профилю экспрессии мРНК в клетках буккального соскоба, отличающийся тем, что в клетках буккального соскоба измеряют уровни экспрессии генов IL12A и CD68 относительно представленности мРНК референсных генов В2М, GUS, ТВР или HPRT; на основании полученных уровней экспрессии вычисляют значение канонической линейной дискриминантной функции (КЛДФ) следующим образом:
уравнение функции имеет вид:
КЛДФ=-20,48*[IL12A]+0,22*[CD68]+0,40, где
[IL12A] - относительный уровень экспрессии IL12A,
[CD68] - относительный уровень экспрессии CD68,
относительный уровень экспрессии исследуемых генов определяют по формулам:
[IL12A]=2^(NF-Ср IL12A),
[CD68]=2^(NF-Ср CD68),
где Ср - значение порогового цикла соответствующего маркера в образце, определяемое автоматически;
NF - фактор нормировки вычисляют как среднее геометрическое 4 референсных генов (GUS, HPRT, В2М, ТВР) по формуле:
Ср GUS, Ср HPRT, Ср В2М, Ср ТВР - значения пороговых циклов соответствующих маркеров в образце, определяемые автоматически, если значение КЛДФ<0,45, делают заключени