Композиция для контролируемой стимуляции яичников
Иллюстрации
Показать всеГруппа изобретений относится к медицине и предназначена для лечения бесплодия у пациента. Фолликулостимулирующий гормон (ФСГ) применяют в изготовлении лекарственного средства для лечения бесплодия у пациента. Если пациент имеет сывороточный уровень антимюллеровского гормона (АМГ) менее 15 пмоль/л, то лекарственное средство содержит суточную дозу, равную или эквивалентную 11-13 мкг рекомбинантного ФСГ (рФСГ). Причем указанный рФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 99% общего сиалирования - α2,6-сиалирование и от 1 до 99% общего сиалирования - α2,3-сиалирование. Если пациент имеет сывороточный уровень АМГ не менее 15 пмоль/л, то лекарственное средство предназначено для введения в суточной дозе, равной или эквивалентной от 0,09 до 0,19 мкг рФСГ человеческого происхождения на кг массы тела пациента. Причем указанный рФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 99% общего сиалирования - α2,6-сиалирование и от 1 до 99% общего сиалирования - α2,3-сиалирование. Использование группы изобретений обеспечивает эффективное лечение бесплодия у пациента. 2 н. и 8 з.п. ф-лы, 8 ил., 12 табл., 11 пр.
Реферат
Настоящее изобретение относится к композициям и фармацевтическим продуктам для лечения бесплодия.
Методы технологии вспомогательной репродукции (ВРТ), такие как экстракорпоральное оплодотворение (ЭКО), хорошо известны. Для этих методов ВРТ обычно требуется стадия контролируемой стимуляции яичников (КСЯ), при которой когорту фолликулов стимулируют до полного созревания. Стандартные режимы КСЯ включают введение гонадотропинов, таких как фолликулостимулирующий гормон (ФСГ), отдельно или в комбинации с активностью лютеинизирующего гормона (ЛГ), для стимуляции развития фолликулов, обычно при введении аналога гонадотропин-высвобождающего гормона (ГнВГ) до и/или во время стимуляции, чтобы предотвратить преждевременный выброс ЛГ. Фармацевтические композиции, как правило, применяемые для КСЯ, включают рекомбинантный фолликулостимулирующий гормон (рФСГ), ФСГ, полученный из мочи, препараты рекомбинантного ФСГ и ЛГ, менотропин [менопаузальный гонадотропин человека (чМПГ)], полученный из мочи, и высокоочищенный менопаузальный гонадотропин человека (ВО-чМПГ). ЭКО может быть сопряжено с риском синдрома гиперстимуляции яичников (СГСЯ), который в некоторых случаях может угрожать жизни.
Способность к предсказанию потенциального ответа женщин на контролируемую стимуляцию яичников (КСЯ) может дать возможность разработки индивидуализированных протоколов КСЯ. Это может, например, уменьшить риск СГСЯ у женщин, у которых предсказан избыточный ответ на стимуляцию, и/или улучшить результаты беременности у женщин, классифицированных как низкоотвечающие. В настоящее время установлено, что сывороточная концентрация антимюллеровского гормона (АМГ) является надежным маркером яичникового резерва. Понижающиеся уровни АМГ соответствуют сниженному ответу яичников на гонадотропины во время КСЯ. Кроме того, высокие уровни АМГ являются хорошим предсказателем избыточного ответа яичников и показателем риска СГСЯ.
В предварительном исследовании женщин моложе 35 лет, проходящих ВРТ, для предсказания оптимальной начальной дозы ФСГ для КСЯ у женщин с риском развития СГСЯ, был использован алгоритм дозирования единых стандартов предоставления результатов испытания (CONSORT; от англ. "Consolidated Standards of Reporting Trials") (включающий базовый ФСГ, индекс массы тела (ИМТ), возраст и количество антральных фолликулов (КАФ (antral follicle count, AFC)) (Olivennes et. al., 2009). Индивидуализация дозы не привела к адекватному выходу ооцитов и достаточной частоте беременности. Тем не менее, в группе низкой дозы (75 ME (международная единица) ФСГ) частота исключений была высокой вследствие неадекватного ответа, и СГСЯ действительно встречался у значимой доли пациентов.
Следовательно, существует необходимость в композиции для применения в индивидуализированных протоколах КСЯ, обеспечивающей адекватный ответ на стимуляцию и/или пониженный риск СГСЯ.
Как указано выше, стандартные протоколы КСЯ могут включать введение ФСГ. ФСГ в природе секретируется передней долей гипофиза и функционирует как гормон, поддерживающий развитие фолликулов и овуляцию. ФСГ включает 92-аминокислотную альфа-субъединицу, также общую с другими гликопротеиновыми гормонами ЛГ и хорионическим гонадотропином (ХГ), и 111-аминокислотную бета-субъединицу, уникальную для ФСГ, которая придает этому гормону биологическую специфичность (Pierce and Parsons, 1981). Каждая субъединица претерпевает посттрансляционную модификацию посредством присоединения сложных углеводных остатков. Обе субъединицы несут два сайта присоединения N-связанного гликана, альфа-субъединица при аминокислотах 52 и 78, а бета-субъединица при аминокислотных остатках 7 и 24 (Rathnam and Saxena, 1975, Saxena and Rathnam, 1976). Таким образом, ФСГ гликозилируется примерно до 30% по массе (Dias and Van Roey. 2001; Fox era/. 2001).
ФСГ, очищенный из постклимактерической мочи человека, в течение многих лет применяли при лечении бесплодия; как для стимуляции овуляции при естественной репродукции, так и для получения ооцитов для технологий вспомогательной репродукции. Продукты рекомбинантного ФСГ (рФСГ), одобренные в настоящее время для стимуляции яичников, такие как фоллитропин альфа (ГОНАЛ-Ф, Merck Serono/EMD Serono) и фоллитропин бета (ПУРЕГОН/ФОЛЛИСТИМ, MSD/Schering-Plough), получают из линии клеток яичника китайского хомячка (СНО). В настоящее время в продаже отсутствуют продукты рФСГ из линии клеток человека.
Для препаратов ФСГ характерна значительная гетерогенность, связанная с различиями в количестве различных присутствующих изоформ. Индивидуальные изоформы ФСГ демонстрируют идентичные аминокислотные последовательности, но различаются по степени посттрансляционных модификаций; конкретные изоформы характеризуются гетерогенностью структур углеводных ветвей и различающимися количествами включения сиаловой кислоты (концевого сахара), где оба различия, по-видимому, влияют на специфичную биологическую активность изоформы.
Гликозилирование природного ФСГ в высшей степени сложно. Гликаны в гипофизарном ФСГ природного происхождения могут содержать широкий ряд структур, которые могут включать комбинации моно-, би-, три- и тетра-разветвленных гликанов (Pierce and Parsons, 1981; Ryan et al., 1987. Baenziger and Green, 1988). Гликаны могут нести дополнительные модификации: фукозилирование центральной части, разделяющий глюкозамин, цепи, удлиненные ацетиллактозамином, частичное или полное сиалирование, сиалирование с α2,3- и α2,6-связями и сульфатированный галактозамин, замещенный галактозой (Dalpathado et al., 2006). Кроме того, существуют различия между распределениями гликановых структур в индивидуальных сайтах гликозилирования. Сравнимый уровень сложности гликанов был обнаружен в ФСГ, выделенном из сыворотки индивидуумов и из мочи женщин в постклимактерическом периоде (Wide et al, 2007).
Гликозилирование продуктов рекомбинантного ФСГ отражает уровень гликозилтрансфераз, присутствующих в линии клеток-хозяев. Имеющиеся в продаже продукты рФСГ получены из клеток яичника китайского хомячка (клеток СНО), сконструированных методами генной инженерии. Диапазон гликановых модификаций в рФСГ, выделенном из клеток СНО, более ограничен, чем обнаруживаемый в природных продуктах. Примеры сниженной гликановой гетерогенности, обнаруживаемой в рФСГ, полученном из клеток СНО, включают отсутствие разделяющего глюкозамина и пониженное содержание фукозилирования центральной части и ацетиллактозаминных удлинений (Hard et al., 1990). Кроме того, клетки СНО способны присоединять сиаловую кислоту только с использованием α2,3-связи (Kagawa et at, 1988, Takeuchi et al, 1988, Svensson et al., 1990); рФСГ, полученный из клеток СНО, включает только α2,3-связанную сиаловую кислоту и не включает а2,б-связанную сиаловую кислоту.
Таким образом, рФСГ, полученный из клеток СНО, отличается от ФСГ природного происхождения (например, ФСГ гипофиза/сыворотки/мочи человека), который содержит гликаны, включающие смесь α2,3- и α2,6-связанной сиаловой кислоты с преобладанием первой.
Кроме того, также было показано, что имеющийся в продаже препарат рекомбинантного ФСГ отличается количествами ФСГ, имеющего изоэлектрическую точку (pI) ниже 4 (с учетом кислых изоформ) по сравнению с ФСГ гипофиза, сыворотки или постклимактерической мочи (Ulloa-Aguirre et al. 1995). Количество кислых изоформ в препаратах из мочи было значительно выше по сравнению с рекомбинантными продуктами, полученными из клеток СНО, Гоналом-ф (Merck Serono) и Пурегоном (Schering Plough) (Andersen et al. 2004). Это должно отражать более низкое молярное содержание сиаловой кислоты в рекомбинантном ФСГ, поскольку содержание отрицательно заряженного гликана, модифицированного сульфатом, в рекомбинантном ФСГ низко. Более низкое содержание сиаловой кислоты по сравнению с природным ФСГ является признаком обоих имеющихся в продаже продуктов рекомбинантного ФСГ и может отражать ограничение в процессе изготовления.
Время пребывания ФСГ в кровообращении было документировано для материалов из ряда источников. Некоторые из этих материалов были фракционированы на основе общего молекулярного заряда, который характеризуется их pI, в котором большее количество кислоты соответствует более высокому отрицательному заряду. Как установлено ранее, основным фактором, влияющим на общий молекулярный заряд, является суммарное содержание сиаловой кислоты каждой молекулы ФСГ. Например, рФСГ (Organon) имеет содержание сиаловой кислоты примерно 8 моль/моль, тогда как ФСГ полученный из мочи имеет более высокое содержание сиаловой кислоты (de Leeuw et al. 1996). Соответствующие скорости плазматического клиренса у крысы составляют 0,34 и 0,14 мл/мин (Ulloa-Aguirre et al. 2003). В другом примере, где образец рекомбинантного ФСГ был разделен на фракции, имеющие высокую и низкую pI эффективность in vivo фракции с высокой pI (низкое содержание сиаловой кислоты) была снижена, и она имела более короткий период полувыведения из плазмы (D'Antonio et al. 1999). Также было описано, что более основной ФСГ, циркулирующий на последних стадиях цикла овуляции, является следствием понижающей регуляции α2,3-сиалилтрансферазы в передней доле гипофиза, вызванной возрастающими уровнями эстрадиола (Damian-Matsumara et al. 1999; Ulloa-Aguirre et al. 2001). Результаты для α2,6-сиалилтрансферазы не были описаны.
Следовательно, как изложено выше, рекомбинантные белки, экспрессируемые с использованием системы СНО, будут отличаться от их природных двойников своим типом концевых связей сиаловой кислоты. Это соображение важно при получении биопрепаратов для фармацевтического применения, поскольку углеводные группировки могут вносить вклад в фармакологические свойства молекулы.
Авторы настоящего изобретения разработали рекомбинантный ФСГ человеческого происхождения, который является объектом международной заявки на патент №PCT/GB2009/000978, опубликованной какУУ02009/127826А. Рекомбинантный ФСГ, содержащий смесь как α2,3-, так и α2,6-связанной сиаловой кислоты, был получен путем генно-инженерного конструирования линии клеток человека для экспрессии как рФСГ, так и α2,3-сиалилтрансферазы. Экспрессируемый продукт является в высокой степени кислым и несет смесь как α2,3-, так и α2,6-связанных сиаловых кислот;
последние образуются за счет активности эндогенной сиалилтрансферазы, Было обнаружено, что тип связи сиаловой кислоты, α2,3- или α2,6-, может оказывать существенное влияние на биологический клиренс ФСГ. Рекомбинантный ФСГ, содержащий смесь как α2,3-, так и α2,6-связанных сиаловых кислот, обладает двумя преимуществами по сравнению с рФСГ, экспрессируемым в традиционных клетках СНО: во-первых, этот материал в большей степени сиалирован за счет объединенных активностей двух сиалилтрансфераз; и, во-вторых, этот материал в большей степени напоминает природный ФСГ. Это, вероятно, более биологически целесообразно по сравнению с рекомбинантными продуктами, полученными из клеток СНО, которые могут продуцировать только α2,3-связанную сиаловую кислоту (Kagawa et al, 1988, Takeuchi et al, 1988, Svensson et al., 1990) и обладают пониженным содержанием сиаловой кислоты (Ulloa-Aguirre et al. 1995., Andersen et al. 2004).
Продукт рФСГ, раскрытый в международной заявке на патент PCT/GB2009/000978, содержит разветвленные гликановые группировки. ФСГ содержит гликаны (присоединенные к гликопротеинам ФСГ), и эти гликаны могут иметь широкое разнообразие структур. Как хорошо известно в данной области техники, разветвление (гликана) может происходить с таким результатом, что гликан имеет 1, 2, 3, 4 или большее количество концевых сахарных остатков или «ветвей»; гликаны, имеющие 1, 2, 3 или 4 концевых сахарных остатка или «ветви», называют, соответственно, моно-разветвленными, ди-разветвленными, три-разветвленными или тетра-разветвленными структурами. Гликаны могут иметь сиалирование, присутствующее на моно-разветвленных и/или ди-разветвленных и/или три-разветвленных и/или тетра-разветвленных структурах. Иллюстративный рФСГ, раскрытый в международной заявке на патент №PCT/GB2009/000978, включал моно-сиалированные, ди-сиалированные, три-сиалированные и тетра-сиалированные гликановые структуры, имеющие следующие относительные количества: 9-15% моно-сиалированных; 27-30% ди-сиалированных; 30-36% три-сиалированных и 25-29% тетра-сиалированных. Как хорошо известно, моно-сиалированная гликановая структура несет один остаток сиаловой кислоты; ди-сиалированная гликановая структура несет два остатка сиаловой кислоты; три-сиалированная гликановая структура несет три остатка сиаловой кислоты; и тетра-сиалированная гликановая структура несет четыре остатка сиаловой кислоты. В данной заявке терминология, такая как «Х% моно-сиалированных», «Х% ди-сиалированных», «Х% три-сиалированных» или «Х% тетра-сиалированных» относится к числу гликановых структур на ФСГ, который является моно-, ди-, три- или тетра-сиалированным (соответственно), выраженному в процентах (Х%) от общего числа гликановых структур на ФСГ, сиалированном в любом случае (несущем сиаловую кислоту). Таким образом, выражение «30-36% три-сиалированных гликановых структур» означает, что из общего числа гликановых структур на ФСГ, несущем остатки сиаловой кислоты (то есть сиалированном) от 30 до 36% этих гликановых структур являются три-сиалированными (несут три остатка сиаловой кислоты). Авторы изобретения неожиданно обнаружили, что ФСГ, имеющий определенное количество тетра-сиалированных гликановых структур (отличающийся от иллюстративного продукта рФСГ, раскрытого в упомянутом выше документе PCT/GB2009/000978), значительно более эффективен, чем рекомбинантные продукты ФСГ, имеющиеся в настоящее время в продаже. Аминокислотная последовательность продуктов, предложенных авторами изобретения, представляет собой нативную последовательность и идентична последовательности природного ФСГ человека и существующим продуктам рФСГ, полученным из СНО. Однако авторы настоящего изобретения обнаружили, что продукты рекомбинантного ФСГ человеческого происхождения (то есть рекомбинантный ФСГ, продуцируемый или экспрессируемый в линии клеток человека, например, в линии клеток человека, полученной методами генной инженерии), содержащие смесь как α2,3-, так и α2,6-связанной сиаловой кислоты, и/или определенное количество тетра-сиалированных гликановых структур, могут быть особенно эффективными при применении в протоколах КСЯ (например, индивидуализированных).
Согласно настоящему изобретению в первом аспекте предложен продукт (например, фармацевтическая композиция), содержащий фолликулостимулирующий гормон (ФСГ), для применения в лечении бесплодия у пациента (например, у пациента, имеющего сывороточный уровень АМГ 0,05 пмоль/л или выше, например 0,5 пмоль/л или выше), где этот продукт содержит дозу, равную или эквивалентную 1-24 мкг, например 2-24 мкг, например от 2 до 15 мкг, рекомбинантного ФСГ человеческого происхождения. Предпочтительно продукт содержит дозу, равную или эквивалентную от 4,5 до 12,5 мкг, например от 5 до 12,5 мкг, например от 6 до 12,5 мкг, например от 6,3 до 10,5 мкг, рекомбинантного ФСГ человеческого происхождения.
Согласно изобретению предложен продукт (например, фармацевтическая композиция), содержащий фолликулостимулирующий гормон (ФСГ), для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ менее 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л), где продукт содержит (например, суточную) дозу, равную или эквивалентную от 9 до 14 мкг, например от 11 до 13 мкг, например 12 мкг, рекомбинантного ФСГ человеческого происхождения. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека. Доза обеспечивает эффективный ответ, при этом сводя к минимуму риск СГСЯ. Предпочтительно лечение бесплодия включает стадию определения (например, измерения) сывороточного уровня АМГ пациента и введения дозы пациенту, имеющему сывороточный уровень АМГ составляющий менее 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л).
Согласно изобретению в следующем аспекте предложен продукт (например, фармацевтическая композиция), содержащий фолликулостимулирующий гормон (ФСГ) для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ не менее 15 пмоль/л, где продукт содержит (например, суточную) дозу, равную или эквивалентную от 5 до 12,5 мкг, например от 6 до 10,5 мкг, рекомбинантного ФСГ человеческого происхождения. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека. Доза обеспечивает эффективный ответ, при этом сводя к минимуму риск СГСЯ. Предпочтительно лечение бесплодия включает стадию определения (например, измерения) сывороточного уровня АМГ пациента и введения дозы пациенту, имеющему сывороточный уровень АМГ не менее 15 пмоль/л. В одном воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ от 15 до 24,9 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 5 до 12 мкг, например от 7 до 12 мкг, например от 8,7 до 10 мкг, рекомбинантного ФСГ человеческого происхождения (предпочтительно от 9 до 10 мкг рекомбинантного ФСГ человеческого происхождения). В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ от 15 до 24,9 пмоль/л. В другом воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ от 25 до 34,9 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 5 до 12 мкг, например от 6 до 9 мкг, например от 7 до 8 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 7,3 до 8 мкг рекомбинантного ФСГ человеческого происхождения). В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ от 25 до 34,9 пмоль/л. В другом воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ не менее 35 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной от 5 до 11 мкг или эквивалентной ей, например от 6,3 до 7 мкг, рекомбинантного ФСГ человеческого происхождения (предпочтительно от 6 до 7 мкг рекомбинантного ФСГ человеческого происхождения). В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ не менее 35 пмоль/л.
Вышеуказанные дозы могут быть предназначены для лечения бесплодия по первому протоколу стимуляции пациента (субъекта). Понятно, что для следующих циклов стимуляции дозы можно корректировать в соответствии с действительным ответом яичников в первом цикле.
Авторы изобретения обнаружили, что, как правило, необходимо извлекать около девяти ооцитов, чтобы дать возможность отбора двух высококачественных ооцитов для переноса.
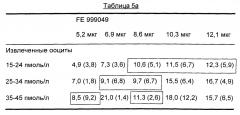
Авторы изобретения обнаружили, что для субъектов, имеющих низкий АМГ (АМГ менее 15 пмоль/л на литр), для достижения этого результата требуется рационально высокая доза рекомбинантного ФСГ (например, 12 мкг). При данной дозе от 8 до 14 ооцитов будет извлечено у 60% субъектов с низким АМГ. Данный результат является неожиданным и значительным усовершенствованием по сравнению с лечением субъектов с низким АМГ 150 ME Гонала-ф, где извлекают от 8 до 14 ооцитов только у 33% субъектов. Авторы изобретения обнаружили, что нет необходимости корректировать эту дозу в соответствии с массой тела пациента.
Тем не менее, 60% населения (и 80% женщин моложе 30 лет, которых лечат от бесплодия) имеют высокий АМГ (то есть, АМГ не менее 15 пмоль/л). Для этих субъектов обычно достаточно просто извлекать в среднем от 9 до 11 ооцитов; проблема протоколов стимуляции заключается в риске СГСЯ. Авторы изобретения обнаружили, что у пациентов, получающих низкие дозы человеческого рекомбинантного ФСГ, существует взаимосвязь между извлекаемыми ооцитами и массой тела субъекта. Это означает, что может существовать риск, сопутствующий лечению фиксированными дозами ФСГ (что обычно в данной области техники). Авторы настоящего изобретения установили соотношение между дозой ФСГ и уровнем АМГ и массой субъекта, обеспечивающее улучшенный профиль безопасности (сниженный риск СГСЯ) с приемлемым или улучшенным извлечением ооцитов по сравнению с известными протоколами лечения (см. пример 10).
Согласно изобретению в следующем аспекте предложен продукт (например, фармацевтическая композиция), содержащий фолликулостимулирующий гормон (ФСГ), для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ не менее 15 пмоль/л, где продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 0,09 до 0,19 мкг (например от 0,09 до 0,17 мкг) рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента. Предпочтительно лечение бесплодия включает стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ не менее 15 пмоль/л. В одном воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ от 15 до 24,9 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 0,14 до 0,19 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 0,15 до 0,16 мкг рекомбинантного ФСГ человеческого происхождения) на кг массы тела пациента. В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ от 15 до 24,9 пмоль/л. В другом воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ от 25 до 34,9 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 0,11 до 0,14 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 0,12 до 0,13 мкг рекомбинантного ФСГ человеческого происхождения) на кг массы тела пациента. В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ от 25 до 34,9 пмоль/л. В другом воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ не менее 35 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 0,10 до 0,11 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента. В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ не менее 35 пмоль/л. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека. Дозы обеспечивают эффективный ответ при сведении к минимуму риска СГСЯ.
Вышеуказанные дозы могут быть предназначены для лечения бесплодия по первому протоколу стимуляции пациента (субъекта). Понятно, что для следующих циклов стимуляции дозы можно корректировать в соответствии с действительным ответом яичников в первом цикле.
Согласно изобретению в следующем аспекте предложен продукт (например, фармацевтическая композиция), содержащий фолликулостимулирующий гормон (ФСГ) для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ менее 15 пмоль/л, где продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 0,15 до 0,21 мкг (например, от 0,19 до 0,21 мкг) рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента. Предпочтительно лечение бесплодия включает стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ менее 15 пмоль/л. Однако, нет необходимости, чтобы пациенты с уровнем АМГ менее 15 пмоль/л, получали дозу продукта в соответствии с массой тела. Понятно, что эти дозы можно легко преобразовать для лечения пациентов, получающих дозу продукта в соответствии с их ИМТ (индекс массы тела), используя преобразования, хорошо известные в данной области техники.
Продукт (например, фармацевтическая композиция) может быть предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ 5,0-14,9 пмоль/л, где продукт содержит дозу, равную или эквивалентную от 6 до 18 мкг, например от 8 до 11 мкг, например от 8,5 до 10,2 мкг, рекомбинантного ФСГ человеческого происхождения. Продукт может быть предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ 15,0-29,9 пмоль/л, где продукт содержит дозу, равную или эквивалентную от 4,8 до 15 мкг, например от 6 до 9 мкг, например от 6,8 до 8,5 мкг, рекомбинантного ФСГ человеческого происхождения. Продукт может быть предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ 30-44,9 пмоль/л, где продукт содержит дозу, равную или эквивалентную от 3,6 до 12 мкг, например от 4 до 7 мкг, например от 5,1 до 6,8 мкг, рекомбинантного ФСГ человеческого происхождения. Продукт может быть предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ 45 пмоль/л или более, где продукт содержит дозу, равную или эквивалентную от 2 до 9 мкг, например от 2,4 до 9 мкг (например, от 3,4 до 5,1 мкг) или от 2 до 5 мкг рекомбинантного ФСГ человеческого происхождения. Продукт может содержать фолликулостимулирующий гормон (ФСГ), для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ 5 пмоль/л или менее, где продукт содержит дозу, равную или эквивалентную от 7,2 до 24 мкг, например от 10 до 15 мкг, например от 10,2 до 13,6 мкг, рекомбинантного ФСГ человеческого происхождения. Продукт может быть предназначен для применения в лечении бесплодия у пациента, где продукт содержит дозу, равную или эквивалентную от 4,8 до 18 мкг, например от 6 до 11 мкг, например от 6,8 до 10,2 мкг, рекомбинантного ФСГ человеческого происхождения. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека.
Предпочтительно рФСГ (например, рекомбинантный ФСГ, полученный из линии клеток человека) включает α2,3- и α2,6-сиалирование. ФСГ (рФСГ) для применения согласно изобретению, может иметь от 1% до 99% общего сиалирования, представляющего собой α2,3-сиалирование. ФСГ (рФСГ) согласно изобретению, может иметь от 1% до 99% общего сиалирования, представляющего собой α2,6-сиалирование. Предпочтительно от 50 до 70%, например от 60 до 69%, например примерно 65%, общего сиалирования представляют собой α2,3-сиалирование. Предпочтительно от 25 до 50%, например от 30 до 50%, например от 31 до 38%, например примерно 35%, общего сиалирования представляет собой α2,6-сиалирование.
Предпочтительно рФСГ (например, рекомбинантный ФСГ, полученный из линии клеток человека) включает моно-, ди-, три- и тетра-сиалированные гликановые структуры, где 15-24%, например 17-23%, сиалированных гликановых структур представляют собой тетра-сиалированные гликановые структуры (например, как показано с помощью анализа заряженных гликанов на слабой анионообменной колонке (WAX; от англ. Weak Anion Exchange), как изложено ниже в Примерах). ФСГ включает гликаны (присоединенные к гликопротеинам ФСГ). Хорошо известно, что гликаны в ФСГ могут иметь широкое разнообразие структур. Они могут включать комбинации моно-, ди-, три- и тетра-разветвленных гликанов. В данной заявке терминология, такая как «Х% сиалированных гликановых структур представляет собой тетра-сиалированные гликановые структуры» относится к числу гликановых структур на ФСГ, являющихся тетра-сиалированными, то есть несущими четыре остатка сиаловой кислоты, выраженному в процентах (Х%) от общего числа гликановых структур на ФСГ, в любом случае являющихся сиалированными (несущими сиаловую кислоту). Таким образом, выражение «15-24% сиалированных гликановых структур представляет собой тетра-сиалированные гликановые структуры» означает, что из общего числа гликановых структур на ФСГ, несущих остатки сиаловой кислоты (то есть являющихся сиалированными) от 15 до 24% этих гликановых структур являются тетра-сиалированными (несут четыре остатка сиаловой кислоты).
рФСГ может быть представлен в виде единственной изоформы или в виде смеси изоформ.
Авторы изобретения разработали «индивидуализированные» протоколы КСЯ, в которых определенные дозы рекомбинантного ФСГ, обладающего определенными характеристиками, применяют для лечения пациентов, опираясь на их определенные уровни АМГ, таким образом, повышая вероятность адекватного ответа на стимуляцию (например, у пациентов, имеющих низкий потенциал ответа) и/или снижение риска СГСЯ (например, у пациентов, классифицированных как пациенты с повышенной реакцией или с избыточной реакцией).
Сывороточный уровень АМГ можно определить (например, измерить) любым способом, известным в данной области техники. Предпочтительно сывороточный уровень АМГ измеряют, используя набор для твердофазного иммуноферментного анализа АМГ Gen-II (Beckman Coulter, Inc., Webster, Texas). В данном анализе можно обнаружить концентрации АМГ, составляющие более 0,57 пмоль/л, при минимальном пределе количественного определения 1,1 пмоль/л. Можно использовать другие анализы.
В данной заявке сывороточные значения АМГ, как правило, указаны в пмоль/л. Эти значения можно преобразовать в нг/мл, используя уравнение преобразования: 1 нг/мл АМГ=7,1 пмоль/л АМГ.
В данной заявке термины «пациент» и «субъект» используют взаимозаменяемо.
Как в данной заявке, так и в формуле изобретения продукт (например, фармацевтическая композиция) предпочтительно содержит суточную дозу, равную или эквивалентную определенным выше количествам рФСГ человеческого происхождения. (Суточная) доза может представлять собой начальную дозу (то есть она может быть снижена, повышена или сохранена в процессе лечения).
Продукт (например, фармацевтическая композиция) может быть предназначен для (ежедневного) введения ФСГ, начиная на первые сутки лечения и продолжая в течение от семи до тринадцати суток, например от девяти до тринадцати суток, например от 10 до 13 суток, например от 10 до 11 суток. Продукт (например, фармацевтическая композиция) может быть предназначен для введения в течение от 12 до 16, например от 13 до 15, например 14 суток после введения (например, после начала введения, например, после начала ежедневного введения) агониста ГнВГ (например, синарела, люпрона, декапептила). Продукт (например, фармацевтическая композиция) может быть предназначен для введения с агонистом ГнВГ. Продукт (например, фармацевтическая композиция) может быть предназначен для введения перед введением антагониста ГнВГ (например, ганиреликса, цетрореликса), например, для введения за пять или шесть суток до введения антагониста ГнВГ. Продукт (например, фармацевтическая композиция) может быть предназначен для введения с антагонистом ГнВГ. Предпочтительно продукт (например, фармацевтическая композиция) предназначен для введения перед введением высокой (овуляторной) дозы хорионического гонадотропина человека (ХГЧ) (например от 4000 до 11000 ME ХГЧ, например 5000 ME ХГЧ, 10000 ME ХГЧ и т.д.; или от 150 до 350 микрограммов рекомбинантного ХГЧ, например 250 микрограммов рекомбинантного ХГЧ), чтобы индуцировать окончательное созревание фолликулов.
Понятно, что продукт может быть предназначен для дозирования с частотами, большими (или меньшими), чем суточные, в этом случае релевантные дозы будут эквивалентны (суточным) дозам, указанным в данной заявке.
В данной заявке термин «лечение бесплодия» включает лечение бесплодия путем контролируемой стимуляции яичников (КСЯ) или способами, включающими стадию или этап контролируемой стимуляции яичников (КСЯ), например, внутриматочное оплодотворение (ВМО), экстракорпоральное оплодотворение (ЭКО) или интрацитоплазматическая инъекция сперматозоида (ИКСИ). Термин «лечение бесплодия» включает лечение бесплодия путем индукции овуляции (ИО) или способами, включающими этап или стадию индукции овуляции (ИО). Термин «лечение бесплодия» включает лечение бесплодия у субъекта, имеющего трубное или необъяснимое бесплодие, включая лечение бесплодия у субъекта, страдающего эндометриозом, например, эндометриозом стадии I или стадии II, и/или у субъекта, страдающего ановуляторным бесплодием, например, ановуляторным бесплодием типа II согласно классификации Всемирной организации здравоохранения (ВОЗ), и/или у субъекта, имеющего партнера с мужским фактором бесплодия. Продукт (или композиция) может быть предназначен для лечения (применения в лечении) бесплодия (и/или для контролируемой стимуляции яичников) у субъекта, страдающего эндометриозом, например, эндометриозом стадии I или стадии II, как определено системой классификации Американского Общества Репродуктивной Медицины (ASRM; The American Society for Reproductive Medicine) для различных стадий эндометриоза (стадия IV самая тяжелая; стадия I наименее тяжелая) [American Society for Reproductive Medicine. Revised American Society for Reproductive Medicine classification of endometriosis: 1996. Fertil Steril 1997; 67,817 821].
Продукт (композиция) может быть предназначен для лечения (применения в лечении) бесплодия (и/или для контролируемой стимуляции яичников) у субъекта, имеющего нормальный сывороточный уровень ФСГ от 1 до 16 МЕ/л, например от 1 до 12 МЕ/л, в ранней фолликулярной фазе.
Продукт (композиция) может быть предназначен для лечения (применения в лечении) бесплодия (и/или для контролируемой стимуляции яичников) у субъекта в возрасте от 18 до 42 лет, например от 25 до 37 лет. Продукт может быть предназначен для лечения (применения в лечении) бесплодия (и/или для контролируемой стимуляции яичников) у субъекта, имеющего ИМТ более 1 и ИМТ менее 35 кг/м2, например у субъекта, имеющего ИМТ более 18 и ИМТ менее 25 кг/м2, например у субъекта, имеющего ИМТ более 20 и ИМТ менее 25 кг/м2.
рФСГ может предпочтительно включать 27-33%, например 30-32%, три-сиалированных гликановых структур. рФСГ может предпочтительно включать 24-33%, например 26-30%, ди-сиалированных гликановых структур. рФСГ может предпочтительно включать 12-21%, например 15-17%, моно-сиалированных гликановых структур. рФСГ предпочтительно включает моно-сиалированные, ди-сиалированные, три-сиалированные и тетра-сиалированные гликановые структуры в следующих относительных количествах: 15-17% моно-сиалированных; 26-30% ди-сиалированных; 27-33% (например 29-32%, например 30-32%, например 30-31%) три-сиалированных и 17-23% тетра-сиалированных (например, как показано с помощью анализа WAX заряженных гликанов, как изложено в Примерах). рФСГ может включать от 0 до 7%, например от 0,1 до 7%, например от 3 до 6%, например от 5 до 6%, нейтральных сиалированных структур. ФСГ содержит гликаны (присоединенные к гликопротеинам ФСГ). В данной заявке терминология, такая как «Х% моно-сиалированных», «Х% ди-сиалированных», «Х% три-сиалированных» или «Х% тетра-сиалированных» относится к числу гликановых структур на ФСГ, являющихся моно-, ди-, три- или тетра-сиалированными (соответственно), выраженному в процентах (Х%) от общего числа гликановых структур на ФСГ, в любом случае являющихся сиалированными (несущих сиаловую кислоту). Таким образом, выражение «27-33% три-сиалированных гликановых структур» означает, что из общего числа гликановых структур на ФСГ, несущих остатки сиаловой кислоты (то есть являющихся сиалированными) от 27 до 33% этих гликановых структур являются три-сиалированными (несут три остатка сиаловой кислоты).
рФСГ может иметь содержание сиаловой кислоты [выраженное в виде отношения числа моль сиаловой кислоты к числу моль белка] 6 моль/моль или более, например от 6 моль/моль до 15 моль/моль, например от 8 моль/моль до 14 моль/моль, например от 10 моль/моль до 14 моль/моль, например от 11 моль/моль до 14 моль/моль, например от 12 моль/моль до 14 моль/моль, например от 12 моль/моль до 13 моль/моль. рФСГ можно продуцировать или экспрессировать в линии клеток человека.
ФСГ (рФСГ), для применения согласно изобретению, может иметь от 1% до 99% общего сиалиро