Способ получения 2-замещенных 1-гидрокси-1н-индол-5,6-дикарбоновых кислот
Иллюстрации
Показать всеИзобретение относится к способу получения 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбоновых кислот, где R=C6H5 или 4-CH3C6H4, или 4-ОСН3C6H4, или 2-тиенил, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных препаратов. Способ получения 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбоновых кислот включает две стадии. На первой стадии замещенные 4-нитро-5-(2-оксоэтил)фталонитрилы нагревают в растворе серной кислоты с образованием соответствующих замещенных 4-[2-R-2-оксоэтил]-5-нитробензол-1,2-дикарбоновых кислот. На второй стадии замещенные 4-[2-R-2-оксоэтил]-5-нитробензол-1,2-дикарбоновые кислоты восстанавливают двухлористым оловом с получением целевых 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбоновых кислот. Использование предложенного метода синтеза 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбоновых кислот позволяет получать новые, ранее неописанные в литературе индол-5,6-дикарбоновые кислоты. 4 пр.
Реферат
Изобретение относится к способу получения новых азотсодержащих гетероциклических соединений, а именно 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбоновых кислот, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных препаратов.
Данные соединения являются новыми, и из уровня техники нам неизвестны способы получения таких соединений.
Задачей изобретения является разработка способа получения 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбоновых кислот структурной формулы:
где R=С6Н5 или 4-СН3С6Н4, или 4-ОСН3С6Н4, или 2-тиенил.
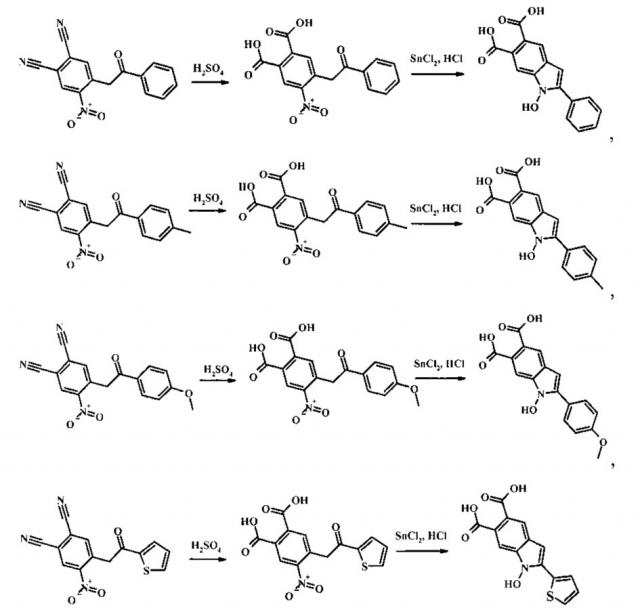
Поставленная задача достигается тем, что способ синтеза 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбоновых кислот включает две стадии. На первой стадии замещенные 4-нитро-5-(2-оксоэтил)фталонитрилы, полученные по патенту RU 2443681 C2, опубл. 27.02.2012, нагревают в растворе серной кислоты с массой долей 75…90% с образованием соответствующих замещенных 4-[2-R-2-оксоэтил]-5-нитробензол-1,2-дикарбоновых кислот. На второй стадии замещенные 4-[2-R-2-оксоэтил]-5-нитробензол-1,2-дикарбоновые кислоты восстанавливают двухлористым оловом с получением целевых 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбоновых кислот.
Вышеуказанные соединения получают следующей реакцией:
при условиях, описанных ниже.
На первой стадии замещенные 4-нитро-5-(2-оксоэтил)фталонитрилы нагревают в растворе серной кислоты с массой долей 75...90% при температуре 100…120°C в течение 20-36 ч. Затем полученную реакционную массу охлаждают, разбавляют десятикратным избытком холодной воды со льдом. Выпавший осадок 4-[2-R-2-оксоэтил]-5-нитробензол-1,2-дикарбоновых кислот отфильтровывают, промывают водой и перекристаллизовывают из спирта. Сушат на воздухе.
На второй стадии к раствору двухлористого олова в концентрированной соляной кислоте при температуре 30…50°C при интенсивном перемешивании прибавляют раствор полученных соответствующих 4-[2-R-2-оксоэтил]-5-нитробензол-1,2-дикарбоновых кислот в этиловом спирте при мольном соотношение 3.0-4.5:1 соответственно и времени реакции 1-2 ч. Выпавший осадок соответствующих 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбоновых кислот отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе.
Все приведенные отличительные признаки являются существенными, и только заявляемая совокупность признаков позволяет достичь технического результата.
Строение полученных соединений подтверждено методами ИК, ЯМР H1, ЯМР C13, NOESY-спектроскопией и масс-спектрометрией.
Изобретение иллюстрируется следующими примерами.
Пример 1. 1-Гидрокси-2-фенил-1H-индол-5,6-дикарбоновая кислота
Раствор 0.006 моль 4-нитро-5-(2-оксо-2-фенилэтил)фталонитрила в 5 мл 85% серной кислоты нагревают при температуре 100-110°C в течение 28 ч. Затем реакционную массу охлаждают, разбавляют 50 мл воды со льдом. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из спирта. Сушат на воздухе. Далее к раствору 0.01 моль двухлористого олова в 2 мл концентрированной соляной кислоты прибавляют раствор 0.003 моль 4-нитро-5-(2-оксо-2-фенилэтил)бензол-1,2-дикарбоновой кислоты в 2 мл спирта и перемешивают при температуре 35°C в течение полутора часов. Полученную реакционную массу охлаждают, а образовавшийся осадок 1-гидрокси-2-фенил-1H-индол-5,6-дикарбоновой кислоты отфильтровывают и перекристаллизовывают из спирта. Получают 0.61 г (73% от теории) 1-гидрокси-2-фенил-1H-индол-5,6-дикарбоновой кислоты - кристаллический осадок светло зеленого цвета, Тпл 234-235°C (с разложением). ИК (ν/cm-1): 3368 (OH), 1691 (С=O), 1603 (C=C). Масс-спектр (ЭУ, 70 эВ), m/z (%): 279 [М+-18] (49), 263 (38), 219 (15), 191 (54), 104 (17), 69 (41) 44 (100). ЯМР 1H (ДМСО-d6 δ, м.д., J/Гц) δ: 6.83 (s. 1Н, Н-3), 7.44 (t, 1Н, Н-4', J 7.7), 7.53 (t, 2Н, Н-3', Н-5', J 7.7), 7.55 (d, 2Н, Н-2', Н-6', J 7.7), 7.72 (s 1H, H-8), 7.93 (s, 1Н, Н-4), 11.65 (s, 1Н, ОН), 12.78. (br.s, 2Н, ОН). Найдено (%): C, 64.49; Н, 3.67; N, 4.68; C16H11NO5. Вычислено (%): C, 64.65; H, 3.73; N, 4.71.
Пример 2. 1-Гидрокси-2-(4-метилфенил)-1H-индол-5,6-дикарбоновая кислота
Раствор 0.006 моль 4-нитро-5-(2-(4-метилфенил)-2-оксоэтил)-фталонитрила в 5 мл 80% серной кислоты нагревают при температуре 110-120°C в течение 34 ч. Затем реакционную массу охлаждают, разбавляют 50 мл воды со льдом. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из спирта. Сушат на воздухе. Далее к раствору 0.01 моль двухлористого олова в 2 мл концентрированной соляной кислоты прибавляют раствор 0.003 моль 4-[2-(4-метилфенил)-2-оксоэтил]-5-нитробензол-1,2-ди-карбоновой кислоты в 2 мл спирта и перемешивают при температуре 40°C в течение полутора часов. Полученную реакционную массу охлаждают, а образовавшийся осадок 1-гидрокси-2-(4-метилфенил)-1H-индол-5,6-дикарбоновой кислоты отфильтровывают и перекристаллизовывают из спирта. Получают 0.66 г (71% от теории) 1-гидрокси-2-(4-метилфенил)-1H-индол-5,6-дикарбоновой кислоты - кристаллический осадок зеленого цвета, Тпл=244-245°C (с разложением). ИК (ν/cm-1): 3670 (OH), 1700, 1691 (С=O), 1604 (C=C). Масс-спектр (ЭУ, 70 эВ), m/z (%): 311 [M+] (4), 293 [M+-18] (100), 277 (19), 276 (27), 249 (11), 221 (31), 205 (11), 204 (22). ЯМР 1H (ДМСО-d6 δ, м.д., J/Гц) δ: 2.37 (s. 3H, Me), 6.78 (s, 1Н, Н-3), 7.33 (d, 2Н, Н-3', Н-5', J 8.1), 7.69 (s 1Н, Н-8), 7.81 (d, 2Н, Н-2', Н-6', J 8.1), 7.89 (s, 1Н, Н-4), 11.58 (s, 1Н, OH), 12.71 (br.s, 2H, OH). Найдено (%): 65.42; Н, 4.16; N, 4.47. C17H13NO5. Вычислено (%): 65.59; Н, 4.21; N, 4.50.
Пример 3. 1-Гидрокси-2-(4-метоксифенил)-1Н-индол-5,6-дикарбоно-вая кислота
Раствор 0.006 моль 4-нитро-5-(2-(4-метоксифенил)-2-оксоэтил)-фталонитрила в 5 мл 90% серной кислоты нагревают при температуре 110-120°C в течение 36 ч. Затем реакционную массу охлаждают, разбавляют 50 мл воды со льдом. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из спирта. Сушат на воздухе. Далее к раствору 0.01 моль двухлористого олова в 2 мл концентрированной соляной кислоты прибавляют раствор 0.003 моль 4-[2-(4-метоксифенил)-2-оксо-этил]-5-нитробензол-1,2-дикарбоновой кислоты в 2 мл спирта и перемешивают при температуре 40°C в течение полутора часов. Полученную реакционную массу охлаждают, а образовавшийся осадок 1-гидрокси-2-(4-метоксифенил)-1Н-индол-5,6-дикарбоновой кислоты отфильтровывают и перекристаллизовывают из спирта. Получают 0.79 г (80% от теории) 1-гидрокси-2-(4-метоксифенил)-1Н-индол-5,6-дикарбоновой кислоты - кристаллический осадок зеленого цвета, Тпл 225-226°C (с разложением). ИК (ν/cm-1): 3368 (ОН), 1691 (C=O), 1607 (C=C). Масс-спектр (ЭУ, 70 эВ), m/z (%): 327 [М+] (16), 309 [М+-18] (100), 293 (60), 283 (84), 221 (17), 220 (36), 177 (11). ЯМР 1H (ДМСО-d6 δ, м.д., J/Гц) δ: 3.82 (s, 3H, OMe), 6.72 (s. 1Н, Н-3), 7.08 (d, 2Н, Н-3', Н-5', J 8.8), 7.68 (s 1H, H-8), 7.85 (d, 2Н, Н-2', Н-6', J 8.8), 7.86 (s, 1H, Н-4), 11.55 (s, 1H, OH), 12.69 (br.s, 2H, ОН). Спектр ЯМР 13C (ДМСО-d6 δ, м.д.): 169.60, 169.38, 159.53, 139.95, 134.44, 129.37 (2С), 126.24, 125.02, 123.49, 122.44, 121.28, 114.27 (2С), 109.40, 96.21, 55.38. Найдено (%): C, 62.26; Н, 3.93; N, 4.25; C17H13NO6. Вычислено (%): C, 62.39; H, 4.00; N, 4.28.
Пример 4. 1-Гидрокси-2-(тиофен-2-ил)-1Н-индол-5,6-дикарбоновая кислота
Раствор 0.006 моль 4-нитро-5-(2-оксо-2-(2-тиенил)этил)фталонитрила в 5 мл 85% серной кислоты нагревают при температуре 100-110°C в течение 20 ч. Затем реакционную массу охлаждают, разбавляют 50 мл воды со льдом. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из спирта. Сушат на воздухе. Далее к раствору 0.01 моль двухлористого олова в 2 мл концентрированной соляной кислоты прибавляют раствор 0.003 моль 4-нитро-5-(2-оксо-2-(тиофен-2-ил)этил)-1,2-дикарбоновой кислоты в 2 мл спирта и перемешивают при температуре 50°C в течение полутора часов. Полученную реакционную массу охлаждают, а образовавшийся осадок 1-гидрокси-2-(тиофен-2-ил)-1Н-индол-5,6-дикарбоновой кислоты отфильтровывают и перекристаллизовывают из спирта. Получают 0.76 г (83% от теории) 1-гидрокси-2-(тиофен-2-ил)-1Н-индол-5,6-дикарбоновой кислоты - кристаллический осадок желтого цвета, Тпл=230-231°C (с разложением). ИК (ν/cm-1): 3368 (OH), 1693 (C=O), 1608 (C=C). Масс-спектр (ЭУ, 70 эВ), m/z (%): 285 [М+-18] (100), 268 (45), 213 (20), 196 (56), 98 (15), 87 (10). ЯМР 1H (ДМСО-d6 δ, м.д., J/Гц) δ: 6.89 (s, 1Н, Н-3), 7.22 (t, 1Н, Н-4' J 3.6/5.0), 7.68 (s, 1Н, Н-8), 7.70 (d, 1Н, H-5', J 5.0), 7.78 (d, 1H, H-3', J 3.6), 7.88 (s, 1H, H-4), 11.91 (s, 1H, OH), 12.72 (br.s, 2H, ОН). Спектр ЯМР 13C (ДМСО-d6 δ, м.д.): 169.51, 169.26, 134.44, 133.88, 130.82, 127.86, 127.75, 126.89, 126.52, 125.34, 123.51, 121.39, 109.35, 95.52. Найдено (%): C, 55.29; H, 2.91; N, 4.59. C14H9NO5S. Вычислено (%): C, 55.44; Н, 2.99; N, 4.62.
Техническим результатом изобретения является получение новых химических соединений достаточной степени чистоты, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ, лекарственных препаратов.
Способ получения 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбоновых кислот:
где R=С6Н5 или 4-СН3С6Н4, или 4-ОСН3С6Н4, или 2-тиенил,
заключающийся в том, что метод синтеза включает две стадии, при этом на первой стадии замещенные 4-нитро-5-(2-оксоэтил)фталонитрилы нагревают в растворе серной кислоты с массовой долей 75…90% при температуре 100…120°С в течение 20-36 ч, после завершения реакции полученную реакционную массу охлаждают, разбавляют десятикратным избытком холодной воды со льдом, далее выпавший осадок 4-[2-R-2-оксоэтил]-5-нитробензол-1,2-дикарбоновых кислот отфильтровывают, промывают водой, перекристаллизовывают из спирта и сушат на воздухе, а на второй стадии к раствору двухлористого олова в концентрированной соляной кислоте при температуре 30…50°С при интенсивном перемешивании прибавляют раствор соответствующих 4-[2-R-2-оксоэтил]-5-нитробензол-1,2-дикарбоновых кислот в этиловом спирте при мольном соотношение 3.0-4.5:1 соответственно и времени реакции 1-2 ч, затем полученную реакционную массу охлаждают, образовавшийся осадок 2-замещенных 1-гидрокси-1H-индол-5,6-дикарбоновых кислот отфильтровывают и перекристаллизовывают из спирта, сушат на воздухе.