Антитела и иммуноконъюгаты, визуализируемые при помощи иммуно-позитрон-эмиссионной томографии, и способы их применения
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано для определения присутствия белка STEAP-1 в биологическом образце, полученном от индивида, имеющего подозрение на метастатический рак предстательной железы. Для этого биологический образец подвергают воздействию меченного 89цирконием антитела против STEAP-1 и измеряют связывание меченного 89цирконием антитела против STEAP-1 с белком в биологическом образце. При этом связывание меченного 89цирконием антитела против STEAP-1 с белком является показателем присутствия белка STEAP-1 в образце. Меченное 89цирконием антитело против STEAP-1 содержит вариабельную область тяжелой цепи, содержащую гипервариабельную область CDR-H1, содержащую GYSITSDYAWN, CDR-H2, содержащую GYISNSGSTSYNPSLKS, и CDR-H3, содержащую ERNYDYDDYYYAMDY; и вариабельную область легкой цепи, содержащую CDR-L1, содержащую KSSQSLLYRSNQKNYLA, CDR-L2, содержащую WASTRES, и CDR-L3, содержащую QQYYNYPRT, и меченное 89цирконием антитело против STEAP-1 представляет собой 89цирконий-десферриоксамид (Df) антитело против STEAP-1. Изобретение позволяет определять присутствия белка STEAP-1 в биологическом образце, полученном от индивида, с метастатическим раком предстательной железы. 5 з.п. ф-лы, 2 табл., 30 ил., 10 пр.
Реферат
Родственная заявка
По настоящей заявке испрашивается приоритет предварительной заявки на патент США № 61/351195, поданной 3 июня 2010 г., которая включена в настоящее описание изобретения в качестве ссылки в полном объеме.
Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам против STEAP-1 и их иммуноконъюгатам. Настоящее изобретение далее относится к способам применения антител против STEAP-1 и их иммуноконъюгатов.
Уровень техники
Рак предстательной железы является одной из наиболее часто диагностируемых злокачественных новообразований у мужчин и второй по распространенности причиной смерти людей от рака. По оценке Американского онкологического общества к 2000 г. будет диагностировано 180400 новых случаев рака предстательной железы и данное заболевание станет причиной смерти 31900 людей. На поздних стадиях развития рак предстательной железы метастазирует в кость. Несмотря на достижения, связанные с ранней диагностикой и лечением локальных опухолей, рак предстательной железы становится неизлечимым после образования метастазов. У индивидов с метастазирующим раком предстательной железы, проходящих курс лечения гормональными препаратами, в конце концов возникает резистентность к андрогену (андрогеннезависимое состояние), что вызывает прогрессирование болезни и смерть. В настоящее время широко используемым маркером опухоли для скрининга, диагностики и мониторинга рака предстательной железы является простатоспецифический антиген (PSA). Однако широкое применение PSA в качестве инструмента для скрининга является весьма спорным, так как PSA не позволяет точно отличить доброкачественное и злокачественное заболевание предстательной железы.
В зависимости от стадии рака предстательной железы и мочевого пузыря лечение включает один способ или комбинацию нижеследующих способов лечения: хирургическую операцию для удаления раковой ткани, лучевую терапию, химиотерапию, депривацию андрогена (например, гормональную терапию) в случае рака предстательной железы. Хотя хирургическая операция или лучевая терапия в значительной степени способствуют выживанию индивидов на ранних стадиях заболевания, возможности лечения очень ограничены на поздних стадиях заболевания, особенно в случае рецидива опухоли после устранения гормона. У большинства индивидов, прошедших курс гормональной терапии, продолжает развиваться андрогеннезависимое заболевание. В настоящее время отсутствует эффективное лечение для 20-40% индивидов с раком предстательной железы, у которых возникает рецидив заболевания после хирургической операции или лучевой терапии и у которых рак уже метастазировал в момент постановки диагноза. Химиотерапия вызывает токсические побочные эффекты, особенно у пожилых индивидов. Разработка новых форм лечения, особенно для заболевания, резистентного к отсутствию андрогена, является насущной потребностью при лечении рака предстательной железы.
В научной литературе (см. патент США № 6329503) был описан новый антиген на поверхности клетки, STEAP-1. STEAP-1 относится к трансмембранным антигенам змеевидного типа на поверхности клетки. Указанный антиген экспрессирован главным образом в раке предстательной железы, поэтому члены данного семейства получили название ”STEAP” (шесть трансмембранных эпителиальных антигенов предстательной железы). Белки STEAP человека характеризуются высокой степенью структурного консерватизма в данном семействе и не обладают значительной структурной гомологией с любыми известными белками человека. STEAP-1 является мембранным белком типа IIIa, экспрессированным главным образом в клетках предстательной железы нормальных тканей человека. В структурном отношении белок STEAP-1 состоит из 339 аминокислот, имеет шесть трансмембранных доменов и N- и С-концы внутри клетки, из чего следует, что укладка цепи данного белка происходит по ”змеевидному” принципу, образуя три внеклеточные и две внутриклеточные петли. Белок STEAP-1 высоко экспрессирован на разных стадиях рака предстательной железы. STEAP-1 сверхэкспрессирован в других раках человека, таких как рак легкого и рак ободочной кишки. Были созданы антитела мыши к фрагментам STEAP-1 человека, которые, как было показано, связываются с STEAP-1 на поверхности клетки (см. заявку на патент США № 20040253232А1).
Терапия на основе антител оказалась очень эффективной при лечении разных типов рака. Например, препараты герцептин® и ритуксан® (компании Genentech, S. San Francisco) были успешно использованы при лечении соответственно рака молочной железы и неходжкинской лимфомы. Герцептин® является гуманизированным моноклональным антителом, выделенным из рекомбинантной ДНК, которое избирательно связывается с внеклеточным доменом протоонкогена рецептора эпидермального фактора роста 2 человека (HER2). Сверхэкспрессия белка HER2 наблюдается в 25-30% случаев первичного рака молочной железы. Ритуксан® является генетически созданным химерным моноклональным антителом мыши/человека против антигена CD20, обнаруженного на поверхности нормальных и злокачественных В-лимфоцитов. Оба указанных антитела продуцированы в клетках СНО.
Использование конъюгатов антитела с лекарственным средством для местной доставки цитотоксических или цитостатических агентов, то есть лекарственных средств для уничтожения или ингибирования опухолевых клеток при лечении рака (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg. Del. Rev. 26:151-172; патент США № 4975278), позволяет осуществлять направленную доставку лекарственной части в опухоли и накапливать лекарственное средство внутри клетки, когда системная доставка неконъюгированных лекарственных средств может вызвать неприемлемые уровни токсичности для нормальных клеток наряду с опухолевыми клетками, подлежащими устранению (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) “Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review,” in Monoclonal Antibodies ’84: Biological And Clinical Applications, A. Pinchera et al. (ed.s), pp. 475-506). При данном способе введения достигается максимальная эффективность при минимальной токсичности. Как отмечалось в научной литературе, в указанных способах лечения могут быть использованы как поликлональные антитела, так и моноклональные антитела (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лекарственные средства, используемые в указанных способах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., Cancer Immunol. Immunother. 21:183-87 (1986)). Токсины, используемые в антитело-токсиновых конъюгатах, включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Kerr et al. (1997) Bioconjugate Chem. 8(6):781-784; Mandler et al. (2000) Journal of the Nat. Cancer Inst. 92(19):1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al. (2002) Bioconjugate Chem. 13:786-791), майтанзиноиды (европейский патент 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихеамицин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (1993) Cancer Res. 53:3336-3342). Токсины могут оказывать цитотоксическое и цитостатическое действие при помощи механизмов, включающих связывание тубулина, связывание ДНК или ингибирование топоизомеразы (Meyer, D.L. and Senter, P.D. “Recent Advances in Antibody Drug Conjugates for Cancer Therapy” in Annual Reports in Medicinal Chemistry, Vol. 38 (2003) Chapter 23, 229-237). Некоторые цитотоксические лекарственные средства становятся неактивными или менее активными при конъюгировании с крупными антителами или лигандами рецепторов белка.
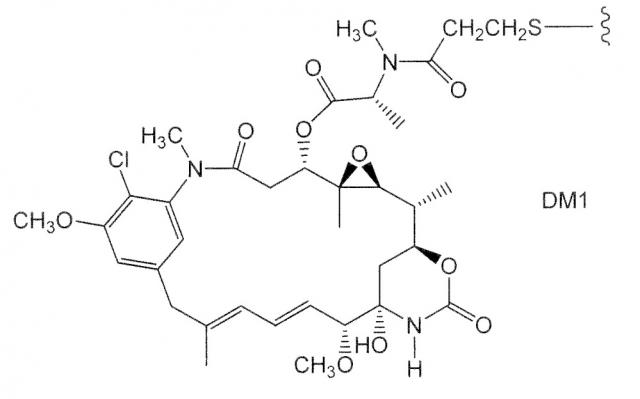
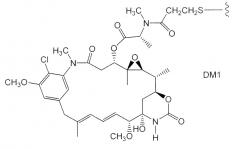
Зевалин® (ибритумомаб тиуксетан, Biogen/Idec) является конъюгатом антитела с радиоактивным изотопом, который состоит из мышиного моноклонального антитела IgG1 с каппа-цепью, направленного против антигена CD20, обнаруженного на поверхности нормальных и злокачественных В-лимфоцитов, и радиоактивного изотопа 111In или 90Y, связанного хелатообразователем с тиомочевинным линкером (Wiseman et al. (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al. (2002) Blood 99(12):4336-42; Witzig et al. (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al. (2002) J. Clin. Oncol. 20(15):3262-69). Хотя зевалин активно воздействует на В-клеточную неходжкинскую лимфому (NHL), при его введении у большинства индивидов возникает тяжелая и продолжительная цитопения. Милотарг™ (гемтузумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитела с лекарственным средством, состоящий из антитела человека против CD33-клеток, связанного с калихеамицином, был утвержден в 2000 г. для лечения острого миелоидного лейкоза путем инъекций (Drugs of the Future (2000) 25(7):686; патенты США №№ 4970198, 5079233, 5585089, 5606040, 5693762, 5739116, 5767285, 5773001). Кантузумаб мертанзин (Immunogen, Inc.), конъюгат антитела с лекарственным средством, состоящий из антитела C242 человека, связанного при помощи дисульфидного линкера SPP с майтанзиноидом, DM1, разработан для лечения злокачественных новообразований, экспрессирующих антиген CanAg, таких как рак ободочной кишки, поджелудочной железы, желудка и других. MLN-2704 (Millennium Pharm., BZL Biologics, Immunogen Inc.), конъюгат антитела с лекарственным средством, состоящий из моноклонального антитела против простатоспецифического мембранного антигена (PSMA), связанного с майтанзиноидом, DM1, находится в стадии разработки предположительно для лечения опухолей предстательной железы. Такой же майтанзиноид, DM1, был связан при помощи линкера SMCC, отличного от дисульфидного линкера, с моноклональным антителом мыши ТА.1 (Chari et al. (1992) Cancer Research 52:127-131). В научной литературе отмечалось, что указанный конъюгат является в 200 раз менее активным, чем соответствующий конъюгат с дисульфидным линкером. Линкер SMCC был признан ”нерасщепляемым”.
Из морского моллюска Dolabella auricularia было выделено несколько короткоцепных пептидных соединений, у которых была обнаружена биологическая активность (Pettit et al. (1993) Tetrahedron 49:9151; Nakamura et al. (1995) Tetrahedron Letters 36:5059-5062; Sone et al. (1995) Journal Org. Chem. 60:4474). Также были получены аналоги указанных соединений, при этом было установлено, что некоторые из них обладают биологической активностью (обзор таких соединений представлен в публикации Pettit et al. (1998) Anti-Cancer Drug Design 13:243-277). Например, ауристатин Е (патент США № 5635483) является синтетическим аналогом морского природного продукта доластатина 10, средства, ингибирующего полимеризацию тубулина благодаря связыванию с тем же сайтом тубулина, что и противораковое лекарственное средство винкристин (G.R. Pettit, (1997) Prog. Chem. Org. Nat. Prod. 70:1-79). Доластатин 10, ауристатин РЕ и ауристатин Е являются линейными пептидами, содержащими четыре аминокислоты, три из которых являются уникальными для соединений класса доластатина, и С-концевой амид.
Пептиды ауристатина, ауристатин Е (АЕ) и монометилауристатин (ММАЕ), синтетические аналоги доластатина, были конъюгированы с: (i) химерными моноклональными антителами cBR96 (специфичными к антигену Левиса Y на карциномах); (ii) сАС10, специфичным к CD30 на гематологических злокачественных новообразованиях (Klussman, et al. (2004), Bioconjugate Chemistry 15(4):765-773; Doronina et al. (2003) Nature Biotechnology 21(7):778-784; “Monomethylvaline Compounds Capable of Conjugation to Ligands”; Francisco et al. (2003) Blood 102(4):1458-1465; заявка на патент США 2004/0018194; (iii) антителами против CD20-клеток, такими как ритуксан® (ритуксимаб) (WO 04/032828), предназначенными для лечения CD20-экспрессирующих злокачественных новообразований и иммунных нарушений; (iv) антителами против EphB2 2Н9 и антителами против IL-8, предназначенными для лечения колоректального рака (Mao et al. (2004) Cancer Research 64(3):781-788; (v) антителом Е-селектином (Bhaskar et al. (2003) Cancer Res. 63:6387-6394) и (vi) другими антителами против CD30-клеток (WO 03/043583). Монометилауристатин (ММАЕ) был также конъюгирован с антителом 2Н9 против EphB2R, который является рецептором тирозинкиназы ТМ типа 1, характеризующимся близкой гомологией у мыши и человека, который сверхэкспрессирован в клетках колоректального рака (Mao et al. (2004) Cancer Res. 64:781-788).
Монометилауристатин MMAF, вариант ауристатина Е (ММАЕ), с фенилаланином у С-конца (патент США № 5767237, патент США № 6124431), как сообщалось в научной литературе, является менее активным, чем ММАЕ, но становится более эффективным при конъюгировании с моноклональными антителами (Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, presented March 28, 2004). Ауристатин F фенилендиамин (AFP), фенилаланиновый вариант ММАЕ, был связан с моноклональным антителом против CD70-клеток, 1F6, у С-конца 1F6 при помощи фенилендиаминового спейсера (Law et al., Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 625, presented Match 28, 2004).
В данной области существует потребность в дополнительных лекарственных средствах для лечения разных злокачественных новообразований, таких как раки и метастазы раков предстательной железы, легкого и ободочной кишки. Особенно полезными лекарственными средствами для указанной цели являются конъюгаты антитела против STEAP-1 с лекарственным средством, направленно воздействующие на клетки предстательной железы, легкого или ободочной кишки, которые обладают значительно более низкой токсичностью и приемлемой терапевтической эффективностью. Целью настоящего изобретения является устранение вышеуказанных и других ограничений и проблем, имевших место в прошлом.
Молекулярная визуализация является важным инструментом разработки и оценки новых фармацевтических средств. Иммуно-позитрон-эмиссионная томография (иммуно-ПЭТ) является способом быстрой визуализации для отслеживания и количественного определения моноклональных антител (mAb) in vivo, так как данный способ эффективно сочетает высокую чувствительность ПЭТ с высокой специфичностью моноклональных антител. Иммуно-ПЭТ является клиническим способом неинвазивной диагностики, обеспечивающим ”всестороннее иммуногистохимическое окрашивание in vivo” (van Dongen GA et al. “Immuno-PET: a navigator in monoclonal antibody development and applications” Oncologist 2007; 12:1379-89; Williams et al. (2001) Cancer Biother. Radiopharm. 16:25-35; Hollinger et al. (2005) Nat. Biotechnol. 23:1126-36)). Создание иммуно-ПЭТ на основе 89Zr сделало возможным измерение экспрессии мишени и биораспределения антител у мышей и человека; клиническое применение иммуно-ПЭТ с 89Zr-трастузумабом позволяет увидеть гетерогенную структуру метастазов в печени и кости (Dijkers et al., Nature Vol. 87 Number 5 (May 2010).
Системы визуализации ПЭТ создают изображения на основе распределения позитрон-излучающих изотопов в ткани индивида. Изотопы обычно вводят индивиду путем инъекции молекул зонда, содержащих позитрон-излучающий изотоп, такой как F-18, C-11, N-13 или О-15, ковалентно связанный с молекулой, которая легко метаболизируется или локализуется в организме (например, глюкоза), или химически связываются с сайтами рецепторов в организме. В некоторых случаях изотоп вводят индивиду в виде ионного раствора или путем ингаляции. Мелкие агенты, визуализируемые при помощи иммуно-ПЭТ, такие как Fab-фрагменты антитела (50 кДа) или диатела, спаренные димеры ковалентно связанной VH-VK области моноклонального антитела, 55 кДа (Shively et al. (2007) J. Nucl. Med. 48:170-2), могут быть особенно полезны, характеризуясь коротким временем полужизни в кровотоке, высокой проникаемостью в ткани и оптимальным соотношением радиоактивности между опухолью и фоном в течение двух-четырех часов после инъекции, что облегчает использование изотопов с коротким периодом полураспада, таких как широко используемый 18F (109,8 мин).
Любые ссылки, приведенные в настоящей заявке, не являются признанием того, что данная ссылка служит прототипом данной заявки. Все ссылки, приведенные в настоящей заявке, включая патенты, заявки на патенты и публикации, включены в настоящее описание изобретения в качестве ссылки в полном объеме.
Сущность изобретения
Настоящее изобретение относится к антителам против STEAP-1 и способам их применения.
В одном из аспектов настоящее изобретение относится к антителу, связывающемуся с STEAP-1, которое содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2А (SEQ ID NO:6), или вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2В (SEQ ID NO:9). В одном из аспектов настоящее изобретение относится к антителу, связывающемуся с STEAP-1, которое содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2А (SEQ ID NO:6), и вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2В (SEQ ID NO:9).
В одном из аспектов настоящее изобретение относится к антителу, связывающемуся с STEAP-1, которое содержит вариабельный домен тяжелой цепи, последовательность которого по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотной последовательности SEQ ID NO:9 или 10. В одном из вариантов осуществления изобретения антитело содержит вариабельный домен тяжелой цепи SEQ ID NO:9 или 10. В одном из вариантов осуществления изобретения антитело содержит остовную область 1 вариабельного домена тяжелой цепи SEQ ID NO:25, остовную область 2 вариабельного домена тяжелой цепи SEQ ID NO:75, 76 или 77, или остовную область 3 вариабельного домена тяжелой цепи SEQ ID NO:78 или 79.
В одном из аспектов настоящее изобретение относится к антителу, содержащему вариабельный домен легкой цепи, последовательность которого по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотной последовательности SEQ ID NO:6. В одном из вариантов осуществления изобретения антитело содержит вариабельный домен легкой цепи SEQ ID NO:6.
В одном из аспектов настоящее изобретение относится к антителу, связывающемуся с STEAP-1, которое содержит вариабельный домен тяжелой цепи, последовательность которого по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотной последовательности SEQ ID NO:9 или 10. В одном из вариантов осуществления изобретения антитело содержит вариабельный домен тяжелой цепи SEQ ID NO:9 или 10. В одном из вариантов осуществления изобретения антитело содержит остовную область 1 вариабельного домена тяжелой цепи SEQ ID NO:25, остовную область 2 вариабельного домена тяжелой цепи SEQ ID NO:75, 76 или 77, или остовную область 3 вариабельного домена тяжелой цепи SEQ ID NO:78 или 79. В одном из вариантов осуществления изобретения антитело далее содержит вариабельный домен легкой цепи, последовательность которого по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотной последовательности SEQ ID NO:6. В одном из вариантов осуществления изобретения антитело содержит вариабельный домен легкой цепи SEQ ID NO:6.
Определенные варианты осуществления изобретения относятся к полинуклеотиду, кодирующему любое из вышеуказанных антител. Один из вариантов осуществления изобретения относится к вектору, содержащему указанный полинуклеотид. Один из вариантов осуществления изобретения относится к клетке-хозяину, содержащей указанный вектор. В одном из вариантов осуществления изобретения клетка-хозяин является эукариотической клеткой. В одном из вариантов осуществления изобретения клетка-хозяин является клеткой яичника китайского хомячка (СНО). В одном из вариантов осуществления изобретение относится к способу получения антитела против STEAP-1, который включает культивирование клетки-хозяина в условиях, пригодных для экспрессии полинуклеотида, кодирующего антитело, и выделение указанного антитела.
В одном из аспектов настоящее изобретение относится к антителу, связывающемуся с STEAP-1, экспрессированным на поверхности клетки. В одном из вариантов осуществления изобретения антитело связывается с эпитопом в области STEAP-1 человека или мыши. В одном из вариантов осуществления изобретения клетка является клеткой млекопитающего. В одном из вариантов осуществления изобретения клетка является клеткой человека. В одном из вариантов осуществления изобретения клетка является раковой клеткой. В одном из вариантов осуществления изобретения клетка является клеткой предстательной железы, легкого или ободочной кишки. В одном из вариантов осуществления изобретения раковая клетка является раковой клеткой предстательной железы. В другом варианте осуществления изобретения клетка является клеткой из метастаза первичного рака предстательной железы, легкого или ободочной кишки.
В определенных вариантах осуществления изобретения любое из вышеуказанных антител является моноклональным антителом. В одном из вариантов осуществления изобретения антитело является фрагментом антитела, выбираемым из Fab, Fab'-SH, Fv, scFv или (Fab')2 фрагмента. В одном из вариантов осуществления изобретения антитело является гуманизированным антителом. В одном из вариантов осуществления изобретения антитело является антителом человека.
В одном из аспектов настоящее изобретение относится к способу обнаружения STEAP-1 в биологическом образце, который включает приведение в контакт биологического образца с любым из вышеуказанных антител в условиях, допускающих связывание антитела с STEAP-1 и обнаружение комплекса, образованного между антителом и STEAP-1. В одном из вариантов осуществления изобретения биологический образец включает клетки предстательной железы. В одном из вариантов осуществления изобретения биологический образец получают у млекопитающего с подозрением на наличие или с наличием нарушения клеток предстательной железы и/или с пролиферативным нарушением клеток или тканей, которое включает, не ограничиваясь ими, рак предстательной железы, легкого, ободочной кишки, мочевого пузыря, яичника и саркому Юинга, а также метастазы первичного рака предстательной железы, легкого, ободочной кишки, мочевого пузыря, яичника и саркомы Юинга. См., например, патент США № 6329503 и публикацию Rodeberg, D.A. et al., Clin. Cancer Res. 11(12):4545-4552 (2005)).
В одном из аспектов настоящее изобретение относится к способу диагностики пролиферативного нарушения клеток, связанного с повышенной экспрессией STEAP-1, который включает приведение в контакт исследуемой клетки с любым из вышеуказанных антител, определение уровня экспрессии STEAP-1 путем обнаружения связывания антитела с белком STEAP-1 и сравнение уровня экспрессии STEAP-1 в исследуемой клетке с уровнем экспрессии STEAP-1 в контрольной клетке, при этом более высокий уровень экспрессии STEAP-1 в исследуемой клетке по сравнению с контрольной клеткой указывает на наличие пролиферативного нарушения клетки, связанного с повышенной экспрессией STEAP-1. В одном из вариантов осуществления изобретения исследуемая клетка является клеткой индивида с подозрением на наличие пролиферативного нарушения клеток, такого как пролиферативное нарушение предстательной железы. В одном из вариантов осуществления изобретения пролиферативное нарушение клеток выбирают из нарушений клеток предстательной железы, которые включают, не ограничиваясь ими, рак предстательной железы. В одном из вариантов осуществления изобретения указанный способ включает определение уровня экспрессии STEAP-1 на поверхности исследуемой клетки (такой как, например, раковая клетка предстательной железы) и сравнение уровня экспрессии STEAP-1 на поверхности исследуемой клетки с уровнем экспрессии STEAP-1 на поверхности контрольной клетки (такой как, например, нормальная клетка предстательной железы в отличие от анормально пролиферирующей клетки предстательной железы).
В одном из аспектов настоящее изобретение относится к способу диагностики пролиферативного нарушения клеток, связанного с увеличением в клетках, таких как клетки предстательной железы, экспрессии STEAP-1, который включает приведение в контакт исследуемых клеток в биологическом образце с любым из вышеуказанных антител, определение уровня антитела, связанного с исследуемыми клетками в образце, путем обнаружения связывания антитела с STEAP-1 и сравнение уровня антитела, связанного с клетками, в контрольном образце, при этом уровень связанного антитела нормализован относительно числа клеток, экспрессирующих STEAP-1, в исследуемом и контрольном образцах, при этом более высокий уровень связанного антитела в исследуемом образце по сравнению с контрольным образцом указывает на наличие пролиферативного нарушения клетки, связанного с клетками, экспрессирующими STEAP-1.
В одном из аспектов настоящее изобретение относится к способу обнаружения растворимого STEAP-1 в крови или сыворотке, который включает приведение в контакт исследуемого образца крови или сыворотки, полученного у млекопитающего с подозрением на пролиферативное нарушение клеток предстательной железы, с антителом против STEAP-1 по настоящему изобретению и обнаружение увеличения растворимого STEAP-1 в исследуемом образце по сравнению с контрольным образцом крови или сыворотки, полученным у здорового млекопитающего. В одном из вариантов осуществления изобретения указанный способ обнаружения может быть использован в качестве способа диагностики пролиферативного нарушения клеток предстательной железы, связанного с увеличением растворимого STEAP-1 в крови или сыворотке млекопитающего.
В одном из аспектов настоящее изобретение относится к сконструированным антителам с цистеиновой заменой, в которых одна или несколько аминокислот материнского антитела заменены свободной аминокислотой цистеином, как описано в публикации WO2006/034488 (которая включена в настоящее описание изобретения в качестве ссылки в полном объеме). Сконструированное антитело с цистеиновой заменой содержит одну или несколько свободных аминокислот, являющихся цистеином, которые имеют значение реакционной способности тиоловой группы в пределах 0,6-1,0. Свободная аминокислота является остатком цистеина, который был введен в материнское антитело и не является частью дисульфидной мостиковой связи. Сконструированные антитела с цистеиновой заменой могут быть использованы для присоединения цитотоксических и/или визуализирующих соединений на сайте введенного цистеина, например, при помощи имида малеиновой кислоты или галогенацетила. Нуклеофильное взаимодействие функциональной тиоловой группы остатка Cys с группой имида малеиновой кислоты примерно в 1000 раз выше по сравнению с любой другой функциональной группой аминокислоты в белке, такой как аминогруппа остатков лизина или N-концевая аминогруппа. Специфическая функциональная тиоловая группа в иодацетиле и имиде малеиновой кислоты может взаимодействовать с аминогруппами, но для этого необходимо более высокое значение рН (>9,0) и более продолжительное время взаимодействия (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London).
Сконструированные антитела с цистеиновой заменой могут быть использованы при лечении рака и включают антитела, специфичные к поверхности клетки, трансмембранным рецепторам и опухолеспецифическим антигенам (ТАА). Такие антитела могут быть использованы в качестве “голых” антител (неконъюгированных с лекарственным средством или меткой) или в виде конъюгатов антитела с лекарственным средством (ADC). Сконструированные антитела с цистеиновой заменой по настоящему изобретению могут быть сайтспецифически и эффективно связаны с реагентом, взаимодействующим с тиоловой группой. Реагент, взаимодействующий с тиоловой группой, может быть многофункциональным линкером, иммобилизованной меткой, флуорофором или промежуточным соединением лекарственного средства с линкером. Сконструированное антитело с цистеиновой заменой может быть помечено детектируемой меткой, иммобилизовано на твердой подложке и/или конъюгировано с лекарственной частью. Реакционная способность тиоловой группы может быть сообщена любому антителу, в котором возможна замена аминокислот реакционноспособными остатками цистеина в легкой цепи в положениях: от L-10 до L-20, от L-38 до L-48, от L-105 до L-115, от L-139 до L-149, от L-163 до L-173; в тяжелой цепи в положениях: от Н-35 до Н45, от Н-83 до Н-93, от Н-114 до Н-127, от Н-170 до Н-184 и в Fc-области в положениях от Н-268 до Н-291, от Н-319 до Н-344, от Н-370 до Н-380 и от Н-395 до Н-405, где нумерация положений аминокислот начинается с положения 1 по системе нумерации Kabat (Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD) и продолжается последовательно, как описано в публикации WO 2006/034488. Реакционная способность тиоловой группы может быть также сообщена определенным доменам антитела, таким как константный домен легкой цепи (CL) и константные домены тяжелой цепи, СН1, СН2 и СН3. Замены аминокислот цистеином с получением значений реакционной способности тиоловой группы, равных 0,6 и выше, могут быть произведены в константных доменах тяжелой цепи α, δ, ε, γ и μ интактных антител: соответственно, IgA, IgD, IgE, IgG и IgM, включая подклассы IgG: IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Такие антитела и их применения описаны в публикации WO 2006/034488.
Сконструированное антитело с цистеиновой заменой по настоящему изобретению, предпочтительно, сохраняют антигенсвязывающую способность материнского антитела дикого типа. Таким образом, сконструированные антитела с цистеиновой заменой могут связываться, предпочтительно, специфически, с антигенами. Такие антигены включают, например, опухолеспецифические антигены (ТАА), белки рецепторов на поверхности клетки и другие молекулы на поверхности клетки, трансмембранные белки, сигнальные белки, факторы, регулирующие выживание клетки, факторы, регулирующие пролиферацию клетки, молекулы, связанные с развитием или дифференцировкой тканей (которые, как известно или предположительно функционально способствуют развитию или дифференцировке тканей), лимфокины, цитокины, молекулы, участвующие в регулировании клеточного цикла, молекулы, участвующие в образовании или развитии сосудов, и молекулы, связанные с развитием кровеносных сосудов (которые, как известно или предположительно функционально способствуют развитию кровеносных сосудов).
Антитело по настоящему изобретению может быть конъюгировано с другими агентами, взаимодействующими с тиоловыми группами, в которых реакционноспособная группа, например, представляет собой малеимид, иодацетамид, пиридилдисульфид или другие партнеры, взаимодействующие с тиоловыми группами (Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55, 643-671). Указанный партнер может быть цитотоксическим агентом (например, токсином, таким как доксорубицин или коклюшевый токсин), флуорофором, таким как флуоресцентный краситель, подобный флуоресцеину или родамину, хелатообразователем для визуализирующего или радиотерапевтического металла, пептидильной или непептидильной меткой или детектирующей меткой, модификатором клиренса, таким как разные изомеры полиэтиленгликоля, пептидом, связывающимся с третьим компонентом, или другим углеводным или липофильным агентом.
В одном из аспектов настоящее изобретение относится к антителам по настоящему изобретению, конъюгированным с любой меткой, которая может быть ковалентно присоединена к антителу при помощи реакционноспособной части, активированной части или реакционноспособной тиоловой группы цистеина (Singh et al. (2002) Anal. Biochem. 304:147-15; Harlow E. and Lane, D. (1999) Using Antibodies: A Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, NY; Lundblad R.L. (1991) Chemical Reagents for Protein Modification, 2nd ed. CRC Press, Boca Raton, FL). Присоединенная метка может: (i) подавать детектируемый сигнал; (ii) взаимодействовать со второй меткой с целью изменения детектируемого сигнала, подаваемого первой или второй меткой, например, осуществлять FRET (перенос энергии резонанса флуоресценции); (iii) стабилизировать взаимодействие или повышать аффинность связывания с антигеном или лигандом; (iv) влиять на подвижность, например, электрофоретическую подвижность или проницаемость клетки с помощью заряда, гидрофобности, формы или других физических параметров, или (v) быть иммобилизованной частью, используемой для модуляции аффинность лиганда, связывания антитела/антигена или ионного комплексообразования.
Меченые сконструированные антитела с цистеиновой заменой могут быть использованы при выполнении диагностических анализов, например, для обнаружения экспрессии представляющего интерес антигена в определенных клетках, тканях или сыворотке. Антитело, предназначенное для использования в диагностике, обычно метят детектируемой частью. Существует много меток, которые можно сгруппировать в следующие категории:
Радиоактивные изотопы (радионуклиды), такие как 3Н, 11С, 14С, 18F, 32Р, 35S, 64Cu, 68Ga, 86Y, 89Zr, 99Tc, 111In, 123I, 124I, 125I, 131I, 133Xe, 177Lu, 211At или 213Bi. Антитела, меченные радиоактивными изотопами, могут быть использованы в экспериментах по визуализации рецепторов-мишеней. Антитела могут быть помечены лигандами, которые связываются, образуют хелаты или в противном случае комплексы радиоактивных изотопов металлов и взаимодействуют с тиоловой группой цистеина, введенного в антитело, при помощи способов, описанных в публикации Current Protocols in Immunology. Volumes 1 and 2, Coligen et al., Ed. Wiley-Interscience, New York, NY, Pubs. (1991). Хелатообразующие лиганды, которые могут образовывать комплекс с ионом металла, включают DOTA, DOTP, DOTMA, DTPA и TETA (Macrocyclics, Dallas, TX). Радионуклиды могут оказывать направленное воздействие в результате образования комплекса с конъюгатами антитела с лекарственным средством по настоящему изобретению (Wu et al. (2005) Nature Biotechnology 23(9):1137-1146).
Линкеры, такие как DOTA-малеимид (4-малеимидобутирамидобензил-DOTA) могут быть получены в результате взаимодействия аминобензил-DOTA с 4-малеимидомасляной кислотой (Fluka), активированной изопропилхлорформиатом (Aldrich), способом, описанным в публикации Axworthy et al. (2000) Proc. Natl. Acad. Sci. USA 97(4):1802-1807). Реагенты, представляющие собой DOTA-малеимид, взаимодействуют со свободным цистеином в сконструированных антителах с цистеиновой заменой и образуют на антителе лиганд, образующий комплекс с металлом (Lewis et al. (1998) Bioconj. Chem. 9:72-86). Хелатообразующие линкеры, меченные реагентами, такие как DOTA-NHS (моно(N-гидроксисукцинимидоэфир 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты), могут быть приобретены коммерческим путем (Macrocyclics, Dallas, TX). Визуализация рецепторов-мишеней при помощи антител, меченных радиоактивными изотопами, позволяет определить активацию пути в результате обнаружения и количественного определения последовательного накопления антител в опухолевой ткани (Albert et al. (1998) Bioorg. Med. Chem. Lett. 8:1207-1210). Конъюгированные радиоактивные металлы могут оставаться внутри клетки после расщепления лизосом.
Хелатные комплексы металлов, которые могут быть использованы в качестве меток антител в экспериментах по визуализации, описаны в патентах США № 5342606, 5428155, 5316757, 5480990, 5462725, 5428139, 5385893, 5739294, 5750660, 5834456 и публикациях Hnatowich et al. (1983) J. Immunol. Methods 65:147-157; Meares et al. (1984) Anal. Biochem. 142:68-78; Mirzadeh et al. (1990) Bioconjugate Chem. 1:59-65; Meares et al. (1990) J. Cancer1990, Suppl. 10:21-26; Izard et al. (1992) Bioconjugate Chem. 3:346-350; Nikula et al. (1995) Nucl. Med. Biol. 22:387-90; Camera et al. (1993) Nucl. Med. Biol. 20:955-62; Kukis et al. (1998) J. Nucl. Med. 39:2105-2110; Verel et al. (2003) J. Nucl. Med. 44:1663-1670; Camera et al. (1994) J. Nucl. Med. 21:640-646; Ruegg et al. (1990) Cancer Res. 50:4221-4226; Verel et al. (2003) J. Nucl. Med. 44:1663-1670; Lee et al. (2001) Cancer Res. 61:4474-4482; Mitchell, et al. (2003) J. Nucl. Med. 44:1105-1112; Kobayashi et al. (1999) Bioconjugate Chem. 10:103-111; Miederer et al. (2004) J. Nucl. Med. 45:129-137; DeNardo et al. (1998) Clinical Cancer Research 4:2483-90; Blend et al. (2003) Cancer Biotherapy & Radiopharmaceuticals 18:355-363; Nikula et al. (1999) J. Nucl. Med. 40:166-76; Kobayashi et al. (1998) J. Nucl. Med. 39:829-36; Mardirossian et al. (1993) Nucl. Med. Biol. 20:65-74; Roselli et al. (1999) Cancer Biotherapy & Radiopharmaceuticals, 14:209-20.
(b) Флуоресцентные метки, такие как хелаты редкоземельных металлов (хелаты европия), флуоресцеин разных типов, включающие FITC, 5-карбоксифлуоресцеин, 6-карбоксифлуоресцеин, родамин разных типов, включающий TAMRA, данзил, лиссамин, цианины, фикоэритрины, техасский красный и их аналоги. Флуоресцентные метки могут быть конъюгированы с антителами способами, описанными, например, в приведенной выше публикации Current Protocols in Immunology. Флуоресцентные красители и флуоресцентные метки включают реагенты, которые могут быть приобретены коммерческим путем в компаниях Invitrogen/Molecular Probes (Eugene, OR) и Pierce Biotechnology, Inc. (Rockford, IL).
(с) Разные ферментные субстраты, используемые в качестве меток и описанные в научных публикациях (патент США № 4275149). Фермент обычно катализирует химическое изменение хромогенного субстрата, которое может быть измерено разными способами. Например, фермент может катализировать изменение цвета субстра