Способ диагностики точечных мутаций в нативной днк с применением оксида графена
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к молекулярно-генетическим способам диагностики точечных мутаций в нативной ДНК. Сущность способа заключается в том, что для диагностики точечной мутации (замены, инсерции, делеции) в нативной ДНК проводится аллель-специфичная ПЦР с двумя флуоресцентно меченными прямыми праймерами, комплементарными последовательностям ДНК разных аллелей в области сайта мутации, и обратным общим праймером с последующим добавлением суспензии оксида графена (в качестве селективного наноструктурного тушителя флуоресценции) к продуктам ПЦР и измерением интенсивностей флуоресценции конечного раствора по двум каналам флуоресценции, соответствующим флуоресцентным меткам прямых праймеров. Для сравнения и получения результатов диагностики используются отрицательные контрольные образцы, не содержащие ДНК на стадии ПЦР. Сравнение интенсивностей флуоресценции в конечном растворе анализируемого образца ДНК по двум каналам флуоресценции с аналогичными интенсивностями для отрицательного контроля позволяет определить генотип анализируемого образца ДНК. При этом для диагностики мутации 4582insT в 25 экзоне гена CUL7, вызывающей 3М-синдром у якутов, прямыми праймерами являются олигонуклеотиды: 5'-FAM-CAGGGGTCCTCAAGATTTCG-3'; 5'-ROX-CAGGGGTCCTCAAGATTCG-3'; обратным праймером является олигонуклеотид: 5'-GATGAGGCAGTTCAGAAGATTCC-3'. Преимущество изобретения заключается в разработке достоверного способа диагностики точечных мутаций (замен, инсерций, делеций) в нативной ДНК с применением оксида графена в качестве селективного тушителя флуоресценции, перспективного для разработки методов ДНК-диагностики наследственных и наследственно предрасположенных заболеваний, фармакогенетических тестов. 2 н.п. ф-лы, 4 ил., 3 табл.
Реферат
Изобретение относится к области медицины, а именно к молекулярно-генетическим методам диагностики точечных мутаций в нативной ДНК.
В современной медицинской генетике существует несколько основных и самых распространенных методов для диагностики точечных мутаций в нативной ДНК (см. Mamotte, C. D. S. Genotyping of single nucleotide substitutions. Clin. Biochem. Rev. 27, 63–75 (2006)): ПЦР-ПДРФ-анализ, флуоресцентные методы детекции (ПЦР в реальном времени, ПЦР с регистрацией сигнала по конечной точке), биочиповые технологии и технологии секвенирования.
Однако у всех этих методов существуют определенные недостатки. Например, метод ПЦР-ПДРФ требует использования зачастую дорогих ферментов и много времени на проведение диагностики (см. Rasmussen, H. B. Gel Electrophoresis - Principles and Basics. (InTech, 2012). doi:10.5772/2205). При этом не исключается возможность возникновения ложных результатов диагностики из-за необходимости субъективной оценки исполнителем результатов электрофореза.
Технологии секвенирования ввиду их высокой стоимости не получили широкого распространения, в большей степени используются для проведения научных исследований, чем для клинической ДНК-диагностики (см. Mestan, K. K., Ilkhanoff, L., Mouli, S. & Lin, S. Genomic sequencing in clinical trials. J. Transl. Med.9, 222 (2011)).
Биочиповые технологии известны как более доступные как по цене, так и по качеству диагностики точечных мутаций (см. LaFramboise, T. Single nucleotide polymorphism arrays: a decade of biological, computational and technological advances. NucleicAcids Res. 37, 4181–93 (2009)), однако разработка биочипов, их внедрение, а также оснащение диагностических лабораторий требует больших затрат.
Флуоресцентные методы (ПЦР в реальном времени, ПЦР с регистрацией сигнала по конечной точке) в большинстве основаны на использовании флуоресцентных олигонуклеотидных зондов, дополнительно меченных тушителем флуоресценции (TaqMan, LightCycler, Scorpion) (см. Arya, M. et al. Basic principles of real-time quantitative PCR. ExpertRev. Mol. Diagn.5, 209–19 (2005)). Стадия введения молекулярного тушителя флуоресценции в структуру зонда является достаточно сложным и затратным процессом, что приводит к относительно высокой стоимости подобных тест-систем и низкой стабильности их компонентного состава (см. Hobart, M. J. A modular ‘universal’ TaqManTM assay. Tech. TipsOnline3, 69–72 (1998)). По этой причине в настоящее время остается актуальным разработка новых более быстрых экономичных и эффективных подходов к диагностике точечных мутаций в нативной ДНК (см. Ye, S. An efficient procedure for genotyping single nucleotide polymorphisms. NucleicAcidsRes.29, 88e–88 (2001)).
Известно, что в последние годы при разработке подходов в области диагностики точечных мутаций активно используют оксид графена в силу дешевизны, простоты синтеза, однако, а также благодаря двум уникальным свойствам – способности к тушению флуоресценции от находящихся вблизи него флуорофоров (см. Li, F. etal.Nanomaterial-Based Fluorescent DNA Analysis: A Comparative Study of the Quenching Effects of Graphene Oxide, Carbon Nanotubes, and Gold Nanoparticles. Adv. Funct. Mater. 23, 4140–4148 (2013)) и различной афинности по отношению к одно- и двуцепочечным молекулам ДНК (см. Huang, P.-J. & Liu, J. Separation of Short Single- and Double-Stranded DNA Based on Their Adsorption Kinetics Difference on Graphene Oxide. Nanomaterials3, 221–228 (2013)).
На основе данных свойств оксида графена за последние 5 лет было разработано и описано в литературе несколько способов диагностики точечных мутаций в ДНК с применением оксида графена, например см. Lu, C. H., Yang, H. H., Zhu, C. L., Chen, X. & Chen, G. N. A graphene platform for sensing biomolecules. Angew. Chemie - Int. Ed.48, 4785–4787 (2009); He, S. et al. A graphene nanoprobe for rapid, sensitive, and multicolor fluorescent DNA analysis. Adv. Funct. Mater.20, 453–459 (2010); Li, J. et al. A power-free microfluidic chip for SNP genotyping using graphene oxide and a DNA intercalating dye. Chem. Commun. (Camb).49, 3125–7 (2013); Li, Z. et al. A label-free amplified fluorescence DNA detection based on isothermal circular strand-displacement polymerization reaction and graphene oxide. Analyst 138, 3616–20 (2013); Li, J. et al. A power-free microfluidic chip for SNP genotyping using graphene oxide and a DNA intercalating dye. Chem. Commun. (Camb).49, 3125–7 (2013); CN №102643916, МПК C12Q 1/68, G01N 21/64, опубл. 22.08.2012 и др.
Известен способ, описанный Xuс соавт. (см. Xu, H. et al.A graphene-based platform for fluorescent detection of SNPs. Analyst138, 2678–82 (2013)), в котором в качестве основы для создания метода диагностики точечных мутаций в ДНК использована реакция однонуклеотидного удлинения (singe-base extension) между флуоресцентно меченным dGTP и продуктом гибридизации нефлуоресцентных олигонуклеотидного зонда и олигонуклеотида-мишени. В случае достижения полной комплементарности мишени и зонда реакция проходит и фрагмент флуорофора встраивается в дуплекс ДНК, что фиксируется по наличию флуоресцентного сигнала у раствора при добавлении к нему суспензии оксида графена. Для анализа флуоресцентного отклика от олигонуклеотида-мишени с мутацией последняя подбирается таким образом, чтобы соответствовать 5`-концу олигонуклеотидного зонда. Это приводит к невозможности протекания реакции однонуклеотидного удлинения, благодаря чему весь флуоресцентно меченный dGTP остается в растворе, а при добавлении в раствор суспензии оксида графена - адсорбируется на него, что приводит к тушению флуоресценции в растворе.
Однако известные решения не позволяют проводить диагностику точечных мутаций в нативной ДНК, так как данные методы предполагают использование в качестве аналита (молекул-мишеней) короткие одноцепочечные олигонуклеотиды вместо нативной ДНК. В то же время авторы приведенных подходов не приводят методик диагностики точечных мутаций в нативной ДНК человека, и описанные подходы не позволяют применять их для диагностики точечных мутаций в нативной ДНК напрямую, что делает невозможным использование данных подходов в качестве молекулярно-генетических методов в медицине.
Задачей, на решение которой направлено заявленное изобретение, является создание способа диагностики точечных мутаций в нативной ДНК с применением оксида графена.
Технический результат, получаемый при решении поставленной задачи, выражается в получении способа диагностики точечных мутаций с применением оксида графена, исключающего недостатки известных способов и позволяющего проводить достоверную диагностику любых точечных мутаций (замен, инсерций, делеций) в нативной ДНК.
Для решения поставленной задачи способ диагностики точечных мутаций (замен, инсерций, делеций) в нативной ДНК с применением оксида графена включает следующие стадии: А) амплификации фрагментов ДНК с помощью аллель-специфичной ПЦР с использованием аллель-специфичной ДНК-полимеразы, а также двух флуоресцентно меченных разными флуорофорами по 5`-концу прямых праймеров, комплементарных последовательностям ДНК разных аллелей и перекрывающих область мутации, и обратным общим праймером, комплементарным последовательности ДНК обеих аллелей, с получением в виде продуктов ПЦР флуоресцентно меченных ампликонов, содержащих различные флуоресцентные метки в зависимости от типа аллели, для которой проходит амплификация; Б) инкубации смеси продуктов ПЦР с селективным тушителем флуоресценции, в качестве которого применяется оксид графена, при этом в ходе инкубации смеси происходит адсорбция избытка флуоресцентно меченных праймеров на поверхности оксида графена с тушением их флуоресценции и не происходит адсорбции и тушения флуоресценции для флуоресцентно меченных ампликонов – продуктов ПЦР; В) регистрации интенсивностей флуоресценции полученных конечных растворов путем измерения интенсивностей флуоресценции по каналам флуоресценции, соответствующим флуоресцентным меткам прямых праймеров; Г) интерпретации результатов диагностики путем сравнения значений интенсивностей флуоресценции в конечных растворах анализируемых образцов ДНК со значениями для конечных растворов для отрицательных контролей, при этом проводятся параллельные опыты по п. А-В с отрицательными контрольными образцами, не содержащими ДНК на стадии проведения аллель-специфичной ПЦР, осуществляется сравнение значений интенсивностей флуоресценции в конечных растворах анализируемых образцов ДНК по каналам флуоресценции, соответствующим флуоресцентным меткам прямых праймеров, с аналогичными интенсивностями для отрицательных контролей и интерпретация результатов диагностики анализируемых образцов ДНК с выводом о генотипах образцов по исследуемой мутации. При этом набор праймеров для диагностики мутации 4582insT в 25 экзоне гена CUL7, вызывающей 3М-синдром у якутов, составляют прямые праймеры: 5`-FAM-CAGGGGTCCTCAAGATTTCG-3`; 5`-ROX-CAGGGGTCCTCAAGATTCG-3` и обратный праймер: 5`-GATGAGGCAGTTCAGAAGATTCC-3`.
Сопоставительный анализ признаков заявленного решения с признаками аналогов свидетельствует о соответствии заявленного решения критерию «новизна».
Совокупность признаков изобретения обеспечивает решение заявленной технической задачи, а именно вывод о генотипе анализируемого образца нативной ДНК по анализируемой мутации.
Основным отличительным признаком является возможность диагностики точечных мутаций (замен, инсерций, делеций) именно в нативной ДНК, при этом в качестве селективного тушителя флуоресценции используется суспензия оксида графена.
По заявленному решению предлагается определенный набор стадий для проведения диагностики: при диагностике точечной мутации в нативной ДНК проводят аллель-специфичную ПЦР с использованием двух флуоресцентно меченных прямых праймеров, комплементарных последовательностям ДНК разных аллелей в области сайта мутации, и обратным общим праймером, комплементарным последовательностям ДНК обоих аллелей, с последующим добавлением раствора суспензии оксида графена к продуктам ПЦР и измерением интенсивностей флуоресценции конечного раствора по двум каналам флуоресценции, соответствующим флуоресцентным меткам прямых праймеров, при этом для сравнения и получения результатов диагностики используются отрицательные контрольные образцы, не содержащие ДНК на стадии ПЦР. Сравнение значений интенсивностей флуоресценции в растворе анализируемого образца ДНК по двум каналам флуоресценции (соответствующим флуорофорам, которыми мечены прямые праймеры) с аналогичными интенсивностями для отрицательного контроля позволяет определить генотип анализируемого образца ДНК по исследуемой мутации.
Заявленное решение иллюстрируется чертежом, где на фиг. 1 показана принципиальная схема диагностики точечных мутаций в нативной ДНК; на фиг. 2 – структуры прямых флуоресцентно меченных праймеров для ДНК-диагностики мутации 4582insT в 25 экзоне гена CUL7, вызывающей 3М-синдром у якутов, выравненные на последовательности ДНК аллелей дикого и мутантного типа; на фиг. 3 - результаты проведения электрофореза для продуктов аллель-специфичной ПЦР при проведении ДНК-диагностики мутации 4582insT в 25 экзоне гена CUL7, вызывающей 3М-синдром у якутов без использования на стадии электрофореза флуоресцентных красителей (бромистого этидия) для окрашивания ДНК в геле; на фиг. 4 - результаты проведения диагностики трех выборок образцов ДНК с различными типами носительства мутации 4582insT, вызывающей 3М-синдром у якутов.
Способ диагностики точечных мутаций в нативной ДНК осуществляется следующим образом (см. фиг. 1).
ДНК выделяется из биологического материала любым доступным способом, позволяющим использовать выделенную ДНК для ПЦР. С использованием анализируемого образца ДНК проводится аллель-специфичная ПЦР. Данная ПЦР отличается от обычной из-за использования аллель-специфичной ДНК-полимеразы (с отсутствующей 5`-3` и 3`-5` экзонуклеазной активностью) и использования трех праймеров. Один из праймеров (обратный, выделен как R на фиг. 1) способен комплементарно отжигаться на последовательностях ДНК аллелей обеих типов (дикого и мутантного типа, согласно схемы на фиг. 1). Два других праймера (прямые, выделены как F1 и F2 на фиг. 1) являются меченными с 5`-конца разными флуорофорами ФЛ1 и ФЛ2 с неперекрывающимися спектрами возбуждения/эмиссии. Каждый из прямых праймеров способен отжигаться на последовательности ДНК аллели только одного типа, ввиду того, что они комплементарны последовательностям ДНК разных аллелей и местом отжига перекрывают область нахождения мутации.
В результате проведения аллель-специфичной ПЦР с нативным образцом ДНК образуются флуоресцентно меченные ампликоны, содержащие участок ДНК с сайтом мутации. В зависимости от типа носительства мутации у донора ДНК в результате ПЦР возможно образование трех видов постамплификационной смеси:
1) в случае, если образец ДНК имеет дикий генотип по анализируемой мутации (условно, согласно схемы на фиг. 1), в результате ПЦР будут образовываться только ампликоны, меченные флуорофором ФЛ1;
2) в случае, если образец ДНК имеет мутантный генотип по анализируемой мутации (условно, согласно схемы на фиг. 1), в результате ПЦР будут образовываться только ампликоны, меченные флуорофором ФЛ2;
3) в случае, если образец ДНК имеет гетерозиготный генотип по анализируемой мутации, в результате ПЦР будут образовываться ампликоны, меченные флуорофорами ФЛ1 и ФЛ2.
Во всех случаях в продуктах ПЦР также будет находиться избыток флуоресцентно меченных праймеров.
Затем к продуктам ПЦР добавляют суспензию оксида графена в качестве селективного тушителя флуоресценции с получением конечного раствора. На поверхности нанолистов оксида графена происходит адсорбция одноцепочечных молекул ДНК – флуоресцентно меченных прямых праймеров, вследствие чего флуоресценция от них гасится в конечном растворе. Двуцепочечные молекулы ДНК (ампликоны), которые являются флуоресцентно меченными, остаются в конечном растворе и не адсорбируются на поверхности нанолистов оксида графена ввиду их низкой афинности к оксиду графена и могут генерировать флуоресцентный сигнал.
После добавления оксида графена у конечного раствора проводят измерение интенсивностей флуоресценции по каналам, соответствующим каждому из флуорофоров ФЛ1 и ФЛ2, которыми мечены прямые праймеры.
Аналогичный опыт (начиная от стадии проведения аллель-специфичной ПЦР и заканчивая измерениями интенсивностей флуоресценции конечного раствора) проводят с отрицательными контролями – образцами с добавлением чистой воды вместо ДНК на стадии проведения аллель-специфичной ПЦР.
Затем проводят сравнение интенсивностей флуоресценции для конечного раствора анализируемого образца (по каналам флуоресценции, соответствующим каждому из флуорофоров: ФЛ1 и ФЛ2) с аналогичными значениями для конечного раствора отрицательного контроля.
По результатам сравнения осуществляется интерпретация результатов - делают один из четырех следующих выводов:
1) в случае, если у конечного раствора анализируемого образца значение интенсивности флуоресценции по каналу, соответствующему ФЛ1, значительно выше аналогичной интенсивности у конечного раствора отрицательного контроля (соотношение интенсивностей образец/контроль значительно больше 1), при этом у конечного раствора анализируемого образца значение интенсивности флуоресценции по каналу, соответствующему ФЛ2, примерно равно аналогичной интенсивности у конечного раствора отрицательного контроля (соотношение интенсивностей образец/контроль примерно равно 1), то делают вывод о том, что у анализируемого образца ДНК обе аллели дикого типа (условно, согласно схемы на фиг. 1);
2) в случае, если у конечного раствора анализируемого образца значение интенсивности флуоресценции по каналу, соответствующему ФЛ2, значительно выше аналогичной интенсивности у конечного раствора отрицательного контроля (соотношение интенсивностей образец/контроль значительно больше 1), при этом у конечного раствора анализируемого образца значение интенсивности флуоресценции по каналу, соответствующему ФЛ1, примерно равно аналогичной интенсивности у конечного раствора отрицательного контроля (соотношение интенсивностей образец/контроль примерно равно 1), то делают вывод о том, что у анализируемого образца ДНК обе аллели мутантного типа (условно, согласно схемы на фиг. 1);
3) в случае, если у конечного раствора анализируемого образца значение интенсивности флуоресценции по каналу, соответствующему ФЛ1, значительно выше аналогичной интенсивности у конечного раствора отрицательного контроля (соотношение интенсивностей образец/контроль значительно больше 1); при этом у конечного раствора анализируемого образца значение интенсивности флуоресценции по каналу, соответствующему ФЛ2, значительно выше аналогичной интенсивности у конечного раствора отрицательного контроля (соотношение интенсивностей образец/контроль значительно больше 1), то делают вывод о том, что у анализируемого образца ДНК гетерозиготный тип носительства мутации;
4) в случае, если у конечного раствора анализируемого образца значение интенсивности флуоресценции по каналу, соответствующему ФЛ1, примерно равно аналогичной интенсивности у конечного раствора отрицательного контроля (соотношение интенсивностей образец/контроль примерно равно 1); при этом у конечного раствора анализируемого образца значение интенсивности флуоресценции по каналу, соответствующему ФЛ2, примерно равно аналогичной интенсивности у конечного раствора отрицательного контроля (соотношение интенсивностей образец/контроль примерно равно 1), то делают вывод о том, что диагностика прошла неудачно.
Предложенный способ диагностики точечных мутаций в ДНК был испытан при создании на его основе тест-системы, способной диагностировать мутацию 4582insT (инсерция) в 25 экзоне гена CUL7 (KIAA0076), вызывающую 3М-синдром у якутов.
3М-синдром является частым аутосомно-рецессивным наследственным заболеванием с достаточно высокой частотой гетерозиготного носительства мутации 4582insT у якутов (около 30 человек на 1000).
Основной компонентный состав тест-системы был подобран следующим образом.
В качестве флуоресцентно меченных прямых праймеров были использованы FAM- и ROX-меченые праймеры, которые на 3`-конце комплементарны последовательностям ДНК в области сайта мутации для разных аллелей (см. фиг. 2).
В качестве обратного (общего) праймера использовался олигонуклеотид следующей структуры: 5`-GATGAGGCAGTTCAGAAGATTCC-3`.
В качестве аллель-специфичной ДНК-полимеразы использовалась SNPdetect полимераза (Евроген) с отсутствующей 5`-3` и 3`-5`экзонуклеазной активностью.
Оксид графена синтезировали по модифицированному методу Хаммерса: 0,1 г порошка графита и 0,05 г нитрата натрия добавляли в концентрированную серную кислоту объемом 14 мл. Далее мелкими порциями постепенно в смесь вносили 0,4 г перманганата калия. Полученную реакционную смесь перемешивали в химическом стакане в течение трех недель на магнитной мешалке при температуре 75оС.
После перемешивания смесь разбавляли деионизованной водой в два раза по объему. Далее в смесь добавляли 5 % раствор перекиси водорода (7 мл) до появления бриллиантово-желтой окраски.
Полученную бриллиантово-желтую смесь промывали на воронке Бюхнера с использованием фильтра обеззоленного (желтая лента, диаметр 70 мм) 300 мл деионизованной воды до установления нейтральной среды в фильтрате. При этом получили коричневую гелеобразную массу оксида графена, которую переносили с фильтра в химический стакан и разбавляли 50 мл воды с последующей ультразвуковой обработкой с объемной мощностью 750 Вт в течение 5 минут на диспергаторе типа ИЛ100-6/3.
Получаемую суспензию центрифугировали при 14500 об/мин (14,1 g) в течение 5 минут, а не расслоившиеся в результате УЗ-обработки частицы оксида графита удаляли путем декантации раствора оксида графена над осадком.
Проводили диализ полученного раствора в диализных мешках в течение 3-х дней с 3-кратной сменой деионизованной воды в стакане с объемом 1 л с диализным пакетом. В результате получали однородную суспензию оксида графена темно-коричневого цвета объемом ~ 50мл.
Для проведения ПЦР использовали термоциклер С1000 (Bio-Rad), для регистрации интенсивностей флуоресценции – флуориметр Джин-4 (ДНК-технология).
Для исследования характеристик работы тест-системы были взяты 3 группы по 16 образцов ДНК пациентов (больные 3М-синдромом с подтвержденной мутацией 4582insT в гомозиготном состоянии, гетерозиготные носители мутации 4582insT, здоровые), выделенных из крови с их информированного согласия, также были использованы 16 отрицательных контролей.
ДНК-диагностика проводилась по следующей методике.
У больного производился забор крови из локтевой вены в количестве 7-10 мл в пробирку, содержащую ЭДТА (этилендиаминтетрауксусная кислота). Выделение ДНК из лейкоцитов периферической крови осуществляли стандартным фенол-хлороформным методом.
Аллель-специфичная ПЦР.
Для каждого образца ДНК готовили 25 мкл смеси, содержащей 2,5 мкл 10хПЦР-буфера, 1,5 мкл MgCl2 (50 мМ), 0,7 мкл дНТФ (10 мМ), 0,25 мкл обратного праймера (20 мкМ), 0,75 мкл прямого FAM-меченого праймера (20 мкМ), 0,083 мкл прямого ROX-меченого праймера (20 мкМ), 18,22 мкл деионизованной воды и 1 мкл ДНК (30 нг/мкл). Для аллель-специфичной ПЦР температурный профиль состоял из 1 цикла (3 минуты) при 95оС, 34 циклов (30 с) при 95оС, (30 с) при 60оС, (1 минута) при 72оС, 1 цикла (5 минут) при 72оС. После завершения реакции продукты ПЦР охлаждались и хранились при 4оС. Успешное протекание ПЦР подтверждалось проведением гель-электрофореза продуктов ПЦР в агарозном геле без использования флуоресцентных красителей для окрашивания ДНК (результаты электрофореза приведены на фиг. 3).
Добавление оксида графена к продуктам ПЦР и регистрация флуоресценции.
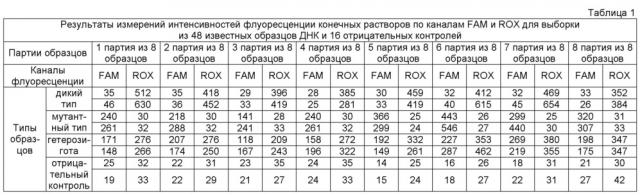
Из каждой ПЦР-пробирки отбирали аликвоту - 15 мкл с продуктами ПЦР - и помещали в 0,6 мл прозрачную микроцентрифужную пробирку. Далее в пробирку добавляли 3,6 мкл натрий-фосфатного буфера (5Х, Gibco, pH 7,4) и 4 мкл суспензии оксида графена (0,5 мг/мл) в натрий-фосфатном буфере (1Х, Gibco, pH 7,4). Полученную смесь инкубировали при комнатной температуре на орбитальном шейкере в течение 20 минут (450 об/мин) и таким образом получали конечные растворы, пригодные для проведения флуоресцентных измерений. Затем измеряли интенсивности флуоресценции по FAM- и ROX-каналам в каждой пробирке с помощью флуориметра Джин-4 (ДНК-технология). Измеренные интенсивности флуоресценции приведены в таблице 1.
По результатам проведенных измерений получен набор следующих интенсивностей флуоресценции I: IFAMтип1 …IFAMтип16, IROXтип1 …IROXтип16, IFAMконтроль1 …IFAMконтроль16, IROXконтроль1 …IROXконтроль16; где тип: дикий, мутантный и гетерозиготный; контроль – отрицательный контроль.
Выполнены расчеты средних значений интенсивностей флуоресценции Ī для анализируемых образцов и отрицательных контролей (ĪFAMконтроль, ĪROXконтроль, ĪFAMтип, ĪROXтип; где тип: дикий, мутантный и гетерозиготный) по следующим формулам (1-4):
QUOTE (1)
QUOTE (2)
QUOTE (3)
QUOTE (4)
Рассчитанные средние значения интенсивностей флуоресценции Ī для анализируемых образцов и отрицательных контролей, а также абсолютные и относительные стандартные отклонения для Ī приведены в таблице 2.
Далее для каждого типа выборки образцов (дикий, мутантный, гетерозиготный) вычислены соотношения интенсивностей флуоресценции N образец/контроль по FAM- и ROX-каналам в отдельности (NFAMтип, NROXтип, где тип: дикий, мутантный и гетерозиготный) по следующим формулам (5):
QUOTE (5)
Результаты расчетов соотношений интенсивностей флуоресценции N приведены в таблице 3.
Результаты проведения диагностики трех выборок образцов ДНК с различными типами носительства мутации 4582insT, вызывающей 3М синдром у якутов, показаны в виде графика на фиг. 4.
Доверительные интервалы построены на основе стандартных отклонений, рассчитанных как сумма относительных стандартных отклонений для интенсивностей флуоресценции анализируемых образцов и отрицательных контролей по FAM- и ROX- каналам флуоресценции.
Данные на фиг. 4 показывают, что разработанная на основе заявленного технического решения тест-система, позволяет достоверно диагностировать все типы носительства мутации 4582insT, вызывающей 3М-синдром у якутов, в образцах нативной ДНК. При этом достоверность диагностики является достаточно высокой, так как интенсивности флуоресценции конечных растворов известных образцов до 20 раз выше интенсивностей флуоресценции конечных растворов контрольных образцов, доверительные интервалы по одинаковым каналам флуоресценции (в совокупности) для каждого типа выборки образцов не перекрываются.
Таким образом, использование заявленного решения позволит создавать тест-системы с применением оксида графена, предназначенные для ДНК-диагностики любых точечных мутаций, что могут быть использованы для диагностики наследственных заболеваний, в фармакогенетическом тестировании и др.
1. Способ диагностики точечных мутаций в нативной ДНК с применением оксида графена, включающий следующие стадии:
(а) амплификация фрагментов ДНК с помощью аллель-специфичной полимеразной цепной реакции с использованием аллель-специфичной ДНК-полимеразы, а также двух флуоресцентно меченных разными флуорофорами по 5'-концу прямых праймеров, комплементарных последовательностям ДНК разных аллелей и перекрывающих область мутации, и обратным общим праймером, комплементарным последовательности ДНК обеих аллелей, с получением в виде продуктов полимеразной цепной реакции флуоресцентно меченных ампликонов, содержащих различные флуоресцентные метки в зависимости от типа аллели, для которой проходит амплификация;
(б) инкубация смеси продуктов ПЦР с селективным тушителем флуоресценции, в качестве которого применяется оксид графена;
(в) регистрация интенсивностей флуоресценции полученных конечных растворов;
(г) интерпретация результатов диагностики путем сравнения значений интенсивностей флуоресценции в конечных растворах анализируемых образцов ДНК со значениями для конечных растворов для отрицательных контролей.
2. Способ диагностики мутации 4582insT в 25 экзоне гена CUL7, вызывающей 3М-синдром у якутов, в нативной ДНК с применением оксида графена, включающий следующие стадии:
(а) амплификация фрагментов ДНК с помощью аллель-специфичной полимеразной цепной реакции с использованием аллель-специфичной ДНК-полимеразы, а также двух флуоресцентно меченных разными флуорофорами по 5'-концу прямых праймеров, комплементарных последовательностям ДНК разных аллелей и перекрывающих область мутации: 5'-FAM-CAGGGGTCCTCAAGATTTCG-3' и 5'-ROX-CAGGGGTCCTCAAGATTCG-3'; и обратным общим праймером, комплементарным последовательности ДНК обеих аллелей: 5'-GATGAGGCAGTTCAGAAGATTCC-3', с получением в виде продуктов полимеразной цепной реакции флуоресцентно меченных ампликонов, содержащих различные флуоресцентные метки в зависимости от типа аллели, для которой проходит амплификация;
(б) инкубация смеси продуктов ПЦР с селективным тушителем флуоресценции, в качестве которого применяется оксид графена;
(в) регистрация интенсивностей флуоресценции полученных конечных растворов;
(г) интерпретация результатов диагностики путем сравнения значений интенсивностей флуоресценции в конечных растворах анализируемых образцов ДНК со значениями для конечных растворов для отрицательных контролей.