Микроорганизм, продуцирующий о-ацетилгомосерин, и способ получения о-ацетилгомосерина с использованием этого микроорганизма
Иллюстрации
Показать всеИзобретение относится к области биохимии, генной инженерии и биотехнологии, в частности к трансформированному микроорганизму Escherichia sp., продуцирующему О-ацетилгомосерин. Настоящий микроорганизм характеризуется тем, что в нем ослаблена или инактивирована активность эндогенной цитратсинтазы. В результате указанной модификации этот микроорганизм способен продуцировать О-ацетилгомосерин с высоким выходом. Изобретение также относится к способу получения О-ацетилгомосерина. Настоящий способ предусматривает культивирование указанного микроорганизма и выделение О-ацетилгомосерина, продуцируемого при культивировании этого микроорганизма. Настоящее изобретение позволяет получать О-ацетилгомосерин с высоким выходом. 2 н. и 5 з.п. ф-лы, 2 ил., 10 табл., 4 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к микроорганизму Escherichia sp., продуцирующему О-ацетилгомосерин и к способу получения О-ацетилгомосерина с высоким выходом с использованием этого микроорганизма.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
О-ацетилгомосерин действует как предшественник метионина, который является одной из незаменимых аминокислот в организме. Метионин широко используется в качестве компонента медицинских инфузионных растворов и сырья для медицинских продуктов, а также в качестве корма для животных и пищевой добавки.
Метионин может быть синтезирован биологически или химически. Недавно был описан двухстадийный способ, в котором предшественник L-метионина, полученный посредством ферментации, превращают в L-метионин посредством ферментативной реакции (международная публикация WO 2008/013432). В указанном выше двухстадийном способе О-сукцинил-гомосерин и О-ацетилгомосерин может быть использован в качестве предшественника метионина и для крупномасштабного высокорентабельного производства метионина важно получать О-ацетилгомосерин с высоким выходом
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая задача
Авторы настоящего изобретения, пытаясь улучшить получение О-ацетилгомосерина, обнаружили, что снижение экспрессии или активности белка цитратсинтазы может значительно увеличивать эффективность получения О-ацетилгомосерина, тем самым обеспечивая осуществление настоящего изобретения.
Техническое решение
Целью настоящего изобретения является создание О-ацетилгомосерин-продуцирующего микроорганизма с улучшенной способностью продуцировать О-ацетилгомосерин.
Другой целью настоящего изобретения является создание способа получения О-ацетилгомосерина с использованием этого микроорганизма.
Полезные эффекты
При использовании микроорганизма по настоящему изобретению, обладающего способностью продуцировать О-ацетилгомосерин, можно получать О-ацетилгомосерин с более высоким выходом и более экологически безопасным образом, чем химический синтез. Кроме того, О-ацетилгомосерин, полученный таким образом, можно использовать в качестве предшественника для синтеза метионина и уксусной кислоты при помощи О-ацетилгомосерин-сульфгидрилазы, тем самым обеспечивая возможность биоконверсии L-метионина, и L-метионин, преобразованный таким образом, можно широко использовать в производстве пищевых продуктов или пищевых добавок для людей, а также кормов для животных или пищевых добавок для животных.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 представлено изображение экспрессионной кассеты для конструирования микроорганизма с ослабленной активностью цитратсинтазы.
На Фиг. 2 представлена рестрикционная карта вектора pBAD24 с антисмысловой РНК (асРНК) цитратсинтазы.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В одном аспекте настоящего изобретения предложен микроорганизм Escherichia sp., продуцирующий О-ацетилгомосерин, с ослабленной или инактивированной активностью эндогенного белка цитратсинтазы.
При использовании в данном описании изобретения термин "О-ацетилгомосерин", являющийся конкретным промежуточным веществом в пути биосинтеза метионина микроорганизма, относится к ацетил-производному L-гомосерина. О-ацетилгомосерин может быть получен посредством ферментативной активности переноса ацетильной группы от ацетил-КоА на гомосерин с использованием гомосерина и ацетил-КоА в качестве субстратов.
При использовании в данном описании изобретения термин "микроорганизм, продуцирующий О-ацетилгомосерин" включает микроорганизм, который, являясь эукариотическим или прокариотическим микроорганизмом, продуцирующим О-ацетилгомосерин в живом организме, обеспечивает О-ацетилгомосерин-продуцирующую способность своему родительскому микроорганизму без О-ацетилгомосерин-продуцирующей способности, или микроорганизм, который эндогенно обладает О-ацетилгомосерин-продуцирующей способностью.
О-Ацетилгомосерин-продуцирующая способность может быть обеспечена или активизирована путем улучшения видов. Микроорганизмы, обладающие О-ацетилгомосерин-продуцирующей способностью, могут включать микроорганизмы, принадлежащие к Escherichia sp., Erwinia sp., Serratia sp., Providencia sp., Corynebacteria sp., Pseudomonas sp., Leptospira sp., Salmonella sp., Brevibacteria sp., Hypomononas sp., Chromobactehum sp.и Norcardia sp., или к грибам или дрожжам; конкретно, микроорганизмы, принадлежащие к Escherichia sp., Corynebacteria sp., Leptospira sp. и к дрожжам; и более конкретно, микроорганизмы, принадлежащие к Escherichia sp., в качестве конкретного примера к Escherichia coli. Микроорганизмами, обладающими О-ацетилгомосерин-продуцирующей способностью, могут быть микроорганизмы, продуцирующие L-лизин, L-треонин, L-изолейцин или L-метионин или их производные, но не ограниченные ими.
При использовании в данном описании изобретения термин "цитратсинтаза (Е.С.2.3.3.1)" относится к ферменту первой стадии цикла ТСА (цикла трикарбоновых кислот), который обеспечивает взаимодействие между оксалоацетатом и ацетил-КоА. В частности, цитратсинтаза опосредует реакцию конденсации между ацетатным остатком, имеющим два атома углерода, который находится в ацетил-КоА, и оксалоацетатом, имеющим четыре атома углерода, посредством чего образуется цитрат, имеющий шесть атомов углерода. В Escherichia coli цитратсинтаза обозначена как GltA, и "цитратсинтаза" и "GltA" в настоящем изобретении используются взаимозаменяемо.
ацетил-КоА + оксалоацетат + Н2О -> цитрат + КоА-SH
В частности, цитратсинтаза может представлять собой цитратсинтазу, происходящую из Escherichia sp. и, более конкретно, GltA, происходящую из Escherichia coli. Цитратсинтаза может быть белком, содержащим аминокислотную последовательность, представленную ка SEQ ID NO: 4, или последовательностями, имеющими 70%-ную или более гомологию с аминокислотной последовательностью SEQ ID NO: 4, конкретно 80% или более и более конкретно 90% или более. Кроме того, для последовательности, имеющей гомологию, если аминокислотная последовательность представляет собой последовательность, имеющую активность цитратсинтазы такую же или соответствующую представленной как SEQ ID NO: 4, очевидно, что аминокислотные последовательности с делецией, модификацией, замещением или добавлением в части последовательностей также должны быть включены в объем настоящего изобретения. Кроме того, учитывая вырожденность генетического кода, полинуклеотидные последовательности, кодирующие одинаковые аминокислотные последовательности и их варианты, также должны быть включены в объем настоящего изобретения.
При использовании в данном описании изобретения термин "эндогенная" активность относится к естественному состоянию белка в микроорганизме или состоянию активности соответствующего белка, имеющемуся в микроорганизме до модификации.
"Ослабление или инактивация активности белка по сравнению с его эндогенной активностью" относится к уменьшению или ликвидации активности белка по сравнению с активностью, имеющейся в его естественном состоянии. Ослабление представляет собой понятие, относящееся к случаю, когда активность белка уменьшена по сравнению с имеющейся исходно у микроорганизма из-за модификации гена, кодирующего белок, к случаю, когда уровень общей экспрессии белка ниже, чем у природного штамма микроорганизма, или к комбинации этих случаев, однако не ограничивается ими. Инактивация включает случай, когда ген, кодирующий белок, не экспрессируется совсем по сравнению с геном в природном штамме, и к случаю, когда ген экспрессируется, но не проявляет активности.
Ослабление или инактивация активности белка могут быть достигнуты различными способами, хорошо известными в данной области. Примеры способов могут включать способ замены гена, кодирующего белок, на хромосоме, геном, модифицированным таким образом, что ферментативная активность белка может быть уменьшена, включая случай ликвидации активности белка; способ введения модификации в последовательность, регулирующую экспрессию гена, кодирующего белок, на хромосоме; способ замены последовательности, регулирующей экспрессию гена, кодирующего белок, последовательностью, имеющей слабую активность или не имеющей активности; способ удаления части или всего гена, кодирующего белок, на хромосоме; способ введения антисмыслового олигонуклеотида (например антисмысловой РНК), который ингибирует трансляцию белка с мРНК посредством комплементарного связывания с транскриптом гена на хромосоме; способ, делающий невозможным прикрепление рибосомы в результате формирования вторичной структуры посредством искусственного добавления последовательности Шайна-Дальгарно (SD) и ее комплементарной последовательности на переднем конце последовательности SD гена, кодирующий белок; способ конструирования посредством обратной транскрипции (RTE), когда добавляют промотор таким образом, чтобы обеспечить обратную транскрипцию на 3'-конце открытой рамки считывания (ORF) соответствующей последовательности и т.д., а также включает комбинацию этих способов, но не ограничивается ими.
В частности, способ удаления части или всего гена, кодирующего белок, может быть осуществлен путем замены полинуклеотида, кодирующего эндогенный целевой белок, в хромосоме с помощью вектора для вставки хромосомы в микроорганизм полинуклеотидом или маркером, у которого удалена часть полинуклеотидной последовательности. Например, может быть использован способ делеции гена посредством гомологичной рекомбинации, без ограничения им. Кроме того, При использовании в данном описании изобретения термин "часть", хотя он может варьироваться в зависимости от видов полинуклеотида, может конкретно относиться к частям, составляющим от 1 нуклеотида до 300 нуклеотидов, более конкретно от 1 нуклеотида до 100 нуклеотидов и еще более конкретно от 1 нуклеотида до 50 нуклеотидов, но не ограничивается ими.
Кроме того, способ модификации последовательности, регулирующей экспрессию, может быть осуществлен путем индукции изменения последовательности, регулирующей экспрессию полинуклеотидной последовательности, путем делеции, вставки, консервативной замены, неконсервативной замены или их комбинации, чтобы дополнительно ослабить активность последовательности, регулирующей экспрессию; или путем замены полинуклеотидной последовательности полинуклеотидной последовательностью с более слабой активностью. Полинуклеотидная последовательность может включать последовательность промотора, последовательность оператора, последовательность, кодирующую домен связывания с рибосомами, и регулирующая последовательность окончания транскрипции и трансляции, но не ограничена ими.
Кроме того, способ модификации последовательности гена на хромосоме может быть осуществлен путем индукции изменения последовательности путем делеции, вставки, консервативной замены, неконсервативной замены или их комбинации, чтобы дополнительно ослабить активность последовательности, регулирующей экспрессию, или путем замены последовательности последовательностью гена, усовершенствованного так, чтобы иметь более слабую активность, или последовательностью гена, усовершенствованного так, чтобы не иметь активности, но не ограничивается ими.
В частности, для ослабления активности белка цитратсинтазы часть аминокислот(ы) в аминокислотной последовательности белка цитратсинтазы может быть заменена другими(ой) аминокислотами(ой). Более конкретно, может быть включена цитратсинтаза, имеющая аминокислотную последовательность, в которой 145-ая аминокислота или 167-ая аминокислота в аминокислотной последовательности белка цитратсинтазы, представленная тирозином (Y) или лизином (K), заменена на другую(ие) аминокислоту(ы). Еще более конкретно, цитратсинтаза может иметь последовательность гена, кодирующую модифицированный полипептид, в котором 145-ая аминокислота в аминокислотной последовательности белка цитратсинтазы, представленная тирозином (Y), заменена на аланин (A) и 167-ая аминокислота, представленная лизином (K), заменена на аланин (A). В частности, номер остатка аминокислоты был определен последовательно после обозначения аминокислоты, расположенной после метионина, который кодируется инициирующим кодоном, как 1-ой аминокислоты. Полипептид может, соответственно, иметь аминокислотную последовательность, представленную SEQ ID NO: 1 или 2. Кроме того, если активность цитратсинтазы более слабая, чем у дикого типа, цитратсинтаза может включать аминокислотные последовательности, имеющие 80%-ную или более гомологию с аминокислотной последовательностью SEQ ID NO: 1 или 2, например 90% или более, особенно 95% или более, и в особенности 97% или более. Что касается последовательности, имеющей гомологию, то, если аминокислотная последовательность имеет биологическую активность по существу такую же или соответствующую активности белка согласно SEQ ID NO: 1 или 2, очевидно, что аминокислотные последовательности с делецией, модификацией, заменой или добавлением в части последовательностей также должны быть включены в объем настоящего изобретения.
При использовании в данном описании изобретения термин "гомология" относится к проценту идентичности двух полинуклеотидов или полипептидных группировок. Гомология последовательностей от фрагмента к другому фрагменту может быть определена с помощью технологии, известной в данной области. Например, гомология может быть определена путем прямой систематизации информации о последовательностях двух различных полинуклеотидных молекул или двух различных полипептидов с использованием систематизации посредством компьютерной программы и легкого получения информации о последовательности. Компьютерная программа может включать BLAST (NCBI), CLC Main Workbench (CLC bio), MegAlignTM (DNASTAR Inc) и другие. Кроме того, гомологию полинуклеотидов можно определить путем гибридизации полинуклеотидов в условиях формирования стабильной двойной нити между гомологичными участками, расщепления с помощью нуклеазы, специфичной к одноцепочечным полипептидам, и определения расщепленных фрагментов.
При использовании в данном описании изобретения термин "гомология" относится к взаимоотношению между белками, имеющими "общее эволюционное происхождение", в том числе гомологичными белками, полученными из суперсемейства белков во всех их грамматических формах или с вариантами написания, и между белками, полученными из разных видов. Эти белки (и гены, кодирующие их) имеют гомологию последовательностей, отражающую высокие уровни сходства последовательности. Однако термин "гомология" для его общего использования и использования в настоящем изобретении будет относиться к сходству последовательностей, охарактеризованному прилагательным, таким как "очень высокое", вместо ссылки на общее эволюционное происхождение.
В типичном воплощении настоящего изобретения микроорганизм может быть таким, в котором активность цистатионин-гамма-синтазы (ЕС 2.5.1.48), гомосеринкиназы (ЕС 2.7.1.39) или активности их обоих ниже, чем их эндогенные активности, или они инактивированы.
При использовании в данном описании изобретения термин "цистатионин-гамма-синтаза" относится к ферменту, который может синтезировать цистатионин посредством химической реакции, описанной ниже, с использованием О-сукцинилгомосерина и L-цистеина в качестве субстратов. В настоящем изобретении цистатионин-гамма-синтаза из Е. coli обозначена как "MetB".
О-сукцинил-L-гомосерин + L-цистеин -> L-цистатионин + сукцинат
В частности, цистатионин-гамма-синтаза из Е. coli, без ограничения эти микроорганизмом, может представлять собой белок, содержащий аминокислотную последовательность, представленную SEQ ID NO: 9, или белки, имеющие гомологию 70% или более с аминокислотной последовательностью SEQ ID NO: 9, в частности 80% или более, и особенно 90% или более. Кроме того, в отношении последовательности, имеющей гомологию, если аминокислотная последовательность представляет собой последовательность, обладающую активностью гомосеринкиназы, такой же или соответствующей аминокислотной последовательности SEQ ID NO: 9, то очевидно, что аминокислотные последовательности с делецией, модификацией, заменой или добавлением в части последовательностей также должны быть включены в объем настоящего изобретения. Кроме того, учитывая вырожденность генетического кода, полинуклеотидные последовательности, кодирующие такую же аминокислотную последовательность, и их варианты также должны быть включены в объем настоящего изобретения.
Способ ослабления и инактивации активности цистатионин-гамма-синтазы может быть осуществлен способом, описанным выше.
При использовании в данном описании изобретения термин "гомосеринкиназа" относится к ферменту, вызывающему фосфорилирование гомосерина, который выполняет химическую реакцию, описанную ниже. В настоящем изобретении гомосеринкиназа из Е. coli обозначена как "ThrB".
ATP + L-гомосерин -> ADP + O-фосфо-L-гомосерин
В частности, гомосеринкиназа из Escherichia sp., без конкретного ограничения ею, может представлять собой белок, содержащий аминокислотную последовательность, представленную SEQ ID NO: 11, или последовательности, имеющие гомологию 70% или более с аминокислотной последовательностью SEQ ID NO: 11, в частности 80% или более, или особенно 90% или более. Кроме того, в отношении последовательности, обладающей гомологией, если аминокислотная последовательность является последовательностью, имеющей активность гомосеринкиназы такую же или соответствующую аминокислотной последовательностью SEQ ID NO: 11, то очевидно, что аминокислотные последовательности с делецией, модификацией, заменой или добавлением в части последовательностей должны быть включены в объем настоящего изобретения. Кроме того, учитывая вырожденность генетического кода, полинуклеотидные последовательности, кодирующие такую же аминокислотную последовательность, и их варианты также должны быть включены в объем настоящего изобретения.
Способ ослабления и инактивации активности гомосеринкиназы может быть осуществлен способом, описанным выше.
В конкретном аспекте настоящего изобретения микроорганизм может представлять собой такой микроорганизм, в котором активность гомосерин-О-ацетилтрансферазы дополнительно введена или усилена или эндогенная гомосерин-О-сукцинилтрансфераза дополнительно модифицирована с получением гомосерин-О-сукцинилтрансферазной активности.
При использовании в данном описании изобретения термин "гомосерин-О-ацетилтрансфераза (ЕС 2.3.1.31)" относится к ферменту, обладающему способностью переносить ацетильную группу из ацетил-КоА в гомосерин.
В частности, микроорганизм по настоящему изобретению может быть введен с активностью гомосерин-О-ацетилтрансферазы. Гомосерин-О-ацетилтрансфераза может происходить из различных видов микроорганизмов, например из микроорганизма, выбранного из Corynebacteria sp., Leptospira sp., Deinococcus sp., Deinococcus sp., Pseudomonas sp. и Mycobacterium sp. В частности, гомосерин-О-ацетилтрансфераза может включать аминокислотные последовательности, представленные как SEQ ID NO: 13 (Leptospira meyeri), SEQ ID NO: 14 (Corynebacterium glutamicum) или SEQ ID NO: 15 (Deinococcus radiodurans), но не ограничена ими. Кроме того, гомосерин-О-ацетилтрансфераза может представлять собой белок, содержащий указанные выше аминокислотные последовательности или имеющие гомологию 70% или более с вышеуказанными аминокислотными последовательностями, особенно 80% или более, или более конкретно 90% или более. Кроме того, учитывая вырожденность генетического кода, полинуклеотидные последовательности, кодирующие такую же аминокислотную последовательность, и их варианты также должны быть включены в объем настоящего изобретения.
Примеры гомосерин-О-ацетилтрансферазы для использования в настоящем изобретении раскрыты в публикации корейской патентной заявки 10-2011-0023703 и в публикации европейской патентной заявки ЕР 2290051, и все характеристики этих патентных документов могут быть включены в качестве ссылок в настоящее изобретение.
Кроме того, белок, в котором эндогенная гомосерин-О-сукцинилтрансфераза (ЕС 2.3.1.46) модифицирована с получением гомосерин-О-сукцинилтрансферазной активности, относится к полипептиду, у которого субстратная специфичность полипептида, имеющего гомосерин-О-сукцинилтрансферазную активность, изменена с сукцинил-КоА на ацетил-КоА. Кроме того, модифицированный белок, но без конкретного ограничения им, может представлять собой полипептид, обладающий гомосерин-О-ацетилтрансферазной активностью, в отличие от дикого типа, в результате замены части аминокислотной последовательности полипептида, имеющего гомосерин-О-сукцинилтрансферазную активность.
Примерами гомосерин-О-сукцинилтрансферазы может быть полипептид из Enterobacteria sp., Salmonella sp., Pseudomonas sp., Bacillus sp. или Escherichia sp., конкретно полипептид из Escherichia sp., имеющий гомосерин-О-сукцинилтрансферазную активность, например полипептид, имеющий гомосерин-О-сукцинилтрансферазную активность из Е. coli. Более конкретно, гомосерин-О-сукцинилтрансфераза из Е. coli может иметь аминокислотную последовательность, представленную SEQ ID NO: 16, но не ограничивается ею. Гомосерин-О-сукцинилтрансферазы из Е. coli обозначена как "MetA".
Модифицированная гомосерин-О-сукцинилтрансфераза может представлять собой вариант полипептида, в котором 111-ая аминокислота полипептида, представленного как SEQ ID NO: 16, или полипептидов, имеющих гомологию 95% или более с полинуклеотидной последовательностью SEQ ID NO: 16 заменена глутаминовой кислотой и, кроме того, 112-ая аминокислота заменена треонином или гистидином. В частности, вариант полипептида может представлять собой полипептид, имеющий любую аминокислотную последовательность из SEQ ID NO: 17-19. Кроме того, вариант полипептида может представлять собой белок, содержащий аминокислотную последовательность, имеющую гомологию 70% или более с вышеуказанной аминокислотной последовательностью, конкретно 80% или более, или особенно 90% или более. Кроме того, учитывая вырожденность генетического кода, полинуклеотидные последовательности, кодирующие такую же аминокислотную последовательность, и их варианты должны быть включены в объем настоящего изобретения. Информацию о модифицированной гомосерин-О-сукцинилтрансферазе можно получить из публикации корейской патентной заявки 10-2012-0070531 или из международной публикации WO 2012/087039, и все описания из этих патентных документов включены в настоящее изобретение в виде ссылок.
При использовании в данном описании изобретения термин "введение или усиление активности" относится к обеспечению активности конкретного белка у микроорганизма, который не имеет этого белка; или усиление внутриклеточной активности белка в микроорганизме, который имеет этот белок, и тому подобное, и относится к увеличению внутриклеточной активности белка по сравнению с эндогенной активностью белка.
При использовании в данном описании изобретения термин "введение или усиление активности белка" относится не только к получению большего эффекта, чем исходная функция, из-за увеличения активности самого белка, но также к увеличению активности белка за счет увеличения эндогенной активность гена, эндогенной амплификации гена при помощи внутренних и внешних факторов, увеличения числа копий, введения гена извне, увеличения ферментативной активности за счет замены, модификации или мутации и т.д., но не ограничен ими.
Среди указанного выше увеличение числа копий гена, хотя и не ограничено этим, может быть осуществлено в состоянии функциональной связи с вектором или путем включения в хромосому в клетке-хозяине. В частности, способ может быть осуществлен путем введения вектора, с которым полинуклеотид, кодирующий белок по настоящему изобретению, функционально связан и может реплицироваться и функционировать независимо от хозяина в клетке хозяина; или путем введения вектора, с которым полинуклеотид функционально связан, введения полинуклеотида в хромосому клетки-хозяина, в клетку-хозяин, тем самым увеличивая число копий гена внутри хромосомы клетки-хозяина.
Вектор представляет собой ДНК-конструкцию, содержащую полинуклеотидную последовательность полинуклеотида, кодирующего целевой белок, который функционально связан с подходящей регулирующей последовательностью, так что целевой белок может экспрессироваться в соответствующем хозяине, где регулирующая последовательность включает промотор, инициирующий транскрипцию, случайная последовательность оператора для регуляции транскрипции, последовательность, кодирующую подходящий домен связывания рибосом в мРНК, и последовательность регулирования транскрипции и трансляции. Вектор после трансформации в подходящую клетку-хозяина может быть реплицирован или функционировать независимо от генома хозяина, или он может быть интегрирован в сам геном хозяина.
Вектор, используемый в настоящем изобретении, может не быть конкретно ограниченным до тех пор, пока этот вектор реплицируется в клетке-хозяине, и можно использовать любой вектор, известный в данной области техники. Примеры вектора могут включать природные и рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например, в качестве фагового вектора или космидного вектора можно использовать pWE15, М13, λMBL3, λMBL4, λIXII, λASHII, λAPII, λt10, λt11, Charon4A, Charon21A, и т.д.; и в качестве плазмидного вектора можно использовать векторы на основе pBR, на основе pUC, на основе pBluescriptII, на основе pGEM, на основе pTZ, на основе pCL, на основе рЕТ и т.д. В частности, можно использовать векторы pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118, pCC1BAC и т.д.
Кроме того, полинуклеотид, кодирующий эндогенный целевой белок, может быть замещен модифицированным полинуклеотидом с использованием вектора для встраивания в хромосому микроорганизма. Встраивание полинуклеотида в хромосому может быть осуществлено с использованием известного в данной области способа, например посредством гомологичной рекомбинации. Так как вектор по настоящему изобретению может быть встроен в хромосому посредством гомологичной рекомбинации, дополнительно может быть включен селективный маркер для подтверждения встраивания в хромосому. Селективный маркер используют для отбора трансформированных клеток, то есть для того, чтобы подтвердить, что целевой полинуклеотид был встроен, и могут быть использованы маркеры, обеспечивающие селектируемые фенотипы, такие как лекарственная резистентность, потребность в питательных веществах, резистентность к цитотоксическим агентам и экспрессия поверхностных белков, без ограничения ими. В условиях обработки селективными агентами только клетки, экспрессирующие селективные маркеры, могут выжить и экспрессировать другие фенотипические признаки и, таким образом, трансформированные клетки могут быть легко отобраны.
При использовании в данном описании изобретения термин "трансформация" относится к способу введения вектора, содержащего полинуклеотид, кодирующий целевой белок, в клетку-хозяина, посредством чего обеспечивается возможность экспрессии полинуклеотида, кодирующего белок в клетке-хозяине. Для трансформированного полинуклеотида не имеет значения, встроен ли он в хромосому клетки-хозяина и находится в ней или находится вне хромосомы, пока он может экспрессироваться в клетке-хозяине. Кроме того, полинуклеотид включает ДНК и РНК, которая кодирует целевой белок. Полинуклеотид может быть встроен в любой форме настолько, насколько он может быть введен в клетку-хозяина и экспрессироваться там. Например, полинуклеотид может быть введен в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой генетическую конструкцию, включающую все существенные элементы, необходимые для ее экспрессии. Экспрессионная кассета обычно может включать промотор, функционально связанный с полинуклеотидом, сигнал окончания транскрипции, домен связывания с рибосомой и сигнал окончания трансляции, и может находиться в форме экспрессионного вектора, способного к саморепликации. Кроме того, полинуклеотид может быть введен в клетку-хозяина как есть и функционально связан с последовательностью, необходимой для его экспрессии в клетке-хозяине. Кроме того, при использовании в данном описании изобретения термин "функционально связан" относится к функциональной связи между последовательностью промотора, который инициирует и опосредует транскрипцию полинуклеотида, кодирующего целевой белок, и последовательностью гена.
Кроме того, модификация последовательности, регулирующей экспрессию, для увеличения экспрессии полинуклеотида может быть осуществлена путем индукции вариации в полинуклеотидной последовательности посредством делеции, вставки, консервативной замены, неконсервативной замены или их комбинации, так чтобы дополнительно повысить активность последовательности, регулирующей экспрессию; или путем замены полинуклеотидной последовательности полинуклеотидной последовательностью с более сильной активностью, но конкретно не ограничена этими методами. Последовательность, регулирующая экспрессию, может включать промотор, последовательность оператора, последовательность, кодирующую домен связывания с рибосомой, и последовательность, регулирующую окончание транскрипции и трансляции и т.д. хотя конкретно и не ограничена ими. Кроме того, сильный экзогенный промотор, вместо исходного промотора, может быть соединен с верхним концом экспрессионной единицы полинуклеотида.
Кроме того, модификация полинуклеотидной последовательности на хромосоме, хотя и не ограничена конкретно ими, может быть осуществлена путем индукции вариации последовательности, регулирующей экспрессию полинуклеотидной последовательности посредством делеции, вставки, консервативной замены, неконсервативной замены или их комбинации, так чтобы усилить активность полинуклеотидной последовательности; или путем замены полинуклеотидной последовательности улучшенной полинуклеотидной последовательностью с более сильной активностью.
Как правило, введение и усиление активности белка может увеличивать активность или концентрацию соответствующего белка относительно активности или концентрацией белка дикого типа или в микроорганизме от по меньшей мере 1%, 10%, 25%, 50%, 75%, 100%, 150%, 200%, 300%, 400% или 500% до максимального значения 1000% или 2000%.
Кроме того, микроорганизм может быть таким, у которого активность эндогенной гомосерин-О-сукцинилтрансферазы ослаблена или инактивирована по сравнению с ее эндогенной активностью, для того чтобы усилить путь биосинтеза О-ацетилгомосерина путем блокировании пути биосинтеза О-сукцинилгомосерина из гомосерина.
Ослабление и инактивация активности гомосерин-О-сукцинилтрансферазы может быть осуществлена в соответствии со способом, описанным выше.
В типичном воплощении настоящего изобретения О-ацетилгомосерин-продуцирующий микроорганизм может быть таким, в котором дополнительно введена или увеличена активность фермента, вовлеченного в путь биосинтеза от фосфоенолпирувата до гомосерина, для того чтобы дополнительно увеличить количество гомосерина, субстрата для биосинтеза О-ацетилгомосерина.
В частности, вышеуказанный микроорганизм может быть таким, в котором дополнительно введена или увеличена активность по меньшей мере одного белка, выбранного из группы, состоящей из фосфоенолпируваткарбоксилазы (ррс, ЕС 4.1.1.31), аспартатаминотрансферазы (aspC, ЕС 2.6.1.1) и аспартатполуальдегиддегидрогеназы (asd, ЕС 1.2.1.11).
Например, в микроорганизм может быть введен ген ppc, кодирующий фосфоенолпируваткарбоксилат, включающий аминокислотную последовательность, представленную SEQ ID NO: 20, ген aspC, кодирующий аспартатаминотрансферазу, включающий аминокислотную последовательность, представленную SEQ ID NO: 21, и ген asd, кодирующий аспартатполуальдегиддегидрогеназу, включающий аминокислоту, представленную SEQ ID NO: 22. Например, активности трех разных ферментов могут быть введены и усилены путем получения всех генов, кодирующих эти три разных фермента, присутствующих в хромосоме клетки-хозяина с числом копий по меньшей мере 2, без ограничения этим методом. Введение и увеличение активностей может быть осуществлено в соответствии с методом, описанным выше.
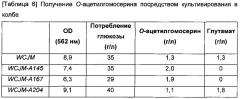
В типичном воплощении настоящего изобретения активность белка цитратсинтазы ослаблена или инактивирована различными способами, которые включают удаление гена цитратсинтазы в микроорганизме Е. coli, продуцирующем О-ацетилгомосерин; введение гена, кодирующего модифицированный белок цитратсинтазы, активность которого ослаблена по сравнению с активностью дикого типа, в положение гена цитратсинтазы; и введение экспрессионного вектора для антисмысловой РНК гена цитратсинтазы. В результате, О-ацетилгомосерин-продуцирующий микроорганизм, сконструированный таким образом, в котором активность белка цитратсинтазы ослаблена или инактивирована, продемонстрировал повышенную способность производить О-ацетилгомосерин по сравнению со способностью родительского микроорганизма (Примеры 1-4).
В другом аспекте настоящего изобретения предложен способ продуцирования О-ацетилгомосерина с использованием О-ацетилгомосерин-продуцирующего микроорганизма с улучшенной способностью продуцировать О-ацетилгомосерин. В частности, в настоящем изобретении предложен способ продуцирования О-ацетилгомосерина, включающий (а) культивирование микроорганизма; и (б) выделение О-ацетилгомосерина, полученного во время культивирования микроорганизма.
Способ культивирования Е. coli, обладающей способностью продуцировать О-ацетилгомосерин, по настоящему изобретению, может быть осуществлен в соответствии с подходящими условиями среды и культивирования, известными в данной области техники. Способ культивирования может быть легко адаптирован специалистом в данной области в зависимости от выбранного микроорганизма. В частности, поскольку микроорганизм по настоящему изобретению является микроорганизмом, у которого активность цитратсинтазы, представляющей собой фермент, опосредующий первую стадию цикла Кребса (ТСА), ослаблена или инактивирована, культуральная среда может включать глутамат, но конкретно не ограничена такой средой.
Примеры способов культивирования могут включать периодическую культуру, непрерывную культуру и культуру с подпиткой, но не ограничены ими. Эти различные методы раскрыты, например, в "Biochemical Engineering" James М. Lee, Prentice-Hall International Editions, pp 138-176.
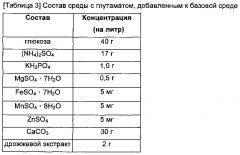
Среда, используемая в культивировании, может подходящим образом удовлетворять требованиям конкретного микроорганизма. В частности, примеры культуральной среды для микроорганизмов раскрыты в "Manual of Methods for General Bacteriology", the American Society for Bacteriology, Washington, DC, 1981. Культуральная среда может быть такой, которая включает подходящий источник углерода, источник фосфора, неорганическое соединение, аминокислоту и/или витамины и т.д., и культивирование может быть осуществлено в аэробных условиях при установленной температуре, pH и т.д.
Примеры источника углерода могут включать углеводы, такие как глюкоза, лактоза, сахароза, молочная кислота, фруктоза, мальтоза, крахмал и целлюлоза; жиры, такие как соевое масло, подсолнечное масло, касторовое масло, аргановое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол; и органические кислоты, такие как уксусная кислота. Эти источники углерода могут быть использованы по отдельности или в комбинации, но не ограничены ими.
Примеры источника азота могут включать органические источники азота, такие как пептон, дрожжевой экстракт, подливка, солодовый экстракт, жидкий кукурузный экстракт (CSL) и мука из бобов; и неорганические источники азота, такие как мочевина, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Эти источники азота можно использовать по отдельности или в комбинации, но не ограничены ими. Культуральная среда может также включать, в качестве источника фосфора, дигидрофосфат калия, гидрофосфат калия и соответствующие натрий-содержащие соли. Культуральная среда может включать металлы, такие как сульфат магния и сульфат железа. Кроме того могут быть включены аминокислоты, витамины и подходящие предшественники. Эта культуральная среда или предшественники могут быть добавлены к культуре в виде периодической культуры или непрерывной культуры, без ограничения