Непрерывный способ алкилирования циклических третичных аминов
Иллюстрации
Показать всеИзобретение относится к непрерывному способу алкилирования третичных аминов и, в частности, к непрерывному способу кватернизации циклических третичных аминов. Способ позволяет получить циклические соли четвертичного аммония с высокой степенью превращения и высокой степенью чистоты. 18 з.п. ф-лы, 1 табл., 6 пр.
Реферат
Настоящее изобретение относится к непрерывному способу алкилирования третичных аминов и в частности к непрерывному способу кватернизации циклических третичных аминов, применимому для получения циклических четвертичных аммониевых солей высокой чистоты.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
В литературе известен ряд четвертичных аммониевых солей, которые применяются в различных областях техники. Получение этих солей обычно включает алкилирование третичных аминов на завершающей стадии, но в большинстве подобных способов для протекания реакции требуется продолжительное время.
Например, в US 2956062 описаны периодические способы алкилирования циклических третичных аминов (N-замещенных 3-пирролидинолов) реакцией с избытком алкилирующего агента в подходящем растворителе, например простом эфире или этилацетате. Для завершения реакции требуется несколько часов или даже дней.
В US 3813441 описан непрерывный способ получения алифатических хлоридов четвертичного аммония из алифатических аминов с длинными цепями взаимодействием с метилхлоридом и водным раствором гидроксида щелочного металла в низкокипящем растворителе под давлением. Побочный продукт реакции - хлорид натрия - необходимо постоянно удалять путем фильтрования.
В ЕР 0288857 описан способ кватернизации третичных аминов в отсутствие растворителя алкилгалогенидов при молярном соотношении в диапазоне от 1:3 до 1:8 при повышенном давлении (вплоть до 27,5 бар).
В US 5041664 описан непрерывный способ кватернизации третичных аминов с длинными цепями взаимодействием с алкилхлоридами при гетерогенном катализе оксидами металлов.
В US 5491240 описано получение четвертичных аммониевых соединений, применимых в качестве мягчителей тканей и/или кондиционирующих агентов для кожи или волос. Получение указанных соединений включает кватернизацию третичных аминов, причем алкилирующий агент добавляют постадийно. Время протекания реакции составляет около 10 часов.
В EP 0869114 описан периодический способ кватернизации сложных эфиров-аминов, где время завершения реакции составляет по меньшей мере 24 часа. Полученные соединения четвертичного аммония подходят в качестве мягчителей.
В WO 2011/091197 описано получение кватернизованных N,N-диалкиламиноэтил(метил)акрилатов, применимых в качестве промежуточных соединений при получении катионных полимеров, являющихся коагулянтами. Способ получения включает двухфазный процесс кватернизации N,N-диалкиламиноэтил(метил)акрилатов, где фазу, содержащую продукт, непрерывно удаляют из реактора.
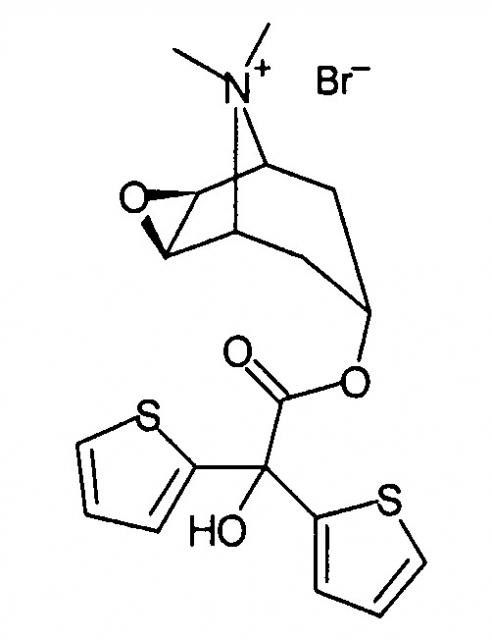
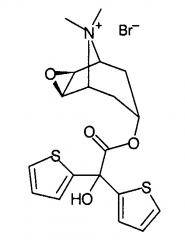
Некоторые циклические четвертичные соли аммония, например тиотропия бромид (химическое наименование: бромид (1α,2β,4β,7β)-7-[(гидрокси-ди-2-тиенилацетил)окси]-9,9-диметил-3-окса-9-азониатрицикло[3.3.1.02,4]нонана) формулы
поступающий в продажу под торговой маркой Spiriva®,
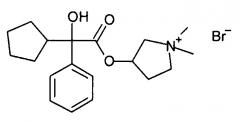
гликопиррония бромид (химическое наименование бромид 3-(2-циклопентил-2-гидрокси-2-фенилацетокси)-1,1-диметилпирролидиния) формулы
поступающий в продажу под торговой маркой Robinul®,
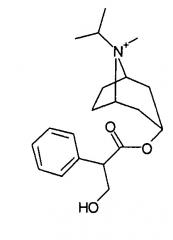
и ипратропия бромид (химическое наименование: [8-метил-8-(1-метилэтил)-8-азониабицикло[3.2.1]окт-3-ил]-3-гидрокси-2-фенилпропаноат) формулы
поступающий в продажу под торговой маркой Atrovent®, являются известными антихолинергическими средствами, применяемыми для различных целей, в основном для лечения хронической обструктивной болезни легких (COPD). Получение этих соединений обычно включает алкилирование соответствующих циклических третичных аминов на завершающей стадии, но большинство таких способов получения требует продолжительного времени реакции и последующей очистки для получения степени чистоты, необходимой для фармацевтических препаратов.
Например, в US 5610163 описано получение тиотропия бромида и его аналогов реакцией соответствующих третичных аминов, растворенных в метиленхлориде/ацетонитриле, с раствором метилбромида в ацетонитриле при комнатной температуре в течение 24 часов.
До сих пор существует потребность в эффективном усовершенствованном способе, в частности эффективном непрерывном способе получения циклических четвертичных аммониевых соединений. Авторы изобретения разработали способ непрерывного алкилирования циклических третичных аминов, применимый, в частности, для получения циклических четвертичных аммониевых соединений высокой степени чистоты, необходимой для фармацевтического применения, который является более эффективным, чем известные способы кватернизации.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предметом настоящего изобретения является способ непрерывного алкилирования циклических третичных аминов, включающий:
- непрерывную подачу раствора циклического третичного амина в подходящем растворителе или смеси растворителей, а также алкилирующего агента, необязательно растворенного в подходящем растворителе или смеси растворителей, в проточный реактор непрерывного действия;
- поддержание температуры в диапазоне 20-140°C;
- сбор раствора, содержащего чистое циклическое соединение четвертичного аммония;
- выделение чистого циклического соединения четвертичного аммония.
Способ по настоящему изобретению позволяет непосредственно получать циклическое соединение четвертичного аммония высокой чистоты и не требует проведения какой-либо последующей стадии очистки. Кроме того, этот способ дает ряд дополнительных преимуществ по сравнению со способами известного уровня техники, например лучшее управление реакцией, лучший температурный контроль реакции и несложное увеличение масштаба для получения большего количества продукта.
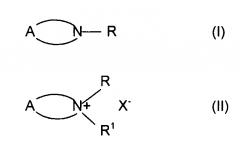
В рамках настоящей заявки циклические третичные амины и циклические соединения четвертичного аммония представляют собой соединения общей формулы
соответственно, где
R является линейной или разветвленной C1-C12 алкильной группой;
R1 является линейной или разветвленной C1-C3 алкильной группой;
X означает атом галогена или карбонат, сульфат или трифлат;
и A представляет собой фрагмент, образующий необязательно замещенную моноциклическую, бициклическую или трициклическую систему, включающую атом азота.
В соединениях формулы (I) и (II), R предпочтительно означает C1-C4 алкильную группу, например метил, этил, пропил, изопропил, бутил, изобутил и т-бутил, причем метил и изопропил являются особенно предпочтительными.
В соединениях формулы (II), R1 предпочтительно означает метил, этил, пропил и изопропил и особенно предпочтительным является метил.
В соединениях формулы (I) и формулы (II) указанные циклические системы выбраны из необязательно замещенных моноциклических систем, включающих от 4 до 7 атомов, в число которых помимо атома азота, с которым связан фрагмент A, необязательно входят 1 или 2 гетероатома, выбранных из N, O и S; необязательно замещенных бициклических систем, включающих от 6 до 9 атомов, в число которых помимо атома азота, с которым связан фрагмент A, необязательно входят 1 или 2 гетероатома, выбранных из N, O и S; и необязательно замещенных трициклических систем, включающих от 8 до 12 атомов, в число которых помимо атома азота, с которым связан фрагмент A, необязательно входят 1 или 2 гетероатома, выбранных из N, O и S.
Примерами особенно предпочтительных моноциклических, бициклических и трициклических систем являются фрагменты следующих формул
и соответствующие четвертичные аммониевые соли
где R, R1 и X имеют указанные выше значения и Y является заместителем, выбранным из (цикло)алкила, арила, гетероарила, арилалкила, гетероарилалкила, (цикло)алкокси, арилокси, гетероарилокси, (цикло)алкилкарбонила, арилкарбонила, гетероарилкарбонила, (цикло)алкилкарбонилокси, арилкарбонилокси, гетероарилкарбонилокси, арилалкилкарбонилокси и гетероарилалкилкарбонилокси.
В особенно предпочтительном варианте осуществления настоящего изобретения заместитель Y выбран из (цикло)алкилкарбонилокси, арилалкилкарбонилокси и гетероарилалкилкарбонилокси групп.
Примерами особенно предпочтительной структуры заместителя Y являются группы формулы
где заместители R2, R3 и R4, которые могут являться одинаковыми или различными, представляют собой водород, гидрокси, гидроксиалкил, предпочтительно гидроксиметил, фенил, циклоалкил, предпочтительно циклопентил, и гетероарил, предпочтительно тиенил.
Конкретными примерами являются
Алкилирующий агент, применимый в способе по настоящему изобретению, представляет собой соединение формулы R1X, где R1 и X имеют указанные выше значения.
Предпочтительно алкилирующий агент представляет собой соединение формулы R1X, где X является атомом галогена, выбранным из Cl, Br и I, еще более предпочтительно X означает Br.
Примерами алкилирующих агентов, применимых в способе по настоящему изобретению, являются метилхлорид, метилбромид, метилйодид, этилхлорид, этилбромид, этилйодид, н-пропилхлорид, н-пропилбромид, н-пропилйодид, изопропилхлорид, изопропилбромид и изопропилйодид.
Особенно предпочтительными являются метилхлорид, метилбромид и метилйодид и еще более предпочтительным является метилбромид.
Способ по настоящему изобретению характеризуется применением подходящего растворителя или смеси растворителей, предназначенных для растворения циклического третичного амина и, необязательно, также алкилирующего агента.
Выбор растворителя имеет решающее значение для достижения желаемых результатов, т.е. высокой степени превращения и высокой чистоты.
Авторы изобретения провели ряд экспериментов для получения максимальной степени превращения при сохранении высокой чистоты конечного продукта и обнаружили, что лучшие результаты достигаются при применении полярных апротонных растворителей, выбранных из амидов, нитрилов и сульфоксидов, например ацетонитрила, диметилформамида, диметилацетамида, N-метилпирролидона и диметилсульфоксида.
Указанный полярный апротонный растворитель применяется для получения раствора циклического третичного амина, который предполагается кватернизовать по способу настоящего изобретения.
Алкилирующий агент можно применять без растворителя или в форме раствора в подходящем растворителе. Указанный растворитель может быть тем же растворителем, который применяется для растворения третичного циклического амина, или другим растворителем.
Если алкилирующий агент в способе по настоящему изобретению применяется в виде раствора, растворителем предпочтительно является полярный апротонный растворитель, отличающийся от растворителя, применяемого для растворения амина.
Для получения раствора алкилирующего агента, который предполагается применять в способе по настоящему изобретению, особенно предпочтительным растворителем является ацетонитрил.
Особенно предпочтительными растворителями для растворения циклического третичного амина являются диметилацетамид, диметилсульфоксид и N-метилпирролидон.
Еще более предпочтительной является комбинация N-метилпирролидона для растворения циклического третичного амина и ацетонитрила для растворения алкилирующего агента.
Раствор циклического третичного амина и алкилирующий агент в чистом виде или в виде раствора можно вводить в проточный реактор непрерывного действия по отдельности, или в качестве альтернативы раствор циклического третичного амина и алкилирующий агент в чистом виде или в виде раствора можно смешать заранее, перед вводом в проточный реактор непрерывного действия.
Температура реакции находится в пределах от 20 до 200°C, предпочтительно от 40 до 85°C.
Для полноты протекания реакции необходимо надлежащим образом отрегулировать скорость потока, чтобы получить оптимальное время пребывания реакционной смеси в проточном реакторе непрерывного действия.
Диапазоны скорости потока и давления являются характеристиками модели реактора. Например, для реактора Corning Advanced Flow G1 скорость потока, как правило, находится в диапазоне от 1 до 30 г/мин и давление находится в диапазоне от 1 до 20 бар.
Способ по настоящему изобретению особенно применим для получения антихолинергических лекарственных средств, например тиотропия бромида, гликопиррония бромида и ипратропия бромида.
В особенно предпочтительном варианте осуществления способ по настоящему изобретению применим для получения тиотропия бромида.
Ниже по тексту настоящее изобретение проиллюстрировано следующими не ограничивающими примерами.
Сравнительный пример 1
Синтез тиотропия бромида периодическим способом
В 250 мл колбе в атмосфере азота при комнатной температуре растворяли N-деметилтиотропий (10,0 г) в N-метилпирролидоне (33 мл). Добавляли смесь метилбромид/ацетонитрил 1:1 (масс./масс.) (25 г). Через 22 часа перемешивания при комнатной температуре отделяли белый осадок фильтрованием, промывали ацетоном и высушивали. Чистота по данным ВЭЖХ: 99,66%.
Пример 2
Синтез тиотропия бромида взаимодействием с жидким метилбромидом в потоке
Раствор N-деметилтиотропия (12 г) в ацетонитриле (139,4 мл) и дихлорметане (180 мл) вводили в проточный реактор непрерывного действия со скоростью 10 г/мин. Жидкий метилбромид вводили со скоростью 0,5 г/мин. Температура реактора составляла 40°C.
Раствор, выходящий из реактора непрерывного действия, собирали и перемешивали в течение ночи при комнатной температуре. Осадок отделяли фильтрованием, промывали дихлорметаном и высушивали при пониженном давлении.
Пример 3
Синтез тиотропия бромида в потоке взаимодействием с метилбромидом в виде раствора при предварительном смешивании
Смесь 1:1 (масс./масс.) метилбромид/ацетонитрил (15 г) добавляли к раствору N-деметилтиотропия (6,0 г) в N-метилпирролидоне (20 мл). Раствор вводили в реактор непрерывного действия со скоростью 10 г/мин. Температура реактора составляла 80°C. Собирали раствор, выходящий из реактора, охлаждали до комнатной температуры, затем до 0°C. Добавляли ацетон (100 мл). Полученную суспензию перемешивали в течение еще одного часа, затем хранили при 0-5°C в течение ночи. Продукт отделяли фильтрованием, дважды промывали ацетоном и высушивали при пониженном давлении.
Чистота по данным ВЭЖХ: 99,98%.
1H ЯМР (300 МГц, d6-ДМСО): 7,52 (дд, J=5,0 Гц, 1,1, 2Н), 7,41 (с, 1Н), 7,13 (дд, J=3,6, 1,1 Гц, 2Н), 7,01 (дд, J=5,0 3,7 Гц, 2Н), 5,12 (т, J=5,8 Гц, 1Н), 4,13 (уш.д, J=5,8 Гц, 2Н), 3,50 (с, 2Н), 3,25 (с, 3Н), 1,93 (с, 1Н), 1,93 (с, 1Н), 1,87 (с, 1Н).
13C ЯМР (75,5 МГц, d6-ДМСО): 170,2, 147,1, 127,3, 126,7, 126,3, 76,8, 65,0, 64,2, 56,5, 54,1, 47,6, 28,7.
Рентгеновский спектр идентичен рентгеновскому спектру тиотропия бромида, полученного по методике, описанной в US 5610163.
Пример 4
Повторяли методику примеров 2 и 3 с различными растворителями или смесями растворителей.
Результаты экспериментов показаны в приведенной ниже таблице
| Таблица 1 | ||||
| Растворитель амин/MeBr | Давление | Температура | Степень превращения | Чистота |
| CH2Cl2+MeCN/- | 0,35 бар (жидкость) | 41°C | 17% | нет данных |
| CH2Cl2+MeCN | 12,3 бар | 70°C | 25% | 99,1% |
| MeOH/MeCN | 15,6 бар | 81°C | 61% | 73,9% |
| MeOH/MeCN | 3,4 бар | 80°C | 84% | нет данных |
| ДМФА/MeCN | 10,6 бар | 81°C | 97% | нет данных |
| DMA/MeCN | 10,6 бар | 81°C | 97% | 99,95% |
| ДМСО/MeCN | 10,8 бар | 81°C | 94% | 98,20% |
| NMP/MeCN | 10,3 бар | 81°C | 99,7% | 99,98% |
Полученные результаты показывают, что дихлорметан является плохим растворителем конечного продукта, который может осаждаться в проточном реакторе непрерывного действия и забивать трубопроводы. Замена дихлорметана метанолом позволяет увеличить температуру, но степень превращения остается довольно низкой. Применение полярных апротонных растворителей, выбранных из амидов, нитрилов и сульфоксидов, согласно способу по настоящему изобретению приводит к очень высоким степеням превращения. Кроме того, способ является очень селективным и конечный продукт можно выделить с очень высокой чистотой, соответствующей требованиям фармацевтики, без необходимости дополнительной очистки.
Пример 5
Получение гликопиррония бромида
Гликопиррония бромид получали способом, аналогичным описанному в примере 3.
1H ЯМР (300 МГц, D2O): 7,71-7,63 (м, 2Н), 7,53-7,38 (м, 3Н), 5,54 (с, 1Н), 3,92-3,68 (м, 2Н), 3,67-3,49 (м, 2Н), 3,23-3,14 (м, 1Н), 3,22 (с, 3На), 3,18 (с, 3Hb), 3,06 (с, 3На), 2,90 (с, 3Hb), 2,84-2,64 (м, 1Н), 2,45-2,31 (м, 1Hb), 2,23-2,09 (м, 1На), 1,81-1,46 (м, 8Н), 1,34-1,20 (м, 1Н).
13C ЯМР (75,5 МГц, D2O): 174,4, 140,6+140,5 (1 Ca+b) 128,7 (2 С), 128,3 126,2+126,0 (2 Ca+b), 80,7+80,5(1 Ca+b), 74,0, 70,1, 64,8, 53,5, 52,9, 44,9+44,7 (1 Ca+b), 29,9+29,7 (1 Ca+b), 26,6+26,5 (1 Ca+b), 26,1+26,0 (2 Ca+b), 25,8+25,6 (1 Ca+b).
а=(R,S)/(S,R)
b=(S,S)/(R,R)
Пример 6
Получение ипратропия бромида
Ипратропия бромид получали способом, аналогичным описанному в примере 3.
1H-ЯМР (300 МГц, D2O): 7,41-7,25 (м, 5Н), 5,09-5,02 (м, 1Н), 4,19-4,07 (м, 1Н), 3,97-3,87 (м, 2Н), 3,87-3,79 (м, 1Н), 3,76-3,68 (м, 1Н), 2,71 (с, 3Н), 2,61-2,41 (м, 2Н), 2,30-1,91 (м, 3Н), 1,71 (д, J=17 Гц, 1Н).
13C-ЯМР (75,5 МГц, D2O): 173,0, 135,2, 129,2 (2 С), 128,3 (2 С), 128,2, 65,5, 65,4, 64,1, 62,1, 55,5, 53,5, 39,0, 30,7, (2 С), 24,4, 24,1, 15,5 (2 С).
1. Способ непрерывного алкилирования циклических третичных аминов, включающий:
- непрерывную подачу раствора циклического третичного амина в подходящем растворителе или смеси растворителей, а также алкилирующего агента, растворенного в подходящем растворителе или смеси растворителей, в проточный реактор непрерывного действия, где указанный подходящий растворитель или смесь растворителей являются полярными апротонными растворителями, выбранными из амидов, нитрилов и сульфоксидов;
- поддержание температуры в диапазоне 20-200°C;
- сбор раствора, содержащего чистое циклическое соединение четвертичного аммония;
- выделение чистого циклического соединения четвертичного аммония;
где указанные циклические третичные амины и циклические соединения четвертичного аммония представляют собой соединения общей формулы
соответственно, где
R является линейной или разветвленной С1-С12 алкильной группой;
R1 является линейной или разветвленной C1-С3 алкильной группой;
X означает атом галогена или карбонат, сульфат или трифлат;
и А представляет собой фрагмент, образующий необязательно замещенную моноциклическую, бициклическую или трициклическую систему, включающую атом азота, где указанная циклическая система выбрана из необязательно замещенных моноциклических систем, включающих от 4 до 7 атомов, в число которых помимо атома азота, с которым связан фрагмент А, необязательно входят 1 или 2 гетероатома, выбранных из N, О и S; необязательно замещенных бициклических систем, включающих от 6 до 9 атомов, в число которых помимо атома азота, с которым связан фрагмент А, необязательно входят 1 или 2 гетероатома, выбранных из N, О и S; и необязательно замещенных трициклических систем, включающих от 8 до 12 атомов, в число которых помимо атома азота, с которым связан фрагмент А, необязательно входят 1 или 2 гетероатома, выбранных из N, О и S.
2. Способ по п. 1, где R представляет собой С1-С4 алкильную группу.
3. Способ по п. 2, где R означает метил или изопропил.
4. Способ по п. 1, где R1 означает метил.
5. Способ по п. 1, где указанные моноциклические, бициклические и трициклические системы представляют собой фрагменты следующих формул
и соответствующие четвертичные аммониевые соли
где R, R1 и X имеют указанные выше значения и Y является заместителем, выбранным из (цикло)алкила, арила, гетероарила, арилалкила, гетероарилалкила, (цикло)алкокси, арилокси, гетероарилокси, (цикло)алкилкарбонила, арилкарбонила, гетероарилкарбонила, (цикло)алкилкарбонилокси, арилкарбонилокси, гетероарилкарбонилокси, арилалкилкарбонилокси и гетероарилалкилкарбонилокси.
6. Способ по п. 5, где заместитель Y выбран из (цикло)алкилкарбонилокси, арилалкилкарбонилокси и гетероарилалкилкарбонилокси групп.
7. Способ по п. 6, где Y означает группу формулы
где заместители R2, R3 и R4, которые могут являться одинаковыми или различными, представляют собой водород, гидрокси, гидроксиалкил, предпочтительно гидроксиметил, фенил, циклоалкил, предпочтительно циклопентил, и гетероарил, предпочтительно тиенил.
8. Способ по п. 1, где алкилирующий агент является соединением формулы R1X, где R1 и X имеют указанные выше значения.
9. Способ по п. 8, где алкилирующий агент является соединением формулы R1X, где X является атомом галогена, выбранным из Cl, Br и I.
10. Способ по п. 9, где алкилирующий агент выбран из метилхлорида, метилбромида, метилйодида, этилхлорида, этилбромида, этилйодида, н-пропилхлорида, н-пропилбромида, н-пропилйодида, изопропилхлорида, изопропилбромида и изопропилйодида.
11. Способ по п. 10, где алкилирующий агент является метилбромидом.
12. Способ по п. 1, где указанный полярный апротонный растворитель выбран из ацетонитрила, диметилформамида, диметилацетамида, N-метилпирролидона и диметилсульфоксида.
13. Способ по п. 1, где алкилирующий агент вводят в проточный реактор непрерывного действия в чистом виде.
14. Способ по п. 1, где алкилирующий агент вводят в проточный реактор непрерывного действия в виде раствора, необязательно заранее смешанного с раствором циклического третичного амина.
15. Способ по п. 14, где растворитель для получения раствора алкилирующего агента представляет собой ацетонитрил.
16. Способ по п. 1, где растворитель для растворения циклического третичного амина выбран из диметилацетамида, диметилсульфоксида и N-метилпирролидона.
17. Способ по п. 16, где указанный растворитель представляет собой N-метилпирролидон.
18. Способ по п. 1, где температура находится в пределах от 20 до 200°C, предпочтительно от 40 до 85°C.
19. Способ по любому из предшествующих пунктов для получения тиотропия бромида, гликопиррония бромида и ипратропия бромида.