Способ прогнозирования устойчивости к инотропной терапии у новорожденных с артериальной гипотензией путем выявления молекулярно-генетических предикторов
Иллюстрации
Показать всеИзобретение относится к области медицины и предназначено для прогнозирования устойчивости к инотропной терапии у новорожденных с артериальной гипотензией. Из образцов периферической крови выделяют ДНК. Методом полимеразной цепной реакции проводят генотипирование полиморфизмов генов ADD1:1378G>T, ADRA2A:-1291C>G, SLC6A2:-182Т>С, ACE:287bp Ins>Del. Вероятность устойчивости к терапии рассчитывается по формуле. Изобретение позволяет с высокой долей чувствительности и специфичности прогнозировать устойчивость к инотропной терапии у новорожденных с артериальной гипотензией. 4 табл., 2 пр.
Реферат
1. Область техники
Изобретение относится к медицине, а именно к интенсивной терапии новорожденных, и предназначено для прогнозирования устойчивости к инотропной терапии у новорожденных с артериальной гипотензией (АГ).
2. Уровень техники
Артериальная гипотензия (АГ) является одним из наиболее часто встречающихся патологических состояний периода новорожденности, характерным для недоношенных новорожденных. На основании ряда исследований предполагается причинно-следственная связь между системной гипотензией и рядом тяжелых заболеваний, включая внутрижелудочковые кровоизлияния и поражение белого вещества головного мозга (1, 2, 3, 4). В качестве инотропной терапии наиболее часто используются: допамин, реже добутамин, адреналин, норадреналин. Препаратом первой линии в терапии АГ у новорожденных в подавляющем большинстве случаев применяется допамин (5). При клиническом наблюдении обращает на себя внимание группа новорожденных, которые требуют более продолжительной и более высокодозированной инотропной терапии для достижения нормальных цифр артериального давления. Степень восприимчивости новорожденных к терапии АГ инотропными препаратами различна в отношении минимально эффективной для повышения артериального давления (АД) дозы, а также в отношении продолжительности потребности в инфузии инотропного препарата для поддержания АД.
Исследование полиморфизма молекулярно-генетических маркеров позволит выявить генетические детерминанты новорожденных, которые развивают устойчивость к терапии артериальной гипотензии в раннем неонатальном периоде, что позволит оптимизировать подходы к терапии артериальной гипотензии, объяснить причину резистентной АГ, характерной для недоношенных новорожденных. Нами был выполнен патентный поиск за период 2014-2017 гг., аналогичных работ не было выявлено.
В данном патенте предложен метод прогнозирования возможного ответа на инотропную терапию недоношенных новорожденных с артериальной гипотензией. Предложенный метод может позволить оптимизировать Протокол терапии артериальной гипотензии у новорожденных в части расширения показаний к более быстрому наращиванию дозы вводимых инотропных препаратов у категории пациентов с предрасположенностью к резистентной артериальной гипотензии.
Предложенный способ может быть актуальным в тех случаях, когда причина резистентности к проводимой антигипотензивной терапии остается неясной.
Из данных литературы, патентов и патентных заявок на исследование полиморфизма молекулярно-генетических маркеров для прогнозирования устойчивости к проведению антигипотензивной терапии не известно.
3. Описание изобретения
Предложен способ прогнозирования эффективности инотропной терапии у недоношенных новорожденных с артериальной гипотензией с помощью определения генотипа пациента.
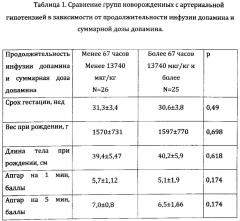
При сравнении распределения аллелей и генотипов в зависимости от ответа на проводимую инотропную терапию, выяснилось, что сравнительно более длительная инфузия допамина и сравнительно более высокая дозировка ассоциированы со следующими полиморфными локусами: ADD1:1378G>T, ADRA2A:1291C>G, SLC6A2:182 Т>С, ACE:287bp Ins>Del.
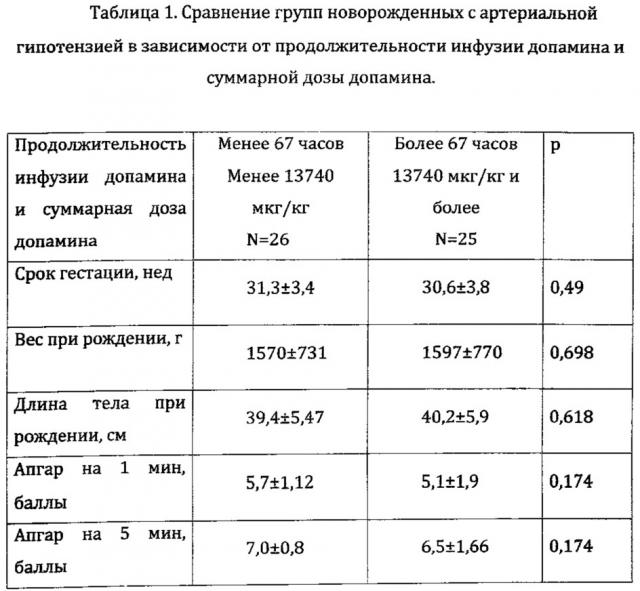
В ходе сравнительного анализа был собран первичный материал о 275 новорожденных различного гестационного возраста, наблюдавшихся в ОРИТН в период 2013-2014 гг. У 74 (27,0%) новорожденных была зарегистрирована артериальная гипотензия в течение первых 72 часов жизни, которая оценивалась как снижение АД при трех последовательных измерениях ниже цифр в мм рт ст, равных ГВ пациента в неделях. Оценивались молекулярно-генетические предикторы устойчивости к инотропной терапии. На основании медицинской документации была оценена продолжительность инфузии допамина и суммарная доза допамина в пересчете на массу тела у новорожденных, у которых развилась АГ в течение первых 72 ч жизни. Из исследования были исключены пациенты, о составе терапии которых не было достоверных сведений (23 новорожденных). Таким образом, из 74 новорожденных, у которых была зарегистрирована АГ, был выделен 51 пациент.
Продолжительность инфузии допамина составила от 3 до 720 ч, медиана - 67 часов. Суммарная доза от 360 мкг/кг до 329 820 мкг/кг, медиана - 13 740 мкг/кг. Было решено сравнить полиморфизм молекулярно-генетических маркеров двух групп новорожденных в два этапа.
На первом этапе сравнение производилось в зависимости от суммарной дозы допамина, которая потребовалась - менее 13 740 мкг/кг и менее (26 новорожденных) и более 13 740 мкг/кг (25 новорожденных). Группы были сопоставимы по основным показателям - сроку гестации, весу и длине тела при рождении, а также оценке по шкале Апгар на 1 минуте и 5 минуте (Табл. 1) В дальнейшем была предпринята попытка сравнить группы в зависимости от продолжительности инфузии допамина - до 67 часов (26 новорожденных) и более 67 часов (25 новорожденных). Однако эти группы оказались идентичными с предыдущим сравнением. (Табл. 1).
При сравнении распределения аллелей и генотипов в указанных группах с помощью бинарной логистической регрессии была разработана математическая модель, позволяющая по генотипу пациента прогнозировать ответ на терапию артериальной гипотензии.
Уравнение классифицирующей функции имеет вид:
,
где
Z - классифицирующая функция
[ADD1] - генотип ADD1:1378G>T (G/G=1, G/T=2, Т/Т=3)
[ADRA2A] - генотип ADRA2A:-1291C>G (C/C=1, C/G=2, G/G=3)
[SLC6A2] - генотип SLC6A2: -182 Т>С (С/С=1, С/Т=2, Т/Т=3)
[АСЕ] - генотип ACE:287bp Ins>Del (Del/Del=1, Ins/Ins или Ins/Del=0)
Вероятность устойчивости к терапии рассчитывается по формуле
,
где
Р - вероятность устойчивости к терапии
Z - классифицирующая функция (1)
Предсказательная способность модели оценена с помощью ROC-анализа. Площадь под характеристической кривой составила 0,98 (0,95-1,00), р=3,2*10-6. Чувствительность и специфичность составили 88 и 94% соответственно. Часть дисперсии, объяснимой с помощью данного изобретения, составила 90% (оценена по методу Наделькеркеса).
На основании определения полиморфизма генов ADD1:1378G>T, ADRA2A:-1291C>G, SLC6A2: -182 Т>С и ACE:287bp Ins>Del станет возможно прогнозирование устойчивости недоношенных новорожденных к терапии артериальной гипотензии.
4. Реализация изобретения
Генотипирование проводится методом полимеразной цепной реакции (ПЦР) с анализом кривых плавления модифицированным методом «примыкающих проб» (adjacent probes, kissing probes), или аналогичным методом. ДНК для генотипирования выделяется из образцов периферической крови, взятой из периферической вены, с добавлением этилендиаминтетрауксусной кислоты (EDTA) в качестве антикоагулянта.
5. Примеры использования изобретения
Пример 1
Недоношенный мальчик А., 1 из двойни, родился на сроке гестации 31 нед. У матери беременность вторая, протекала на фоне угрозы прерывания. Роды вторые, самопроизвольные. Масса при рождении 1600 г, длина 43 см, оценка по шкале Апгар 6-7 баллов. С рождения состояние средней тяжести за счет дыхательной недостаточности, вводился сурфактант. В течение 12 суток находился на респираторной поддержке методом назального СРАР через носовые канюли. В возрасте 4 часов жизни отмечено снижение среднего артериального давления, на фоне отсутствия признаов гиповолемии и шока, до 26 мм рт. ст., что потребовало начала инфузии допамина с постепенным подбором дозы с 2 мкг/кг/мин. Отсутствие реакции на низкие дозы допамина привело к быстрому увеличению дозировки до максимально 12 мкг/кг/мин. С целью коррекции артериальной гипотонии ребенку требовалась продолжительная инфузия допамина в течение 166 часов. Суммарная доза допамина за этот период в пересчете на вес ребенка составила 24180 мкг/кг/мин.
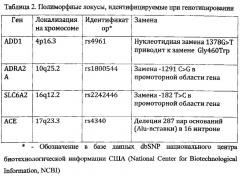
Наблюдался с диагнозом: Врожденная пневмония. Гипербилирубинемия недоношенных. Дискинезия ЖКТ. Анемия недоношенных. Асфиксия легкой степени тяжести при рождении. Недоношенность. При генотипировании получены следующие результаты (Табл. 3).
Z=-19.18-37.28+2*56.05-54.55=1,09
p=1/(1+e-z)=1/(1+e-1,09)=0,748
Вероятность устойчивости к инотропной терапии 75%. Рекомендуется увеличение дозы препарата.
Пример 2
Недоношенный мальчик Б., 2 из тройни, родился на сроке гестации 29 нед. У матери беременность первая, протекала с угрозой прерывания, на фоне истмико-цервикальной недостаточности. Роды первые, путем операции кесарева сечения в связи с поперечным положением третьего плода. Масса тела при рождении 1167 г, длина 36 см, оценка по шкале Апгар 5-7 баллов. После рождения состояние средней тяжести за счет дыхательной недостаточности, вводился сурфактант. В течение 48 часов находился на респираторной поддержке методом назального СРАР. В возрасте 4 часов жизни отмечена артериальная гипотензия, снижение среднего артериального давления до 27 мм рт. ст. Признаков гиповолемии и шока не отмечалось. С целью коррекции артериальной гипотензии начата инфузия допамина с 2 мкг/кг/мин. Ребенок продемонстрировал быстрый ответ на введение инотропного препарата [допамина]. При подборе дозы максимальная дозировка составила 4 мкг/кг/мин. Общая продолжительность инфузии допамина для коррекции артериальной гипотензии - 54 часа, суммарная доза препарата в пересчете на вес ребенка - 9300 мкг/кг/мин. Наблюдался с диагнозом: Респираторный дистресс-синдром. Асфиксия средней тяжести при рождении. Очень низкая масса тела при рождении.
Недоношенность. При генотипировании получены следующие результаты (Табл. 4).
Z=-19.18-37.28+2*56.05-54.55=1,09
p=1/(1+e-z)=1/(1+e1,09)=0,25
Вероятность устойчивости к инотропной терапии 25%. Не требуется увеличения дозы препарата.
Список литературы
1. K., Lou Н.С., Greisen G. Cerebral white matter blood flow and arterial blood pressure in preterminfants. Acta Paediatr. 2010 Oct; 99(10): 1489-92.
2. Shah D., Paradisis M., Bowen J.R. Relationship between systemic blood flow, blood pressure, inotropes, and aEEG in the first 48 h of life in extremely preterm infants. Pediatr Res. 2013 Sep.; 74(3): 314-20.
3. Hofstetter A.O., Legnevall L., Herlenius E., Katz-Salamon M. Cardiorespiratory development in extremely preterm infants: vulnerability to infection and persistence of events beyond term-equivalent age. Acta Paediatr. 2008 Mar; 97(3): 285-92.
4. Doyle L.W. Cardiopulmonary outcomes of extreme prematurity. Semin Perinatol. 2008 Feb.; 32(1): 28-34.
5. Stranak Z., Semberova J., Barrington K., O'Donnell C., Marlow N., Naulaers G., Dempsey E., HIP consortium. International survey on diagnosis and management of hypotension in extremely preterm babies. Eur J. Pediatr. 2014 Jun; 173(6): 793-8.
Способ прогнозирования устойчивости к инотропной терапии у новорожденных с артериальной гипотензией путем выявления молекулярно-генетических предикторов, характеризующийся тем, что из образцов периферической крови выделяют ДНК, проводят генотипирование полиморфизма генов ADD1:1378G>T, ADRA2A:-1291C>G, SLC6A2:-182Т>С, ACE:287bp Ins>Del методом полимеразной цепной реакции (ПЦР), для выявления вероятности устойчивости используют уравнение, имеющее следующий вид:
где
Z - классифицирующая функция
[ADD1] - генотип ADD1:1378G>T (G/G=1, G/T=2, Т/Т=3)
[ADRA2A] - генотип ADRA2A:-1291C>G (C/C=1, C/G=2, G/G=3)
[SLC6A2] - генотип SLC6A2:-182Т>С (С/С=1, С/Т=2, Т/Т=3)
[АСЕ] - генотип ACE:287bp Ins>Del (Del/Del=1, Ins/Ins или Ins/Del=0)
вероятность устойчивости к терапии рассчитывается по формуле
P=1/(1+e-z) (2),
где Р - вероятность устойчивости к терапии, z - классифицирующая функция (1).