Способ получения n-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида
Иллюстрации
Показать всеИзобретение относится к органической химии, а именно к способу получения N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида, обладающего антигельминтной активностью. Способ получения N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида осуществляют в среде толуола ацетилированием 3,5-дихлорсалициловой кислоты с образованием 2-ацетокси-3,5-дихлорбензойной кислоты. Затем получают ее хлорангидрид и проводят реакцию хлорангидрида с 4-метил-3-хлоранилином с дальнейшим выделением целевого продукта. Причем ацетилирование 3,5-дихлорсалициловой кислоты осуществляют ацетилхлоридом в мольном отношении 1:2 при температуре с 65 до 90°С, хлорангидрид 2-ацетокси-3,5-дихлорбензойной кислоты получают воздействием хлористого тионила в мольном отношении 1:1,5 с добавкой каталитического количества диметилформамида при 76-80°С в течение 1 ч. Реакцию хлорангидрида с 4-метил-3-хлоранилином проводят в присутствии водного раствора гидрокарбоната натрия в мольном отношении соответственно 1,05:1:1,2 при температуре 18-22°С, а целевой продукт выделяют фильтрованием в виде осадка. Технический результат – получение N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида с высоким выходом в результате разработки безопасного, малоотходного, экономичного и эффективного способа. 2 пр.
Реферат
Изобретение относится к области органической химии, а именно к способу получения N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I, который обладает антигельминтным действием, в эксперименте на животных не проявляет эмбриотоксичности и поэтому перспективен для создания лекарственных препаратов для лечения гельминтозов человека и животных [Михайлицын, Ф.С. Противогименолепидозная активность соединения МСТ-02 / Ф.С. Михайлицын, Д.П. Севбо, С.Н. Трусов, Г.А. Гицу, А.Ю. Малахова // Медицинская паразитология и паразитарные болезни. - 2010. - №1. - С. 47-48; Козлов, С.А. Эмбриотоксические свойства отечественного антигельминтика Надината / С.А. Козлов, М.Б. Мусаев // Медицинская паразитология и паразитарные болезни. - 2015. - №3. - С. 55-58].
Известен способ получения N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида из товарной 3,5-дихлорсалициловой кислоты II (схема 1).
В соответствии со схемой 1 при кипячении 3,5-дихлорсалициловой кислоты II с 4-метил-3-хлоранилином в среде толуола в присутствии треххлористого фосфора получается N-(4-метил-3-хлорфенил)-2-гидрокси-3,5-дихлорбензамид III. Его очищают кристаллизацией из смеси 1,4-диоксана и водного 2-пропанола. Выход на стадии составляет 85,5% [Трусов, С.Н. Получение соединения МСТ-01 и его противогименолепидозная активность / С.Н. Трусов, Д.П. Севбо, Г.А. Гицу, Ф.С. Михайлицын // Медицинская паразитология и паразитарные болезни. - 2011. - №3. - С. 43].
Далее полученный N-(4-метил-3-хлорфенил)-2-гидрокси-3,5-дихлорбензамид III ацетилируют 8-кратным избытком уксусного ангидрида в присутствии пиридина в среде ацетона при комнатной температуре. Реакционную массу выливают в воду, осадок отфильтровывают и сушат. Выход неочищенного N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I в пересчете на III составляет 83%, а в пересчете на II - 71,0% [Михайлицын, Ф.С. Противогименолепидозная активность соединения МСТ-02 / Ф.С. Михайлицын, Д.П. Севбо, С.Н. Трусов, Г.А. Гицу, А.Ю. Малахова // Медицинская паразитология и паразитарные болезни. - 2010. - №1, - С. 47-48].
К недостаткам схемы 1 следует отнести использование токсичных, канцерогенных и малодоступных химических реагентов (треххлористого фосфора, пиридина), наличие большого количества жидких отходов на стадии ацетилирования, отсутствие возможности регенерации большого избытка уксусного ангидрида, пиридина и растворителя ацетона.
В литературе не описаны альтернативные пути получения N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида.
Задачей изобретения явилось получение продукта с более высоким выходом, разработка безопасного, малоотходного, экономичного и эффективного способа его синтеза.
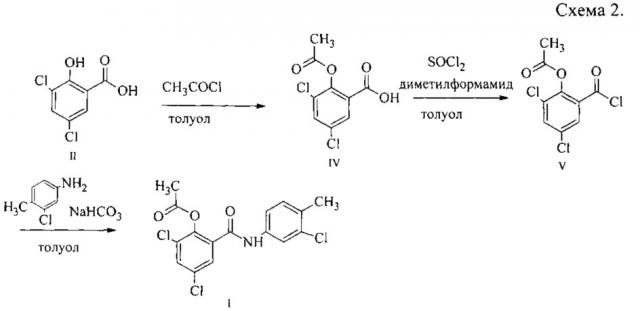
Задача решается созданием способа получения N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида, характеризующегося тем, что в среде толуола осуществляют ацетилирование 3,5-дихлорсалициловой кислоты с образованием 2-ацетокси-3,5-дихлорбензойной кислоты, затем получают ее хлорангидрид и проводят реакцию хлорангидрида с 4-метил-3-хлоранилином с дальнейшим выделением целевого продукта, причем ацетилирование 3,5-дихлорсалициловой кислоты осуществляют ацетилхлоридом в мольном отношении 1:2 при температуре с 65 до 90°С, хлорангидрид 2-ацетокси-3,5-дихлорбензойной кислоты получают воздействием хлористого тионила в мольном отношении 1:1,5 с добавкой каталитического количества диметилформамида при 76-80°С в течение 1,0 ч, реакцию хлорангидрида с 4-метил-3-хлоранилином проводят в присутствии водного раствора гидрокарбоната натрия в мольном отношении соответственно 1,05:1:1,2 при температуре 18-22°С, а целевой продукт выделяют фильтрованием в виде осадка (схема 2).
Описываемый способ получения N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I заключается в том, что сначала проводят ацетилирование 3,5-дихлорсалициловой кислоты II с образованием 2-ацетокси-3,5-дихлорбензойной кислоты IV, затем получают хлорангидрид 2-ацетокси-3,5-дихлорбензойной кислоты V и проводят реакцию хлорангидрида V с 4-метил-3-хлоранилином с образованием N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I.
Было предложено проводить ацетилирование 3,5-дихлорсалициловой кислоты II ацетилхлоридом. Эксперименты проводили в среде толуола при температуре кипения реакционной массы, которая по мере расходования ацетилхлорида повышалась с 65 до 100°С. Выделяющийся хлороводород предложено поглощать водой с образованием технической соляной кислоты. Ход реакции контролировали с помощью тонкослойной хроматографии и ИК-спектроскопии. 2-Ацетокси-3,5-дихлорбензойная кислота IV выделялась в виде осадка, который отфильтровывали и высушивали.
Величина избытка ацетилхлорида, оптимальная температура и время реакции определялись экспериментально. Оказалось, что для полного эффективного прохождения реакции достаточно добавления 2,0-кратного количества ацетилхлорида по отношению к исходной 3,5-дихлорсалициловой кислоте II и температуры, которая по ходу реакции меняется с 65 до 90°С примерно в течение 10 ч. С помощью тонкослойной хроматографии установлено, что при температуре выше 90°С начинается побочная реакция, возможно самоацилирование 3,5-дихлорсалициловой кислоты II с образованием димера.
Наиболее удобным методом получения хлорангидридов карбоновых кислот выбрана обработка кислоты избытком хлористого тионила в присутствии катализатора диметилформамида, поскольку данный метод приводит к образованию только газообразных отходов - диоксида серы и хлороводорода. Экспериментально, с использованием ИК-спектроскопии, установлено, что реакция 2-ацетокси-3,5-дихлорбензойной кислоты IV с 1,5-кратным количеством хлористого тионила в присутствии диметилформамида протекает при температуре 76-80°С за 1 ч. Предложено в качестве разбавителя использовать толуол для лучшего перемешивания реакционной массы.
Хлорангидрид 2-ацетокси-3,5-дихлорбензойной кислоты V предложено использовать для ацилирования 4-метил-3-хлоранилина в среде толуола в присутствии водного раствора гидрокарбоната натрия в качестве акцептора протонов. Мольное отношение хлорангидрида 2-ацетокси-3,5-дихлорбензойной кислоты V: 4-метил-3-хлоранилин: гидрокарбонат натрия 1,05:1,00:1,20. С помощью тонкослойной хроматографии показано, что после полного смешения реагентов достаточно выдержки реакционной массы в 1 ч при 20°С. Выделившийся осадок N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I отделяли фильтрованием, промывали 5% водным раствором гидрокарбоната натрия для очистки от неорганических веществ и непрореагировавшей 2-ацетокси-3,5-дихлорбензойной кислоты IV, затем промывали толуолом для очистки от непрореагировавшего амина и высушивали. Очистку проводили методом перекристаллизации из 2-пропанола. Установлено, что при повторном использовании толуольного маточника от выделения технического N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I выход последнего можно повысить с 83 до 93%. Качество продукта при этом не ухудшается, что доказано с помощью температуры плавления.
Описываемый способ получения N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I по сравнению с известным имеет следующие преимущества:
1. Исключается использование малодоступного высокотоксичного канцерогена треххлористого фосфора.
2. На стадии ацетилирования 3,5-дихлорсалициловой кислоты II отсутствует использование токсичного пиридина, а выделяющийся хлороводород может быть утилизирован водой с получением технической соляной кислоты, пригодной для использования.
3. Используемые в производстве сырье ацетилхлорид и растворитель толуол возможно регенерировать, что делает производство более экономичным.
4. Возможно повторное использование (до четырех раз) маточного толуольного раствора на стадии получения технического N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I по предложенной схеме без потери качества целевого продукта. При этом суммарный выход его без стадии очистки по предложенной схеме несколько выше (76,5%), чем по известной схеме (71,0%).
Пример 1
Получение 2-ацетокси-3,5-дихлорбензойной кислоты.
20,7 г 3,5-дихлорсалициловой кислоты (0,1 моль), 14,2 мл ацетилхлорида (0,2 моль) и 20 мл толуола перемешивают в трехгорлой колбе, температуру повышают за это время с 65 до 90°С, что занимает примерно 10 ч. После охлаждения отфильтровывают 2-ацетокси-3,5-дихлорбензойной кислоту, промывают толуолом и высушивают осадок. Выход 21,2 г (85% от теории). Методом тонкослойной хроматографии было установлено, что продукт однороден. В ИК-спектре наблюдаются характеристические полосы сложноэфирной группы νC=O 1762 см-1 и карбоксильной группы, не связанной водородной связью, νC=O 1691 см-1, и отсутствует полоса карбоксильной группы исходной кислоты. Температура плавления полученной 2-ацетокси-3,5-дихлорбензойной кислоты 152-153°С.
Получение хлорангидрида 2-ацетокси-3,5-дихлорбензойной кислоты.
21,2 г полученной 2-ацетокси-3,5-дихлорбензойной кислоты, 9,5 мл хлористого тионила, 0,1 мл диметилформамида и 10 мл толуола перемешивали в трехгорлой колбе при 76-80°С в течение 1,0 ч. Избыток хлористого тионила и толуол отогнали в вакууме и получили 24,0 г кубового остатка. В ИК-спектре наблюдали наличие полос хлорангидридной и сложноэфирной групп νC=O 1775 см-1 и отсутствие полосы карбоксильной группы 2-ацетокси-3,5-дихлорбензойной кислоты, что свидетельствует о полном прохождении реакции.
Получение N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I.
В трехгорлой колбе смешивают 8,57 г (0,102 моль) гидрокарбоната натрия, 80 мл воды, 12,0 г 4-метил-3-хлоранилина (0,085 моль) и 30 мл толуола. Прикапывают в колбу при перемешивании раствор 24,0 г полученного хлорангидрида 2-ацетокси-3,5-дихлорбензойной кислоты V в 80 мл толуола, высушенного над гидроксидом натрия. Температуру в колбе поддерживают в пределах 18-22°C с помощью бани с холодной водой. Через 1 ч после окончания прикапывания толуольного раствора хлорангидрида 2-ацетокси-3,5-дихлорбензойной кислоты V выпавший осадок N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I отфильтровывали, промывали его 5% водным раствором гидрокарбоната натрия, водой и толуолом и высушивали. Выход 24,8 г (83% от теории в пересчете на 4-метил-3-хлоранилин).
Для очистки 24,8 г полученного технического N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I растворяли в 375 мл 2-пропанола при температуре 80-82°С, осветляли горячий раствор 0,5 г активированного угля, фильтровали в горячем виде, охлаждали до 18-22°С, отфильтровывали осадок, промывали 70 мл 2-пропанола и высушивали. Получили 18,6 г очищенного N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I. Температура плавления 162-163°С. В ИК-спектре присутствуют полосы амидной группы νNHамид=3307 см-1 и νC=Oамид=1660 см-1, а также полоса сложноэфирной группы νC=O 1774 см-1. В спектре ПМР, δ, м. д.: 2,28 (с, 3Н, СН3-Аr), 2,32 (с, 3Н, СН3-СО), 7,22 (д, 1Н), 7,47 (д, 1Н), 7,76 (д, 1Н), 7,81 (с, 2Н), 10,46 (с, 1Н, NH). По данным ВЭЖХ содержание основного вещества 99%.
Пример 2
Получение N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I с повторным использованием толуольного маточника.
Отличается от примера 1 тем, что в трехгорлую колбу загружали не 30 мл толуола, а 140 мл толуольного слоя, полученного после фильтрации технического N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида I (пример 1). Получили 27,8 г продукта (93% от теории), который очищали, как описано в примере 1. Температура плавления 162-163°С. ИК и ПМР спектры аналогичны спектрам из примера 1. По данным ВЭЖХ содержание основного вещества не менее 99%.
Предлагаемый способ предлагается использовать в синтезе лекарственной субстанции для получения лекарственных препаратов.
Способ получения N-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида, характеризующийся тем, что в среде толуола осуществляют ацетилирование 3,5-дихлорсалициловой кислоты с образованием 2-ацетокси-3,5-дихлорбензойной кислоты, затем получают ее хлорангидрид и проводят реакцию хлорангидрида с 4-метил-3-хлоранилином с дальнейшим выделением целевого продукта, причем ацетилирование 3,5-дихлорсалициловой кислоты осуществляют ацетилхлоридом в мольном отношении 1:2 при температуре с 65 до 90°С, хлорангидрид 2-ацетокси-3,5-дихлорбензойной кислоты получают воздействием хлористого тионила в мольном отношении 1:1,5 с добавкой каталитического количества диметилформамида при 76-80°С в течение 1 ч, реакцию хлорангидрида с 4-метил-3-хлоранилином проводят в присутствии водного раствора гидрокарбоната натрия в мольном отношении соответственно 1,05:1:1,2 при температуре 18-22°С, а целевой продукт выделяют фильтрованием в виде осадка.