Способ получения производных 1-ацил-4-фенилсульфонилпролинамида и новые промежуточные соединения
Иллюстрации
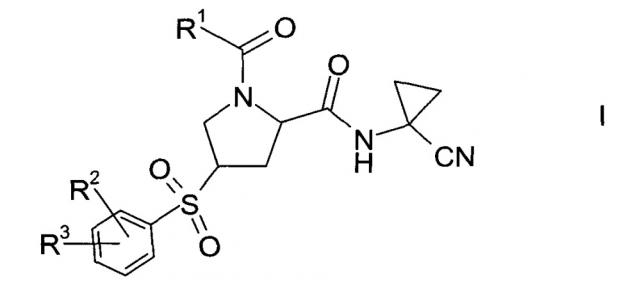
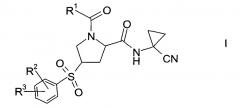
Показать всеИзобретение относится к способу получения производных пролина формулы 1, где R1 выбран из C1-7-алкила или радикала формулы II, где R4 выбран из группы, содержащей С1-7-алкил, галоген-С1-7-алкил и фенил, возможно замещенный галогеном; R2 выбран из группы, содержащей галоген или галоген-С1-7-алкил; и R3 выбран из группы, содержащей водород, галоген, галоген-С1-7-алкил, С1-7-алкокси, галоген-С1-7-алкокси или 5- или 6-членный гетероцикл, содержащий один или два атома азота, причем цикл возможно замещен C1-7-алкилом или галогеном, и новым промежуточным соединением, используемым в способе. Производные пролина формулы 1 являются предпочтительными ингибиторами цистеиновой протеазы катепсина S и таким образом полезны при лечении метаболических заболеваний, таких как диабет, атеросклероз, аневризма брюшной аорты, заболевания периферических артерий и диабетическая невропатия. 3 н. и 26 з.п. ф-лы, 1 пр.
Реферат
Изобретение относится к способу получения производных пролина формулы:
где,
R1 выбран из числа C1-7-алкилов или
где R4 выбран из группы, содержащей C1-7-алкил, галоген-С1-7-алкил, или фенил, возможно, замещенный галогеном.
R2 выбран из группы, содержащей галоген или галоген-С1-7-алкил, и
R3 выбран из группы, содержащей водород, галоген, галоген-С1-7-алкил, С1-7-алкокси, галоген-С1-7-алкокси, или 5- или 6-членный гетероцикл, содержащий один или два атома азота, причем цикл может быть замещен C1-7-алкилом или галогеном.
Пролиновые производные формулы 1 представляют собой предпочтительные ингибиторы цистеиновой протеазы катепсина S и, таким образом, полезны для лечения метаболических заболеваний, таких как диабет, атеросклероз, аневризма брюшной аорты, заболеваний периферических артерий и диабетическая невропатия (РСТ Publ. WO 2010/121918).
Целью настоящего изобретения является разработка масштабируемого способа изготовления соединений формулы I.
Цель может быть достигнута при использовании способа по настоящему изобретению, который включает следующие этапы:
а) трансформация спирта формулы II
где значение R1 описано выше, в сульфонат формулы III
где значение R1 описано выше, а R5 представляет собой C1-7-алкил, галоген-С1-7-алкил или фенил, возможно, замещенный C1-7-алкилом, нитрогруппой или бромом;
b) взаимодействие сульфоната формулы III с тио-соединением формулы IV
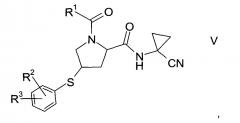
где значение R2 и R3 описаны выше, а R6 представляет собой водород или защитную группу, с получением тиоэфира формулы V.
где значения R1, R2 и R3 описаны выше, и
с) окисление тиоэфира формулы V с образованием производного пролина формулы I, где значения R1, R2 и R3 описаны выше.
Для иллюстрации и определения назначения и объема различных терминов, применяемых при описании настоящего изобретения, вводятся следующие определения.
Термин "C1-7-алкил", один или совместно с другими группами, означает разветвленный или линейный одновалентный насыщенный алифатический углеводородный радикал, содержащий от одного до семи атомов углерода, в особенности, от одного до четырех атомов углерода. Этот термин раскрывается примерами радикалов, такими как метил, этил, н-пропил, изопропил, м-бутил, втор-бутил, трет-бутил, пентил, гексил или гептил и их изомеры.
Термин "С1-9-алкил", один или совместно с другими группами, означает разветвленный или линейный одновалентный насыщенный алифатический углеводородный радикал, содержащий от одного до девяти атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, пентил, циклопентил, гексил, циклогексил, гептил, октил, нонил и их изомеры.
Термин "галоген-С1-7-алкил" означает замещенный галогеном C1-7-алкильный радикал, где значение термина "галоген" раскрыто далее. Конкретные "галоген-С1-7-алкильные" радикалы представляют собой фторированные C1-7-алкильные радикалы, такие как CF3, CH2CF3, СН(CF3)2, СН(СН3)(CF3), C4F9, в особенности CF3.
Термин "С1-7-алкокси" означает разветвленный или линейный одновалентный насыщенный алифатический углеводородный радикал, содержащий от одного до семи атомов углерода, предпочтительно, от 1 до 4 атомов углерода, связанных с атомом кислорода. Примеры "алкокси" включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, пентокси, гексилокси или гептокси. Особые используемые здесь алкокси-группы рассматриваются здесь на примерах.
Термин "моно- или ди-(С1-7-алкил)-амино", один или совместно с другими группами, означает один или два разветвленных или прямых одновалентных насыщенных алифатических углеводородных радикалов, содержащих от одного до семи атомов углерода, в особенности, от одного до четырех атомов углерода, связанных с атомом азота. Дополнительно, в случае "ди-(С1-7-алкил)-амино", два C1-7-алкильных радикала могут быть соединены вместе с образованием насыщенного гетероцикла, содержащего атом азота. Примерами "моно- или ди-(С1-7-алкил)-амино" являются метиламино, диметиламино, этиламино, диэтиламино, пирролидинил, этилметиламино, этилпропиламино или пиперидинил.
Термин "галоген-С1-7-алкокси" означает замещенный галогеном радикал C1-7-алкокси, где значение термина "галоген" раскрыто далее. Конкретные "галоген-С1-7-алкокси" радикалы включают фторированные C1-7-алкоксильные радикалы, такие как OCF3, OCH2CF3, OCH(CF3)2, ОСН(СН3)(CF3), OCF4F9, в особенности, OCH2CF3 или ОСН(СН3)(CF3).
Термин "5- или 6-членный гетероцикл, содержащий один или два атома азота" относится к возможно замещенному 5- или 6-членному гетероарильному радикалу, содержащему один или два атома азота и выбранному из группы, содержащей пиридил, пиридазинил, пиримидинил, пиразинил, пирролил, пиразолил или имидазолил, в особенности, пиридинил или пиразолил. Подходящим заместителем является C1-7-алкильная группа, где особенно широко используется метильная группа, или атом галогена, причем особенно широко используется хлор.
Термин "арил" означает радикал фенила, возможно, связанный с одним - тремя заместителями, выбранными из числа C1-7-алкила, C1-7-алкокси и моно- или ди-(С1-7-алкил)-амино.
Термин "галоген" означает атом фтора, хлора, брома или иода.
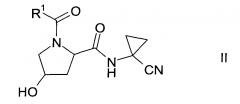
Получение спирта формулы II:
Спирт формулы II
где значение R1 описано выше, можно получить либо
а1) путем реакции гидроксипролинового эфира формулы VI
где R7 представляет собой C1-7-алкил,
с карбонильным соединением формулы VII
где значение R1 описано выше, a Y представляет собой галоген или ОН, с получением карбонилпролинового эфира формулы IX
где R1 и R7 описаны выше;
b1) с последующим образованием сульфоната формулы Х
где R1 и R7 описаны выше, a R8 представляет собой C1-7-алкил, возможно, замещенный галогеном или фенил, который возможно замещен C1-7-алкилом, нитро или бром, и
с1) превращением сульфоната формулы Х в присутствии аминоциклопропан карбонитрила формулы XI
в спирт формулы II
или
а2) путем трансформирования соли сульфоната формулы XII
где R9 представляет собой C1-7-алкил или фенил, возможно, замещенный C1-7-алкилом, в амид формулы XIII
где R1 описан выше, с последующим
b2) превращением амида формулы XIII в присутствии аминоциклопропанкарбонитрила формулы XI
в спирт формулы II.
В соответствии с конкретным воплощением, спирт формулы II, полученный при выполнении описанной выше последовательности этапов а1)-с1) или а2)-b2), представляет собой хиральный изомер формулы
где значение группы R1 описано выше.
Этап а1):
На этапе а1) осуществляется взаимодействие гидроксипролинового эфира формулы VI с карбонильным соединением формулы VII с образованием карбонилпролинового эфира формулы IX.
Эта реакция может проходить в соответствии с принципами, известными опытному специалисту по получению амидов.
Карбонильное соединение формулы VII может представлять собой карбонилхлорид или карбоновую кислоту.
При осуществлении реакции присоединения карбоновой кислоты, как правило, используются распространенные агенты присоединения, используемые для образования амидной связи, например, кратко описанные в журнале Chemical Reviews, том 111 (2011), страницы 6557-6602; например, такими агентами могут быть DCC или DIC.
В соответствии с конкретным воплощением, используемые карбонилхлориды, как правило, готовят in situ из соответствующей карбоновой кислоты с применением распространенного галогенирующего агента, такого как оксалилхлорид или тионилхлорид.
В соответствии с конкретным воплощением настоящего изобретения, гидроксипролиновый эфир формулы VI представляет собой коммерчески доступный гидроксипролиновый метиловый эфир гидрохлорид.
Реакцию, как правило, проводят в инертном органическом растворителе, таком как дихлорметан, тетрагидрофуран или толуол при температурах от -10°C до 25°C.
Удобно, если присутствует подходящий третичный амин, такой как триэтиламин или диизопропилэтиламин.
Карбониловый пролиновый эфир формулы IX может либо быть выделен способами, известными специалисту, либо, предпочтительно, сохранен в растворе и перенесен на следующий этап реакции b1).
Этап b1):
На этапе b1) получают сульфонат формулы X.
Как правило, при этом можно использовать распространенный сульфонирующий агент, такой как метансульфонил хлорид, бензол сульфонил хлорид или п-толуол сульфонил хлорид.
Соответственно, группа R8 конкретно представляет собой метил, фенил или п-толил, более конкретно, метил.
Реакцию преимущественно проводят в той же среде, что была не предыдущем этапе, при температурах от -10°C до 40°C.
Сульфонат формулы Х можно выделить известными специалисту способами, такими как экстракция из реакционной смеси с использованием подходящих растворителей, таких как дихлорметан, и последующей кристаллизацией, например, в изобутил ацетате.
Этап с1):
На этапе с1) осуществляют преобразование сульфоната формулы Х в присутствии аминоциклопропан карбонитрила формулы XI в спирт формулы II.
Реакция включает первоначальный гидролиз сложноэфирной группы, который удобно проводить с неорганическим водным основанием, таким как водный раствор гидроксида щелочного металла, например, гидроксида натрия, гидроксида калия или гидроксида лития, при температуре от 0°C до 30°C, с последующим промежуточным образованием лактона.
Аминоциклопропана карбонитрил формулы XI может реагировать в виде свободного основания, также как и в виде подходящей соли, в особенности, гидрохлорида. Гидрохлорид является наиболее подходящей солью.
Аминолиз лактона с помощью соли аминоциклопропана карбонитрила, такой как гидрохлорид, ускоряется при добавлении, по меньшей мере, стехиометрических количеств соли щелочного металла и алкил- или арилкарбоксилата MR10COO, где М=Li, Na, К или Cs, в частности Na, a R10=C1-9-алкил или арил. В особенности, для ускорения реакции можно использовать 2-этилгексаноат.
Альтернативно, аминолиз лактона с использованием соли аминоциклопропан карбонитрила, такой как гидрохлорид, ускоряется при добавлении суб-стехиометрических количеств алкил- или арилкарбоксилата щелочного металла MR10COO, где М и R10 описаны выше, особенно, натрия 2-этилгексаноата, совместно со стехиометрическим количеством подходящего основания, такого как триэтиламин.
Если используется свободное основание аминоциклопропан карбонитрил, аминолиз лактона ускоряется при добавлении стехиометрических или суб-стехиометрических количеств алкил- или арилкарбоксилата щелочного металла MR10COO, где М и R10 описаны выше, особенно 2-этилгексаноата натрия, или при добавлении стехиометрических или суб-стехиометрических количеств алкил- или арилкарбоновой кислоты R10COOH, где группа R10 определена выше, особенно 2-этилгексановой кислоты.
В систему можно добавить органический растворитель, такой как тетрагидрофуран, реакцию выполняют при температуре от 40 до 130°C, в особенности, от 50 до 70°C.
Выделение продукта из реакционной смеси можно проводить в соответствии со способами, известными специалисту в уровне техники, например, путем экстракции с подходящим растворителем, таким как этилацетат, и последующей кристаллизацией полученного продукта также из подходящего органического растворителя или смеси растворителей, например, этилацетат/гептан.
Альтернативно, спирт формулы II можно синтезировать следующим образом:
Этап а2)
На этапе а2) происходит превращение сульфонатной соли формулы XII в амид формулы XIII.
Подходящими сульфонатными солями формулы XII являются либо метан сульфонат (R9= метил), либо п-толуол сульфонат (R9= п-толил).
Эти сульфонаты можно синтезировать известными в литературе способами, например, приведенными в журнале Journal of Organic Chemistry, том 71, страницы 7133-7145.
Амид получают в соответствии с принципами, известными специалисту в уровне техники, и в соответствии с описанием этапа а1).
Выделение продукта из реакционной смеси можно проводить в соответствии со способами, известными специалисту в уровне техники, например, путем экстракции с подходящим растворителем, таким как дихлорметан, и последующей кристаллизацией полученного продукта также из подходящего органического растворителя или смеси растворителей, например, этилацетат/гептан.
Этап b2)
На этапе b2) происходит превращение амида формулы XIII в спирт формулы II в присутствии аминоциклопропан карбонитрила формулы XI.
Аминоциклопропан карбонитрил формулы XI может вступать в реакцию в виде свободного основания или подходящей соли, особенно, гидрохлорида. Наиболее подходящей солевой формой является гидрохлорид.
Аминолиз лактона с использованием соли аминоциклопропан карбонитрила, такой как гидрохлорид, ускоряется при добавлении по меньшей мере стехиометрических количеств алкил- или арилкарбоксилата щелочного металла MR10COO, где М=Li, Na, К или Cs, в особенности, Na, a R10 представляет собой C1-9-алкил или арил. В частности, для ускорения реакции можно использовать 2-этилгексаноат натрия.
Альтернативно, аминолиз лактона с использованием соли аминоциклопропан карбонитрила, такой как гидрохлорид, ускоряется при добавлении суб-стехиометрических количеств алкил- или арилкарбоксилата щелочного металла MR10COO, где М и R10 описаны выше, особенно, 2-этилгексаноата натрия, совместно со стехиометрическим количеством подходящего основания, такого как триэтиламин.
Если используется свободное основание аминоциклопропан карбонитрил, аминолиз лактона ускоряется при добавлении стехиометрических или суб-стехиометрических количеств алкил- или арилкарбоксилата щелочного металла MR10COO, где М и R10 описаны выше, особенно, 2-этилгексаноата натрия, или при добавлении стехиометрических или суб-стехиометрических количеств алкил- или арилкарбоновой кислоты R10COOH, где группа R10 определена выше, особенно 2-этилгексановой кислоты.
Обычно, реакцию проводят в полярных растворителях, таких как тетрагидрофуран, дихлорметан, вода или их смеси, или без растворителя (мягких условиях), при температуре от 40 до 130°C, в особенности от 50 до 70°C.
Выделение продукта из реакционной смеси можно проводить в соответствии со способами, известными специалисту в уровне техники, например, путем экстракции с подходящим растворителем, таким как этилацетат, и последующей кристаллизацией полученного продукта также из подходящего органического растворителя или смеси растворителей, например, этилацетат/гептан.
Спирт формулы II
где R1 описан выше, неизвестен в уровне техники и, таким образом, является особым воплощением настоящего изобретения.
В соответствии с еще одним особым воплощением, группа R1 представляет собой
где R4 выбран из группы, содержащей C1-7-алкил, галоген-С1-7-алкил или фенил, возможно, замещенный галогеном.
Более конкретно, R4 представляет собой метил или трифторметил.
В соответствии с еще одним особым воплощением, спирт формулы II представляет собой хиральный изомер формулы
где значение группы R1 описано выше.
Получение тио-соединения формулы IV:
Тио-соединение формулы IV, где R6=Н
Тио-соединение формулы IV
где R2 и R3 определены выше, a R6 представляет собой водород, можно изготовить следующим образом:
а3) снятие защиты с соединения формулы XX
где R2 и R3 определены выше, а R9 представляет собой третичную алкильную группу формулы
где R11, R12 и R13 независимо друг от друга представляют собой C1-7-алкил с помощью кислоты;
или
b3) снятие защиты с соединения формулы XX
где R2 и R3 определены выше, а R9 представляет собой тритил, с помощью кислоты в присутствии восстановителя;
c3) литиирование галогенированного соединения формулы XXI
где R2 и R3 определены выше, а Х представляет собой атом галогена, с последующей обработкой продукта серой;
или
d3) взаимодействие галогенированного соединения формулы XXI
где R2 и R3 определены выше, а Х представляет собой атом галогена с реактивом Гриньяра с последующей обработкой продукта серой;
Этап a3)
Вариант способа a3) предполагает снятие защиты с соединения формулы XX, где R9 представляет собой третичную алкильную группу, действием кислоты.
В особенности, группа R9 соответствует формуле:
где R10, R11 и R12 независимо друг от друга представляют собой C1-7-алкил и, более конкретно, C1-4-алкил. Еще более конкретно, R9 представляет собой трет-бутил.
Соединения формулы XX либо доступны коммерчески, либо можно получить способами, знакомыми специалисту в уровне техники.
Соединения формулы XX, где R9= трет-бутил, можно приготовить реакцией соответствующего фторированного предшественника с 2-метил-2-пропан-тиолом в присутствии алкоксида щелочи.
Подходящие кислоты можно выбрать из числа водных минеральных кислот, таких как соляная кислота, или из числа органических кислот, таких как трифторуксусная кислота.
При использовании органической кислоты может присутствовать органический растворитель, такой как дихлорметан.
Условия реакции и способы выделения тио-соединений формулы IV зависят от используемой кислоты, но их адаптация может соответствовать методикам, известным специалисту в уровне техники.
Этап b3)
Вариант способа b3) предполагает снятие защиты с соединения формулы XX, где R9 представляет собой тритил, действием трифторуксусной кислоты в присутствии восстановителя.
Подходящим восстановителем является триэтилсилан.
Может использоваться органический растворитель, такой какдихлорметан.
Условия реакции и выделения тио-соединения формулы IV могут соответствовать методикам, известным специалисту в уровне техники.
Этап c3)
Вариант способа c3) включает литиирование галогенированного соединения формулы XXI с последующей обработкой серой.
Подходящие агенты для литиирования могут быть выбраны из числа коммерчески доступных агентов, таких как бутил литий.
Литиирование, как правило, проводят в присутствии органического растворителя, такого как толуол, при температуре от -80 до -20°C.
Удобно использовать также хелатор, такой как диэтиловый эфир или ди-н-пропиловый эфир.
Последующая обработка серой может проводиться при температуре от -80 до -40°C, как правило, в той же реакционной среде, что используется и для литиирования.
Способы выделения тио-соединения формулы IV могут соответствовать методикам, известным в уровне техники.
Этап d3)
Вариант способа d3) предполагает реакцию галогенированного соединения формулы XXI с реактивом Гриньяра с последующей обработкой серой.
Х представляет собой, в особенности, бром.
Подходящие реактивы Гриньяра можно выбрать из числа коммерчески доступных агентов, таких как изопропил магний хлорид или изопропил магний хлорид/литий хлорид в тетрагидрофуране.
Как правило, реакция Гриньяра проходит в присутствии органического растворителя, в котором реактив Гриньяра продается, например, в тетрагидрофуране.
Удобно удерживать температуру реакции в диапазоне от 0 до 40°C, особенно около комнатной температуры.
Последующая обработка серой может проводиться при температуре от -20 до 20°C, как правило, в той же реакционной среде, что используется и реакции Гриньяра.
Выделение тио-соединения формулы IV может соответствовать методикам, известным в уровне техники.
Тио-соединение формулы IV с R6= защитная группа
Подходящая защитная группа может быть выбрана из числа следующих: 2-карбамоилэтил, C1-7-алкоксикарбонилэтил-, а также моно или ди-C1-7-алкиламинокарбонилэтил.
Показано, что особенно удобно, если R6= 2-карбамоилэтил.
Эти соединения можно приготовить по следующей далее схеме. Х представляет собой атом галогена, в частности, брома, группы R2 и R3 соответствуют приведенному выше определению.
Схема 1:
2-Карбамоилэтильную защитную группу можно ввести путем реакции соответствующего тиофенола с акриламидом в присутствии каталитических (или стехиометрических) количеств подходящего основания, например, тетрабората натрия, в подходящем полярном растворителе, таком как метанол, вода или их смесь. В случае других замещенных пропионамидных или сложноэфирных защитных групп реагирующий акриламид заменяют соответствующим образом. С полученным замещенным тиофенолом можно затем работать способами, известными специалисту в уровне техники. Например, чтобы заменить атом брома 5- или 6-членным гетероциклом R3, определенным выше, необходимо провести реакцию с подходящим реагентом R3-Z, где Z=В(ОН)2, В(ОМе)2, B(OEt)2, В(OiPr)2,_4,4,5,5-тетраметил-[1,3,2]-диоксаборил)-, Sn(н-Bu)3, MgX, ZnX или Si(OEt)3, в особенности, В(ОН)2 или 4,4,5,5-тетраметил-[1,3,2]-диоксаборил)-. В конкретных случаях, реакцию проводят в присутствии каталитического количества подходящего комплекса переходного металла, например, [1,1'-бис(дифенилфосфино)ферроцен]-ди-хлор-палладий(II) или тетракис(трифенилфосфин)палладий(0), стехиометрического количества подходящего основания, например, карбоната калия, карбоната натрия или фосфата натрия, в подходящем растворителе, таком как, например, диметилформамид, диметилацетамид, толуол, тетрагидрофуран, трет-бутанол, N-метилпирролидон или диоксан, возможно и предпочтительно, в смеси с водой, при повышенной температуре от 40 до 140°C, предпочтительно от 50 до 70°C.
Кроме того, описанные выше реагенты R3-Z, в особенности, Z=4,4,5,5-тетраметил-[1,3,2]-диоксаборил)-, можно получить in situ, начиная от соответствующих R3-X, где Х представляет собой атом галогена, в особенности, брома или иода, путем их реакции с 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксабороланом) в присутствии соответствующего основания, например, ацетата натрия или калия, и каталитического количества подходящего комплекса палладия, такого как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), в подходящем растворителе, например, диметилформамиде, при температуре от 60 до 120°C, в особенности, от 70 до 90°C, с последующей проводимой в той же емкости реакцией с защищенным галотиофенолом, в особенности, используя похожий, более конкретно, тот же растворитель и комплекс палладия.
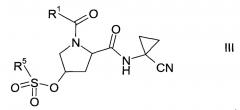
Этап а)
На этапе а) осуществляется превращение спирта формулы II в сульфонат формулы III.
В соответствии с конкретным воплощением, используется хиральный изомер спирта формулы II, структура которого соответствует формуле
где значение R1 определено выше.
Сульфонирование проводят способами, известными специалисту в уровне техники, применяя распространенные коммерчески доступные агенты сульфонирования. Конкретными агентами сульфонирования являются бензосульфонил хлорид или метансульфонил хлорид.
Как правило, в системе присутствует третичный амин, такой как триэтиламин. Реакцию можно ускорить добавлением подходящего основания Льюиса, например 4-(диметиламино)пиридина.
Как правило, реакцию проводят в органическом растворителе, таком как тетрагидрофуран, при температурах от -10 до 40°C.
Выделение сульфоната формулы III можно проводить способами, известными специалисту в уровне техники.
Сульфонат формулы III
где значение группы R1 описано выше, a R5 представляет собой C1-7-алкил, галоген-С1-7-алкил или фенил, возможно, замещенный C1-7-алкилом, нитрогруппой или бромом, не известен в уровне техники и, таким образом, является особым воплощением настоящего изобретения.
В соответствии с еще одним особым воплощением, R1 представляет собой
где R4 выбрана из группы, содержащей C1-7-алкил, галоген-С1-7-алкил или фенил, возможно, замещенный галогеном, а R5 представляет собой C1-7-алкил или фенил, возможно, замещенный C1-7-алкилом.
Более конкретно, R4 представляет собой метил или трифторметил, а R5 представляет собой метил или фенил.
В соответствии с другим особым воплощением, сульфонат формулы III представляет собой хиральный изомер формулы:
где R1 и R5 описаны выше.
Этап b)
На этапе b) сульфонат формулы III реагирует с тио-соединением формулы IV с образованием тиоэфира формулы V.
Реакцию удобно проводить в присутствии основания, такого как алкоголят или карбонат щелочного металла.
Более конкретно, используется трет-бутилат лития, натрия или калия.
Удобно использовать органический растворитель, такой как тетрагидрофуран, диметилацетамид или их смеси.
Температура реакции может быть выбрана в диапазоне от 10 до 90°C.
Тиоэфир формулы V можно выделить из реакционной смеси в соответствии со способами, известными специалисту в уровне техники, например, путем экстракции с подходящим растворителем, таким как этилацетат или трет-бутилметиловый эфир. Дальнейшую очистку можно проводить кристаллизацией полученного продукта из подходящего органического растворителя, например, толуола, н-гептана, 2-бутанола или их смеси.
Тиоэфир формулы V
где R1, R2 и R3 описаны выше, неизвестен в уровне техники и, таким образом, представляет собой особое воплощение настоящего изобретения.
В соответствии с еще одним особым воплощением, R1 представляет собой
где R4 выбран из группы, содержащей C1-7-алкил, галоген-С1-7-алкил или фенил, возможно, замещенный галогеном.
R2 представляет собой галоген или галоген-С1-7-алкил, и
R3 представляет собой галоген-С1-7-алкокси или 5- или 6-членный гетероцикл, содержащий один или два атома азота, причем цикл может быть замещен C1-7-алкилом или галогеном.
Более конкретно,
R4 представляет собой метил или трифторметил
R2 представляет собой трифторметил или хлор, и
R3 представляет собой 2,2,2-трифторэтокси, 2-метилпирид-4-ил, 1-метил-1Н-пиразол-4-ил или 2,2,2-трифтор-1-метилэтокси.
В соответствии с еще одним особым воплощением, тиоэфир формулы V представляет собой хиральный изомер формулы
еще более конкретно,
где значения R1, R2 и R3 определены выше.
Этап с)
На этапе с) тиоэфир формулы V окисляется с образованием пролинового производного формулы I.
Окисление может проводиться с использованием коммерчески доступных окислителей, таких как пероксомоносульфат калия, доступный, например, в виде тройной соли "оксон" (Oxone®), или гексагидрат монопероксофталаата магния.
Удобно использовать полярный органический растворитель, такой как ацетонитрил. Дополнительно можно также добавлять воду или водные растворы неорганических кислот, таких как серная или фосфорная кислота.
Температура реакции может быть выбрана в диапазоне от 0 до 60°C.
Пролиновое производное формулы 1 можно выделить из реакционной смеси в соответствии со способами, известными специалисту в уровне техники, например, путем экстракции с подходящим растворителем, таким как этилацетат. Дальнейшую очистку можно проводить кристаллизацией полученного продукта из подходящего растворителя, например, ацетона, изопропанола, воды или их смеси.
В соответствии с конкретным воплощением настоящего изобретения, пролиновые производные формулы 1 представляют собой хиральные изомеры формулы
еще более конкретно, формулы
где значения R1, R2 и R3 определены выше.
В соответствии с еще одним конкретным воплощением,
R1 представляет собой
где R4 выбран из группы, содержащей C1-7-алкил, галоген-С1-7-алкил или фенил, возможно, замещенный галогеном,
R2 представляет собой галоген или галоген-С1-7-алкил и
R3 представляет собой галоген-С1-7-алкокси или 5- или 6-членный гетероцикл, содержащий один или два атома азота, причем цикл может быть замещен C1-7-алкилом или галогеном
Более конкретно,
R4 представляет собой метил или трифторметил,
R2 представляет собой трифторметил или хлор, и
R3 представляет собой 2,2,2-трифторэтокси, 2-метилпирид-4-ил, 1-метил-1H-пиразол-4-ил или 2,2,2-трифтор-1-метилэтокси.
Примеры:
Общая часть:
Все растворители и реагенты были приобретены у коммерческих поставщиков и использованы в том виде, в каком приобретены. Как правило, реакции сопровождались анализом по методу ТСХ (ТСХ плашки F254, "Мерк"), ЖХ (жидкостная хроматография) или ГХ (газовая хроматография). Протонные спектры ЯМР записывали на приборе "Брукер" (Bruker) 300, 400 или 600 МГц, химические сдвиги (δ, м.д.) записывались относительно триметилсилана в качестве внутреннего стандарта в следующем формате: химический сдвиг в м.д. (форма пика, константа сопряжения, если применимо, интеграл). Используются следующие сокращения ЯМР: s, синглет; d, дублет; t, триплет; q, квадруплет; quint, квинтет; sext, секстет; hept, гептет; m, мультиплет; br, уширение. Чистоту анализировали методом ВЭЖХ в обращенной фазе. Элементный анализ проводили на приборе Agilent 1100 & 1200 (производство "Аджилент"). Элементный анализ проводили в компании "Солвиас АГ" (Solvias AG, Маттенштрассе, почтовый ящик, СН-4002 Базель, Швейцария). Колоночную хроматографию проводили на силикагеле 60 (32-60 меш, 60 Å) или на заполненных колонках (Isolute Flash Si). Масс-спектры записывали на спектрометре Agilent 6520 QTOF при следующих одновременно задаваемых условиях (множественный режим, multimode): ESI (электронно-ионная ионизация) и APCI (химическая ионизация при атмосферном давлении), а также на приборе Agilent 5975 в режиме EI (электронная ионизация) с детекцией либо положительно (pos.), либо отрицательно (neg.) заряженных ионов. Если не указано иное, регистрировались положительно заряженные ионы.
Получение спирта:
А1. Получение (1-циано-циклопропил)-амида (2S,4S)-4-гидрокси-1-(1-трифторметил-циклопропанкарбонил)-пирролидин-2-карбоновой кислоты
а.) (1S,4S)-3-Оксо-2-окса-5-азония-бицикло[2.2.1]гептан метансульфонат
Трет-бутиловый эфир (1S,4S)-3-оксо-2-окса-5-аза-бицикло[2.2.1]гептан-5-карбоновой кислоты (100,0 г, 469 ммоль) растворили в этилацетате (970 мл) и при температуре 45°C добавили метансульфоновую кислоту (43,5 мл, 659 ммоль). Смесь 16 часов перемешивали при 45°C. Суспензию охладили до комнатной температуры, профильтровали, осадок промыли этилацетатом (240 мл) и высушили в вакууме в получением заявленного соединения в виде белого кристаллического вещества (94,2 г, 96%). MS (El, neg): m/z=113 [катион - Hf, 69 [катион - Н - CO2]+, 68 [катион - Н - НСО2]+. 1H ЯМР (ДМСО-d6, 600 МГц): δ 2,12 (dd, J=1,2 Гц, 12,0 Гц, 1Н), 2,33 (s, 3H), 2,59 (d, J=12,0 Гц, 1Н), 3,33 и 3,50 (АВХ, JAB=12,0 Гц, JAX=1,9 Гц, JBX=0 Гц, каждый 1Н), 4,58 (s, 1Н), 5,41 (s, 1Н), 9.74 (br s, 2H).
b) (15,45)-5-(1-Трифторметил-циклопропанкарбонил)-2-окса-5-аза-бицикло[2.2.1]гептан-3-он
1-Трифторметил-циклопропанкарбоновую кислоту (167.0 г, 1084 ммоль) суспендировали в толуоле (500 мл), после чего добавили диметилформамид (3.6 мл, 47 ммоль). Смесь охладили на водяной бане до 2°C, после чего по каплям в течение 25 минут добавили раствор оксалил хлорида (90 мл, 1037 ммоль) в толуоле (167 мл). После этого смесь перемешивали еще 30 минут и затем 4 часа при комнатной температуре. Затем ее снова охладили до 0°C (сухой лед/метанольная баня) и медленно добавили метансульфонат (1S,4S)-3-оксо-2-окса-5-азония-бицикло[2.2.1]гептана (200 г, 956 ммоль), тетрагидрофуран (330 мл) и триэтиламин (500 мл, 3,59 моль), удерживая температуру ниже 5°C. Следует отметить, что, особенно после добавления 50% триэтиламина, реакция становится сильно экзотермической, и важно обеспечивать достаточное охлаждение системы. После этого смесь 20 часов перемешивали при комнатной температуре, вылили в водный раствор лимонной кислоты (10% в воде, 1,6 л), и фазы разделили. Водную фазу проэкстрагировали этилацетатом (3×500 мл). Объединенные органические экстракты трижды промыли концентрированным соляным раствором (500 мл), высушили над сульфатом натрия и сконцентрировали в вакууме. Неочищенный продукт (245 г, коричневое масло) растворили в дихлорметане (330 мл), после чего добавили этилацетат (130 мл) и гептан (660 мл), а дихлорметан осторожно удалили перегонкой в вакууме. Продукт начал кристаллизоваться. Суспензию охладили до 2°C (ледяная баня) и перемешивали один час, затем отфильтровали. Осадок промыли смесью этилацетат/гептан 1:9 (об./об., 300 мл) и высушили в вакууме, получив указанное в заголовке соединение в виде светло-коричневого порошка (219 г, 92%). 1H ЯМР (CDCl3, 400 МГц): (51,17-1,25 (m, 1H), 1,30 (dd, J=5,3 Гц, 8,3 Гц, 1H), 1,37-1,46 (m, 2H), 2,13 и 2,37 (АВ, JAB=10,7 Гц, все 1Н), 3,63 и 3,73 (AB, JAB=12,1 Гц, все 1Н), 4,99 (s,1H), 5,21 (s, 1H).
с) (13,45)-5-(1-Метил-циклопропанкарбонил)-2-окса-5-аза-бицикло[2.2.1]гептан-3-он
1-Метил-циклопропанкарбоновую кислоту (56,4 г, 552 ммоль) растворили в дихлорметане (365 мл), и добавили диметилформамид (405 мкл, 5,2 ммоль). Смесь охладили до 2°C, после чего по каплям добавили оксалил хлорид (70,8 г, 547 ммоль). Системе позволили нагреться и 90 минут перемешивали при комнатной температуре. После этого ее добавили к суспензии метансульфоната (15,45)-3-оксо-2-окса-5-азония-бицикло[2.2.1]гептана (110 г, 526 ммоль) в дихлорметане (400 мл). Полученную суспензию охладили до 2°C, и к ней медленно добавили триэтиламин (256 мл, 1,84 моль) (экзотермический процесс). После 70-минутного перемешивания при комнатной температуре в систему добавили раствор лимонной кислоты (81,0 г, 421 ммоль) в воде (550 мл) при 2°C. После разделения системы на фазы водную фазу проэкстрагировали дихлорметаном (300 мл). Объединенные органические экстракты промыли водой (400 мл) и сконцентрировали в вакууме до объема, приблизительно, 500 мл. Добав