Композиции и способы лечения миелофиброза
Иллюстрации
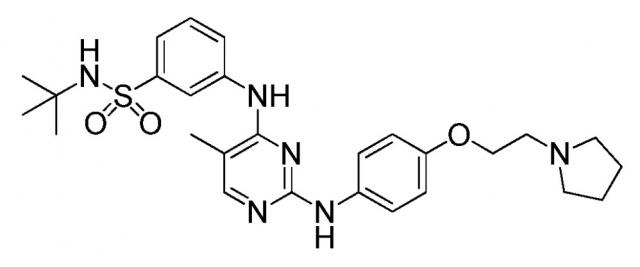
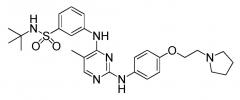
Показать всеИзобретение описывает капсулу для перорального введения, предназначенную для лечения миелофиброза. Капсула содержит смесь соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, микрокристаллической целлюлозы и стеарилфумарата натрия. Смесь содержит от 10 до 500 мг указанного соединения. Массовое соотношение соединения к микрокристаллической целлюлозе в смеси находится в диапазоне от 1:1,5 до 1:15. Количество стеарилфумарата натрия в смеси составляет 1% от массы содержимого капсулы. Также описан способ получения капсулы, способ лечения миелофиброза и набор для лечения миелофиброза. Лекарственный препарат N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамида в виде капсулы демонстрирует характеристики стабильности и мгновенного высвобождения. 4 н. и 34 з.п. ф-лы, 18 ил., 25 табл., 6 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка испрашивает приоритет предварительной заявки США №61/410924, поданной 7 ноября 2010, которая включена в этот документ путем ссылки в полном ее объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В этом документе предоставлены композиции и способы для лечения миелофиброза. Композиции и способы, представленные в этом документе, относятся к лечению миелофиброза соединениями, которые ингибируют JAK2-киназы, или их фармацевтически приемлемыми солями, или их гидратами.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Миелофиброз («MF») представляет собой редкое заболевание, в основном поражающее людей старческого возраста. MF представляет собой BCR-ABL1-негативную миелопролиферативную неоплазию («MPN»), которая является вновь возникшим заболеванием (первичным заболеванием) или может предваряться истинной полицитемией («PV») или эссенциальной тромбоцитемией («ET»). Клинические признаки включают прогрессирующую анемию, выраженную спленомегалию, конституциональные симптомы (например, утомляемость, ночные приливы, боль в костях, зуд и кашель) и потерю веса (Tefferi A, N. Engl. J. Med. 342:1255-1265, 2000). Медиана выживаемости колеблется в диапазоне от менее 2 лет до более 15 лет, что основано на выявленных в последнее время прогностических факторах (Cervantes F. et al., Blood 113:2895-2901, 2009; Hussein K. et al. Blood 115:496-499, 2010; Patnaik MM et al., Eur. J. Haematol 84:105-108, 2010). Мутации, вовлекающие JAK2-киназу (James C. et al., Nature 434:1144-1148, 2005; Scott L.M. et al., N. Engl. J. Med. 356:459-468, 2007), ген MPL (монофосфорил липид А) (Pikman Y. et al., PLoS. Med. 3:e270, 2006), ген TET2 (Delhommeau F. et al., N. Engl. J. Med. 360:2289-2301, 2009), ген ASXL1 (Carbuccia N. et al., Leukemia 23:2183-2186, 2009), ген IDH1/IDH2 (изоцитратдегидрогеназы) (Green A. et al., N. Engl. J. Med. 362:369-370, 2010; Tefferi A. et al., Leukemia 24:1302-1309, 2010), ген CBL (Grand FH et al., Blood 113:6182-6192, 2009), ген IKZF1 (Jager R. et al., Leukemia 24:1290-1298, 2010), ген LNK (Oh. ST. et al., Blood 116:988-992, 2010) или ген EZH2 (Ernst T. et al., Nat. Genet. 42:722-726) были описаны у пациентов с MNP, в том числе у пациентов с MF. Некоторые мутации возникают с высокой частотой при MF (например, мутации JAK2-киназ у ~50% пациентов) и либо непосредственно (например, мутации JAK2-киназы или MPL), либо косвенно (например, мутации LNK или CBL) индуцируют гиперактивацию JAK-STAT-киназ ((сигнальный трансдуктор и активатор транскрипции)-киназа).
Доступные в настоящее время методы лечения являются неэффективными в реверсировании течения процесса MF, будь то первичное или повторное/вторичное заболевание. Единственной возможностью вылечить заболевание на сегодняшний день является трансплантация костного мозга. Однако большинство пациентов не являются подходящими кандидатами для трансплантации костного мозга ввиду их старческого среднего возраста на момент постановки диагноза, где клинические проявления заболевания и смертность, связанные с трансплантацией, возрастают. Таким образом, возможности управления течением миелофиброза на настоящий момент являются неадекватными в том, чтобы удовлетворять потребностям всех пациентов. Основные возможности для активного вмешательства включают циторедуктивную терапию, например, с помощью гидроксимочевины, лечение анемии с помощью андрогенов, эритропоэтина и спленэктомию. Эти возможности, как было показано, не улучшают выживаемость и большей частью рассматриваются как паллиативные (временно облегчающие или ослабляющие проявление заболевания) (Cervantes F., Myelofibrosis: Biology and treatment options, European Journal of Haematology, 2007, 79 (suppl.68) 13-17). Таким образом, существует потребность в обеспечении дополнительных методов терапии для пациентов, страдающих миелофиброзом.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
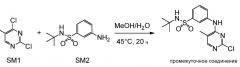
В этом документе предоставлены капсулы, подходящие для перорального введения. В некоторых вариантах осуществления капсулы содержат смесь, включающую (i) соединение, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, (ii) микрокристаллическую целлюлозу и (iii) стеарилфумарат натрия, где смесь содержится в капсуле.
В некоторых вариантах осуществления капсула содержит приблизительно 10 мг – приблизительно 680 мг соединения, где указанная масса дана в расчете на массу фрагмента соединения, соответствующего свободному основанию. В некоторых вариантах осуществления капсула содержит приблизительно 10 мг – приблизительно 500 мг соединения. В некоторых вариантах осуществления капсула содержит любое количество, выбираемое из 10 мг, 40 мг, 100 мг, 200 мг, 300 мг, 400 мг, 500 мг или 600 мг соединения. В некоторых вариантах осуществления массовое соотношение соединения к микрокристаллической целлюлозе в капсуле находится от приблизительно 1:1,5 до 1:15, где масса для соединения в массовом соотношении равна массе фрагмента соединения, соответствующего свободному основанию. В некоторых вариантах осуществления массовое соотношение соединения к стеарилфумарату натрия в капсуле составляет от приблизительно 5:1 до приблизительно 50:1, где масса для соединения в массовом соотношении равна массе фрагмента соединения, соответствующего свободному основанию. В некоторых вариантах осуществления микрокристаллическая целлюлоза представляет собой силикатированную микрокристаллическую целлюлозу. В некоторых вариантах осуществления силикатированная микрокристаллическая целлюлоза представляет собой комбинацию 98% микрокристаллической целлюлозы и 2% коллоидного диоксида кремния.
Также предоставлены в этом документе стандартные лекарственные формы, содержащие смесь, включающую (i) соединение, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, (ii) микрокристаллическую целлюлозу и (iii) стеарилфумарат натрия. В некоторых вариантах осуществления, стандартные лекарственные формы предназначены для лечения миелофиброза, а именно для лечения миелофиброза в соответствии со способом, описанным в этом документе.
В некоторых вариантах осуществления стандартная лекарственная форма содержит смесь, включающую (i) от приблизительно 10 мг до приблизительно 680 мг (или от приблизительно 10 мг до приблизительно 500 мг) соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, где указанная масса соответствует массе фрагмента соединения, составляющего свободное основание, (ii) микрокристаллическую целлюлозу и (iii) стеарилфумарат натрия. В некоторых вариантах осуществления стандартная лекарственная форма имеет форму капсулы, и смесь содержится в капсуле. В некоторых вариантах осуществления соединение в смеси составляет от приблизительно 10 мг до приблизительно 500 мг, где указанная масса соответствует массе фрагмента соединения, составляющего свободное основание. В некоторых вариантах осуществления добавка содержит (i) приблизительно 10 мг (или приблизительно любое количество, выбираемое из 40 мг, 100 мг, 200 мг, 300 мг, 400 мг или 500 мг) соединения, (ii) микрокристаллическую целлюлозу и (iii) стеарилфумарат натрия, где указанная масса дана в расчете на массу фрагмента соединения, соответствующего свободному основанию. В некоторых вариантах осуществления соединение представляет собой моногидрат дигидрохлорида N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамида. В некоторых вариантах осуществления массовое соотношение соединения к микрокристаллической целлюлозе в капсуле находится в диапазоне от приблизительно 1:1,5 до приблизительно 1:15, где масса соединения в массовом соотношении дана в расчете на массу фрагмента соединения, соответствующего свободному основанию. В некоторых вариантах осуществления массовое соотношение соединения к стеарилфумарату натрия в капсуле находится в диапазоне между приблизительно 5:1 и приблизительно 50:1, где масса соединения в массовом соотношении дана в расчете на массу фрагмента соединения, соответствующего свободному основанию. В некоторых вариантах осуществления микрокристаллическая целлюлоза представляет собой силикатированную микрокристаллическую целлюлозу. В некоторых вариантах осуществления силикатированная микрокристаллическая целлюлоза представляет собой комбинацию 98% микрокристаллической целлюлозы и 2% коллоидного диоксида кремния.
В некоторых вариантах осуществления стеарилфумарат натрия составляет приблизительно 1% (масс./масс.) от массы содержимого капсулы. В некоторых вариантах осуществления массовое соотношение соединения к микрокристаллической целлюлозе, например, к силикатированной микрокристаллической целлюлозе, составляет от приблизительно 40:60 до приблизительно 10:90 (например, приблизительно 40:60 или приблизительно 1:1,5 или приблизительно 10:90 или приблизительно 1:9).
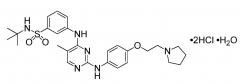
В некоторых вариантах осуществления соединение представляет собой моногидрат дигидрохлорида N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамида. В некоторых вариантах осуществления стандартная лекарственная форма или капсула содержит смесь, включающую приблизительно 12 мг моногидрата дигидрохлорида N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамида, приблизительно 122 мг силикатированной микрокристаллической целлюлозы и приблизительно 1 мг стеарилфумарата натрия. В некоторых вариантах осуществления стандартная лекарственная форма или капсула содержит смесь, включающую приблизительно 47 мг моногидрата дигидрохлорида N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамида, приблизительно 448 мг силикатированной микрокристаллической целлюлозы и приблизительно 5 мг стеарилфумарата натрия. В некоторых вариантах осуществления стандартная лекарственная форма или капсула содержит смесь, включающую приблизительно 117 мг моногидрата дигидрохлорида N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамида. В некоторых вариантах осуществления стандартная лекарственная форма или капсула содержит смесь, включающую приблизительно 235 мг моногидрата дигидрохлорида N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамида, приблизительно 357 мг силикатированной микрокристаллической целлюлозы и приблизительно 6,00 мг стеарилфумарата натрия. В некоторых вариантах осуществления капсула представляет собой твердую желатиновую капсулу.
Также предоставлены в этом документе способы получения капсульного лекарственного продукта, включающие в себя а) смешение смазывающего вещества с соединением, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, для получения гранул и b) смешение гранул, полученных на стадии а), с эксципиентом. В некоторых вариантах осуществления смазывающее вещество представляет собой стеарилфумарат натрия. В некоторых вариантах осуществления эксципиент представляет собой микрокристаллическую целлюлозу, например, силикатированную микрокристаллическую целлюлозу. В некоторых вариантах осуществления стеарилфумарат натрия составляет приблизительно 1% (масс./масс.) от массы содержимого капсулы. В некоторых вариантах осуществления массовое соотношение соединения к силикатированной микрокристаллической целлюлозе составляет от приблизительно 1:1,5 до приблизительно 1:9. В некоторых вариантах осуществления массовое соотношение соединения к силикатированной микрокристаллической целлюлозе составляет приблизительно 1:1,5. В некоторых вариантах осуществления массовое соотношение соединения к силикатированной микрокристаллической целлюлозе составляет приблизительно 1:9. В некоторых вариантах осуществления капсула представляет собой твердую желатиновую капсулу.
Также предоставлены в этом документе способы лечения миелофиброза у субъекта, включающие в себя пероральное введение соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, где соединение содержится в смеси, включающей в себя (i) соединение, (ii) эксципиент (например, микрокристаллическую целлюлозу) и (iii) смазывающее вещество (например, стеарилфумарат натрия). Могут быть использованы любые из стандартных лекарственных форм или капсул, описанных в этом документе. В некоторых вариантах осуществления предоставляют способ лечения миелофиброза у субъекта, включающий в себя пероральное введение соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, где соединение находится в капсуле, содержащей смесь, включающую в себя (i) соединение, (ii) микрокристаллическую целлюлозу (например, силикатированную микрокристаллическую целлюлозу) и (iii) стеарилфумарат натрия.
Также предоставлены в этом документе способы лечения миелофиброза у субъекта, включающие в себя введение субъекту эффективного количества соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, где субъект дает отрицательный результат в отношении мутации с заменой валина на фенилаланин в позиции 617 в гене Янус-Киназы 2 (JAK2) человека или дает отрицательный результат в отношении мутации, соответствующей мутации с заменой валина на фенилаланин в позиции 617 гена JAK2-киназы человека.
Также предоставлены в этом документе способы лечения миелофиброза у субъекта, включающие в себя введение субъекту эффективного количества соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, где субъект ранее получил другое лечение миелофиброза. В некоторых вариантах осуществления предыдущее лечение представляет собой метод лечения с помощью ингибитора JAK2-киназы, который представляет собой не N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат. В некоторых вариантах осуществления предыдущее лечение включает в себя введение INCB018424 (руксолитиниб). В некоторых вариантах осуществления субъект не восприимчив к предыдущему лечению. В некоторых вариантах осуществления предыдущее лечение представляет собой метод лечения с помощью N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамида или его фармацевтически приемлемой соли или гидрата соли. В некоторых вариантах осуществления предыдущее лечение было прервано при показании, включающем повышенные уровни амилазы, липазы, аспартат-аминотрансферазы («AST»), аланин-аминотрансферазы («ALT») и/или креатинина. В некоторых вариантах осуществления предыдущее лечение было прервано при показании гематологического состояния, выбранного из группы, состоящей из анемии, тромбоцитопении и нейтропении.
Также предоставлены в этом документе способы уменьшения интенсивности симптомов состояния насыщенности клетками ткани костного мозга или фиброза костного мозга, сопутствующего миелофиброзу, у субъекта, включающие в себя введение субъекту эффективного количества соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат.
Также предоставлены в этом документе способы уменьшения зуда, сопутствующего миелофиброзу, у субъекта, включающие в себя введение субъекту эффективного количества соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат.
Также предоставлены в этом документе способы контроля за проведением лечения миелофиброза у субъекта, включающие в себя (а) введение субъекту эффективного количества соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат; (b) контроль негематологического параметра, выбранного из группы, состоящей из уровня амилазы, уровня липазы, уровня аспартат-аминотрансферазы (AST) и уровня креатинина, у субъекта; и (с) определение того, что следует ли субъекту продолжать лечение или следует прервать его. Также предоставлены в этом документе способы контроля за проведением лечения миелофиброза у субъекта, включающие в себя введение субъекту эффективного количества соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат; и прерывание лечения при показании повышенных уровней одного или более ферментов или молекул, выбранных из группы, состоящей из амилазы, липазы, аспартат-аминотрансферазы (AST), аланин-аминотрансферазы (ALT) и креатинина в сыворотке субъекта, без предварительного снижения дозы. В некоторых вариантах осуществления один или более повышенных уровней составляют осложнения 4 степени.
Также предоставлены в этом документе способы контроля за проведением лечения миелофиброза у субъекта, включающие в себя (а) введение субъекту эффективного количества соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат; (b) контроль гематологического параметра, выбранного из группы, состоящей из анемии, тромбоцитопении и нейтропении, в сыворотке субъекта; и (с) определение того факта, следует ли субъекту продолжать лечение или следует прервать его. Также предоставлены в этом документе способы контроля за проведением лечения миелофиброза у субъекта, включающие в себя введение субъекту эффективного количества соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид или его фармацевтически приемлемую соль или его гидрат; и прерывание лечения при показании одного или более гематологических состояний, выбранных из группы, состоящей из анемии, тромбоцитопении и нейтропении, без предварительного снижения дозы. В некоторых вариантах осуществления одно или более гематологических состояний составляют осложнения 4 степени.
В некоторых вариантах осуществления способов контроля за проведением лечения, предоставляемых в этом документе, способы дополнительно включают в себя введение субъекту эффективного количества соединения, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, после прерывания субъекту лечения, по меньшей мере, на 2 недели. В некоторых вариантах осуществления субъекту было прервано лечение, по меньшей мере, на 3 недели. В некоторых вариантах осуществления субъекту было прервано лечение, по меньшей мере, на 4 недели. В некоторых вариантах осуществления лечение было прервано без предварительного снижения дозы.
В некоторых вариантах осуществления соединение вводят субъекту-человеку в дозе от приблизительно 240 мг в день до приблизительно 680 мг в день, где указанная масса соответствует массе фрагмента соединения, составляющего свободное основание. В некоторых вариантах осуществления соединение вводят в дозе от приблизительно 300 мг в день до приблизительно 500 мг в день (например, от приблизительно 300 мг в день до приблизительно 400 мг в день или от приблизительно 400 мг в день до приблизительно 500 мг в день), где указанная масса соответствует массе фрагмента соединения, составляющего свободное основание. В некоторых вариантах осуществления соединение вводят в дозе, равной приблизительно любой дозе из приблизительно 240 мг в день, 250 мг в день, 300 мг в день, 350 мг в день, 400 мг в день, 450 мг в день, 500 мг в день, 550 мг в день, 600 мг в день, 650 мг в день или 680 мг в день, где указанная масса соответствует массе фрагмента соединения, составляющего свободное основание. В некоторых вариантах осуществления соединение вводят ежедневно и/или перорально. В некоторых вариантах осуществления соединение вводят в течение периода, по меньшей мере, 1 цикла, по меньшей мере, 2 циклов, по меньшей мере, 3 циклов, по меньшей мере, 4 циклов, по меньшей мере, 5 циклов или, по меньшей мере, 6 циклов (например, по меньшей мере, 7 циклов, по меньшей мере, 8 циклов, по меньшей мере, 9 циклов, по меньшей мере, 10 циклов, по меньшей мере, 11 циклов, по меньшей мере, 12 циклов, по меньшей мере, 15 циклов, по меньшей мере, 18 циклов, по меньшей мере, 24 циклов), где 1 цикл представляет собой 28-дневный цикл лечения. В некоторых вариантах осуществления соединение находится в капсуле и вводится перорально. В некоторых вариантах осуществления соединение находится в стандартной лекарственной форме. Могут быть введены любые капсулы или стандартные лекарственные формы, описанные в этом документе. В некоторых вариантах осуществления способов, предоставляемых в этом документе, соединение находится в смеси, включающей (i) соединение, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, (ii) микрокристаллическую целлюлозу и (iii) стеарилфумарат натрия. В некоторых вариантах осуществления массовое соотношение соединения к микрокристаллической целлюлозе в смеси находится в диапазоне от приблизительно 1:1,5 до 1:15, где масса соединения дана в расчете на массу фрагмента соединения, соответствующего свободному основанию. В некоторых вариантах осуществления массовое соотношение соединения к стеарилфумарату натрия в смеси имеет значение в диапазоне от приблизительно 5:1 до приблизительно 50:1, где масса соединения дана в расчете на массу фрагмента соединения, соответствующего свободному основанию. В некоторых вариантах осуществления соединение представляет собой моногидрат дигидрохлорида N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамида. В некоторых вариантах осуществления микрокристаллическая целлюлоза представляет собой силикатированную микрокристаллическую целлюлозу. В некоторых вариантах осуществления субъектом является человек.
В некоторых вариантах осуществления композиций и способов, предоставляемых в этом документе, субъект имеет первичный миелофиброз. В некоторых вариантах осуществления композиций и способов, предоставляемых в этом документе, субъект имеет миелофиброз, развившийся на фоне предшествующей истинной полицитемии. В некоторых вариантах осуществления композиций и способов, предоставляемых в этом документе, субъект имеет миелофиброз, развившийся на фоне предшествующей эссециальной тромбоцитемии. В некоторых вариантах осуществления субъект имеет высокий риск возникновения миелофиброза. В некоторых вариантах осуществления субъект имеет средний риск возникновения миелофиброза (например, как промежуточный 2 уровень риска возникновения заболевания). В некоторых вариантах осуществления композиций и способов, предоставляемых в этом документе, субъект дает положительный результат в отношении мутации с заменой валина на фенилаланин в позиции 617 в Янус-киназе 2 (JAK2) человека или дает положительный результат в отношении мутации, соответствующей мутации с заменой валина на фенил аланин в позиции 617 JAK2-киназы человека. В некоторых вариантах осуществления композиций и способов, предоставляемых в этом документе, субъект дает отрицательный результат в отношении мутации с заменой валина на фенилаланин в позиции 617 в Янус-киназе 2 (JAK2) человека или дает отрицательный результат в отношении мутации, соответствующей мутации с заменой валина на фенилаланин в позиции 617 JAK2-киназы человека. В некоторых вариантах осуществления композиций и способов, предоставляемых в этом документе, субъект имеет пальпируемую спленомегалию. В некоторых вариантах осуществления субъект с миелофиброзом имеет селезенку, расположенную, по меньшей мере, на 5 см ниже реберного края, что определено пальпацией. В некоторых вариантах осуществления композиций и способов, предоставляемых в этом документе, субъект является трансфузионно-зависимым (зависим от поддерживающей трансфузионной терапии). В некоторых вариантах осуществления композиций и способов, предоставляемых в этом документе, субъект не является трансфузионно-зависимым.
В некоторых вариантах осуществления способов, предоставляемых в этом документе, приведении соединения субъекту-человеку, Сmax соединения достигается в пределах от приблизительно 2 до приблизительно 4 часов после введения дозы. В некоторых вариантах осуществления после введения соединения субъекту-человеку, период полувыведения соединения составляет от приблизительно 16 до приблизительно 34 часа. В некоторых вариантах осуществления среднее значение AUC (площади под кривой), полученной для соединения, увеличивается более, чем пропорционально с повышением доз, находящихся в диапазоне от приблизительно 30 мг до приблизительно 800 мг в день. В некоторых вариантах осуществления накопление соединения находится в диапазоне от приблизительно 1,25-кратного до приблизительно 4,0-кратного в стационарном состоянии, когда дозу соединения вводят один раз в день. В некоторых вариантах осуществления соединение находится в смеси, включающей в себя (i) соединение, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, (ii) микрокристаллическую целлюлозу и (iii) стеарилфумарат натрия. В некоторых вариантах осуществления массовое соотношение соединения к микрокристаллической целлюлозе в смеси находится в диапазоне между приблизительно 1:1,5 и 1:15, где масса соединения соответствует массе фрагмента соединения, составляющего свободное основание. В некоторых вариантах осуществления массовое соотношение соединения к стеарилфумарату натрия в смеси имеет значение в диапазоне от приблизительно 5:1 до приблизительно 50:1, где масса соединения дана в расчете на массу фрагмента соединения, соответствующего свободному основанию. В некоторых вариантах осуществления соединение представляет собой моногидрат дигидрохлорида N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамида. В некоторых вариантах осуществления микрокристаллическая целлюлоза представляет собой силикатированную микрокристаллическую целлюлозу.
Также предоставлены в этом документе изделия производства или наборы, содержащие (а) любое изделие из капсул, обеспечиваемых в данной заявке, и (b) листок-вкладыш в упаковке или этикетку, где указано, что капсула полезна для лечения миелофиброза у субъекта. Также предоставлены в этом документе изделия производства или наборы, содержащие (а) любое изделие из стандартных лекарственных форм, обеспечиваемых в этой заявке, и (b) листок-вкладыш в упаковке или этикетку, указывающий(ую), что капсула полезна в лечении миелофиброза у субъекта. В некоторых вариантах осуществления предоставляется изделие производства или набор, содержащий (а) смесь, включающую в себя (i) соединение, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, (ii) микрокристаллическую целлюлозу и (iii) стеарилфумарат натрия, и (b) листок-вкладыш в упаковке или этикетку, указывающий(ую), что добавка полезна в лечении миелофиброза у субъекта.
Также предоставлены в этом документе изделия производства или наборы, содержащие (а) соединение, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, и (b) листок-вкладыш в упаковке или этикетку, указывающий(ую), что соединение может быть применено для лечения миелофиброза у субъекта, где субъект дает отрицательный результат в отношении мутации с заменой валина на фенилаланин в позиции 617 Янус-киназы 2 (JAK2) человека или дает отрицательный результат в отношении мутации, соответствующей мутации с заменой валина на фенилаланин в позиции 617 JAK2-киназы человека.
Также предоставлены в этом документе изделия производства или наборы, содержащие (а) соединение, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, и (b) листок-вкладыш в упаковке или этикетку, указывающий(ую), что соединение может быть применено для лечения миелофиброза у субъекта, где субъект ранее получил другое лечение миелофиброза. В некоторых вариантах осуществления предыдущее лечение представляет собой метод лечения с применением ингибитора JAK2-киназы, который не представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат.
Также предоставлены в этом документе изделия производства или наборы, содержащие (а) соединение, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, и (b) листок-вкладыш в упаковке или этикетку, указывающий(ую), что соединение может быть применено для уменьшения интенсивности симптомов состояния насыщенности клетками ткани костного мозга и/или фиброза костного мозга.
Также предоставлены в этом документе изделия производства или наборы, содержащие (а) соединение, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, и (b) листок-вкладыш в упаковке или этикетку, указывающий(ую), что соединение может быть применено для уменьшения зуда, сопутствующего миелофиброзу.
Также предоставлены в этом документе изделия производства или наборы, содержащие соединение, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, и листок вкладыш-инструкцию в упаковке или этикетку, указывающую на упаковке, что соединение может быть применено для лечения миелофиброза у субъекта и что субъект должен прервать лечение при показании повышенных уровней одного или более ферментов или молекул, выбранных из группы, состоящей из: амилазы, липазы, аспартат-аминотрансферазы (AST), аланин-аминотрансфкразы (ALT) и креатинина, в сыворотке субъекта и/или при показании одного или более гематологических состояний, выбранных из группы, состоящей из анемии, тромбоцитопении и нейтропении. В некоторых вариантах осуществления листок-вкладыш в упаковке или этикетка на упаковке дополнительно указывает, что введение соединения может быть прекращено без предварительного снижения дозы. В некоторых вариантах осуществления один или несколько показателей повышенных уровней ферментов или молекул представляют собой осложнения 4 степени. В некоторых вариантах осуществления одно или несколько гематологических состояний представляют собой осложнения 4 степени.
В некоторых вариантах осуществления листок-вкладыш в упаковке или этикетка на упаковке размещен(а) так, чтобы бы его/ее могли увидеть предполагаемые покупатели. В некоторых вариантах осуществления соединение находится в стандартной лекарственной форме или капсульной форме.
В некоторых вариантах осуществления листок-вкладыш или этикетка показывает, что при введении субъекту-человеку Сmax соединения достигается в пределах от приблизительно 2 до приблизительно 4 часов после введения дозы. В некоторых вариантах осуществления листок-вкладыш в упаковке или этикетка на упаковке показывает, что при введении соединения субъекту-человеку, период полувыведения соединения составляет от приблизительно 16 до приблизительно 34 часа. В некоторых вариантах осуществления листок-вкладыш показывает, что AUC (средняя площадь под кривой), полученной для соединения, увеличивается более, чем пропорционально с увеличением доз, находящихся в диапазоне от приблизительно 30 мг до приблизительно 800 мг в день. В некоторых вариантах осуществления листок-вкладыш в упаковке или этикетка на упаковке указывает, что накопление соединения находится в диапазоне от приблизительно 1,25-кратного до приблизительно 4,0-кратного в стационарном состоянии, когда дозу соединения вводят один раз в день. В некоторых вариантах осуществления соединение находится в смеси, включающей в себя (i) соединение, которое представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, (ii) микрокристаллическую целлюлозу и (iii) стеарилфумарат натрия. В некоторых вариантах осуществления массовое соотношение соединения к микрокристалличекой целлюлозе в смеси составляет от приблизительно 1:1,5 до 1:15, где масса соединения дана в расчете на массу фрагмента соединения, соответствующего свободному основанию. В некоторых вариантах осуществления массовое соотношение соединения к стеарилфумарату натрия в смеси имеет значение в диапазоне от приблизительно 5:1 до приблизительно 50:1, где масса соединения дана в расчете на массу фрагмента соединения, соответствующего свободному основанию. В некоторых вариантах осуществления соединение представляет собой моногидрат дигидрохлорида N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамида. В некоторых вариантах осуществления микрокристаллическая целлюлоза представляет собой силикатированную микрокристаллическую целлюлозу.
В некоторых вариантах осуществления предоставляется применение соединения в изготовлении лекарственного препарата для лечения миелофиброза у субъекта, где соединение представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат. В некоторых вариантах осуществления соединение находится в смеси, включающей в себя (i) соединение, (ii) эксципиент (например, микрокристаллическую целлюлозу, такую как силикатированную микрокристаллическую целлюлозу) и (iii) смазывающее вещество (например, стеарилфумарат натрия). В некоторых вариантах осуществления соединение вводят перорально. В некоторых вариантах осуществления применение осуществляют в соответствии со способом, описанным в этом документе.
В некоторых вариантах осуществления предоставляется применение соединения в изготовлении лекарственного препарата для лечения миелофиброза у субъекта, где соединение представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтически приемлемую соль, или его гидрат, где субъект дает отрицательный результат в отношении мутации с заменой валина на фенилаланин в позиции 617 в Янус-киназе 2 (JAK2) человека или дает отрицательный результат в отношении мутации, соответствующей мутации с заменой валина на фенилаланин в позиции 617 в JAK2-киназе человека. В некоторых вариантах осуществления предоставляется применение соединения в изготовлении лекарственного препарата для лечения миелофиброза у субъекта, где соединение представляет собой N-трет-бутил-3-[(5-метил-2-{[4-(2-пирролидин-1-илэтокси)фенил]амино}пиримидин-4-ил)амино]бензолсульфонамид, или его фармацевтическ