2-фенилтиометил замещенные 1,3-дикетоны и диметилмалонат - средства с фунгицидной активностью
Иллюстрации
Показать всеИзобретение относится к средству для борьбы с грибковыми заболеваниями растений формулы
где R1=Me, R2=Ph; R1=R2=Ph; R1=R2=OMe. 1 табл.
Реферат
Изобретение относится к области новых средств, обладающих фунгицидной активностью, конкретно к 2-фенилтиометил замещенным 1,3-дикетонам и диметилмалонату формулы (1)
где R1=Me, R2=Ph; R1=R2=Ph; R1=R2=OMe.
2-Фенилтиометил замещенные 1,3-дикетоны и диметилмалонат (1) обладают фунгицидной активностью по отношению к микромицетам фитопатогенных грибов Bipolaris sorokiniana, Fusarium oxysporum, Rhizoctonia solani, вызывающих различные заболевания сельскохозяйственных растений, в том числе корневую гниль зерновых культур [В.И. Билай, Р.И. Гвоздяк, И.Р. Скрипаль и др. Микроорганизмы-возбудители болезней растений. Под ред. Билай В.И. Киев: Наукова думка, 1988, 552 с.].
Известен фунгицид [Н.Н. Мельников. Пестициды: химия, технология и применение. М.: Химия, 1987, 712 с] 2,3-дициано-1,4-дитиадигидроантрахинон (дитианон) (2), структура которого содержит 1,4-дитиахиноновый фрагмент, предназначенный для борьбы с грибковыми заболеваниями сельскохозяйственных культур.
Производство известного фунгицида является многостадийным и базируется на использовании труднодоступных исходных реагентов.
Известен фунгицид [Н.Н. Юхтин. Краткий справочник по ядохимикатам. М.: Колос, 1973, 252 с.] 6-метил-1,3-дитиоло[4,5-b]хиноксалинона-2 (хинометионат) (3), структура которого содержит дитиа-хиноксалиновый фрагмент, предназначенный для борьбы с нежелательными грибами при защите растений.
Производство известного фунгицида является многостадийным и базируется на использовании высокотоксичных исходных реагентов.
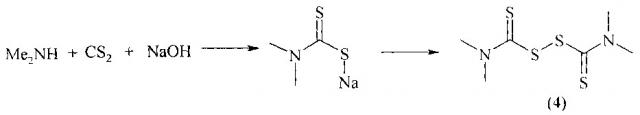
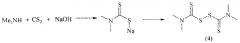
Известен фунгицид [А.Т. Солдатенков, Н.М. Колядина, А. Ле Туан. Пестициды и регуляторы роста: прикладная и органическая химия. М: БИНОМ. Лаборатория знаний, 2012, 223 с.] бис-(диметилтиокарбомоил)-дисульфид (тирам) (4), применяемый в сельском хозяйстве (в том числе, в смеси с другими действующими веществами) для борьбы с заболеваниями растений.
Производство известного фунгицида является двухстадийным.
Наиболее близким аналогом являются соединения [F. Adelowo-Imeokparia, I.A.O. Ojo. Synthesis and fungicidal activity of some sulphide derivatives of o-ethyl-N-substituted phenylcarbamates. Pak. J. Sci. Ind. Res. 2006 49(5), P. 324-329; F.E. Adelowo, I.A.O. Ojo, O.S. Amuda. Synthesis and fungicidal activity of some sulphide derivatives of o-phenyl-N-substituted phenylcarbamates. Advances in Biological Chem., 2011, 1, P. 122-127] бис-[N-этоксикарбонил-N-(3-нитрофенил)]моносульфид (5) и бис-[N-феноксикарбонил-N-(3-нитрофенил)]дисульфид (6), проявляющие фунгицидную активность в отношении Aspergillus niger, Aspergillus flavus, Rhizopus stolonifer, Fusarium oxysporum.
Синтез указанных соединений (5) и (6) является двухстадийным и базируется на использовании дорогостоящих соединений.
Сущностью изобретения является использование 2-фенилтиометил замещенных 1,3-дикетонов и диметилмалоната в качестве средств с фунгицидной активностью, получаемых в одну препаративную стадию из доступных исходных реагентов.
Результат достигается тем, что в качестве соединений, обладающих фунгицидной активностью, предлагается 2-фенилтиометил замещенные 1,3-дикетоны и диметилмалонат формулы (1).
Способ получения 2-фенилтиометил замещенных 1,3-дикетонов и диметилмалоната формулы (1) основан на взаимодействии формальдегида (СН2О) с тиофенолом (Ph-SH), 1,3-дикетонами (1-фенилбутан-1,3-дион, 3,5-гептандион, 1,3-дифенилпропан-1,3-дион) или диметилмалонатом в присутствии катализатора BuONa при мольном соотношении CH2O:R-SH:1,3-дикетон:BuONa=1:1:1:1 в среде растворителей CHCl3-С2Н5ОН (1:1, об.) при комнатной температуре (~20°С) и атмосферном давлении в течение 6 ч. Реакция протекает по схеме
где R1=Me, R2=Ph; R1=R2=Ph; R1=R2=OMe.
2-Фенилтиометил замещенные 1,3-дикетоны и диметилмалонат формулы (1) образуются только лишь с участием формальдегида, тиофенола, 1,3-дикетонов или диметилмалоната, промотора BuONa, взятых в стехиометрических количествах. При другом соотношении исходных реагентов снижается выход целевых продуктов (1). Реакции проводили при комнатной температуре (~20°С). При температуре выше 20°С (например, 60°С) увеличиваются энергозатраты, а при температуре ниже 20°С (например, 0°С) снижается скорость реакции. Опыты проводили в среде растворителей этанол-хлороформ (1:1, об.), т.к. в них хорошо растворяются исходные соединения.
Спектральные характеристики соединений (1а-в)
2-Фенилтиометил-1-фенилбутан-1,3-дион (1а)
Масло красного цвета, выход 1.18 г (83%).
ИК-спектр (ν, см-1): 692, 739 (C-S), 968, 1000, 1025 (С-О), 1181, 1281, 1357, 1721 и 1676 (С=O), 3432.
Спектр ЯМР 1Н (δ, м.д., J, Гц): 2.16 и 2.20 (с, 3Н, СН3 (20) кетонная и енольная форма); 3.48 и 3.57 НаНв (д.д., 2Н, J1=12, J1=8, СН2 (8) кетонная форма); 3.87 (с, 2Н, СН2 (8) енольная форма); 4.75 (т, 1Н, J1=8, CH (9)) 7.25-7.45 (м, 10Н, Ar); 17.20 (1Н, ОН (енольная форма)).
Спектр ЯМР 13С (δ, м.д.): 22.81 (С-14, 15); 33.47 (С-8); 127.07, 129.08, 131.17, 135.89 (С-Ar); 68.11 и 105.98 (С-9 кетонная и енольная форма); 192.42 и 202.22 (С-10,12 кетонная и енольная форма).
Масс-спектр, m/z: 307.091 [M+Na]+. Найдено (%): С, 72.05; Н, 5.51; S, 11.65. C17H16O2S. Мтеор.=284.374. Вычислено (%): С, 71.80; Н, 5.67; S, 11.28.
2-Фенилтиометил-1,3-дифенилпропан-1,3-дион (1б)
Масло красного цвета, выход 1.53 г (88%).
ИК-спектр (ν, см-1): 689, 738 (C-S), 910, 1025 (С-О), 1160, 1284, 1672 и 1695 (С=O), 3488.
Спектр ЯМР 1Н (δ, м.д., J, Гц): 3.70 (д, 2Н, J=6.8, СН2 (8)); 5.60 (т, 1H, J=6.8, (9)) (кетонная форма); 7.31-7.36, 7.38-7.44, 7.51-7.59 (м, 15Н, Ar); 17.38 (1Н, ОН (енольная форма)).
Спектр ЯМР 13С (δ, м.д.): 33.70 (С-8); 56.22 (С-9); 127.36-135.80 (С-Ar); 56.22 и 68.30 (С-9 кетонная и енольная форма); 194.46 и 196.71 (С-10,12 кетонная и енольная форма).
Масс-спектр, m/z: 369.089 [M+Na]+. Найдено (%): С, 75.92; Н, 5.52; S, 9.63. C22H18O2S. Мтеор.=346.443. Вычислено (%): С, 76.27; Н, 5.24; S, 9.26.
2-Фенилтиометил-диметилмалонат (1в)
Безцветное масло, выход 1.27 г (85%).
ИК-спектр (ν, см-1): 693, 741 (C-S), 912, 1026 (С-О), 1 152, 1438, 1737 (С=O), 3530.
Спектр ЯМР 1Н (δ, м.д., J, Гц): 3.35 (д, 2Н, J=8, СН2 (8)); 3.56 (м, 1Н, СН, (9)); 3.60 (с, 6Н, СН3 (15,17)); 7.14-7.27 (м, 5Н, Ar).
Спектр ЯМР 13С (δ, м.д.): 32.81 и 35.64 (С-8); 52.56 и 52.70 (С-15,17); 60.33 и 63.04 (С-9); 126.89, 127.18, 128.93, 129.15, 130.77, 130.90 (С-Ar); 56.22 и 68.30 (С-9 кетонная и енольная форма); 194.46 и 196.71 (С-10,12 кетонная и енольная форма).
Масс-спектр, m/z: 254 (100) [М]+; 223 (5) [М-ОСН3]; 194 (30) [М-СН3ОС=O]; 163 (43) [M-C6H5SCH2CHCO]; 135 (50) [M-CH3OCHOHCH-2CHOHOCH3]; 123 (91) [CH2SC6H5]; 109 () [SC6H5]. Найдено (%): С, 56.99; H, 5.62; S, 12.97. C12H14O4S. Мтеор.=254.303. Вычислено (%): С, 56.68; Н, 5.56; S, 12.61.
Оценку фунгицидной активности проводили методом диффузии в агар (Н.С. Егоров. Практикум по микробиологии. М.: МГУ, 1976, 307 с). Поверхность картофельно-глюкозный агара, разлитого по 20-25 мл в стандартные чашки Петри d 90 мм, засевали суспензией спор тест-культур грибов. Затем в среде сверлом диаметром 10 мм вырезали 3 лунки, в которые помещали по 100 мкл испытываемых растворов. Фунгицидную активность оценивали по диаметру зоны подавления роста микромицетов, а также наблюдая за развитием тест-культур с использованием светового микроскопа «Leika». Контролем служило развитие грибов на питательной среде. Время инкубации 12 суток при 28°С.
В качестве тест-культур были использованы микроскопические грибы Bipolaris sorokiniana, Fusarium oxysporum, Rhizoctonia solani из коллекции микроорганизмов Института биологии УНЦ РАН.
2-Фенилтиометил замещенные 1,3-дикетоны и диметилмалонат формулы (1) полностью подавляет развитие Bipolaris sorokiniana, Rhizoctonia solani. Развитие Fusarium oxysporum соединения (1a) и (1б) в концентрации 0,5% подавляют в зоне действия соединения (Таблица).
Средство для борьбы с грибковыми заболеваниями, вызванными микромицетами Bipolaris sorokiniana, Fusarium oxysporum, Rhizoctonia solani, отличающееся тем, что в качестве средства с фунгицидной активностью используют 2-фенилтиометил замещенные 1,3-дикетоны и диметилмалонат формулы (1)
где R1=Me, R2=Ph; R1=R2=Ph; R1=R2=OMe.