Способ прогнозирования развития раннего тромбоза зоны реконструкции после реконструктивных операций на брюшной аорте и артериях нижних конечностей в зависимости от генетических вариантов наследственных тромбофилий и клинико-лабораторных показателей
Иллюстрации
Показать всеИзобретение относится к области медицинской диагностики и предназначено для прогнозирования риска развития раннего тромбоза зоны реконструкции после реконструктивных операций на брюшной аорте и артериях нижних конечностей. У пациента осуществляют забор крови, выделение ДНК и анализ полиморфизмов генов 677 С/Т MTHFR и 455 G/A FGB. В крови определяют уровень Д-димера, гомоцистеина, фибриногена, антитромбина III, ЛПВП, ЛПВП и количество тромбоцитов. Полученные значения включают в формулы расчета y1 и y2. Риск формирования тромбоза зоны реконструкции прогнозируют в случае, если y1 больше y2. Изобретение позволяет формировать группы риска по развитию осложнений после реконструктивных операций на брюшной аорте и артериях нижних конечностей, что будет способствовать более эффективной реализации лечебно-профилактических мероприятий по предупреждению развития тромбоза зоны реконструкции. 2 ил., 2 табл., 2 пр.
Реферат
Изобретение относится к области медицинской диагностики, может быть использовано для прогнозирования риска развития тромбоза после реконструктивных операций на брюшной аорте и артериях нижних конечностей.
Одной из наиболее частых причин повторных реконструктивных операций являются тромбозы и окклюзии шунтов и зон реконструкций [Султанян Т.Л. Осложнения после реконструктивных операций на магистральных артериях нижних конечностей и методы их коррекции / Т.Л. Султанян, А.С. Саркисян, А.М. Хачатрян // Ангиология и сосудистая хирургия. - 2013. - Т. 19, №1. - С. 124-128]. По данным литературы, частота тромбозов после операций на аорто-бедренном сегменте достигает 9,3%, а бедренно-подколенно-тибиальном до 12% [Прогнозирование ранних тромбогеморрагических осложнений после реконструктивных операции на магистральных артериях нижних конечностей / А.А. Полянцев, П.В. Мозговой, Д.В. Фролов [и др] // Вестник Волгоградского государственного медицинского университета. - 2004. - №11. - С. 68-72]. Среди причин развития тромботических осложнений в первые месяцы послеоперационного периода многие авторы выделяют ошибки хирургической техники и несостоятельность дистального русла [Покровский, А.В. Результаты использования комбинированных шунтов с дистальным анастомозом ниже щели коленного сустава / А.В. Покровский, Д.И. Яхонтов // Ангиология и сосудистая хирургия. - 2014. - Т. 20, №2. - С. 140-147]. Значительную роль в развитии тромботических окклюзий играют нарушения свертывающей системы крови [Белов Ю.В. Повторные реконструктивные операции на аорте и магистральных артериях / Ю.В. Белов, А.Б. Степаненко. - Москва: Медицинское информационное агентство, 2009. - 176 с.; Risk Stratification for the Development of Respiratory Adverse Events Following Vascular Surgery / E.A. Genovese, L. Fish, G.E. Al-Khoury, M.S. Makaroun, D.T. Baril // Journal of Vascular Surgery. - 2015. - Vol. 62, Issue 3. - P. 793-794]. Реокклюзии шунтов по срокам их возникновения подразделяют на ранние, формирующиеся в течение трех месяцев после хирургического вмешательства, отсроченные, развивающиеся в сроки до 1,5 лет, и поздние, проявляющиеся спустя 1,5 года и более, после операции [Современное состояние проблемы реокклюзии после реконструктивных вмешательств на артериях таза и нижних конечностей у больных облитерирующим атеросклерозом / М.Р. Кузнецов, К.В. Комов, С.А. Тепляков, И.В. Косых, Б.В. Тугдумов // Ангиология и сосудистая хирургия. - 2009. - Т. 15, №4. - С. 145-151]. По данным Белова Ю.В., (2009) ранними послеоперационными тромбозами считаются тромботические осложнения, возникшие в первые шесть месяцев после операции, соответственно, - поздние послеоперационные тромбозы, возникшие более шести месяцев после вмешательства. Увеличение числа артериальных тромбозов может быть связано с комбинацией различных факторов генетического риска тромбоза [Sheweita S.A. Role of genetic changes in the progression of cardiovascular diseases / S.A. Sheweita, H. Baghdadi, A.R. Allam // International Journal of Biomedical Sciences. - 2011. - Vol. 7 (4). - P. 238-248]. Факторы риска тромбообразования и механизмы формирования тромбофилических состояний, создающие высокий риск развития тромбозов и тромбоэмболий, во многом определяют дальнейшее течение и последующий прогноз заболевания, как в раннем послеоперационном периоде, так и в отдаленные сроки [Современные методы распознавания состояния тромботической готовности: монография / А.П. Момот, Л.П. Цывкина, И.А. Тараненко [и др.]; под ред. А.П. Момота. - Барнаул: Изд-во Алтайского государственного университета, 2011. - 138 с.]. Современные диагностические лабораторные методы позволяют выявить нарушения гемостаза на дооперационном этапе и далее контролировать качество проводимой терапии в послеоперационном периоде. Основным методом исследования и контроля состояния системы гемостаза является коагулограмма [Вавилова Т.В. Лабораторные исследования в монторинге антитромботической терапии / Т.В. Вавилова // Новости хирургии. - 2010. - Т. 18, №3. - С. 150-161], а также ряд отдельных исследований свертывающей системы крови: антитромбин, D-димер и гомоцистеин, выделяемые из сыворотки крови больного. Гипергомоцистеинемия развивается за счет мутации гена MTHFR, способствуя формированию как венозных, так и артериальных тромбозов. Гипергомоцистеинемия приводит к раннему развитию атеросклероза и тромбоза коронарных, церебральных и периферических артерий за счет развития эндотелиальной дисфункции через активацию тромбоцитов [Тарханова И.Ю. и др., 2009; Федосеева А.А. Гомоцистеин сыворотки крови и некоторые показатели гемостаза при дегенеративно-дистрофических заболеваниях тазобедренного сустава / А.А. Федосеев, Д.Я. Алейник // Медицинских альманах. - 2012. - №1. - С. 149-152.; Генетическая предрасположенность к венозному тромбозу: роль полиморфизмов компонентов плазменного и тромбоцитарного звеньев гемостаза / С.И. Капустин, В.М. Шмелева, А.М. Паншина [и др.] // Ученые записки СПбГМУ им. акад. И.П. Павлова. - 2004. - Т. 11, №3. - С. 10-15], нарушению липидного обмена [Казанцев А.В. Исследование системы гемостаза и маркеров дисфункции эндотелия у больных с облитерирующим атеросклерозом бедренно-подколенной локализации / А.В. Казанцев, Е.А. Корымасов // Научные ведомости Белгородского государственного университета. Сер. Медицина. Фармация. - 2010. - Т. 12, №22. - С. 80-85]. Антитромбин играет центральную роль в ингибировании коагуляции и воспалительных процессов сосудистого эндотелия [Khor, В. Laboratory tests for antithrombin deficiency / В. Khor, E.M. Van Cott // American Journal of Hematology. - 2010. - Vol. 85. - P. 947]. Измененные его уровни в плазме крови, повышают риск тромбообразования в венозном и артериальном руслах [Inherited Thrombophilia / Н.М. Phillippe, L.В. Hornsby, S. Treadway, Е.М. Armstrong, J.М. Bellone // Journal of Pharmacy Practice. - 2014. - 27 (3). - P. 227-233]. D-димер - это специфический продукт деградации фибрина, является диагностическим маркером активации системы гемостаза, который отражает процессы как образования фибрина, так и его лизиса [Adam S.S., Key N.S., Greenberg C.S. D-dimer antigen: current concepts and future prospects. //Blood. - 2009. - Vol. 113. - №13. - P. 2878-2887]. Повышение его концентрации свидетельствует о риске развития тромботических осложнений. Доказана значимая роль генетических факторов наследственных тромбофилий (1691G/A фактора V, 20210G/A протромбина, -455 G/A фибриногена, 677С/Т MTHFR и др.) в развитии венозных и артериальных тромбозов любой локализации как в дооперационном, так и в послеоперационном периоде (раннем и позднем) [Yilmaz, S. Inherited risk factors in low-risk venous thromboembolism in patients under 45 years / S. Yilmaz, S. Gunaydin // Interactive Cardiovascular and Thoracic Surgery. - 2015. - Vol. 20 (1). - P. 21-23; Role of thrombophilia factors in acute systemic-pulmonary shunt obstruction / Y. Ergul, N. Kiplapinar, I.C. Tanidir, E. Ozturk, A. Guzeltas, S. Hay din, A. Akcay, E. Erek, M. Yeniterzi, E. Odemis, I. Bakir // Pediatrics International. - 2015. - Vol. 57 (6). - P. 1072-1077]. Работы, посвященные изучению вклада наследственных тромбофилий в развитие тромботических окклюзий зоны реконструкции при операции на брюшной аорте и артериях нижних конечностей немногочисленны и представлены в основном исследованиями зарубежных авторов [Bilateral renal artery thrombosis in inherited thrombophilia: a rare cause of acute kidney injury / K.S. Wiles, L. Hastings, V.M. Muthuppalaniappan, M. Hanif, S. Abeygunasekara // International Journal of Nephrology and Renovascular Disease. - 2014. - Vol. 7. - P. 35-38; Thrombosis of the aorta abdominalis in infants-diagnosis and thrombolytic therapy / U. Krause, H.E. Schneider, M. Webel, T. Paul // Klinische Padiatrie. - 2012. - Vol. 224 (3). - P. 179-182].
Для оценки сложившейся патентной ситуации был выполнен поиск по охранным документам за период с 1990 по 2015 гг. Анализ документов производился по направлению: способ прогнозирования риска развития раннего тромбоза зоны анастомоза после реконструктивных операций на брюшной аорте и артериях нижних конечностей на основе молекулярно-генетических факторов риска в зависимости от полиморфных маркеров генов 677 С/Т MTHFR, 455 G/A FGB.
Способ оценки состоятельности русла оттока при бедренно-подколенном шунтировании в изолированный сегмент у больных с критической ишемией (RU 2545419). Способ основан на оценке состояния путей «оттока», т.е. состояния артериального русла берцового сегмента, в сочетании с оценкой степени ишемии конечности. Каждому показателю присваивается определенный балл и затем по балльной шкале определяется качество берцового сегмента, по которому можно прогнозировать срок службы шунта. Недостатком способа является отсутствие учета данных о системе гемостаза, в том числе молекулярно-генетических, которые не в меньшей мере влияют на сроки развития тромбоза зоны реконструкции.
За прототип способ диагностики наследственной предрасположенности к тромбофилий по патенту РФ №2352641 (опубликован 20.04.2009), сущность которого заключается в том, что у пациента берут пробу крови, производят выделение ДНК, амплификацию участков генов МТГФР человека, V фактора свертываемости крови (FV) и протромбина (FII) путем проведения полимеразной цепной реакции с использованием трех пар специально подобранных олигонуклеотидных праймеров, обработку амплификационных фрагментов эндонуклеазой рестрикции TaqI и определение размера полученных фрагментов с помощью электрофореза. При выявлении полиморфных замен С677→Т в гене МТГФР, G1691→А в гене FV и G20210→А в гене FII диагностируют наследственную предрасположенность к тромбофилии.
Недостатком способа является отсутствие ассоциации генетических вариантов генов наследственных тромбофилий с клинико-лабораторными показателями. Изолированное выявление факта наличия наследственной тромбофилий не позволяет создать модель прогнозирования рисков развития тромбоза зоны реконструкции в послеоперационном периоде.
Задачей настоящего исследования является расширение способов диагностики, а именно создание способа прогнозирования развития тромбоза зоны реконструкции после реконструктивных операций на брюшной аорте и артериях нижних конечностей в первые 6 месяцев после оперативного вмешательства на основе данных о генетическом полиморфизме генов 677 С/Т MTHFR, 455 G/A FGB в сочетании с другими клинико-лабораторными показателями.
Технический результат использования изобретения - получение критериев оценки риска развития тромбоза зоны реконструкции после реконструктивных операций на брюшной аорте и артериях нижних конечностей жителей Центрального Черноземья России русской национальности для формирования группы с повышенным риском развития данной патологии.
В соответствии с поставленной задачей был разработан способ прогнозирования риска развития тромбоза зоны реконструкции после реконструктивных операций на брюшной аорте и артериях нижних конечностей, включающий:
- забор крови у пациента;
- выделение ДНК из периферической венозной крови;
- анализ полиморфизмов генов 677 С/Т MTHFR, 455 G/A FGB;
- определение уровня других клинико-лабораторных предикторов тромбоза зоны реконструкции: Д-димер, гомоцистеин, количество тромбоцитов в крови, фибриноген, антитромбин III, липопротеиды низкой плотности (ЛПНП), липопротеиды высокой плотности (ЛПВП);
- определение y1 и y2 по формулам линейной дискриминантной функции (ЛДФ):
y1=-101,554+8,549х1+5,193х2+1,733х3+0,154х4+3,796х5+0,735х6++1,255х7+8,135х8;
y2=-71,4118+6,1074х1+1,6767х2+1,0168х3+0,1197х4+2,8396х5+0,6612х6++2,4880x7+6,1074х8,
где x1 - генетический полиморфизм 455 G/A FGB, 677 С/Т MTHFR (1 - комбинация аллелей 455 A FGB и 677 Т MTHFR, 2 - другие комбинации генетических вариантов по локусам 455 G/A FG и 677 С/Т MTHFR), х2 - уровень Д-димера в крови (мкг/мл), х3 - уровень гомоцистеина в крови (мкмоль/л), х4 - количество тромбоцитов в крови (×109/л), х5 - уровень фибриногена в крови (г/л), x6 - уровень антитромбина III в крови (%), х7 - уровень ЛПНП в крови (ммоль/л), х8 - уровень ЛПВП в крови (ммоль/л);
- прогнозирование риска формирования тромбоза зоны реконструкции в случае, если y1 больше y2.
Новизна и изобретательский уровень заключаются в том, что из уровня техники не известна возможность прогноза риска развития тромбоза зоны реконструкции после реконструктивных операций на брюшной аорте и артериях нижних конечностей по данным о генетических вариантах 677 С/Т MTHFR, 455 G/A FGB в сочетании с другими факторами риска.
Способ осуществляют следующим образом.
Производят забор крови у пациента. ДНК выделяют из образцов периферической венозной крови индивидуумов в 2 этапа. На первом этапе к 4 мл крови добавляют 25 мл лизирующего буфера, содержащего 320 мМ сахарозы, 1% тритон Х-100, 5 мМ MgCl2, 10 мМ трис-HCl (рН=7,6). Полученную смесь перемешивают и центрифугируют при 4°С, 4000 об./мин в течение 20 минут. После центрифугирования надосадочную жидкость сливают, к осадку добавляют 4 мл раствора, содержащего 25 мМ ЭДТА (рН=8,0) и 75 мМ NaCl, ресуспензируют. Затем прибавляют 0,4 мл 10% SDS, 35 мкл протеиназы К (10 мг/мл) и инкубируют образец при 37°С в течение 16 часов.
На втором этапе из полученного лизата последовательно проводят экстракцию ДНК равными объемами фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием при 4000 об./мин в течение 10 минут. После каждого центрифугирования производят отбор водной фазы. ДНК осаждают из раствора двумя объемами охлажденного 96% этанола. Сформированную ДНК растворяют в бидистиллированной, деионизованной воде и хранят при -20°С. Выделенную ДНК затем подвергают полимеразной цепной реакции.
Анализ полиморфизмов генов 677 С/Т MTHFR, 455 G/A FGB проводят методом полимеразной цепной реакции синтеза ДНК на амплификаторе IQ5 (Bio-Rad) в режиме real time с использованием ДНК-полимеразы Thermus aquaticus производства фирмы «Силекс-М» и олигонуклеотидных праймеров и зондов, синтезированных фирмой «Синтол» с последующим анализом полиморфизмов методом дискриминации аллелей. Для дискриминации аллелей используют программу Bio-Rad «IQ5-Standart Edition». Генотипирование осуществляют методом TagMan зондов по данным величин уровня относительной флуоресценции (УОФ) каждого зонда.
Изобретение охарактеризовано на фиг. 1, где представлена дискриминация аллелей по локусу -455 G/A FGB (где - гомозиготы -455GG FGB, - гомозиготы -455АА FGB, - гетерозиготы -455GA FGB, - неопределенный или отрицательный контроль.
Две полосы, вертикальная и горизонтальная, делят график на Фиг. 1 на четыре секции: одна для каждого гомозиготного состояния, одна для гетерозиготного состояния и секция без реакции. Присвоение генотипов неизвестным образцам определяется вычерчиванием УОФ для одного флуорофора на оси х относительно УОФ для другого флуорофора на оси у на диаграмме дискриминации аллелей. Зонд с флуоресцентным красителем ROX соответствует аллелю А, зонд с красителем FAM - аллелю G.
- Если значения УОФ неизвестного образца находятся выше горизонтальной полосы и правее вертикальной полосы, генотип гетерозиготен (GA).
- Если значения УОФ неизвестного образца находятся выше горизонтальной полосы и левее вертикальной полосы, генотип гомозиготен по аллелю А (УОФ аллеля А отложены по оси y).
- Если значения УОФ неизвестного образца находятся ниже горизонтальной полосы и правее вертикальной, генотип гомозиготен по аллелю G (УОФ аллеля А отложены по оси x).
- Если значения УОФ неизвестного образца находятся ниже горизонтальной полосы и левее вертикальной, определение генотипа невозможно: в данном случае неопределенный образец - отрицательный контроль.
На Фиг. 2 представлена дискриминация аллелей по локусу 677 СТ гена MTHFR (где - гомозиготы 677Т гена MTHFR, - гомозиготы 677С гена MTHFR, - гетерозиготы 677С/Т гена MTHFR, - неопределенный или отрицательный контроль).
Возможность использования предложенного способа для оценки риска развития тромбоза зоны реконструкции после реконструктивных операций на брюшной аорте и артериях нижних конечностей подтверждает анализ результатов наблюдений 84 пациентов после реконструктивных операций на брюшной аорте и артериях нижних конечностей (44 случаев тромбоза зоны реконструкции, 40 без тромботических осложнений) и 35 человек контрольной группы.
Критерии включения в исследуемые выборки:
1. Индивидуумы мужского пола, русской национальности, являющиеся уроженцами Центрального Черноземья РФ и не имеющие родства между собой.
2. Добровольное согласие пациентов на проведение исследования.
3. В группу больных включались индивидуумы с впервые установленным или подтвержденным диагнозом: облитерирующий атеросклероз артерий нижних конечностей со степенью хронической артериальной недостаточности нижних конечностей II Б - III степенью по классификации Фонтейна - Покровского [Покровский А.В., 2004], перенесшие операцию прямой реваскуляризации брюшной аорты и артерий нижних конечностей.
Диагностика осуществлялась на основании результатов общепринятых стандартов обследования больных с облитерирующими заболеваниями аорты и периферических артерий, представленные в Российском консенсусе «Рекомендуемые стандарты для оценки результатов лечения пациентов с хронической ишемией нижних конечностей» (2005 г.).
4. В контрольную группу включались индивидуумы мужского пола, не имеющие сопутствующих инфекционных или воспалительных заболеваний (в том числе брюшной аорты и магистральных артерий).
Критерии исключения из исследуемых выборок:
1. Пациенты женского пола.
2. Больные, имеющие сопутствующие инфекционные или воспалительные заболевания (в том числе брюшной аорты и магистральных артерий).
3. Наличие онкологических заболеваний на момент исследования или в анамнезе.
4. Наличие клинических или лабораторных признаков тромбофилий.
Клиническое и лабораторное обследование индивидуумов проводилось на базе отделения сосудистой хирургии ОГБУЗ Белгородской областной клинической больницы Святителя Иоасафа. Типирование молекулярно-генетических маркеров осуществлялось в лаборатории «Молекулярной генетики человека» медицинского института Белгородского государственного национального исследовательского университета. Формирование базы данных и статистические расчеты осуществлялись с использованием программы «STATISTICA 6.0».
Прогнозирование риска развития тромбоза зоны реконстукции после реконструктивных операций на брюшной аорте и артериях нижних конечностей осуществлялось с использованием дискриминантного анализа [Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA [Текст] / О.Ю. Реброва. - [3-е изд.]. - Москва: Медиа Сфера, 2006. - 305 с.: ил.; Боровиков В.П. Statistical искусство анализа данных на компьютере [Текст] / В.П. Боровиков. - 2-е изд. - Санкт-Петербург: Питер, 2003. - 688 с.]. Анализировались результаты молекулярно-генетического обследования, анамнестические данные, клинико-лабораторные показатели, позволяющие дискриминировать индивидуумов на две группы: с высоким риском развития тромбоза зоны реконструкции и низким риском развития тромбоза зоны реконструкции. Уравнение линейной дискриминантной функции (ЛДФ) имеет следующий вид [Реброва О.Ю., 2006]:
y=a1x1+a2x2+a3x3+…+anxn+С,
где xi - информативные признаки, ai - коэффициенты для данных признаков, С - константа.
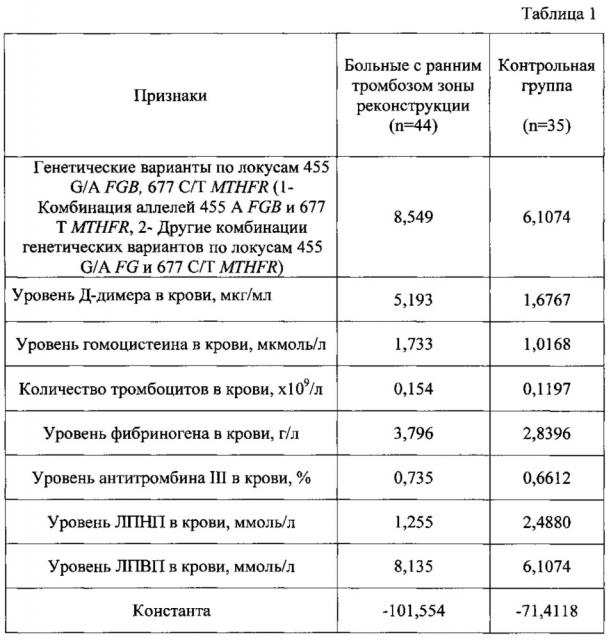
Коэффициенты в уравнениях линейных дискриминантных функций для индивидуумов с высоким риском развития тромбоза зоны реконструкции и низким риском развития тромбоза зоны реконструкции включают следующие генетические и клинико-лабораторные показатели: генетические варианты по локусам 455 G/A FGB и 677 С/Т MTHFR, уровень Д-димера, гомоцистеина в крови, количество тромбцитов в крови, уровень фибриногена, антитромбина III, ЛПНП и ЛПВП в крови.
Следовательно, после подстановки соответствующих коэффициентов аi, приведенных в таблице 1, в уравнение линейных дискриминантных функций получают две дискриминантные функции:
y1=-101,554+8,549x1+5,193x2+1,733x3+0,154x4+3,796x5+0,735x6++1,255х7+8,135х8;
y2=-71,4118+6,1074x1+1,6767х2+1,0168х3+0,1197x4+2,8396х5+0,6612х6++2,4880x7+6,1074х8,
где:
x1 - генетический полиморфизм 455 G/A FGB, 677 С/Т MTHFR (1 - комбинация аллелей 455 A FGB и 677 Т MTHFR, 2 - другие комбинации генетических вариантов по локусам 455 G/A FG и 677 С/Т MTHFR);
x2 - уровень Д-димера в крови (мкг/мл);
x3 - уровень гомоцистеина в крови (мкмоль/л);
x4 - количество тромбоцитов в крови (×109/л);
x5 - уровень фибриногена в крови (г/л);
x6 - уровень антитромбина III в крови (%);
х7 - уровень ЛПНП в крови (ммоль/л);
x8 - уровень ЛПВП в крови (ммоль/л).
Значения коэффициентов ai для информативных признаков xi в уравнениях линейных дискриминантных функций.
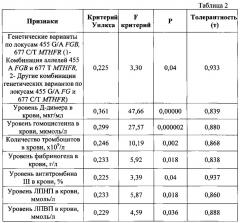
Выявленные нами показатели при дискриминантном анализе дали значение критерия Уилкса 0,21489, при F (8,70)=31,969 и р<0,0000. Эти данные позволяют заключить, что две рассматриваемые группы индивидов (с развитием раннего тромбоза в зоне реконструкции и контрольная группа) по набору из восьми изученных параметров демонстрируют неслучайную межгрупповую вариацию. Значения критериев Уилкса, F-критериев, вероятности Р, а также показателей толерантности для каждого из выявленных в дискриминантном анализе показателей представлены в таблице 2. Анализ F-критериев и показателей вероятности статистической ошибки 1-го рода (р) по отдельным показателям свидетельствует о том, что по всем изученным параметрам р<0,05, и это позволяет их использовать при дискриминантном анализе. Значения толерантности по рассматриваемым показателям (Т=0,84-0,94) существенно выше критического уровня Т<0,10 [Дерябин, 2001], что исключает мультиколлениарность данных признаков, т.е. отсутствуют высокие взаимные корреляции этих признаков, наличие которых снижает точность оценок. Точность распознания индивидов, относящихся к группе больных с ранним тромбозом зоны реконструкции, составляет 95,46%, а в контрольной группе - 100%. В среднем процент правильных дискриминаций в группу больных с ранним тромбозом зоны реконструкции после операции на брюшной аорте и артериях нижних конечностей и в контрольную группу на основе данных о генетических вариантах по локусам 455 G/A FGB, 677 С/Т MTHFR и клинико-лабораторных показателях (уровень Д-димера, гомоцистеина в крови, количество тромбцитов в крови, уровень фибриногена, антитромбина III, ЛПНП и ЛПВП в крови) составляет 97,47%.
Значения критериев отбора для признаков, включенных в дискриминантный анализ.
В вышеуказанные уравнения ЛДФ подставляют значения соответствующих показателей у конкретного индивидуума и рассчитывают значения y1 и y2. Установлено, что в случае, когда y1 больше y2, индивидуума следует отнести в группу пациентов с высоким риском развития тромбоза зоны реконструкции, а в случае, когда y2 больше y1, можно прогнозировать низкий риск развития тромбоза зоны реконструкции [Боровиков, 2001].
С целью проверки работоспособности заявленного технического решения в анализ были включены дополнительно еще два пациента.
У больного И. по данным молекулярно-генетического обследования выявлены генотипы 455GA FGB и 677 СТ MTHFR (2), при лабораторном исследовании во время подготовки к реконструктивной операции на артериях нижних конечностей выявлены следующие показатели: уровень Д-димера в крови - 2,3 мкг/мл; уровень гомоцистеина в крови - 16,2 мкмоль/л; количество тромбоцитов в крови - 315×109/л; уровень фибриногена в крови - 4,7 г/л; уровень антитромбина III в крови - 101,3%; уровень ЛПНП в крови - 2,9 ммоль/л; уровень ЛПВП в крови - 0,95 ммоль/л. Подставляем эти значения признаков в два вышеуказанных уравнения ЛДФ и находим в каждом уравнении новый признак y.
y1 для больных с ранним тромбозом зоны реконструкции после операции на брюшной аорте и артериях нижних конечностей
y1=-101,554+8,549х1+5,193х2+1,733х3+0,154х4+3,796х5+0,735х6++1,255x7+8,135х8=-101,554+8,549×2+5,193×2,3+1,733×16,2+0,154×315++3,796×4,7+0,735×101,3+1,255×2,9+8,135×0,95=107,737
y2 для контрольной группы=-71,4118+6,1074х1+1,6767х2++1,0168х3+0,1197х4+2,8396х5+0,6612х6++2,4880х7++6,1074х8=-71,4118++6,1074×2+1,6767×2,3+1,0168×16,2+0,1197×315+2,8396×4,7+0,6612×101,3++2,4880×2,9+6,1074×0,95=92,18
Поскольку у данного пациента значение y1 превышает значение y2, это позволяет отнести данного пациента в группу с высоким риском раннего тромбоза зоны реконструкции. Дальнейшее амбулаторное наблюдение за больным выявило развитие тромбоза в зоне пластики бедренной артерии через 3 месяца после операции.
У больного Д. по данным молекулярно-генетического обследования выявлены генотипы 455GG FGB и 677 СС MTHFR (1), при лабораторном исследовании во время подготовки к реконструктивной операции на артериях нижних конечностей выявлены следующие показатели: уровень Д-димера в крови - 0,35 мкг/мл; уровень гомоцистеина в крови - 9,7 мкмоль/л; количество тромбоцитов в крови - 202×109/л; уровень фибриногена в крови - 3,84 г/л; уровень антитромбина III в крови - 107%; уровень ЛПНП в крови - 2,27 ммоль/л; уровень ЛПВП в крови - 1,15 ммоль/л. Подставляем эти значения признаков в два вышеуказанных уравнения ЛДФ и находим в каждом уравнении новый признак y.
y для больных с ранним тромбозом зоны реконструкции после операции на брюшной аорте и артериях нижних конечностей
y1=-101,554+8,549x1+5,193х2+1,733х3+0,154х4+3,796х5+0,735х6+1,255х7++8,135х8=-101,554+8,549×1+5,193×0,35+1,733×9,7+0,154×202++3,796×3,84+0,735×107+1,255×2,27+8,135×1,15=62,16
y2 для контрольной группы = -71,4118+6,1074x1+1,6767x2++1,0168х3+0,1197х4+2,8396х5+0,6612х6++2,4880х7++6,1074х8=-71,4118++6,1074×1+1,6767×0,35+1,0168×9,7+0,1197×202+2,8396×3,84+0,6612×107++2,4880×2,27+6,1074×1,15=63,65
Так как у данного пациента значение y2 превышает значение y2, это позволяет отнести данного пациента в группу с низким риском развития раннего тромбоза зоны реконструкции. Дальнейшее наблюдение за пациентом в течении 6 месяцев не выявило тромботической окклюзии бедренно-подколенного шунта.
Предложенный способ прогнозирования риска развития тромбоза зоны реконструкции в первые 6 месяцев после операции на брюшной аорте и артериях нижних конечностей позволяет формировать среди пациентов группы риска по развитию данного осложнения, что будет способствовать более эффективной реализации лечебно-профилактических мероприятий по предупреждению развития тромбоза зоны реконструкции и его раннему выявлению с целью своевременного начала лечения и предупреждения прогрессирования заболевания.
Способ прогнозирования риска развития раннего тромбоза зоны реконструкции после реконструктивных операций на брюшной аорте и артериях нижних конечностей, включающий забор крови у пациента, отличающийся тем, что выделяют ДНК из периферической венозной крови, проводят анализ полиморфизмов генов 677 С/Т MTHFR, 455 G/A FGB, определяют уровень других клинико-лабораторных предикторов тромбоза зоны реконструкции, определяют значения y1 и y2 по формулам линейной дискриминантной функции:
y1 = -101,554 + 8,549х1 + 5,193х2 + 1,733х3 + 0,154х4 + 3,796х5 + 0,735х6 + 1,255х7 + 8,135х8;
y2 = -71,4118 + 6,1074x1 + 1,6767x2 + 1,0168x3 + 0,1197х4 + 2,8396х5 + 0,6612х6 + 2,4880x7 + 6,1074х8,
где х1 - генетический полиморфизм 455 G/A FGB, 677 С/Т MTHFR (1 - комбинация аллелей 455 A FGB и 677 Т MTHFR, 2 - другие комбинации генетических вариантов по локусам 455 G/A FG и 677 С/Т MTHFR), х2 - уровень Д-димера в крови (мкг/мл), х3 - уровень гомоцистеина в крови (мкмоль/л), х4 - количество тромбоцитов в крови (х 109/л), х5 - уровень фибриногена в крови (г/л), х6 - уровень антитромбина III в крови (%), х7 - уровень ЛПНП в крови (ммоль/л), х8 - уровень ЛПВП в крови (ммоль/л), и прогнозируют риск формирования тромбоза зоны реконструкции в случае, если y1 больше y2.