Адамантиламиды серосодержащих кислот и их противогриппозная активность
Иллюстрации
Показать всеИзобретение относится к новым синтетическим соединениям, а именно 1-(1-адамантил)этиламиду-3-(2-тиэнил)-пропеновой кислоты (TEPr-Rem), 1-адамантаиламиду-3-(2-тиэнил)-пропеновой кислоты (TEPr-Amt) и 1-(1-адамантил)этиламиду-4-(2-тиэнил)-бутановой кислоты (TEBu-Rem):
Предложенные соединения: TEPr-Rem, TEPr-Amt и TEBu-Rem ингибируют репродукцию патогенных штаммов вируса гриппа A/H1N1pdm2009 и A/H5N1, также обладают вирулицидным действием по отношению к вирусным частицам гриппа A/H5N1. 2 н. и 1 з.п. ф-лы., 6 пр., 8 ил.
Реферат
Изобретение относится к новым биологически активным сульфоциклическим производным 1-(1-адамантил)этиламина (ремантадина) и может найти применение в фармакологии и вирусологии.
Инфекции сезонного гриппа А, а также возникновение опасных для жизни штаммов гриппа являются серьезной проблемой здравоохранения во всем мире. Каждый год эпидемии гриппа становятся причиной многих смертей и миллионов госпитализаций [1, 2]. Кроме ежегодных эпидемических вспышек, вирус гриппа представляет собой угрозу как патогенный микроорганизм из-за его способности вызывать пандемии, как это произошло в 2009 году с появлением и всемирным распространением пандемического гриппа H1N1. Существующие профилактические вакцины не достаточно эффективны против новых штаммов гриппа А и, таким образом, эффективная противовирусная терапия является важным компонентом в борьбе против инфекций, вызванных вирусом гриппа А.
В настоящее время существует только четыре противовирусных препарата, одобренных для использования против гриппозной инфекций в организме человека: два ингибитора протонного канала М2, амантадин и ремантадин, и два ингибитора нейраминидазы, занамивир (Relenza™), и озельтамивир (Tamiflu™)
Возникшая лекарственная устойчивость к обоим классам ингибиторов является большой проблемой здравоохранения. Устойчивость к действию препаратов класса адамантана сейчас настолько широка, что центры по контролю и профилактике заболеваний выступили против продолжения их использования [2, 3]. С 2007-2008 годов все чаще сообщается о широком распространении лекарственной устойчивости к озельтамивиру [4-8]. Более того, есть сообщения о появлении штаммов гриппа с двойной устойчивостью к обоим классам противовирусных препаратов [9].
Устойчивость к препаратам-ингибиторам функции протонного канала М2 связана с мутациями в гене трансмембранного домена белка М2. Гомотетрамерная структура канала М2 накладывает ограничения на виды лекарственно-устойчивых мутаций, которые могут быть приемлемы для жизнеспособного вириона. Точечная мутация в последовательности белка М2 в результате приводит к четырем аминокислотным заменам остатков, выстилающих пору канала, где происходит связывание с препаратом. Хотя многие мутации могут не влиять на функциональность канала in vitro [10-12], но у диких штаммов встречаются только несколько мутаций, свободно переносящихся в высоко трансмиссивных вирусах. Мутации V27A, L26F и S31N неизменно составляли более 99% передаваемых М2 мутантов, среди которых S31N является сейчас преобладающей в 98-100% из передающихся амантадин-устойчивых штаммов гриппа A/H1N1, A/H5N1 и A/H3N2, выделенных от людей, птиц и свиней в последнее десятилетие [1].
В результате, существует настоятельная необходимость разработки второго поколения ингибиторов функции канала М2, нацеленных на наиболее распространенную мутацию S31N. Однако эта мутация представляет значительные трудности для поиска новых соединений, потому что боковые цепи остатка аспарагина (Asn31) частично заполняют сайт связывания с амантадином и также остаток аспарагина заметно отличается по своим химико-физическим свойствам от остатка серина (Ser31).
Ингибиторы функции белка М2, как правило, состоят из гидрофобной части молекулы (в препаратах амантадин и ремантадин - адамантан), соединенной с полярной функциональной группой, которая, как правило, положительно заряжена, в амантадине или римантадине заместитель представлен амино- или этиламиногруппой, Адамантильный остаток может быть заменен на другие гидрофобные группы, в том числе сопряженные и спиро-сопряженные мультициклические алканы, разветвленные ациклические алканы и силаны [13, 14]. Эти соединения показали отличную активность в отношении дикого типа, а некоторые были весьма активны в отношении мутантов V27A и L26F [14, 15]. Однако ни одно из этих производных не показало значительно большей противовирусной активности в отношении мутанта S31N, чем это было продемонстрировано для амантадина. Подбор полярных групп также был предметом широких структурных поисков методом компьютерного моделирования (SAR). Но и в этом случае активность примененных заместителей была терпима в экспериментах в отношении дикого типа, но не превосходила активность амантадина в отношении мутанта S31N. Таким образом, после нескольких десятилетий исследований в медицинской химии не было достигнуто никакого прогресса в направлении ингибирования этой доминирующей мутантной формы, предполагая, что S31N вариант мутации может быть малодоступен в качестве мишени для противовирусных препаратов [16-20], однако сам тетрамер М2 многие ученые до сих пор рассматривают как «ахиллесову пяту» вируса гриппа А.
Для преодоления трудностей, связанных с химико-физическими особенностями боковой цепи остатка аспарагина (Asn31), нужно было сменить полярность вводимой функциональной группы. Т.к. остаток аспарагина имеет карбоксамидную группу в отличии гидроксильной группы серина, то необходимости в амино-фукциональной группе уже не было. Аминогруппу заменили на тиофеновую, а в качестве спейсера к карбоциклу адамантана использовали карбоновые кислоты. Замена амина на тиофен позволила ввести π-избыточную гетероароматическую систему, обладающую выраженными ароматическими свойствами, для образования водородных связей внутри поры канала М2.
В конструкции молекул предлагаемых соединений в качестве гидрофобной части был использован римантадин (1-(1-адамантил)этиламин), а в качестве функциональной группы были выбраны тиофенкарбоновые кислоты: 3-(2-тиэнил)-пропеновая кислота и 4-(2-тиэнил)-бутановая кислота.
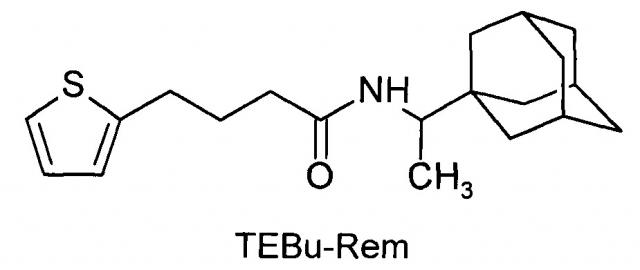
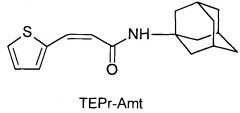
Сущность изобретения заключается в создании новых синтетических соединений, являющихся производными 1-(1-адамантил)этиламина, а именно 3-(2-тиэнил)-пропенил-1-адамантаилэтиламин (TEPr-Rem) и 4-(2-тиэнил)-бутил-1-адамантаилэтиламин (ТЕВu-Rem) и 1-аминоадамантана, а именно 3-(2-тиэнил)-пропенил-1-адамантаиламид (ТЕРr-Amt), которые ингибируют репродукцию патогенных штаммов вируса гриппа A/H1N1pdm2009 и A/H5N1, резистентных к действию ремантадина, а также обладающие вирулицидным действием по отношению к штамму вируса гриппа A/H5N1. Более того, соединения обладают меньшим токсическим эффектом на монослой клеток MDCK и Vero-E6, чем ремантадин. Соединения TEPr-Rem, TEPr-Amt и TEBu-Rem имеют следующие структурные формулы:
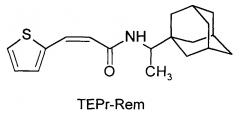
N-[3-(2-тиэнил)-пропенил]-1-адамантаилэтиламин (TEPr-Rem),
N-[3-(2-тиэнил)-пропенил]-1-адамантиламин (TEPr-Amt),
N-[4-(2-тиэнил)-бутил]-1-адамантаилэтиламин (TEBu-Rem).
Технический результат - синтезированы новые соединения, малотоксичные, обладающие противогриппозной, в том числе вирулицидной, активностью и действующие на штаммы вируса гриппа А, резистентные к действию препаратов ремантадина и амантадина.
Краткое описание чертежей.
Для более ясного понимания сути заявленного изобретения, которое отражено в формуле изобретения, а также для демонстрации ее особенностей и преимуществ далее приводится подробное описание со ссылками на фигуры чертежей.
На фиг. 1 представлена схема синтеза соединения TEPr-Rem методом смешанных ангидридов.
На фиг. 2а представлены спектральные данные соединения TEPr-Rem.
На фиг. 2б представлены спектральные данные соединения TEPr-Amt.
На фиг. 3 представлены спектральные данные соединения TEBu-Rem.
На фиг. 4 представлены в виде таблицы 1 данные влияния различных концентраций соединений TEPr-Rem, TEPr-Amt и TEBu-Rem на репродукцию пандемического штамма вируса гриппа А/Калифорния/07/2009(H1N1)pdm09 в культуре клеток Madin Darby Canine Kidney (MDCK) при добавлении вещества одномоментно с вирусом. Испытания противовирусной активности соединений TEPr-Rem и TEBu-Rem проведены в сравнении с ремантадином.
На фиг. 5 представлены в виде таблицы 2 данные противовирусных свойств соединений TEPr-Rem, TEPr-Amt и TEBu-Rem в отношении инфекции, вызванной высоко патогенным вирусом гриппа A/duck/Novosibirsk/56/05 (H5N1).
На фиг. 6 в виде таблицы 3 представлены данные цитотоксического действия на культуры клеток MDCK и Vero-E6.
На фиг. 7 представлены в виде таблицы 4 данные вирулицидной активности синтезированных соединений в отношении высокопатогенного вируса гриппа A/duck/Novosibirsk/56/05 (H5N1).
Для получения соединений TEPr-Rem, TEPr-Amt и TEBu-Rem могут быть использованы различные подходы. Один из способов получения соединений TEPr-Rem, TEPr-Amt и TEBu-Rem - метод смешанных ангидридов (Фиг. 1). Однако предложенный метод синтеза не должен рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
Образование пептидной связи между римантадином/амантадином гидрохлоридом, содержащим аминогруппу, и тиофенкарбоновыми кислотами проводили в одну стадию в эквимолярном соотношении.
При синтезе соединений использовали рацемический римантадин гидрохлорид фирмы Zhejiang Kangyu Pharmaceutical Со (Китай), рацемический амантадин гидрохлорид фирмы Sigma-Aldrich (США), тиофенкарбоновые кислоты фирмы Sigma-Aldrich (США). Использовали изо-бутилхлорформиат (IBCF) фирмы «Fluka» (Швейцария), N-метилморфолин (NMM) фирмы Sigma-Aldrich (США). Все используемые для конденсации и удаления защитных групп растворители предварительно абсолютировали и перегоняли по стандартным методикам. Идентификация полученных соединений осуществлялась с помощью ТСХ на пластинах Silufol (Чехия) в системах: метанол - хлороформ, 13:60 (А), втор-бутанол - 3%-ный аммиак, 100:44 (В), н-бутанол - уксусная кислота - вода - пиридин, 30:3:12:10 (С), позволяющих констатировать полное отсутствие в испытуемых образцах следов ремантадина. Молекулярный вес был установлен на MALDI-TOF-времяпролетном масс-спектрометре Bruker UltraFlex II с программным обеспечением для сбора и обработки масс-спектров flexControl 1.1. и flexAnalys 2.2. Инфракрасные спектры были получены на ИК Фурье спектрометре ИнфраЛЮМ ФТ-10. Температуру плавления полученных соединений измеряли на цифровом приборе для определения точки плавления SMP20 Stuart Scientific.
Настоящее изобретение проиллюстрировано нижеследующими примерами. Однако эти примеры не должны рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
Пример 1. Синтез TEPr-Rem (3-{2-тиэнил)-пропенил-1-адамантаилэтиламин) и его выделение (см. фиг. 1)
TEPr-ОН (3-(2-тиэнил)-пропеновая кислота) была получен от фирмы Sigma-Aldrich (США). Чистота ≥98.0%, температура плавления 145-148°C. Коммерческая ТЕРr-ОН была использована в синтезе конечного соединения.
В трехгорлую колбу, снабженную механической мешалкой, термометром и хлоркалыдевой трубкой, вносят 1,0 г (6,48 мМ) 3-(2-тиэнил)-пропеновой кислоты в смеси 10,0 мл. CHCl3 с 10,0 мл тетрагидрофурана и прибавляют 0,71 мл (6,48 мМ) N-метилморфолина (NMM). Охлаждают до -25°С и при перемешивании в реакционную массу добавляют 0,84 мл (6,48 мМ) изо-бутилхлорформиата (IBCF). Перемешивают 10 мин. Затем добавляют, заранее приготовленный и охлажденный до - 20°С, раствор 1,4 г (6,48 мМ) хлоргидрата 1-(1-адамантаил)этиламина в 10,0 мл CHCl3 с 0,71 мл (6,48 мМ) NMM. Перемешивают - 30 мин при -15°С, затем еще 1 час при 0°С и 10 часов при комнатной температуре.
Растворители удаляют на роторном испарителе при 45°С и 15 мм рт.ст. Остаток растворяют в 35,0 мл этилацетата и 10,0 мл H2O. Раствор переносят в делительную воронку и последовательно промывают 0,5 н серной кислотой (4,0 мл × 1), 0,5 н KНСО3 (10,0 мл × 2), затем подкисляют 1н H2SO4 и промывают Н2O (5,0 мл × 1). Органический слой отделяют и сушат безводным Na2SO4. Этилацетат удаляют в вакууме, получают вспененное масло, которое через некоторое время твердеет.
Выход: 1,98 г. (97%), Rf=0,90(A); Rf=0,83(B); Rf=0,92(С).
Из данных ИК-спектра продукта реакции (TEPr-Rem) о присоединении молекулы 1-(1-адамантаил)этиламина к исходному соединению с замещением ОН- от карбонильной группы на амино-группу свидетельствует наличие в спектре одной полосы валентных колебаний ν(NH) при 3304 см-1 вместо двух полос, присутствующих в спектре исходного 1-(1-адамантаил)этиламина. В спектре продукта присутствует одна полоса ν(C=O) карбонильной группы при 1652 см-1 вместо двух полос, наблюдающихся в спектре исходной тиокислоты (ТЕРr-ОН).
Масс-спектр: найдено [М+Н]+: 316,17; Mr(C20H29NOS) 315,47 atomic unit (a.u.) (фиг. 2а).
Соединение TEPr-Amt (3-(2-тиэнил)-пропенил-1-адамантаиламид) было получено аналогичным образом с использованием в синтезе вместо римантадина гидрохлорида амантадин гидрохлорид.
Выход: 1,68 г. (90%), Rf=0,90(A); Rf=0,81(В); Rf=0,93(С).
ИК-спектр продукта реакции (TEPr-Amt), демонстрирует полосы валентных колебаний ν(NH) при 3304 см-1 вместо двух полос, присутствующих в спектре исходного 1-адамантиламина и одну полосу ν(C=O) карбонильной группы при 1652 см-1 вместо двух полос, наблюдающихся в спектре исходной тиокислоты (ТЕРr-ОН).
Масс-спектр: найдено [М+Н]+: 288,14; Mr(C17H21NOS) 287,42 a.u. (фиг. 2б).
Пример 2. Синтез TEBu-Rem (4-(2-тиэнил)-бутил-1-адамантаилэтиламин)и его выделение
TEBu-ОН (4-(2-тиэнил)-бутановая кислота) была получена от фирмы Sigma-Aldrich (США). Чистота ≥98.0%, показатель преломления света [n]D20=1,532, жидкость плотностью 1,169 г/мл. Коммерческая TEBu-ОН была использована в синтезе конечного соединения.
В трехгорлую колбу, снабженную механической мешалкой, термометром и хлоркальцевой трубкой, вносят 1,0 г (5,87 мМ) 4-(2-тиэнил)-бутановой кислоты (TEBu-ОН) в 15,0 мл тетрагидрофурана и прибавляют 0,64 мл (5,87 мМ) N-метилморфолина (NMM). Охлаждают до -25°С и при перемешивании в реакционную массу добавляют 0,76 мл (5,87 мМ) изо-бутилхлорформиата (IBCF). Перемешивают 10 мин. Затем добавляют, заранее приготовленный и охлажденный до -20°С, раствор 1,27 г (5,87 мМ) хлоргидрата 1-(1-адамантаил)этиламина в 10,0 мл CHCl3 с 0,64 мл (5,87 мМ) NMM. Перемешивают -30 мин при -15°С, затем еще 1 час при 0°С и 10 часов при комнатной температуре.
Растворители удаляют на роторном испарителе при 50°С и 15 мм рт.ст. Остаток растворяют в 35,0 мл этилацетата и 10,0 мл Н2O. Раствор переносят в делительную воронку и последовательно промывают, 0,5 н серной кислотой (4,0 мл × 1), 0,5 н KHCO3 (10,0 мл × 2), затем подкисляют 1н H2SO4 и промывают Н2O (5,0 мл × 1). Органический слой отделяют и сушат безводным Na2SO4. Этилацетат удаляют в вакууме, получают вязкое масло, которое при промывке диэтиловым эфиром твердеет.
Выход: 1,71 г. (87%), аморфный, Rf 0,95(А); Rf0,93(B); Rf 0,90(С).
В ИК-спектре о протекании реакции между TEBu-ОН и 1-(1-адамантаил)этиламина свидетельствует наличие в спектре продукта интенсивной полосы ν(NH) при 3332 см-1 вместо двух полос, присутствующих в спектре исходного 1-(1-адамантаил)этиламина. Полоса валентных колебаний ν(C=O), характерная для карбонильной группы, проявляется при 1638 см-1.
Масс-спектр: найдено [М+Н]+: 332,20; Mr(C20H29NOS) 331,51 a.u. (фиг. 3).
Пример 3. Определение противовирусной активности синтетических соединений в отношении вируса гриппа А/-Калифорния/07/2009(H1N1)pdm09
Изучение противовирусной активности синтетических соединений проводили на 96-луночных панелях со сформировавшимся монослоем клеток культуры ткани MDCK. Одномоментно с инфицированием в монослой клеток вносили римантадина гидрохлорид,, в качестве референс-препарата, и изучаемые синтетические соединения в концентрациях 0,5, 1,0, 2,5, 5,0, 7,5 и 10,0 мкг/мл. Панели инкубировали 24 часа при 37°С, а затем останавливали реакцию фиксированием клеток 80% ацетоном на фосфатном буфере. Постановку метода клеточного иммуноферментного анализа (ИФА) проводили согласно методике, описанной ранее [21, 22]. Процент ингибирования вирусной активности соединениями определяли по формуле (1):
где ОПопыт - оптическая плотность опытной лунки (с веществом) при 492 н.м., ОП кл.к - ОП492 клеточного контроля, ОП вир.к. - ОП492 вирусного контроля.
Рассчитывали цитотоксическую дозу 50 (ЦД50), которая соответствовала минимальной концентрации соединений, приводящей к гибели 50% клеток монослоя к 72 часам. На фиг. 4 представлены средние значения результатов испытания противовирусной активности синтезированных соединений из параллельных опытов, проводимых в аналогичных условиях.
Результаты эксперимента показывают, что синтезированные соединения TEPr-Rem, TEPr-Amt и TEBu-Rem защищают клетки монослоя MDCK от цитопатического действия вируса. При использовании предлагаемых соединений отмечен выраженный эффект ингибирования репродукции штамма вируса гриппа А/-Калифорния/07/2009(H1N1)pdm09, устойчивого к действию ремантадина. Ингибирующая доза (ИД50) для соединения TEPr-Rem составила 7,0 мкг/мл, а для TEBu-Rem ИД50 составила 7,5 мкг/мл. Самое активное соединение - TEPr-Amt, ИД50 которого составила 3,4 мкг/мл. Отсутствие ингибирующего эффекта римантадина гидрохлорида, косвенно свидетельствует о резистентности данного штамма к препаратам ремантадин и амантадин.
Пример 4. Определение противовирусной активности синтетических соединений
Изучение противовирусной активности синтезированных соединений проводили на панелях со сформировавшимся монослоем клеток Vero-Е6 (перевиваемая линия почки африканской зеленой мартышки), инфицированных вирусом гриппа A/duck/Novosibirsk/56/05 (H5N1). Противовирусную активность проверяли в трех схемах введения соединений в культуру клеток: за 6 часов до заражения клеток, в момент заражения и через 6 часов после заражения культур клеток. Соединения вносили в концентрациях 50, 25, 12, 6, 3, 1,5, и 0,3 мкг/мл. В качестве контроля использовали инфицированную культуру клеток без добавления соединений (К.в.). Оценку цитотоксического действия определяли колориметрическим методом после инкубации клеток с синтезированными соединениями (TEPr-Rem, TEPr-Amt и TEBu-Rem) в течение 72 часов при 37°С.
Противовирусный эффект соединения оценивается по проценту жизнеспособных инфицированных клеток, путем сравнения интенсивности окрашивания раствора в контрольных и опытных лунках при добавлении нейтрального красного на автоматическом спектрофотометре при длине волны 450 нм. (Фиг. 5).
Из данных таблицы 2 (Фиг. 5) видно, что производное римантадина гидрохлорида с тиофенпропеновой кислотой (TEPr-Rem) эффективно во всех схемах внесения соединения: ИД50<0,3 мкг/мл, для схем до инфицирования и одномоментного введения и ИД50=6,0 мкг/мл для схемы введения через 6 часов после инфицирования. Соединение TEBu-Rem с тиофенбутановой кислотой также проявляло высокий эффект защиты клеток: при схеме внесения до инфицирования ИД50 составило 3,0 мкг/мл, а в схемах введения одномоментно с вирусом и через 6 часов после заражения ИД50=12,0 мкг/мл и менее 12 мкг/мл. Для соединения TEPr-Amt ИД50=1,56 мкг/мл, для схемы внесения до инфицирования, и в схемах введения одномоментно с вирусом и через 6 часов после заражения ИД50 составила менее 6,25 мкг/мл.
Пример 5. Исследование цитотоксического действия соединений in vitro
Использовали соединения TEPr-Rem, TEPr-Amt и TEBu-Rem. Оценку цитотоксического действия синтезированных соединений для клеток Vero-Е6 и MDCK проводили по стандартной методике. Клеточную суспензию в ростовой среде (концентрация клеток - 4*105 клеток в 1 мл) вносили в 96 - луночные пластиковые панели и через 24 часа после инкубации при 37°С монослой клеток дважды отмывали раствором Хенкса. Добавляли по 20,0 мкл соединений в различных концентрациях в среду поддержки, при этом общий объем жидкости в лунке составлял 200 мкл. Обработанные и необработанные таким образом культуры клеток инкубировали в течение 72 часов, после чего клетки, окрашенные метиленовым синим, подсчитывали, используя слайдный цитометр (Cauntess) фирмы Invitrogen (США). Рассчитывали цитотоксическую дозу 50 (ЦД50), которая соответствовала минимальной концентрации соединений, приводящей к гибели 50% клеток монослоя к 72 часам.
Оценку цитотоксического действия синтезированных соединений для клеток MDCK проводили по методике, описанной нами ранее [21]. Для соединений TEPr-Rem, и TEBu-Rem ЦД50 в культуре клеток Vero-E6 составила 6 мкг/мл, что значительно меньше, чем для клеточной культуры MDCK, для которой этот показатель составил 30 и более 40 мкг/мл соответственно. Соединение TEPr-Amt оказалось менее токсичным для обеих клеточных линий, так для клеток Vero-Е6 токсичность не обнаружена даже при 50 мкг/мл, а в культуре MDCK ЦД50 составила более 40 мкг/мл (фиг. 6).
Пример 6. Исследование вирулицидной активности соединений в отношении вируса гриппа A/duck/Novosibirsk/56/05 (H5N1)
Вирулицидная активность соединения связана с прямым инактивирующим действием на вирионы в составе вирусной популяции, в результате чего частично или полностью утрачивается инфекционная активность вируса. Чтобы проверить вирулицидные свойства соединения достаточно провести инкубацию смеси вируса и соединения в течение определенного времени, после чего проверить инфекционные свойства вируса без исследуемого соединения и вируса в смеси с веществом методом титрования в культурах клеток. Достоверное снижение инфекционной активности вируса на 1,0 и более логарифмов (lg) или ее полная утрата по сравнению с вирусом без вещества свидетельствует о проявлении вирулицидной активности исследуемого соединения. В опыте использованы концентрации соединений 10,0 мг/мл, которые смешивали с вирусом следующим образом: 200,0 мкл раствора соединения с добавлением 100,0 мкл вируссодержащего материала в исходной концентрации. Экспозиция с вируссодержащим материалом проведена при комнатной температуре в течение 20 минут, после чего титровали инфекционную активность вируса в каждом варианте опыта в культурах клеток Vero-Е6 при различных разведениях смеси соединений с вирусом степень деструкции оценивали под световым микроскопом по общепринятой четырехкрестовой системе соответственно количеству погибших клеток (фиг. 7). По разнице титров вируса в контрольных и опытных экспериментах судили о вирулицидной активности соединения - его способности подавлять инфекционную активность вируса гриппа A/duck/Novosibirsk/56/05 (H5N1). Вирулицидная активность синтетических соединений проиллюстрирована в таблице 4, из которой видно, что высокая вирулицидная активность отмечена для синтетических соединений TEPr-Rem и TEPr-Amt (фиг. 7). При контакте вируссодержащего материала с соединениями в течение 20 минут произошла полная утрата инфекционной активности вируса. Соединение TEBu-Rem обладает меньшей вирулицидной активностью, снижение инфекционного титра составило лишь 2,7 логарифма (100-1000 раз) по отношению к вирусному контролю (lgТЦИД50/0,2=7,7).
Таким образом, предложенные соединения: TEPr-Rem, TEPr-Amt и TEBu-Rem ингибируют репродукцию патогенных штаммов вируса гриппа A/H1N1pdm2009 и A/H5N1. Эти соединения также обладают вирулицидным действием по отношению к вирусным частицам гриппа A/H5N1, что доказывает прямое действие соединений на вирус, которое предположительно заключается в ингибиторование функции протонселективного канала М2 вируса гриппа А. Предлагаемые соединения можно рекомендовать для создания новых противовирусных препаратов, с использованием как в виде индивидуального средств, так и в составе композиций.
ЛИТЕРАТУРА
1. Bright, R.A.; Medina, M.J.; Xu, X.Y.; Perez-Oronoz, G.; Wallis, T.R.; Davis, X.H.M.; Povinelli, L.; Cox, N.J.; Klimov, A.I. Incidence of adamantane resistance among influenza A (H3N2) viruses isolated worldwide from 1994 to 2005: a cause for concern. Lancet 2005, v. 366, p. 1175-1181.
2. Bright, R.A.; Shay, D.K.; Shu, В.; Cox, N.J.; Klimov, A.I. Adamantane resistance among influenza A viruses isolated early during the 2005-2006 influenza season in the United States. JAMA 2006, v. 295, p. 891-894.
3. Cheng, P.K.; Leung, T.W.; Ho, E.C.; Leung, P.C.; Ng, A.Y.; Lai, M.Y.; Lim, W.W. Oseltamivirand amantadine-resistant influenza viruses A (H1N1). Emerg. Infect. Dis. 2009, v. l5, p. 966-968.
4. Sheu, T.G.; Deyde, V.M.; Okomo-Adhiambo M., e. a. Surveillance for neuraminidase inhibitor resistance among human influenza A and В viruses circulating worldwide from 2004 to 2008. Antimicrob. Agents Chemother. 2008, v. 52, p. 3284-3292.
5. Moscona, A. Global Transmission of Oseltamivir-Resistant Influenza. N. Engl. J. Med. 2009, v. 360, p. 953-956.
6. Moore, C.; Galiano, M.; Lackenby, A.; Abdelrahman, Т.; Barnes, R.; Evans, M.R.; Fegan, C.; Froude, S.; Hastings, M.; Knapper, S.; Litt, E.; Price, N.; Salmon, R.; Temple, M.; Davies, E. Evidence of person to person transmission of oseltamivir resistant pandemic influenza A(H1N1) 2009 virus in a hematology unit J. Infect. Dis. 2010, v. 203, p. 18-24.
7. Hayden, F.G.; deJong, M.D. Emerging Influenza Antiviral Resistance Threats. J. Infect. Dis. 2011, v. 203, p. 6-10.
8. Baz, M. Emergence of Oseltamivir-Resistant Pandemic H1N1 Virus during Prophylaxis N. Engl. J. Med. 2009, v. 361, p. 2296-2297.
9. Sheu, T.G.; Fry, A.M.; Garten, R.J.; Deyde, V.M.; Shwe, Т.; Bullion, L.; Peebles, P.J.; Li, Y.; Klimov, A.I.; Gubareva, L.V. Dual resistance to adamantanes and oseltamivir among seasonal influenza A(H1N1) viruses: 2008-2010. J. Infect. Dis. 2011, v. 203, p. 13-17.
10. Balannik, V.; Carnevale, V.; Fiorin, G.; Levine, B. G.; Lamb, R.A.; Klein, M.L.; DeGrado, W.F.; Pinto, L.H. Functional studies and modeling of pore-lining residue mutants of the influenza a virus M2 ion channel. Biochemistry 2010, v. 49, p. 696-708.
11. Hay, A.J.; Wolstenholme, A.J.; Skehel, J.J.; Smith, M.H. The Molecular-Basis of the Specific Anti-Influenza Action of Amantadine. Embo. J. 1985, v. 4, p. 3021-3024.
12. Grambas, S.; Hay, A.J. Maturation of influenza A virus hemagglutinin-Estimates of the pH encountered during transport and its regulation by the M2 protein. Virology 1992, v. 190, p. 11-18.
13. Hu, W.; Zeng, S.; Li, C.; Jie, Y.; Li, Z.; Chen, L. Identification of hits as matrix-2 protein inhibitors through the focused screening of a small primary amine library. J. Med. Chem. 2010, v. 53, p. 3831-3834.
14. Wang, J.; Ma, C.; Balannik, V.; Pinto, L.H.; Lamb, R.A.; Degrado, W.F. Exploring the Requirements for the Hydrophobic Scaffold and Polar Amine in inhibitors of M2 from Influenza A Virus. ACS Med. Chem. Lett. 2011, v. 2, p. 307-312.
15. Wang, J.; Ma, C.; Fiorin, G.; Carnevale, V.; Wang, Т.; Hu, F.; Lamb, R.A.; Pinto, L.H.; Hong, M.; Klein, M.L.; DeGrado, W.F. Molecular dynamics simulation directed rational design of inhibitors targeting drug-resistant mutants of influenza A virus M2. J. Am. Chem. Soc. 2011, v. 133, p. 12834-12841.
16. Kurtz, S.; Luo, G.; Hahnenberger, К.M.; Brooks, C.; Gecha, O.; Ingalls, K.; Numata, K.; Krystal, M. Growth impairment resulting from expression of influenza virus M2 protein in Saccharomyces cerevisiae: identification of a novel inhibitor of influenza virus. Antimicrob. Agents Chemother. 1995, v. 39, p. 2204-2209.
17. De Clercq, E. Antiviral agents active against influenza A viruses. Nat Rev Drug Discov 2006, v.5, 1015-1025.
18. Severson, W.E.; McDowell, M.; Ananthan, S.; Chung, D.H.; Rasmussen, L.; Sosa, M.I.; White, E.L.; Noah, J.; Jonsson, С.B. High-Throughput Screening of a 100,000 - Compound Library for Inhibitors of Influenza A Virus (H3N2). J. Biomol. Screen. 2008, v. 13, p. 879-887.
19. Lagoja, I.M.; De Clercq, E. Anti-influenza virus agents: Synthesis and mode of action. Med. Res. Rev. 2008, v. 28, p. 1-38.
20. Das, K., Antivirals Targeting Influenza A Virus. J. Med. Chem. 2012, 55, p. 6263-6277.
21. Бурцева Е.И., Шевченко E.C., Ленева И.А. и др. Чувствительность к ремантадину и арбидолу вирусов гриппа, вызвавших эпидемические подъемы заболеваемости в России в сезоне 2004-2005 гг. Вопр. вирусол. 2007, №2, с. 24-29.
22. Ленева И.А., Фадеева Н.И., Федякина И.Т. и др. Применение иммуноферментной индикации вирусспецифических антигенов в изучении нового противовирусного препарата. Хим. - фарм. журнал. 1994, №9, с. 4-15.
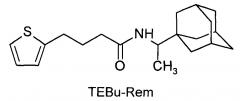
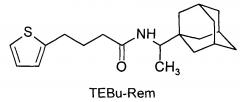
1. Соединение 1-(1-адамантил)этиламид-4-(2-тиэнил)-бутановой кислоты (TEBu-Rem):
2. Средство, обладающее противовирусной активностью в отношении вирусов гриппа А и действующие на штаммы, резистентные к действию ремантадина и амантадина, отличающееся тем, что в качестве действующего вещества используют соединения 1-(1-адамантил)этиламид-4-(2-тиэнил)-бутановой кислоты (TEBu-Rem)
1-(1-адамантил)этиламид-3-(2-тиэнил)-пропеновой кислоты
и 1-адамантаиламид-3-(2-тиэнил)-пропеновой кислоты
3. Средство по п. 2, обладающее вирулицидной активностью в отношении вирусов гриппа А.