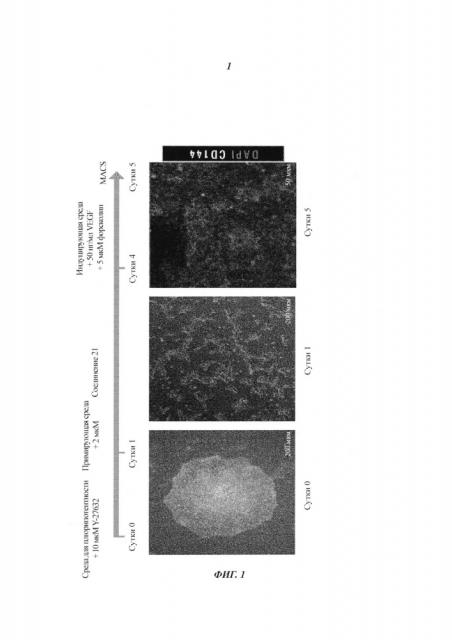
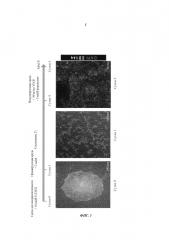
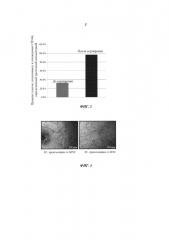
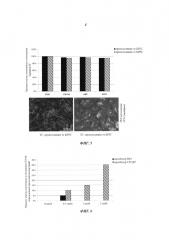
Способ дифференциации плюрипотентных стволовых клеток в клетки сосудистого русла
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ дифференциации плюрипотентных стволовых клеток (PSC) в клетки сосудистого русла. Берут плюрипотентные стволовые клетки и получают монослой плюрипотентных стволовых клеток в среде для плюрипотентности. Инкубируют указанные клетки в течение 2-4 суток в примирующей среде с добавлением низкомолекулярного соединения, которое активирует путь бета-катенина, и/или сигнальный путь Wnt, и/или сигнальный путь hedgehog (НН), выбранного из группы низкомолекулярных ингибиторов киназы 3 гликогенсинтазы (Gsk3a-b), низкомолекулярных ингибиторов CDC-подобной киназы 1 (Clk1-2-4), низкомолекулярных ингибиторов митогенактивируемой протеинкиназы 15 (Mapk15), низкомолекулярных ингибиторов киназы двойной специфичности, регулируемой фосфорилированием тирозина (Y) (Dyrk1a-b 4), низкомолекулярных ингибиторов циклин-зависимой киназы 16 (Pctk1-3 4), активаторов и модуляторов Smoothened (SMO) взаимодействия между β-катенином (или γ-катенином) и коактивирующими белками СВР (белок, связывающий CREB) и р300 (белок p300, связывающий Е1А). Индуцируют дифференциацию посредством инкубирования указанных примированных клеток в индуцирующей среде. Изобретение расширяет арсенал способов дифференциации клеток в клетки сосудистого русла. 17 з.п. ф-лы, 20 ил., 1 табл., 8 пр.
Реферат
Данная заявка относится к способу дифференциации плюрипотентных стволовых клеток (PSC) в клетки сосудистого русла (т.е. эндотелиальные клетки (EC) и/или гладкомышечные клетки сосудов (VSMC)). Кроме того, данная заявка относится к способу дифференциации человеческих эмбриональных стволовых клеток (ESC) и индуцированных плюрипотентных стволовых клеток (iPSC) в клетки сосудистого русла на основе связанных стадий индукции химически определенной средой.
Практически все ткани человеческого организма зависят от кровоснабжения. Эндотелиальные клетки образуют выстилки кровеносных сосудов и обеспечивают барьер между кровью и тканями, обладающий селективной проницаемостью. Кроме того, в стенках кровеносных сосудов находятся гладкомышечные клетки сосудов, играющие важную роль в контроле сужения кровеносных сосудов. Повреждение, активация или дисфункция эндотелиальных клеток являются важными характеристиками патофизиологии многих заболеваний.
Следовательно, понимание фундаментальных принципов биологии сосудов имеет крайнюю важность для открытия новых подходов для лечения многих пациентов. Например, пациенты, страдающие от диабета типа 2, имеют значительно большую частоту возникновения заболеваний коронарных артерий (CAD) и периферических сосудистых осложнений, подобных нефропатии и ретинопатии. Таким образом, сосудистые осложнения являются главной причиной значительно повышенных частот смертности и заболеваемости в данной популяции пациентов. Дисфункция эндотелиальных клеток в почке приводит к усиленному росту гладкомышечных клеток сосудов и мезангиальных клеток и к сужению сосудов, приводя к диффузному гломерулосклерозу и затем вызывая тяжелую почечную недостаточность. При диабетической ретинопатии гипергликемия индуцирует гибель гладкомышечных клеток сосудов, приводящую к повреждению и усиленному росту эндотелиальных клеток капилляров сетчатки, что вызывает патофизиологическую пролиферацию сетчатки, которая затем приводит к ухудшению или даже к полной потере зрения. Таким образом, существует потребность в специфичных для пациента моделях клеток сосудистого русла in vitro для исследования сосудистых осложнений и для идентификации подходящих новых мишеней и стратегий для лечения сосудистых осложнений у пациентов с диабетом типа 2.
Эндотелиальные клетки являются критически важными в ангиогенезе и образовании и развитии сосудов, например, в ответ на патологические состояния, такие как хроническая гипоксия или ишемия ткани. Факторы роста, такие как фактор роста эндотелия сосудов (VEGF), могут активировать эндотелиальный каскад сигнализации, приводя к пролиферации клеток и образованию новых трубок. Эндотелиальные клетки-предшественники (EPC) с недавних пор находятся в центре внимания в качестве потенциального терапевтического лечения в регенеративной медицине сосудов: эффективную неоваскуляризацию, индуцированную трансплантацией EPC, для задних конечностей, миокарда и ишемии мозга оценивали во многих доклинических исследованиях, а также в клинических испытаниях для лечения ишемических сердечно-сосудистых заболеваний при хронических и острых заболеваниях коронарных артерий (Yamahara K, Itoh Н., Ther Adv Cardiovasc Dis. 2009 Feb; 3(1): 17-27; Kawamoto A, Asahara Т., Catheter Cardiovasc Interv. 2007 Oct 1; 70(4): 477-84; Marsboom G, Janssens S., Expert Rev Cardiovasc Ther. 2008 Jun; 6(5): 687-701). Одним из главных недостатков потенциального применения автологичных EC/EPC в терапии на основе клеток является их ограниченная способность к размножению и доступность.
Индуцированная лекарственными средствами токсичность часто вызывает повреждение важных органов, таких как печень и легкое. Токсичное лекарственное средство или его метаболит влияет на биологию клеток-мишеней непосредственно, либо провоцирует иммунный ответ в данном органе. При поражении синусоидальных эндотелиальных клеток печени и эндотелиальных клеток легкого токсичностью, индуцированной лекарственным средством, развивается тяжелый отек, который может приводить к печеночной недостаточности или одышке. Разработка специфичных для пациента моделей эндотелиальных клеток in vitro позволила бы оценивать токсичность лекарственного средства in vitro, облегчая разработку лекарственных средств с пониженным риском вызова отека ткани.
Эмбриональные стволовые (ES) клетки и специфичные для пациента индуцированные плюрипотентные стволовые клетки (iPSC) представляют собой потенциальный источник широкомасштабного получения эндотелиальных клеток и эндотелиальных клеток-предшественников для регенеративной сосудистой медицины. При использовании технологии индуцированных плюрипотентных стволовых клеток (iPSC) (Takahashi, K. & Yamanaka, S., "Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors", Cell 126, 663-676 (2006)) соматические клетки могут быть перепрограммированы в iPSC путем трансдукции четырех определенных факторов (Sox2, Oct4, Klf4, c-Myc). Технология iPSC обеспечивает генерацию специфичных для пациента iPSC, которые могут дифференцироваться в специфичные для пациента эндотелиальные клетки. Данные специфичные для пациента эндотелиальные клетки являются полезными, например, в моделировании in vitro патофизиологии сосудистых осложнений, ассоциированных с диабетом типа-2, или для оценки токсичности лекарственного средства.
Одним важным предварительным условием для попытки такого моделирования заболевания in vitro является внедрение эффективной, надежной и варьируемой по объему системы дифференциации (Grskovic et al., 2011; Tiscornia et al., 2011; Zhu et al., 2011). Предыдущие попытки дифференцировать человеческие PSC в клетки сосудистого русла не достигли масштабов и эффективности, релевантных для кампаний по изысканию новых лекарственных средств или регенеративных клеточных терапий. Было опубликовано несколько способов дифференциации человеческих плюрипотентных стволовых клеток (эмбриональных стволовых клеток и iPSC) в эндотелиальные клетки. Эндотелиальные клетки, происходящие от плюрипотентных стволовых клеток, определяются минимальным требованием экспрессирования поверхностных маркеров, таких как CD31 и CD144, и способностью формировать трубки на планшетах, покрытых матригелем. James et al. (Nature Biotech 28, 161-167, 2010) дифференцировали эндотелиальные клетки из культур эмбриоидных телец, полученных из эмбриональных стволовых клеток. В данном процессе эмбриоидные тельца последовательно стимулировали разными факторами роста, подобными морфогенетическому белку кости 4, активину А, фактору роста фибробластов 2 и VEGF-A. Авторы использовали маленькую ингибирующую молекулу TGFb (трансформирующий фактор роста-бета) (например, SB431542) для того, чтобы увеличить выход и воспроизводимость дифференциации эндотелиальных клеток. Однако данный способ имеет важные недостатки: во-первых, абсолютный выход эндотелиальных клеток был всего лишь меньше 10% и, во-вторых, общее время, необходимое для дифференциации плюрипотентных стволовых клеток в эндотелиальные клетки, составляло минимум 10 суток. Недавно Tatsumi et al. (Cell Transplantation, 2010) обошли некоторые из этих ограничений с использованием нового подхода для дифференциации эндотелиальных клеток, происходящих от человеческих эмбриональных стволовых клеток. С использованием способа дифференциации, состоящего из поэтапной комбинации 3 суток инкубации в химически определенной бессывороточной среде, дополненной 5 мкМ ингибитором киназы-3b гликогенсинтазы (GSK-3) - ((2'Z,3'E)-6-броминдирубин-3'-оксимом, именуемым «BIO»), и 2 суток инкубации в среде, дополненной фактором роста эндотелия сосудов (VEGF), эндотелиальные клетки индуцируются за 5 суток с примерно 20%-ной эффективностью, определенной по эндотелиальным клеткам, экспрессирующим поверхностный маркер CD144 (кроме того, описываемым как клетки CD144+). Эндотелиальные клетки CD144+ затем сортируют с использованием разделения посредством магнитно-активированной клеточной сортировки (MACS) и размножают для разных пассажей в среде, дополненной VEGF. Затем дифференцированные эндотелиальные клетки тестировали на некоторые отличительные характеристики эндотелиальных клеток: образование капилляроподобных трубок, поглощение ацетилированного липопротеина низкой плотности, меченного 1',1'-диоктадецил-3,3,3',3'-тетраметилиндокарбоцианином (Dil-Ac-LDL) и экспрессия маркеров CD31, CD34, CD144 и VEGFR-2 (рецептор-2 фактора роста эндотелия сосудов). При использовании данного способа общее время, необходимое для дифференциации эндотелиальных клеток, составляло лишь 5 суток, однако абсолютный выход (примерно 20%) эндотелиальных клеток был лишь слегка увеличен. Данный подход имеет дополнительные недостатки: на исходной стадии недифференцированные человеческие эмбриональные стволовые клетки диссоциируют на маленькие комки клеток, и их высаживают на чашки, покрытые коллагеном типа I. При использовании маленьких комков эмбриональных стволовых клеток исходные условия плохо определены, что имеет отрицательное влияние на воспроизводимость.
В заключение, главным недостатком всех известных способов дифференциации является необходимость неопределенных факторов, таких как сыворотка, кондиционированная среда, сокультуры с мышиными стромальными клетками ОР9 или питающими слоями, гетерогенная природа агрегатов клеток или эмбриоидных телец (James et al., 2010, Sumi et al., 2008; Vodyanik et al., 2005; Wang et al., 2007; Levenberg et al., 2002 PNAS; Kane et al., 2010; Tatsumi et al., 2010).
Сохраняется потребность в легко доступном и воспроизводимом способе дифференциации плюрипотентных стволовых клеток в клетки сосудистого русла. Согласно настоящему изобретению предложен улучшенный способ дифференциации плюрипотентных стволовых клеток в эндотелиальные клетки за меньшее время (5 суток) и со значительно повышенным выходом (вплоть до 85%, при определении по клеткам, экспрессирующим маркер CD144), и он может полностью воспроизводиться. Данный новый способ уменьшает необходимость получения эмбриоидных телец или маленьких комков клеток из плюрипотентных стволовых клеток и устраняет главный недостаток в виде низкой воспроизводимости и стандартизации способов, известных в данной области. Кроме того, высокая эффективность (вплоть до 85%-ного выхода эндотелиальных клеток, экспрессирующих маркер CD144) теперь делает возможным применение данных эндотелиальных клеток при изыскании новых лекарственных средств и исследовании их безопасности в больших масштабах, в приложениях регенеративной медицины и в моделировании заболевания in vitro в фармацевтической промышленности. Кроме того, новый способ обеспечивает селективную модуляцию сосудистых клеток-предшественников, что делает возможным сдвиг детерминации линии либо преимущественно в эндотелиальные (~85%), либо в гладкомышечные клетки сосудов (~90%).
Здесь предложен способ дифференциации плюрипотентных стволовых клеток в клетки сосудистого русла, включающий следующие стадии:
а) получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности;
б) инкубирование указанных клеток в примирующей среде, дополненной маленькой молекулой, которая активирует путь бета-катенина (белок бета 1, ассоциированный с кадгерином; название человеческого гена CTNNB1) и/или путь сигнализации с участием рецептора Wnt, и/или путь сигнализации hedgehog (HH);
в) индуцирование дифференциации путем инкубирования указанных примированных клеток в индуцирующей среде.
Предпочтительно среды заменяют между каждой стадией, что означает отбрасывание первой среды, например, путем отсоса перед добавлением к клеткам второй среды.
Фраза «монослой плюрипотентных клеток» в том виде, как она здесь используется, означает то, что берут плюрипотентные стволовые клетки в виде одиночных клеток, которые прикрепляются к адгезивному субстрату в виде пленки толщиной в одну клетку, в отличие от культивирования комков клеток или эмбриоидных телец, при котором к адгезивному субстрату прикрепляется твердая масса клеток во многих слоях, образующих разных трехмерные образования.
Получение монослоя плюрипотентных стволовых клеток на исходной стадии играет решающую роль для воспроизводимости и эффективности способа, и оно не было ранее описано в каких-либо способах дифференциации клеток сосудистого русла. В одном воплощении монослои плюрипотентных стволовых клеток можно получать путем ферментативной диссоциации клеток на одиночные клетки и помещения их на адгезивный субстрат, такой как планшеты, заранее покрытые матригелем (например, BD Matrigel, подходящий для hESC (человеческие эмбриональные стволовые клетки), от BD Bioscience, Geltrex, подходящий для hESC, от Invitrogen, Synthemax от Corning). Примеры ферментов, подходящих для диссоциации на одиночные клетки, включают аккутазу (Invitrogen), трипсин (Invitrogen), TrypLe Express (Invitrogen). В одном воплощении в планшет на адгезивный субстрат высаживают от 20000 до 60000 клеток на см2. Используемая здесь среда представляет собой среду для плюрипотентности, которая облегчает прикрепление и рост плюрипотентных стволовых клеток в виде одиночных клеток в монослое. Термин «среда для плюрипотентности» в том виде, в котором он здесь используется, относится к любой химически определенной среде, полезной для прикрепления плюрипотентных стволовых клеток в виде одиночных клеток в монослое, при сохранении их плюрипотентности, и они хорошо известны в данной области. Термин «среда для плюрипотентности» относится к среде, которая содержит по меньшей мере один из следующих факторов роста: основной фактор роста фибробластов (bFGF, также описываемый как фактор роста фибробластов 2, FGF2) и трансформирующий фактор роста β (TGFβ). В одном воплощении среда для плюрипотентности представляет собой бессывороточную среду, дополненную низкомолекулярным ингибитором Rho-ассоциированного белка, образующего суперспираль, из семейства серин/треониновых киназ (ROCK) протеинкиназ (именуемый здесь ингибитор ROCK киназы).
Таким образом, в одном воплощении стадия а) описанного выше способа включает получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности, где указанная среда для плюрипотентности представляет собой бессывороточную среду, дополненную ингибитором ROCK киназы.
Примерами бессывороточных сред, подходящих для прикрепления, являются mTeSR1 или TeSR2 от Stem Cell Technologies, среда для клеток приматов ES/iPS от ReproCELL и StemPro hESC SFM от Invitrogen, X-VIVO от Lonza. Примерами полезного здесь ингибитора ROCK киназы являются фазудил (1-(5-изохинолинсульфонил)гомопиперазин), тиазовивин (N-бензил-2-(пиримидин-4-иламино)тиазол-4-карбоксамид) и Y27632 ((+)-(R)-транс-4-(1-аминоэтил)-N-(4-пиридил)цикло-гексанкарбоксамида дигидрохлорид, например каталожный номер: 1254 от Tocris bioscience). В одном воплощении среда для плюрипотентности представляет собой бессывороточную среду, дополненную 2-20 мкМ Y27632, предпочтительно 5-10 мкМ Y27632. В другом воплощении среда для плюрипотентности представляет собой бессывороточную среду, дополненную 2-20 мкМ фазудилом. В другом воплощении среда для плюрипотентности представляет собой бессывороточную среду, дополненную 0,2-10 мкМ тиазовивином.
В одном воплощении стадия а) описанного выше способа включает получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности и выращивание указанного монослоя в среде для плюрипотентности в течение одних суток (24 часа). В другом воплощении стадия а) описанного выше способа включает получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности и выращивание указанного монослоя в среде для плюрипотентности в течение 18 часов-30 часов, предпочтительно в течение 23-25 часов.
В другом воплощении стадия а) описанного выше способа включает получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности, где указанная среда для плюрипотентности представляет собой бессывороточную среду, дополненную ингибитором ROCK киназы, и выращивание указанного монослоя в среде для плюрипотентности в течение одних суток (24 часа). В другом воплощении стадия а) описанного выше способа включает получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности, где указанная среда для плюрипотентности представляет собой бессывороточную среду, дополненную ингибитором ROCK киназы, и выращивание указанного монослоя в среде для плюрипотентности в течение 18 часов - 30 часов, предпочтительно в течение 23-25 часов.
Фраза «подходящая среда для примирования», также описываемая как «примирующая среда», в том виде, как она здесь используется, относится к любой химически определенной среде, полезной для примирования плюрипотентных стволовых клеток до эндотелиальных клеток. Термин «примирующая среда» в том виде, как он здесь используется, относится к среде, которая содержит по меньшей мере один фактор, такой как маленькая молекула, которая активирует путь бета-катенина (белок бета 1, ассоциированный с кадгерином; название человеческого гена CTNNB1) и/или путь сигнализации с участием рецептора Wnt, и/или путь сигнализации hedgehog (HH), что стимулирует индуцирующую активность мезодермы. При инкубации в примирующей среде плюрипотентные стволовые клетки начинают менять морфологию клеток с течением времени, и увеличивается пролиферация клеток. Стадия «примирования» определяется экспрессией конкретных генов и маркеров, участвующих в мезодермальном переходе (например, GATA2, VIMENTIN, SMA, HAND1, FOXa2 (низкая экспрессия), KDR), и понижающей регуляцией генов и маркеров, ассоциированных с плюрипотентностью (например, ОСТ4 (POU5F1), NANOG, SOX2, REX1 (ZFP42), LEFTY1, LEFTY2, TDGF1, DNMT3B, GABRB3, GDF3, TERT).
В одном воплощении указанные маленькие молекулы, активирующие путь бета-катенина (белок бета 1, ассоциированный с кадгерином; название человеческого гена CTNNB1) и/или путь сигнализации с участием рецептора Wnt, и/или путь сигнализации hedgehog (HH), выбраны из группы, состоящей из низкомолекулярных ингибиторов киназы 3 гликогенсинтазы (Gsk3a-b), низкомолекулярных ингибиторов CDC-подобной киназы 1 (Clk-2-4), низкомолекулярных ингибиторов митогенактивируемой протеинкиназы 15 (Mapk15), низкомолекулярных ингибиторов киназы двойной специфичности, регулируемой фосфорилированием тирозина (Y) (Dyrk1a-b 4), низкомолекулярных ингибиторов циклин-зависимой киназы 16 (Pctk-3 4), сглаженных (SMO) активаторов и модуляторов взаимодействия между β-катенином (или γ-катенином) и коактивирующими белками СВР (белок, связывающий CREB) и p300 (белок p300, связывающий E1A).
Предпочтительно указанные ингибиторы киназы 3 гликогенсинтазы (Gsk3a-b) представляют собой ингибиторы GSK3 на основе пирролидинона. Термин «ингибитор GSK3 на основе пирролидинона» в том виде, как он здесь используется, относится к селективным проникающим в клетку конкурирующим с АТФ ингибиторам GSK3α и GSK3β с низкими значениями ИК50 (полумаксимальная ингибирующая концентрация).
В одном воплощении указанный ингибитор GSK3 на основе пирролидинона выбран из группы, включающей 3-(2,4-дихлорфенил)-4-(1-метил-1Н-индол-3-ил)-1Н-пиррол-2,5-дион (SB216763), 3-[(3-хлор-4-гидроксифенил)амино]-4-(2-нитрофенил)-1Н-пиррол-2,5-дион (SB415286), N6-{2-[4-(2,4-дихлорфенил)-имидазол-1-ил-пиримидин-2-иламино]-этил}-3-нитро-пиридин-2,6-диамин 2HCl, 3-имидазо[1,2-a]пиридин-3-ил-4-[2-(морфолин-4-карбонил)-1,2,3,4-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-7-ил]-пиррол-2,5-дион, 9-бром-7,12-дигидро-индоло-[3,2-d][1]бензазепин-6(5Н)-он (кенпауллон), 9-бром-7,12-дигидро-пиридо[3',2':2,3]азепино[4,5-b]индол-6(5Н)-он (CHIR99021) и (3-(3-аминофенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион (CP21R7, также именуемый здесь как «соединение 21»; см., например, L. Gong et al; Bioorganic& Medicinal Chemistry Letters 20 (2010), 1693-1696).
В одном воплощении указанный ингибитор CDC-подобной киназы 1 (Clk1-2-4) выбран из группы, включающей бензотиазол и 3-фтор-N-[1-изопропил-6-(1метил-пиперидин-4-илокси)-1,3-дигидро-бензоимидазол-(2Е)-илиден]-5-(4-метил-1Н-пиразол-3-сульфонил)-бензамид.
В одном воплощении указанный ингибитор митогенактивируемой протеинкиназы 15 (Mapk15) выбран из группы, состоящей из 4-(4-фторфенил)-2-(4-метилсульфинилфенил)-5-(4-пиридил)-1Н-имидазола (SB203580) и 5-изохинолинсульфонамида (Н-89).
В одном воплощении указанный ингибитор киназы двойной специфичности, регулируемой фосфорилированием тирозина (Y) (Dyrk1a-b 4), выбран из группы, включающей 6-[2-амино-4-оксо-4Н-тиазол-(52)-илиденметил]-4-(тетрагидро-пиран-4-илокси)-хинолин-3-карбонитрил.
В одном воплощении указанный сглаженный активатор представляет собой пурморфамин-(2-(1-нафтокси)-6-(4-морфолиноанилино)-9-циклогексилпурин.
Примеры модуляторов взаимодействия между β-катенином (или γ-катенином) и коактивирующими белками CBP (белок, связывающий CREB) и p300 (белок p300, связывающий E1A) представляют собой IQ-1 (2-(4-ацетил-фенилазо)-2-[3,3-диметил-3,4-дигидро-2H-изохинолин-(1E)-илиден]-ацетамид и ICG-001 ((6S,9aS)-6-(4-гидроксибензил)-8-нафталин-1-илметил-4,7-диоксо-гексагидро-пиразино[1,2-а]пиримидин-1-карбоновой кислоты бензиламид (WO 2007056593).
В одном воплощении указанная примирующая среда представляет собой бессывороточную среду, дополненную инсулином, трансферрином и прогестероном. В одном воплощении указанная бессывороточная среда дополнена 10-50 мкг/мл инсулина, 10-100 мкг/мл трансферрина и 10-50 нМ прогестероном, предпочтительно 30-50 мкг/мл инсулина, 20-50 мкг/мл трансферрина и 10-30 нМ прогестероном. Примеры бессывороточных сред, подходящих для примирования, представляют собой среду N2B27 (N2B27 представляет собой смесь 1:1 DMEM (среда Игла, модифицированная по Дульбекко)/F12 (Gibco, Paisley, Великобритания), дополненную N2 и В27 (оба от Gibco)), среду N3 (состоящую из DMEM/F12 (Gibco, Paisley, Великобритания), 25 мкг/мл инсулина, 50 мкг/мл трансферрина, 30 нМ селенита натрия, 20 нМ прогестерона, 100 нМ путресцина (Sigma)) или среду для пролиферации NeuroCult® NS-A (Stemcell Technologies). В одном воплощении указанная примирующая среда представляет собой бессывороточную среду, дополненную инсулином, трансферрином, прогестероном и маленькой молекулой, которая активирует путь бета-катенина (белок бета 1, ассоциированный с кадгерином; название человеческого гена CTNNB1) и/или путь сигнализации с участием рецептора Wnt, и/или путь сигнализации hedgehog (HH). Предпочтительно указанная маленькая молекула выбрана из группы, включающей 3-(2,4-дихлорфенил)-4-(1-метил-1Н-индол-3-ил)-1Н-пиррол-2,5-дион (SB216763), 3-[(3-хлор-4-гидроксифенил)амино]-4-(2-нитрофенил)-1Н-пиррол-2,5-дион (SB415286), N6-{2-[4-(2,4-дихлорфенил)-5-имидазол-1-ил-пиримидин-2-иламино]-этил}-3-нитро-пиридин-2,6-диамин 2HCl, 3-имидазо[1,2-а]пиридин-3-ил-4-[2-(морфолин-4-карбонил)-1,2,3,4-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-7-ил]-пиррол-2,5-дион, 9-бром-7,12-дигидро-индоло[3,2-d][1]бензазепин-6(5Н)-он (кенпауллон), 9-бром-7,12-дигидро-пиридо[3',2':2,3]азепино[4,5-b]индол-6(5Н)-он (CHIR99021), 3-(3-аминофенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион (CP21R7, также именуемый здесь «соединение 21», бензотиазол, 3-фтор-N-[1-изопропил-6-(1-метил-пиперидин-4-илокси)-1,3-дигидро-бензоимидазол-(2Е)-илиден]-5-(4-метил-1Н-пиразол-3-сульфонил)-бензамид, 4-(4-фторфенил)-2-(4-метилсульфинилфенил)-5-(4-пиридил)-1Н-имидазол (SB203580), 5-изохинолинсульфонамид (Н-89), 6-[2-амино-4-оксо-4H-тиазол-(5Z)-илиденметил]-4-(тетрагидро-пиран-4-илокси)-хинолин-3-карбонитрил, 2-(1-нафтокси)-6-(4-морфолиноанилино)-9-циклогексилпурин (пурморфамин), 2-(4-ацетил-фенилазо)-2-[3,3-диметил-3,4-дигидро-2Н-изохинолин-(1Е)-илиден]-ацетамид (IQ-1) и ICG-001 ((6S,9aS)-6-(4-гидроксибензил)-8-нафталин-1-илметил-4,7-диоксо-гексагидро-пиразино[1,2-а]пиримидин-1-карбоновой кислоты бензиламид.
В одном предпочтительном воплощении примирующая среда представляет собой бессывороточную среду, содержащую 10-50 мкг/мл инсулина, 10-100 мкг/мл трансферрина и 10-50 нМ прогестерон, дополненную 0,5-4 мкМ CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион).
В одном воплощении указанная примирующая среда дополнительно содержит рекомбинантный морфогенный белок кости-4 (BMP4).
В одном предпочтительном воплощении примирующая среда представляет собой бессывороточную среду, содержащую 10-50 мкг/мл инсулина, 10-100 мкг/мл трансферрина и 10-50 нМ прогестерон, дополненную 0,5-4 мкМ CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дионом) и 10-50 нг/мл рекомбинантного морфогенного белка кости-4 (BMP4).
В одном воплощении стадия б) описанного выше способа включает инкубирование указанных клеток в примирующей среде в течение по меньшей мере 3 суток (72 часа).
В одном воплощении стадия б) описанного выше способа включает инкубирование указанных клеток в примирующей среде в течение 2-4 суток (от 48 часов до 96 часов).
В другом воплощении стадия б) описанного выше способа включает инкубирование указанных клеток в примирующей среде, где указанная примирующая среда представляет собой бессывороточную среду, дополненную CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дионом). Предпочтительно указанная примирующая среда дополнена 0,5-4 мкМ CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион), наиболее предпочтительно 1-2 мкМ CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион).
В одном воплощении указанная примирующая среда дополнительно содержит рекомбинантный морфогенный белок кости-4 (BMP4).
В другом воплощении стадия б) описанного выше способа включает инкубирование указанных клеток в примирующей среде, где указанная примирующая среда представляет собой бессывороточную среду, дополненную CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион), и инкубирование указанных клеток в течение трех суток (72 часа).
В одном воплощении указанная примирующая среда дополнительно содержит рекомбинантный морфогенный белок кости-4 (BMP4).
В другом воплощении стадия б) описанного выше способа включает инкубирование указанных клеток в примирующей среде, где указанная примирующая среда представляет собой бессывороточную среду, дополненную CP21R7 (3-(3-аминофенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион), и выращивание указанных клеток в течение 2-4 суток (от 48 часов до 96 часов).
В одном воплощении указанная примирующая среда дополнительно содержит рекомбинантный морфогенный белок кости-4 (BMP4).
Термин «индуцирующая среда» в том виде, как он здесь используется, относится к любой химически определенной среде, полезной для индукции примированных клеток в CD144 позитивные (CD144+) эндотелиальные клетки или гладкомышечные клетки сосудов, позитивные в отношении рецептора бета PDGF (CD140b+), или в общий тип клетки-предшественника на монослое.
Для предпочтительной индукции эндотелиальных клеток указанную индукционную среду дополняют VEGF (фактор роста эндотелия сосудов) или плацентарным фактором роста 1 (PLGF-1) и низкомолекулярным активатором аденилатциклазы. В одном воплощении указанный низкомолекулярный активатор аденилатциклазы приводит к активации пути сигнализации PKA/PKI. В одном воплощении указанные низкомолекулярные активаторы аденилатциклазы выбраны из группы, включающей форсколин ((3R)-(6aальфаH)додекагидро-6бета, 10альфа, 10bальфа-тригидрокси-3бета,4aбета,7,7,10aбета-пентаметил-1-оксо-3-винил-1Н-нафто[2,1-b]пиран-5бета-ил ацетат), 8-бром-цАМФ (8-бромаденозин-3',5'-циклический монофосфат) и адреномедуллин. В одном воплощении указанная индуцирующая среда представляет собой бессывороточную среду, дополненную человеческим сывороточным альбумином, этаноламином, трансферрином, инсулином и гидрокортизоном. Примерами бессывороточных сред, подходящих для индукции, являются StemPro-34 (Invitrogen, основные компоненты: человеческий сывороточный альбумин, липидные агенты, такие как человеческий Ex-Cyte® и этаноламин или их смесь, человеческий цинк инсулин, гидрокортизон, насыщенный железом, переносящий 2-меркаптоэтанол и D,L-токоферола ацетат или их производные, или смеси) и X-VIVO 10 и 15(Lonza).
В одном воплощении указанная индуцирующая среда представляет собой бессывороточную среду, дополненную человеческим сывороточным альбумином, этаноламином, трансферрином, инсулином, гидрокортизоном и 1-10 мкМ форсколином и 5-100 нг/мл VEGF-A. В другом воплощении индуцирующая среда содержит StemPro-34 (от Invitrogen), дополненный 30-70 нг/мл VEGF-A или 30-70 нг/мл плацентарного фактора роста 1 (PLGF-1).
В одном воплощении стадия в) описанного выше способа включает индуцирование дифференциации в эндотелиальные клетки путем инкубирования указанных примированных клеток в индуцирующей среде, дополненной VEGF-A или плацентарным фактором роста 1 (PLGF-1) и низкомолекулярным активатором аденилатциклазы, где указанный низкомолекулярный активатор аденилатциклазы выбран из группы форсколина, 8-бром-цАМФ и адреномедуллина.
В другом воплощении стадия в) описанного выше способа включает индуцирование дифференциации в эндотелиальные клетки путем инкубирования указанных примированных клеток в индуцирующей среде, дополненной VEGF-A или плацентарным фактором роста 1 (PLGF-1) и низкомолекулярным активатором аденилатциклазы, в течение одних суток.
В другом воплощении стадия в) описанного выше способа включает индуцирование дифференциации в эндотелиальные клетки путем инкубирования указанных примированных клеток в индуцирующей среде, дополненной VEGF-A или плацентарным фактором роста 1 (PLGF-1) и низкомолекулярным активатором аденилатциклазы, в течение 18 часов - 48 часов, предпочтительно в течение 22 часов-36 часов.
В другом воплощении стадия в) описанного выше способа включает индуцирование дифференциации в эндотелиальные клетки путем инкубирования указанных примированных клеток в индуцирующей среде, дополненной VEGF-A или плацентарным фактором роста 1 (PLGF-1) и низкомолекулярным активатором аденилатциклазы, в течение одних суток, где указанный низкомолекулярный активатор аденилатциклазы выбран из группы форсколина, 8-бром-цАМФ и адреномедуллина.
С использованием способа, представленного в данном изобретении, теперь возможно дифференцировать эндотелиальные клетки из плюрипотентных стволовых клеток с выходом вплоть до 85% (Фиг. 2). Продукт стадии в) можно легко идентифицировать в культуре клеток как клетки CD144+.
Для преимущественной индукции гладкомышечных клеток сосудов стадия в) описанного выше способа включает инкубацию указанных примированных клеток в индуцирующей среде VSMC в течение 18-48 ч, предпочтительно в течение 22-36 часов. Индуцирующая среда VSMC представляет собой химически определенную среду, дополненную факторами роста и/или маленькими молекулами, усиливающими образование и выживание гладкомышечных клеток сосудов.
В одном воплощении данной стадии индуцирующая среда представляет собой химически определенную среду с заменителем сыворотки (SR среда). SR среда включает основную среду (например, среда RPMI, Invitrogen, кат. №11835-063 или среда DMEM (среда Игла, модифицированная по Дульбекко)), дополненную химически определенным заменителем сыворотки (2-15%), например заменителем сыворотки Knock-out от Invitrogen, кат. №10828028. Она может, кроме того, содержать стабильный глутамин, заменимые аминокислоты и бета-меркаптоэтанол.
В другом воплощении индуцирующая среда дополнена IWR1 (ингибитор ответа Wnt 1) в интервале от 1 до 5 мкМ.
В другом воплощении индуцирующая среда содержит бессывороточную среду, дополненную 2-20 нг/мл активатора пути сигнализации фактора роста тромбоцитов (PDGF) и 2-10 нг/мл активатора пути сигнализации TGF бета. Примеры активаторов сигнализации PDGF включают, например, PDGF-AA, PDGF-ВВ (например, RnD, кат. №220-ВВ) и PDGF-AB. Одним типичным активатором сигнализации TGFбeтa является активинА (например, RnD, кат. №338-АС). Примерами бессывороточных сред, подходящих для индукции, являются среда N2B27 (N2B27 представляет собой смесь 1:1 DMEM/F12 (Gibco, Paisley, Великобритания), дополненную N2 и В27 (оба от Gibco), StemPro-34 (Invitrogen, основные компоненты: человеческий сывороточный альбумин, липидные агенты, такие как человеческий Ex-Cyte®, и этаноламин или их смесь, человеческий цинк инсулин, гидрокортизон, насыщенный железом трансферрин, 2-меркаптоэтанол и D,L-токоферола ацетат или их производные, или смеси) и X-VIVO 10 и 15 (Lonza). В предпочтительном воплощении указанная бессывороточная среда, полезная для преобладающей индукции гладкомышечных клеток сосудов, представляет собой среду N2B27.
В другом воплощении индуцирующая среда содержит бессывороточную среду, дополненную 2-20 нг/мл активатора пути синализации фактора роста тромбоцитов (PDGF) и 2-10 нг/мл активатора пути синализации TGF бета, и, кроме того, содержит человеческий сывороточный альбумин, этаноламин, трансферрин, инсулин и гидрокортизон.
В другом воплощении стадия в) описанного выше способа включает индуцирование дифференциации в гладкомышечные клетки сосудов путем инкубирования указанных примированных клеток в индуцирующей среде, как описано выше, в течение одних суток.
В другом воплощении стадия в) описанного выше способа включает индуцирование дифференциации в гладкомышечные клетки сосудов путем инкубирования указанных примированных клеток в индуцирующей среде, как описано выше, в течение 18 часов - 48 часов, предпочтительно в течение 22 часов - 36 часов.
С использованием способа, представленного в данном изобретении, теперь возможна дифференциация гладкомышечных клеток сосудов из плюрипотентных стволовых клеток с выходом 90%. Продукт стадии в) можно легко идентифицировать в культуре клеток как клетки CD140b+.
В другом воплощении указанный способ дополнительно включает стадию
г) инкубирования продукта стадии в) при подходящих условиях для пролиферации эндотелиальных клеток или гладкомышечных клеток сосудов.
Предпочтительно указанные подходящие условия для пролиферации эндотелиальных клеток включают отбор указанных клеток CD144+ и размножение их в химически определенной среде для размножения. Термин «отбор» в том виде, как он здесь используется, относится к ферментативной диссоциации клеток от адгезивного субстрата и последующему ресуспендированию в новой среде. В одном предпочтительном воплощении клетки сортируют после отбора. Сортировка клеток может достигаться способами, известными в данной области, например, посредством магнитно-активированной клеточной сортировки (MACS) (Фиг. 3) или разделения посредством проточной цитометрии - флуоресцентной сортировки клеток (FACS). Термин «среда для размножения» в том виде, как он здесь используется, относится к любой химически определенной среде, полезной для размножения и пассирования эндотелиальных клеток CD144+ на монослое. В одном воплощении указанная среда для размножения представляет собой бессывороточную среду, дополненную VEGF-A. Примерами бессывороточных сред, подходящих для размножения эндотелиальных клеток, являются StemPro-34 (Invitrogen), EGM2 (Lonza) и DMEM/F12 (Invitrogen), дополненные 8 нг/мл FGF-2, 50 нг/мл VEGF и 10 мкМ SB431542 (4-(4-бензо[1,3]диоксол-5-ил-5-пиридин-2-ил-1Н-имидазол-2-ил)-бензамид). Предпочтительно эндотелиальные клетки культивируют в условиях культивирования, связанных с прикреплением к субстрату. В одном воплощении среда для размножения дополнена 5-100 нг/мл VEGF-A. В другом воплощении среда для размножения представляет собой StemPro-34, дополненную 5-100 нг/мл VEGF-A.
Эндотелиальные клетки, полученные описанным здесь способом, можно размножать в течение нескольких пассажей, и их культивирование хорошо охарактеризовано. Можно воспроизводимо замораживать и размораживать аликвоты эндотелиальных клеток, полученных описанным здесь способом.
Предпочтительно указанные условия пролиферации VSMC включают отбор указанных клеток CD140b+ и их размножение в химически определенной среде для размножения. Термин «отбор» в том виде, как он здесь используется, относится к ферментативной диссоциации клеток от адгезивного субстрата и последующему ресуспендированию в новой среде. В одном предпочтительном воплощении клетки сортируют после отбора либо путем позитивной селекции на VSMC CD140b+, либо путем обеднения эндотелиальными клетками CD144+. Сортировка клеток может достигаться способами, известными в данной области, например посредством магнитно-активированной клеточной сортировки (MACS) (Фиг. 3) или разделения посредством проточной цитометрии - флуоресцентной сортировки клеток (FACS). Термин «среда для размножения» в том виде, как он здесь используется, относится к любой химически определенной среде, полезной для размножения и пассирования VSMC CD140b+ на монослое. В одном воплощении указанная среда для размножения идентична описанной индуцирующей среде VSMC. В другом воплощении среда для размножения представляет собой бессывороточную среду, дополненную EGF (эпидермальный фактор роста) (5-20 нг/мл) и FGF2 (фактор роста фибробластов 2) (5-20 нг/мл). Примерами бессывороточных сред, подходящих для размножения VSMC, являются StemPro-34 (Invitrogen), DMEM/F12 (Invitrogen) и DMEM (Invitrogen) или описанная ранее N2B27.
В другом воплощении среда для размножения представляет собой указанную среду SR. Предпочтительно VSMC культивируют в условиях культивирования, связанных с прикреплением к субстрату.
VSMC, полученные описанным здесь способом, можно размножать в течение нескольких пассажей, и их культивирование хорошо охарактеризовано.
В одном воплощении настоящего изобрет