Способ получения ингибиторов гиразы и топоизомеразы iv
Иллюстрации
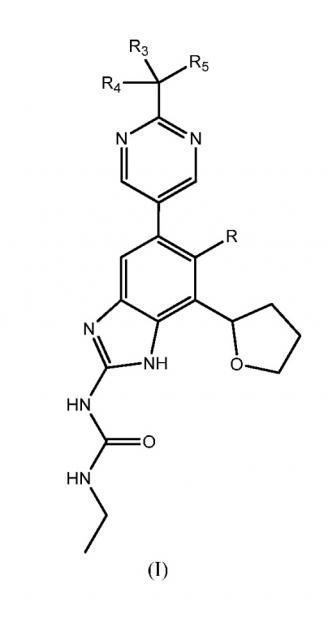
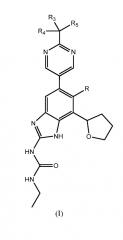
Показать всеДанная заявка относится к способу получения соединений формулы (I)
или их фармацевтически приемлемых солей, где R представляет собой H или F и каждый из R3, R4, и R5 независимо представляет собой С1-С6 алкил или гидроксильную группу, а также к промежуточным соединениям и способам их получения. Соединения формулы (I) или их соли ингибируют бактериальную гиразу и/или топоизомеразу IV и полезны при лечении бактериальных инфекций. 4 н. и 14 з.п. ф-лы, 2 ил., 2 пр.
Реферат
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка, согласно § 119 Кодекса законов США, испрашивает приоритет предварительной заявке на патент США № 61/432990, поданной 14 января 2011 года, содержание которой включено в настоящее описание посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Резистентность бактерий к антибиотикам известна давно, и она считается сегодня во всем мире серьезной проблемой здоровья. В результате этой устойчивости, некоторые бактериальные инфекции трудно лечить антибиотиками или они даже являются неизлечимыми. Эта проблема стала особенно серьезной в связи с недавним развитием у некоторых штаммов бактерий, таких как Streptococcus pneumoniae (SP), Mycobacterium tuberculosis и Enterococcus, множественной резистентности к лекарственным препаратам. Появление ванкомицин-резистентных энтерококков вызвало особую тревогу, поскольку ранее ванкомицин был единственным эффективным антибиотиком для лечения этой инфекции, и он расценивался как "последнее средство" среди лекарственных препаратов для многих инфекций. Хотя многие другие лекарственно-резистентные бактерии не вызывают опасные для жизни заболевания, как энтерококки, существует опасение, что гены, которые вызывают резистентность, могут распространиться на более смертоносные микроорганизмы, такие как Staphylococcus aureus, для которых устойчивость к метициллину является широко распространенной (De Clerq, et al., Current Opinion in Anti-infective Investigational Drugs, 1999, 1, 1; Levy, "The Challenge of Antibiotic Resistance", Scientific American, March, 1998).
Еще одной проблемой является вопрос, как быстро может распространяться устойчивость к антибиотикам. Например, до 1960-х годов бактерии SP были полностью чувствительны к пенициллину, и в 1987 году в США только 0,02% штаммов SP были устойчивы к нему. Тем не менее, к 1995 году стало известно, что устойчивость SP к пенициллину была на уровне около семи процентов и достигала 30% в некоторых частях США (Lewis, FDA Consumer magazine (September, 1995); Gershman in The Medical Reporter, 1997).
Больницы, в частности, служат центрами для формирования и передачи лекарственно-резистентных микроорганизмов. Случаи инфицирования в больницах, известные как внутрибольничные инфекции, становятся все более серьезной проблемой. Каждый год в больницах инфицируется два миллиона американцев, и более половины из этих инфекций являются устойчивыми по крайней мере к одному антибиотику. Центр по контролю и профилактике заболеваний США сообщил, что в 1992 году более 13000 больничных пациентов умерло от бактериальных инфекций, которые были резистентны к лечению антибиотиками (Lewis, "The Rise of Antibiotic-Resistant Infections", FDA Consumer magazine, September 1995).
В результате необходимости борьбы с лекарственно-резистентными бактериями и увеличения неэффективности доступных лекарственных средств, наблюдается возрождение интереса к разработке новых антибиотиков. Одной из привлекательных стратегий разработки новых антибиотиков является ингибирование ДНК гиразы и/или топоизомеразы IV, бактериальных ферментов, необходимых для репликации ДНК и, следовательно, необходимых для роста бактерий и деления клеток. Активности гиразы и/или топоизомеразы IV также связаны с событиями при транскрипции, репарации и рекомбинации ДНК.
Гиразы являются представителями топоизомеразы, группы ферментов, которые катализируют взаимопревращение топологических изомеров ДНК (см., в общем, Kornberg and Baker, DNA Replication, 2d Ed., Chapter 12, 1992, W. H. Freeman and Co.; Drlica, Molecular Microbiology, 1992, 6, 425; Drlica and Zhao, Microbiology and Molecular Biology Reviews, 1997, 61, pp. 377-392). Гираза сама по себе контролирует суперспирализацию ДНК и снимает топологический стресс, который возникает, когда в процессе репликации раскручиваются нити ДНК родительского дуплекса. Гираза также катализирует конверсию раскрученных замкнутых кольцевых дуплексных ДНК в отрицательную суперспиральную форму, которая более благоприятна для рекомбинации. Механизм сверхспиральной реакции включает охватывание гиразой области ДНК, двойное разрушение нити в этой области, пропускание второй области ДНК через этот разрыв и повторное соединение разорванных нитей. Такой механизм расщепления характерен для топоизомеразы типа II. Реакция суперспирализации вызывается связыванием АТФ с гиразой. Затем, в ходе реакции, АТФ подвергается гидролизу. Это связывание и последующий гидролиз АТФ вызывают конформационные изменения в ДНК-связанной гиразе, необходимые для ее активности. Кроме того, было обнаружено, что уровень суперспирализации ДНК (или степень раскрученности) зависит от соотношения АТФ/АДФ. В отсутствие АТФ, гираза способна только к раскручиванию суперспиральной ДНК.
Бактериальные ДНК-гиразы представляют собой белковый тетрамер с массой 400 кДа, состоящий из двух субъединиц А (GyrA) и двух субъединиц В (GyrB). Связывание и расщепление ДНК связано с GyrA, в то время как АТФ связывается и гидролизуется белком GyrB. GyrB состоит из амино-концевого домена, который обладает АТФазной активностью, и карбокси-концевого домена, который взаимодействует с GyrA и ДНК. В отличие от этого, эукариотические топоизомеразы типа II являются гомодимерами, которые могут раскручивать отрицательные и положительные суперспирали, но не могут формировать отрицательные суперспирали. В идеале, антибиотик, основанный на ингибировании бактериальной ДНК-гиразы и/или топоизомеразы IV, будет селективным для этих ферментов и будет относительно неактивным против эукариотической топоизомеразы типа II.
В первую очередь, топоизомеразы IV разрывают связанные димеры хромосом на заключительной стадии репликации ДНК.
Широко распространенные антибиотики хинолонового ряда ингибируют бактериальную ДНК-гиразу (GyrA) и/или топоизомеразу IV (ParC). Примеры хинолонов включают давно известные соединения, такие как налидиксовая кислота и оксолиновая кислота, а также позднее, более мощные фторхинолоны, такие как норфлоксацин, ципрофлоксацин и тровафлоксацин. Эти соединения связываются с GyrA и/или Parc, стабилизируя расщепленный комплекс, ингибируя, таким образом, общую функцию гиразы, что приводит к гибели клеток. Фторхинолоны ингибируют каталитические субъединицы гиразы (GyrA) и/или Топоизомеразы IV (ParC) (см. Drlica and Zhao, Microbiology and Molecular Biology Reviews, 1997, 61, 377-392). Однако лекарственная резистентность также признается как проблема для этого класса соединений (WHO Report, "Use of Quinolones in Food Animals and Potential Impact on Human Health", 1998). В случае хинолонов, как и с другими классами антибиотиков, бактерии, на которые воздействовали давно известные соединения, часто формируют перекрестную резистентность к более эффективным соединениям того же класса.
Связанные субъединицы, отвечающие за поставку энергии, необходимы для каталитического оборота/восстановления ферментов при гидролизе АТФ, представляют собой GyrB (гираза) и ParE (топоизомераза IV), соответственно (см.: Champoux, J.J., Annu. Rev. Biochem., 2001, 70, pp. 369-413). Соединения, для которых мишенью являются эти же сайты связывания АТФ в субъединицах GyrB и ParE, были бы полезны для лечения различных бактериальных инфекций (см.: Charifson et al., J. Med. Chem., 2008, 51, pp. 5243-5263).
Известно меньшее число ингибиторов, которые связываются с GyrB. Их примеры включают кумарины, новобиоцин и коумермицин A1, циклотиалидин, цинодин и клероцидин. Как было показано, кумарины очень сильно связываются с GyrB. Например, новобиоцин образует сеть водородных связей с белком и формирует несколько гидрофобных контактов. В то же время новобиоцин и АТФ формируют связи внутри сайта связывания АТФ с минимальным перекрытием в ориентации связей этих двух соединений. Перекрывающиеся части представляют собой сахаридные единицы в новобиоцине и аденин в АТФ (Maxwell, Trends in Microbiology, 1997, 5, 102).
Для кумарин-резистентных бактерий наиболее распространенной точкой мутации является остаток аргинина на поверхности, который связывается с карбонилом кумаринового кольца (Arg136 в GyrB кишечной палочки). В то же время ферменты с этой мутацией показывают более низкую суперспирализацию и АТФазную активность, и они также менее чувствительны к ингибированию лекарственными препаратами кумаринового ряда (Maxwell, Mol. Microbiol., 1993, 9, 681).
Несмотря на то, что кумарины являются мощными ингибиторами суперспирализации гиразы, они не были широко использованы в качестве антибиотиков. Как правило, они непригодны из-за их низкой проницаемости в отношении бактерий, токсичности в отношении эукариотов и из-за плохой растворимости в воде (Maxwell, Trends in Microbiology, 1997, 5, 102). Было бы желательно, чтобы новый эффективный ингибитор GyrB и ParE преодолел бы эти недостатки и, предпочтительно, в своей активности не был бы основан на исключительном связывании с Arg136. Такой ингибитор будет привлекательным кандидатом-антибиотиком, без проблем в части резистентности, которые мешают другим классам антибиотиков.
Поскольку резистентность бактерий к антибиотикам стала важной проблемой для общественного здравоохранения, существует постоянная потребность в разработке новых и более мощных антибиотиков. В частности, существует потребность в антибиотиках, которые представляют собой новый класс соединений, который ранее не использовался для лечения бактериальных инфекций. Соединения, которые нацелены на сайты связывания АТФ в субъединицах как GyrB (гираза), так и ParE (топоизомераза IV), были бы полезны для лечения различных бактериальных инфекций. Такие соединения были бы особенно полезны при лечении внутрибольничных инфекций в лечебных заведениях, где формирование и трансмиссия резистентных бактерий становится все более распространенной.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном варианте осуществления настоящее изобретение относится к способу получения соединения формулы (I)
или к его фармацевтически приемлемой соли, где R представляет собой Н или F, и каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу.
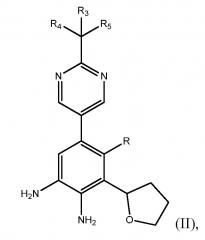
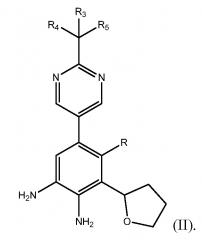
Способ включает получение фенилпиримидинового соединения формулы (II)
где R представляет собой Н или F, и каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу;
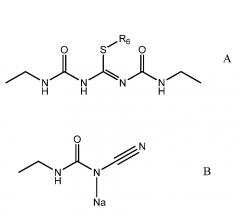
и взаимодействие фенилпиримидинового соединения формулы (II) с производным мочевины формулы А или В:
,
где R6 представляет собой необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный насыщенный или ненасыщенный карбоцикл или необязательно замещенный насыщенный или ненасыщенный гетероцикл, с получением соединения формулы (I), и, необязательно, взаимодействие соединения формулы (I) с подходящей кислотой, с получением фармацевтически приемлемой соли соединения формулы (I).
В некоторых случаях данного варианта выполнения изобретения, R6 может представлять собой метил, этил, бензил или п-нитробензил. В дополнительном варианте выполнения изобретения, реакция может быть проведена в смеси диоксана и буфера при температуре от 75°С до 125°С. В одном дополнительном варианте выполнения изобретения, буфер может иметь рН 3,5, и реакция может быть проведена при температуре дефлегмации.
Во втором варианте осуществления настоящее изобретение относится к способу получения фенилпиримидинового соединения формулы (II)
Способ включает получение фенилтетрагидрофуранового производного формулы (IV)
где R представляет собой Н или F, и
взаимодействие фенилтетрагидрофуранового производного формулы (IV) с производным бороновой кислоты формулы (III)
где каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу, и
В* представляет собой ,
где каждый из R1 и R2 независимо представляет собой алкил или H, или OR1 и OR2 вместе с атомом B, к которому они присоединены, образуют необязательно замещенное 5-, 6- или 7-членное кольцо или BF3X, где X может представлять собой любой одновалентный катион, в присутствии палладиевого катализатора в полярном растворителе с получением фенилпиримидинового соединения формулы (V)
где R представляет собой Н или F, и каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу; и обработку фенилпиримидинового соединения формулы (V) подходящим восстанавливающим агентом с получением фенилпиримидинового соединения формулы (II).
В некоторых случаях этого варианта осуществления изобретения В* может представлять собой
,
где каждый из атомов углерода в кольце может быть незамещенным или замещенным одной или двумя метильными или этильными группами. В дополнительном варианте выполнения изобретения В* может представлять собой
В третьем варианте осуществления настоящее изобретение относится к способу получения фенилтетрагидрофуранового соединения формулы (IV)
Способ включает получение соединения формулы (VI)
где R представляет собой Н или F,
и нитрование соединения формулы (VI) соответствующим нитрующим агентом с получением фенилтетрагидрофуранового соединения формулы (IV).
В четвертом варианте осуществления настоящее изобретение относится к альтернативному способу получения фенилтетрагидрофуранового соединения формулы (IV). Способ включает получение соединения формулы (VI)
где R представляет собой Н или F;
защиту аминогруппы в соединении формулы (VI) аминозащитной группой с получением амино-защищенного соединения;
нитрование амино-защищенного соединения подходящим нитрующим агентом с получением амино-защищенного нитросоединения, и снятие защиты с защищенного амино-нитросоединения с получением фенилтетрагидрофуранового соединения формулы (IV).
В некоторых аспектах этого варианта осуществления изобретения, указанное получение фенилпиримидинового соединения формулы (II) может дополнительно включать восстановление фенилпиримидинового производного формулы (V)
где R представляет собой Н или F, и каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу, подходящим восстанавливающим агентом с получением соединения формулы (II). В дополнительном варианте выполнения изобретения нитрование соединения формулы (VI) может включать взаимодействие соединения формулы (VI) с NH4NO3 в присутствии сильной кислоты, при температуре от приблизительно 20°С до приблизительно 50°С, с получением соединения (IV).
В пятом варианте осуществления настоящее изобретение относится к способу получения соединения формулы (VI)
Способ включает получение соединения формулы (VII)
где R представляет собой Н или F, и взаимодействие соединения формулы (VII) с бромирующим агентом в полярном апротонном растворителе с получением соединения формулы (VI).
В некоторых вариантах этого выполнения изобретения, соединение формулы (VII) может быть энантиомерно обогащенным.
В шестом варианте осуществления настоящее изобретение относится к способу получения соединения формулы (VII)
Способ включает получение дигидрофуранилнитробензольного соединения, выбранного из группы, состоящей из соединения формулы (VIIIa)
где R представляет собой Н или F,
и соединения формулы (VIIIb)
где R представляет собой Н или F, и обработку дигидрофуранилнитробензольного соединения восстанавливающим агентом с получением соединения формулы (VII).
В седьмом варианте осуществления настоящее изобретение относится к способу получения дигидрофуранилнитробензольного соединения формулы (VIIIa)
где R представляет собой Н или F,
или соединения формулы (VIIIb)
где R представляет собой Н или F,
где способ включает следующие стадии:
получение соединения формулы (IX)
где R представляет собой Н или F,
и обработка соединения формулы (IX) 2,3-дигидрофураном в присутствии палладиевого катализатора с получением дигидрофуранилнитробензольного соединения.
В восьмом варианте осуществления настоящее изобретение относится к соединению формулы
,
где R представляет собой Н или F, или его фармацевтически приемлемой соли, полученному в соответствии со способами настоящего изобретения. В некоторых вариантах осуществления изобретения соединение формулы (I) имеет формулу
,
где R представляет собой Н или F, или представляет его фармацевтически приемлемую соль. В других вариантах осуществления изобретения соединение формулы (I) может представлять собой (R)-1-этил-3-(5-(2-(2-гидроксипропан-2-ил)пиримидин-5-ил)-7-(тетрагидрофуран-2-ил)-1H-бензо[d]имидазол-2-ил)мочевину или ее фармацевтически приемлемую соль, (R)-1-этил-3-(6-фтор-5-(2-(2-гидроксипропан-2-ил)пиримидин-5-ил)-7-(тетрагидрофуран-2-ил)-1H-бензо[d]имидазол-2-ил)мочевину или ее фармацевтически приемлемую соль, кислую метансульфоновую соль (R)-1-этил-3-(5-(2-(2-гидроксипропан-2-ил)пиримидин-5-ил)-7-(тетрагидрофуран-2-ил)-1H-бензо[d]имидазол-2-ил)мочевины или кислую метансульфоновую соль (R)-1-этил-3-(6-фтор-5-(2-(2-гидроксипропан-2-ил)пиримидин-5-ил)-7-(тетрагидрофуран-2-ил)-1H-бензо[d]имидазол-2-ил)мочевины.
В девятом варианте выполнения настоящее изобретение дополнительно относится к соединению формулы (II)
,
где R представляет собой Н или F, и каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу. Соединение формулы (II) может быть получено способом, включающим получение фенилтетрагидрофуранового производного формулы (IV)
и взаимодействие фенилтетрагидрофуранового производного формулы (IV) с производным бороновой кислоты формулы (III)
в присутствии палладиевого катализатора в полярном растворителе, где каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу, и В* представляет собой , где каждый из R1 и R2 независимо представляет собой алкил или H, или OR1 и OR2 вместе с атомом B, к которому они присоединены, образуют необязательно замещенное 5-, 6- или 7-членное кольцо или BF3X, где X является любым одновалентным катионом.
В некоторых случаях данного варианта осуществления способ дополнительно включает восстановление фенилпиримидинового производного формулы (V)
где R представляет собой Н или F, и каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу, с получением соединения формулы (II).
В десятом варианте осуществления настоящее изобретение относится к соединению формулы (V)
где R представляет собой Н или F, и каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу. Соединение формулы (V) может быть получено способом, включающим получение фенилтетрагидрофуранового производного формулы (IV)
где R представляет собой Н или F, и взаимодействие фенилтетрагидрофуранового производного формулы (IV) с производным бороновой кислоты формулы (III)
в присутствии палладиевого катализатора в полярном растворителе, где каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу, и В* представляет собой , где каждый из R1 и R2 независимо представляет собой алкил или H, или OR1 и OR2 вместе с атомом B, к которому они присоединены, образуют необязательно замещенное 5-, 6- или 7-членное кольцо или BF3X, где X является любым одновалентным катионом, с получением соединения формулы (V).
В одиннадцатом варианте осуществления настоящее изобретение относится к способу получения соединения формулы (I)
или его фармацевтически приемлемой соли, где R представляет собой Н или F, и каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу. Способ включает получение дигидрофуранилнитробензольного соединения формулы
,
где R представляет собой Н или F, и превращение соединения формулы (VIIIa) или (VIIIb) или их комбинации в соединение формулы (I) или его фармацевтически приемлемую соль.
В двенадцатом варианте осуществления настоящее изобретение относится к способу получения дигидрофуранилнитробензольного соединения формулы (VIIIa) или (VIIIb). Способ включает взаимодействие соединения формулы (IX)
где R представляет собой Н или F, с 2,3-дигидрофураном в присутствии палладиевого катализатора с получением дигидрофуранилнитробензольного соединения формулы (VIIIa) или (VIIIb).
В одном варианте этого осуществления способ дополнительно включает взаимодействие соединения формулы (VIIIa) или (VIIIb) с восстанавливающим агентом с получением соединения формулы (VII)
,
где R представляет собой Н или F. В другом варианте выполнения изобретения способ дополнительно включает взаимодействие соединения формулы (VII) с бромирующим агентом в полярном апротонном растворителе с получением соединения формулы (VI). В еще одном варианте выполнения изобретения способ дополнительно включает нитрование соединения формулы (VI) соответствующим нитрующим агентом с получением фенилтетрагидрофуранового соединения формулы (IV). В еще одном дополнительном варианте выполнения изобретения, способ дополнительно включает взаимодействие фенилтетрагидрофуранового соединения формулы (IV) с производным бороновой кислоты формулы (III)
где каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу, и В* представляет собой , где каждый из R1 и R2 независимо представляет собой алкил или H, или OR1 и OR2 вместе с атомом B, к которому они присоединены, образуют необязательно замещенное 5-, 6- или 7-членное кольцо или BF3X, где X является любым одновалентным катионом, в присутствии палладиевого катализатора в полярном растворителе с получением фенилпиримидинового соединения формулы (V)
где R представляет собой Н или F, и каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу; и взаимодействие фенилпиримидинового соединения формулы (V) с подходящим восстанавливающим агентом с получением фенилпиримидинового соединения формулы (II). Способ может дополнительно включать взаимодействие фенилпиримидинового соединения формулы (II) с производным мочевины формулы А или В:
,
где R6 представляет собой необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный насыщенный или ненасыщенный карбоцикл или необязательно замещенный насыщенный или ненасыщенный гетероцикл, с получением соединения формулы (I) и, необязательно, взаимодействие соединения формулы (I) с подходящей кислотой с получением фармацевтически приемлемой соли соединения формулы (I).
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1 представляет собой графическое изображение двух симметрично независимых молекул соединения 12, полученных способом эллипсоида тепловых колебаний.
Фиг. 2 представляет собой графическое изображение двух симметрично независимых молекул соединения 23, полученных способом эллипсоида тепловых колебаний.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к способу получения соединений и их фармацевтически приемлемых солей, полезных в качестве ингибиторов гиразы и антибактериальных агентов. Ингибиторы гиразы по настоящему изобретению, в целом охватываемых патентом США № RE40245 E, и могут быть представлены соединениями формулы (I) или их солями:
,
где R представляет собой Н или F, и каждый из R3, R4 и R5 независимо представляет собой необязательно замещенный алкил или необязательно защищенную гидроксильную группу.
В конкретном варианте осуществления соединения по настоящему изобретению могут быть представлены соединениями формулы (Ia) или их солями:
,
где R представляет собой Н или F.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение следующей структуры:
.
В дополнительных вариантах осуществления изобретения, соединение формулы (I) представляет собой соединение следующей структуры:
.
В дополнительных вариантах осуществления изобретения, соединение формулы (I) представляет собой соединение следующей структуры:
Способ получения соединения формулы (I) отражен на Схеме 1.
Схема 1
На стадии А бромнитробензол (IX), где R представляет собой Н или F, обрабатывают 2,3-дигидрофураном в присутствии подходящего палладиевого катализатора и подходящего основания. Арилирование реакцией Хека при помощи 2,3-дигидрофурана приводит к получению смеси дигидрофуранилнитробензолов формулы (VIIIa) и формулы (VIIIb), где R представляет собой Н или F.
Палладиевый катализатор, используемый в реакции арилирования Хека, может быть любым подходящим катализатором на основе палладия, из числа известных специалистам в данной области. Примеры палладиевых катализаторов, пригодных для реакции арилирования Хека между бромнитробензолом формулы (IX) и 2,3-дигидрофураном, включают комплексы Pd(II), Pd(I) и Pd(0). В одном варианте осуществления комплекс Pd(II), подходящий для целей настоящего изобретения, имеет общую формулу PdX2(фосфин)2, где Х представляет собой одновалентную отрицательно заряженную группу, такую как галоидная группа, а фосфин, как используется здесь, относится к классу соединений, в котором один, два или три атома водорода в соединении PH3 заменены на соответствующее число таких групп, как фенил (Ph), циклогексил (Су), трет-бутил (tBU) или изопропил (iPr). Примеры фосфиновых лигандов для Pd-катализаторов по настоящему изобретению включают ди-трет-бутилметилфосфин, ди-трет-бутилнеопентилфосфин, дициклогексил-(2-метилфенил)фосфин, дициклогексил-(2,4,6-триметилфенил)фосфин, трициклопентилфосфин, трет-бутилдифенилфосфин, циклогексилдифенилфосфин, трис(4-хлорфенил)фосфин, бензилдифенилфосфин, три(м-толил)фосфин, трис(4-метоксифенил)фосфин, 1,3-бис(дифенилфосфино)пропан (dppp), 1,2-бис(дифенилфосфино)этан (dppe), 1,4-бис(дифенилфосфино)бутан (dppb), мезо-2,4-бис(дифенилфосфино)пентан (mbdpp) и 1,3-бис(диизопропилфосфино)пропан (dippp). В другом варианте осуществления Pd-катализаторы, пригодные для реакции арилирования Хека, включают PdCl2(PPh3)2, PdCl2(PCy3)2, PdCl2(PiPr3)2, PdCl2(PhCN)2, Pd(N,N-диметил-β-аланинат)2, PdCl2{PR2(Ph-R’)}2, где R представляет собой трет-бутил и R’ представляет собой 4-диметиламино группу, бис(дибензилиденацетон)палладий(II), ацетат палладия(II), PdCl2(бис-гидразон), дихлорид [1,3-бис(2,6-диизопропилфенил)имидазол-2-илиден](3-хлорпиридил)палладия(II), дихлорид ди(2-пиридил)метанолпалладия, [1,1’-бис(ди-трет-бутилфосфино)ферроцен]дихлорпалладий(II), [1,1’-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (Pd(dppf)Cl2), (NHC)Pd(аллил)Cl, где NHC представляет собой N-гетероциклический карбен, такой как N,N’-бис(2,6-диизопропилфенил)имидазол)-2-илиден, N,N’-бис(2,6-диизопропилфенил)-4,5-дигидроимидазол)-2-илиден, N,N’-бис(2,4,6-триметилфенил)имидазол)-2-илиден и N,N’-бис-трет-бутил-имидазол)-2-илиден. В некоторых вариантах выполнения изобретения, одни или несколько лигандов Pd могут быть связаны с субстратом, таким как частица. Примеры таких катализаторов включают (Ar’Ph2P)2PdCl2, где Ar’ группа является частью полимера таким образом, что катализатор представляет собой полимерный палладиевый катализатор. В другом варианте осуществления комплексные соединения Pd(0), полезные для целей настоящего изобретения, включают Pd(фосфин)4 (например, Pd(PPh3)4, Pd(PCy3)4, Pd(PiPr3)4, Pd(tBu3P)2 и трис(дибензилиденацетон)дипалладий(0). В еще одном варианте осуществления Pd(I)-катализаторы, полезные для целей настоящего изобретения, включают Pd2X2(фосфин)2, где X представляет собой одновалентный анион, такой как галоидное соединение. Пример такого Pd(I)-катализатора включает Pd2Br2(tBu3P)2.
В некоторых вариантах осуществления изобретения палладиевый катализатор, используемый в реакции арилирования Хека, может быть любым подходящим хиральным палладиевым катализатором, из числа известных специалистам в данной области. Примеры хиральных палладиевых катализаторов, подходящих для реакции арилирования Хека между бромнитробензолом формулы (IX) и 2,3-дигидрофураном, включают комплексы Pd(II) и Pd(0) с 2,2’-бис(дифенилфосфино)бинафтилом (ΒIΝΑΡ), с другими лигандами типа ΒIΝΑΡ, c JosiPhos, с другими лигандами типа JosiPhos, PhanePhos, SynPhos, DifluoroPhos, SegPhos, P-Phos, TunePhos, 2,4-бис(дифенилфосфино)пентаном и Phox. Реакции арилирования Хека, которые проводились с использованием хиральных палладиевых катализаторов, могут привести к получению энантиомерно обогащенного дигидрофуранилнитробензольного соединения(ий) формулы (VIIIa) и/или формулы (VIIIb), где R представляет собой Н или F. В некоторых вариантах осуществления изобретения, энантиомерный избыток дигидрофуранилнитробензольного соединения(ий) формулы (VIIIa) и/или формулы (VIIIb) может составлять приблизительно 5-100%, приблизительно 10-100%, приблизительно 20-100%, приблизительно 30-100%, приблизительно 40-100%, приблизительно 50-100%, приблизительно 60-100%, приблизительно 70-100%, приблизительно 80-100%, приблизительно 85-100%, приблизительно 90-100%, приблизительно 91-100%, приблизительно 92-100%, приблизительно 93-100%, приблизительно 94-100%, приблизительно 95-100%, приблизительно 96-100%, приблизительно 97-100%, приблизительно 98-100%, приблизительно 99-100% или составлять приблизительно 100%. Таким образом, любое хиральное соединение, полученное из энантиомерно обогащенного соединения(ий) формулы (VIIIa) и/или (VIIIb), также может содержать избыток одного из двух энантиомеров.
Основание, используемое в реакции арилирования Хека, может быть любым подходящим основанием, из числа известных специалистам в данной области. Примеры оснований, подходящих для реакции арилирования Хека между бромнитробензолом формулы (IX) и 2,3-дигидрофураном, включают карбонат калия, карбонат натрия, карбонат цезия, бикарбонат натрия, фосфат калия, трет-бутоксид натрия, трет-бутоксид калия, триэтиламин, диизопропилэтиламин, 1,8-бис(диметиламино)нафталин, дициклогексиламин, дициклогексилметиламин, 2,6-лутидин, ацетат натрия и ацетат калия.
В качестве растворителя для реакции арилирования Хека может использоваться любой подходящий растворитель, из числа известных специалистам в данной области техники. Примеры растворителей, подходящих для реакции арилирования Хека между бромнитробензолом формулы (IX) и 2,3-дигидрофураном, включают 1,4-диоксан, тетрагидрофуран, 1,2-диметоксиэтан, толуол, Ν,Ν-диметилформамид, диметилсульфоксид, ацетонитрил и N,N-диметилацетамид.
Реакцию арилирования Хека можно проводить при любой подходящей температуре в диапазоне от 0°С до 200°С. В некоторых вариантах осуществления изобретения, реакция может быть проведена при температуре между 50 и 150°С. В других вариантах осуществления реакция может быть проведена при температуре между 75 и 125°С. В других вариантах осуществления реакция может быть проведена при температуре между 90 и 110°С.
На стадии B одно из дигидрофуранилнитробензольных соединений (VIIIa) и (VIIIb), или смеси дигидрофуранилнитробензольных соединений (VIIIa) и (VIIIb), где R представляет собой Н или F, обрабатывают газообразным водородом в присутствии катализатора на основе переходного металла и основания. Каталитическое гидрирование ароматических нитро заместителей и двойной связи в дигидрофуранильном заместителе приводит к получению тетрагидрофураниланилинового соединения формулы (VII), где R представляет собой Н или F.
Катализатор на основе переходного металла, используемый в реакции каталитического гидрирования, может быть любым подходящим катализатором, из числа известных специалистам в данной области техники. Примеры катализаторов на основе переходных металлов, пригодных для каталитического гидрирования дигидрофуранилнитробензольных соединений (VIIIa) и (VIIIb), включают палладий на угле, платину на угле, оксид платины и т.п.
Основание, используемое в реакции каталитического гидрирования, может быть любым подходящим основанием, из числа известных специалистам в данной области. Примеры оснований, пригодных для каталитического гидрирования дигидрофуранилнитробензольных соединений (VIIIa) и (VIIIb), включают карбонат калия, карбонат натрия, карбонат цезия, бикарбонат натрия, фосфат калия, триэтиламин, диизопропилэтиламин и другие аминооснования, такие как пиридин, 2,6-лутидин, дициклогексилметиламин, пирролидин и метилпирролидин.
Каталитическое гидрирование может быть выполнено в любом подходящем растворителе, из числа известных специалистам в данной области. Примеры растворителей, подходящих для каталитического гидрирования дигидрофуранилнитробензольных соединений (VIIIa) и (VIIIb), включают метанол, этанол, изопропанол, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, этилацетат, гексан и толуол, а также любые их смеси.
Каталитическую реакцию гидрирования можно проводить при любой подходящей температуре в диапазоне от -50 до 100°С. В некоторых вариантах осуществления реакция может быть проведена при температуре в диапазоне от 0 до 50°С. В других вариантах осуществления реакция может быть проведена при температуре между 10 и 40°С. В других вариантах осуществления реакция может быть проведена при температуре между 20 и 30°С.
Каталитическая реакция гидрирования может быть проведена при любом подход