Иммуногенная композиция презентации множественных антигенов, относящиеся к ней способы и применения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к иммуногенным системам презентации множественных антигенов, и может быть использовано в медицине. Иммуногенная композиция против одного или более из антигенного полисахарида, пептидного антигена или полипептидного антигена содержит по меньшей мере один антигенный полисахарид, по меньшей мере один пептидный или полипептидный антиген и по меньшей мере одну комплементарную пару аффинных молекул. При этом первая аффинная молекула связана с по меньшей мере одним антигенным полисахаридом, а комплементарная аффинная молекула связана с по меньшей мере одним пептидным или полипептидным антигеном, причем первая аффинная молекула связывается с комплементарной аффинной молекулой для соединения пептидного или полипептидного антигена и антигенного полисахарида. Изобретение позволяет вызывать как гуморальные, так и клеточные иммунные ответы в отношении одного или множественных антигенов одновременно. 3 н. и 17 з.п. ф-лы, 40 ил., 4 табл., 4 пр.
Реферат
Ссылка на родственные заявки
Настоящая заявка испрашивает приоритет согласно 35 U.S.С. § 119(е) по предварительной заявке на выдачу патента США №61/484934, поданной 11 мая 2011, предварительной заявке на выдачу патента США №61/608168, поданной 8 марта 2012 и предварительной заявке на выдачу патента США №61/609974, поданной 13 марта 2012, содержание каждой из которых полностью включено в настоящий документ посредством ссылки.
Область техники
Настоящее изобретение относится к молекулярной генетике, иммунологии и микробиологии. Настоящая заявка, в общем, направлена на композиции и способы получения иммуногенных композиций. Более конкретно, вариант осуществления настоящего изобретения относится к иммуногенному макрокомплексу, содержащему по меньшей мере один белковый или пептидный антиген, прикрепленный к полимеру, такому как полисахарид, который может также представлять собой антиген. Согласно некоторым вариантам осуществления этот комплекс может применяться в качестве иммуногенной композиции, такой как вакцина, для предоставления синергического гуморального и клеточного иммунного ответа; и согласно некоторым вариантам осуществления вызывает синергическую опосредованную антителами и клетками защиту от патогенов, например, летальной инфекции и носительства таких патогенов на слизистых оболочках.
Уровень техники
Вакцины предусматривают профилактику и лечение разнообразных заболеваний, включающих в себя микробную инфекцию, вирусную инфекцию и злокачественные опухоли. Используемые в настоящее время вакцины на полисахаридной основе, тем не менее, не всегда эффективны у большинства уязвимых групп населения. Например, вызванные Streptococcus pneumonia (пневмококком) и Salmonella typhi инфекции представляют собой два основных заболевания детей в развивающихся странах. Для брюшного типа разрешенные к применению Vi полисахаридные вакцины являются неэффективными у детей младше двух лет. Тем не менее, успешное применение вакцин на полисахаридной основе и пассивная иммунизация для профилактики колонизации или заболевание продемонстрировала важность капсульных антител, в частности, в борьбе с заболеванием, вызванным S. pneumoniae. Более того, исследования как на животных, так и на людях показывают, что антитела, активированные в результате пневмококковой вакцинации, могут защищать от назофарингеальной (NP) пневмококковой колонизации, которая предшествует пневмококковому заболеванию.
Ограничение используемых в настоящее время полисахаридных пневмококковых вакцин состоит в том, что защита с помощью антикапсульного антитела ограничена специфичностью его серотипа. Например, хотя 7-валентеная пневмококковая конъюгированная вакцина (PCV7) значительно снижала заболеваемость инвазивным пневмококковым заболеванием, вызванным штаммами вакцинного типа (VT), показали, что не относящиеся к VT серотипы постепенно замещают VT пневмококковые популяции, потенциально ограничивая полезность вакцины. Это привело к оценке того, можно ли предотвратить пневмококковую колонизацию с помощью иммунизации консервативными антигенами. В частности, некоторые пневмококковые белки были оценены в качестве кандидатов вакцины на животных моделях пневмококковой колонизации. Было показано, что иммунизация слизистых оболочек некоторыми из этих белков активирует системные антитела и антитела в слизистых оболочках и предоставляет защиту от пневмококкового заболевания и колонизации. Остается необходимость в иммуногенной композиции, которая включает в себя как пневмококковые полисахариды, так и белки, способной вызывать устойчивые как клеточные, так и гуморальные иммунные ответы на все пневмококковые серотипы.
Кроме того, врожденный иммунный ответ предусматривает быструю и обычно эффективную защиту от микробных патогенов. Этот ответ включает в себя клеточное распознавание связанных с патогеном молекул, запускающее выработку и высвобождение медиаторов воспаления, рекрутинг лейкоцитов и активацию противомикробных эффекторов. Toll-подобные рецепторы (TLR), из которых по меньшей мере одиннадцать были описаны для млекопитающих, способны различать среди разнообразия связанных с патогеном молекул и вызывать защитные ответы. Например, TLR4 распознает многие продукты микроорганизмов, включая в себя продукты от грамотрицательных бактерий, F белок респираторно-синцитиального вируса и зависимые от холестерина цитолизины (CDC) грамположительных бактерий. Кроме того, TLR2 распознает большое число микробных и синтетических соединений. Таким образом, включение таких агонистов TLR может усилить иммунный ответ на вакцины. Остается необходимость в улучшении эффективности вакцин активации врожденного иммунного ответа (опосредованного TLR или другого) против инфекций, таких как пневмококковая колонизация и заболевание.
Сущность изобретения
Настоящее изобретение относится к иммуногенной системе презентации множественных антигенов (MAPS), применимой для получения иммуногенных композиций, таких как применимые в вакцинах композиции. В частности, настоящее изобретение относится к композициям, содержащим иммуногенный комплекс, содержащий по меньшей мере один тип полимера, например, полисахарид, который может быть, необязательно, антигенным; по меньшей мере один антигенный белок или пептид; и по меньшей мере одну комплементарную пару аффинных молекул, содержащую (i) первую аффинную молекулу, которая связана с полимером, и (ii) комплементарную аффинную молекулу, которая связана с белком или пептидом; так чтобы первая и комплементарная аффинные молекулы служили в качестве опосредованной сшивки между полимером и антигенным белком или пептидом. Соответственно, полимер может прикреплять по меньшей мере 1, или по меньшей мере 2, или множество одинаковых или различных белковых или пептидных антигенов. Согласно некоторым вариантам осуществления полимер является антигенным, например, полимер представляет собой пневмококковый капсульный полисахарид. Согласно некоторым вариантам осуществления белковые или пептидные антигены представляют собой рекомбинантные белковые или пептидные антигены.
Раскрытые в настоящем документе иммуногенные композиции могут одновременно вызывать как гуморальные, так и клеточные ответы на один или множество антигенов. Иммуногенные композиции обеспечивают долгосрочную иммунологическую память, потенциально защищающую субъект от инфекции в будущем. Это предусматривает возможность для отдельной иммуногенной композиции, которая вызывает высокий титр функционального антиполисахаридного антитела, и является аналогичной или выгодно отличается от уровней антител, индуцируемых традиционной конъюгированной вакциной. Более того, нет ограничения в отношении специфического белка-носителя и различные антигенные белки могут применяться в конструкте MAPS для генерации устойчивого ответа антиполисахаридных антител. Кроме того, сильный ответ антител и ответы Th17/Th1 являются специфическими ко множественным белковым антигенам, подвергнутым презентации посредством композиции MAPS. Это представляет собой главное преимущество в качестве средства для активации двух форм иммунитета с помощью одного конструкта. В дополнение к более традиционному иммунному ответу на антигенный полисахарид, конъюгированный с белковым носителем, настоящее изобретение предусматривает Т-клеточный ответ и, конкретнее, ответы Th17 и Th1 на белки, системно введенные с помощью инъекции. Более того, иммуногенная композиция по настоящему изобретению может встраивать лиганды в полимерный остов. Это предоставляет потенциальное усиление специфических B-клеточных или T-клеточных ответов путем модификации соотношения белок/полимер, размера комплекса или путем встраивания специфического фактора костимуляции, такого как лиганды TLR2/4 и т.д. в композицию.
По сравнению с типичной технологией конъюгации, которая включает в себя грубую обработку белков, настоящие способы позволяют избежать риска денатурации или другой модификации пептидного антигена. Это предоставляет существенное преимущество в сохранении антигенности включенных белков и увеличивает вероятность того, что сам белок будет служить в качестве антигена (а не просто носителя). Аналогично, настоящие способы позволяют избежать ненужной модификации/повреждения полисахаридного остова, поскольку в настоящем документе отсутствует сильное химическое сшивание: можно точно контролировать биотинилирование для реакции со специфическими функциональными группами полисахарида, и уровень биотинилирования можно легко регулировать. Это является преимущественным в избегании типичного способа конъюгации, который приводит к повреждению критически важных боковых цепей или эпитопов, что может вызвать сниженную иммуногенность и защиту.
Настоящая основанная на аффинности сборка предусматривает простое и высоко адаптивное получение иммуногенной композиции. Она является высоко специфической и стабильной; она может храниться в холоде в течение месяцев и сохранять свою активность. Способ сборки является достаточно простым для обеспечения высокой воспроизводимость; необходимо лишь несколько стадий для снижения риска разброса характеристик изделия от партии к партии, что представляет собой большое промышленное преимущество. Сборка MAPS является высоко эффективной (свыше 95%), даже при низких концентрациях белка и полисахарида (таких как 0,1 мг/мл); это представляет собой основное преимущество, поскольку низкие производительности в производстве конъюгатов (как правило производительности находятся в диапазоне <50%) представляют собой главное затруднение и причину высокой стоимости вакцин. В отношении получения состава: легко регулировать состав и физические свойства конечного продукта. Соотношение белок:полимер в комплексе является регулируемым; с помощью умеренного биотинилирования полимера соотношение белок:полимер может составлять 10:1 (вес/вес) или более; наоборот, соотношение может составлять 1:10 или менее, если это представляет интерес с точки зрения иммунологических целей. Кроме того, размер иммуногенной композиции MAPS может регулироваться путем выбора размера полимера. Способы получения MAPS предусматривают простоту в комбинировании белков и полимеров с небольшой модификацией. Возможная многовалентность конечного продукта путем загрузки множественных белковых антигенов, их одинаковых или различных патогенов (например, пневмококк и туберкулез), в один иммуногенный конструкт предусматривает композицию, которая может применяться для уменьшения количества вакцин, необходимых для иммунизации субъекта против более чем одного заболевания. Более того, композиция MAPS является высоко стабильной; становясь диссоциированной только при кипячении и поддерживая иммуногенность даже после многих месяцев при 4°С. Иммуногенность комплекса MAPS может быть ограничена стабильностью антигенного белкового или пептидного компонента, чья стабильность может быть увеличена путем включения в комплекс MAPS. Используемые в настоящем документе специфические антигены проявляли стабильность при комнатной температуре и после по меньшей мере одного цикла замораживание-оттаивание. Это предусматривает важное преимущество по сравнению с используемыми в настоящее время вакцинами, которые повреждаются, если правильно не поддерживать "холодовую цепь".
Соответственно, один аспект настоящего изобретения относится к иммуногенной композиции, содержащей полимер, по меньшей мере один белковый или пептидный антиген, и по меньшей мере одну комплементарную пару аффинных молекул, в которой комплементарная пара аффинных молекул содержит первую аффинную молекулу, которая связана с полимером, и комплементарную аффинную молекулу, которая связана с белковым или пептидным антигеном так, что когда первая аффинная молекула связывается с комплементарной аффинной молекулой, она опосредованно сшивает антиген с полимером.
Согласно некоторым вариантам осуществления первая аффинная молекула сшита с полимером с помощью сшивающего реагента, например, сшивающего реагента, выбранного из следующего: CDAP (тетрафторборат 1-циано-4-диметиламинопиридиния), EDC (1-этил-3-[3-диметиламинопропил]карбодиимидгидрохлорид), цианоборогидрид натрия; цианогенбромид; или бикарбонат аммония/йодуксусная кислота. Согласно некоторым вариантам осуществления первая аффинная молекула сшита с карбоксильной, гидроксильной, амино, феноксильной, гемиацетальной и меркапто функциональными группами полимера. Согласно некоторым вариантам осуществления первая аффинная молекула ковалентно связана с полимером.
Согласно некоторым вариантам осуществления первая аффинная молекула представляет собой биотин или его производное или молекулу с аналогичной биотину структурой или физическим свойством, например, амин-PEG3-биотин ((+)-биотинил-3-6,9-триоксаундекандиамин) или его производное.
Согласно некоторым вариантам осуществления белковый или пептидный антиген иммуногенной композиции представляет собой белок слияния, содержащий антигенный белок или пептид, слитый с комплементарной аффинной связывающей молекулой. Слияние может представлять собой генетический конструкт, т.е., рекомбинантный пептид или белок слияния. Согласно некоторым вариантам осуществления антиген может быть ковалентно прикреплен в виде белка слияния к комплементарной аффинной молекуле. Согласно альтернативным вариантам осуществления антиген нековалентно прикреплен к комплементарной аффинной молекуле.
Согласно некоторым вариантам осуществления комплементарная аффинная молекула представляет собой связывающий биотин белок или его производное или функциональную часть. Согласно некоторым вариантам осуществления комплементарная аффинная молекула представляет собой авидиноподобный белок или его производное или функциональную часть, например, без ограничения, ризавидин или его производное. Согласно некоторым вариантам осуществления комплементарная аффинная молекула представляет собой авидин или стрептавидин или его производное или функциональную часть.
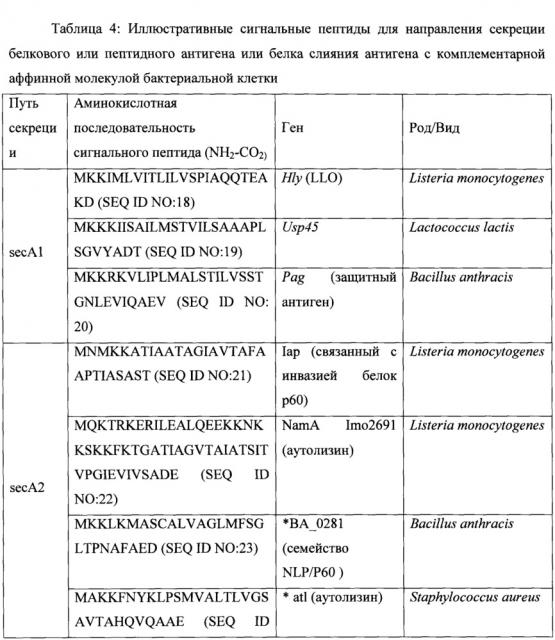
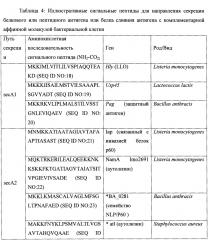
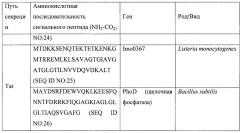
Согласно некоторым вариантам осуществления сигнальный пептид секреции расположен на N-конце авидиноподобного белка. Может использоваться любая сигнальная последовательность, известная специалистам в настоящей области техники; и согласно некоторым вариантам осуществления сигнальная последовательность представляет собой MKKIWLALAGLVLAFSASA (SEQ ID NO:1) или ее производное или функциональная часть. Согласно некоторым вариантам осуществления антиген может быть слит с комплементарной аффинной молекулой посредством гибкого линкерного пептида, причем гибкий линкерный пептид прикрепляет антиген к комплементарной аффинной молекуле.
Согласно некоторым вариантам осуществления полимерный компонент иммуногена содержит полимер, полученный из живого организма, например, полисахарид. Согласно некоторым вариантам осуществления полимер может быть очищен и выделен из естественного источника или может быть синтезированным с естественным составом/структурой или он может быть синтетическим (например, с искусственным составом/структурой) полимером. Согласно некоторым вариантам осуществления полимер получают из организма, выбранного из группы, состоящей из: бактерий, архей или эукариотических клеток, например, клеток грибов, насекомого, растения или их химер. Согласно некоторым вариантам осуществления полимер представляет собой полисахарид, полученный из патогенной бактерии. Согласно конкретным вариантам осуществления полисахарид представляет собой пневмококковый капсульный полисахарид, пневмококковый полисахарид клеточной стенки или Vi полисахарид Salmonella typhi.
Согласно некоторым вариантам осуществления полимер раскрытой в настоящем документе иммуногенной композиций представляет собой полимер с разветвленной цепью, например, разветвленный полисахарид, или альтернативно, может представлять собой полимер неразветвленной цепью, например, одноцепочечный полимер, например, полисахарид. Согласно некоторым вариантам осуществления полимер представляет собой полисахарид, например, декстран или его производное. Согласно некоторым вариантам осуществления полимер, например, полисахарид декстран может характеризоваться средней молекулярной массой, составляющей 425 кДа - 500 кДа, включительно, или согласно некоторым вариантам осуществления более чем 500 кДа. Согласно некоторым вариантам осуществления полимер, например, полисахарид декстран может характеризоваться средней молекулярной массой, составляющей 60 кДа - 90 кДа, включительно, или согласно некоторым вариантам осуществления менее чем 70 кДа. Полимер декстран может быть получен из бактерии, такой как Leuconostoc mesenteroides.
Согласно некоторым вариантам осуществления раскрытая в настоящем документе иммуногенная композиция содержит по меньшей мере 2 антигена, или по меньшей мере 3 антигена, или по меньшей мере 5 антигенов, или 2-10 антигенов, или 10-15 антигенов, или 15-20 антигенов, или 20-50 антигенов, или 50-100 антигенов, или более чем 100 антигенов, включительно. Согласно некоторым вариантам осуществления, если раскрытая в настоящем документе иммуногенная композиция содержит по меньшей мере 2 антигенов, антигены могут быть одинаковым антигеном или по меньшей мере 2 различными антигенами. Согласно некоторым вариантам осуществления антигены могут происходить из одинаковых или различных патогенов, или могут представлять собой различные эпитопы или части одного и того же антигенного белка, или могут быть одним и тем же антигеном, который является специфическим к различным серотипам или сезонным вариантам одного и того же патогена (например, вирус гриппа А, В, и С).
Согласно некоторым вариантам осуществления раскрытая в настоящем документе иммуногенная композиция содержит антиген из патогенного организма или аномальной ткани. Согласно некоторым вариантам осуществления антиген представляет собой опухолевый антиген. Согласно некоторым вариантам осуществления антиген может представлять собой по меньшей мере один антиген, выбранный из антигенов патогенов или паразитов, таких как антигены Streptococcus pneumoniae, Mycobacterium tuberculosis или M. tetanus, Bacillus anthracis, ВИЧ, антигены сезонного или эпидемического гриппа (такие как H1N1 или H5N1), Bordetella pertussis, Staphylococcus aureus, Neisseria meningitidis или N. gonorrhoeae, ВПЧ, Chlamydia trachomatis, ВПГ или другие вирусы герпеса, или вид Plasmodia. Эти антигены могут включать в себя пептиды, белки, гликопротеины или полисахариды. Согласно некоторым вариантам осуществления антиген представляет собой анатоксин или часть токсина.
Согласно некоторым вариантам осуществления раскрытая в настоящем документе иммуногенная композиция содержит антигенный полисахарид, например, такой как Vi антиген (капсульный полисахарид Salmonella typhi), пневмококковые капсульные полисахариды, пневмококковый полисахарид клеточной стенки, капсульный полисахарид Hib (Haemophilus influenzae типа В), менингококковые капсульные полисахариды, полисахарид Bacillus anthracis (возбудитель сибирской язвы) и другие бактериальные капсульные полисахариды или полисахариды клеточной стенки, или любые их комбинации. Полисахарид может характеризоваться белковым компонентом, например, гликопротеином, таким как гликопротеины из вирусов.
Согласно некоторым вариантам осуществления раскрытая в настоящем документе иммуногенная композиция дополнительно содержит по меньшей мере один фактор костимуляции, связанный с полимером или полисахаридом, причем фактор костимуляции может быть связан прямо или опосредованно. Например, согласно определенному варианту осуществления фактор костимуляции может быть ковалентно прикреплен к полимеру. Например, согласно некоторым вариантам осуществления фактор костимуляции может быть ковалентно прикреплен к первой аффинной молекуле, которая затем сшивается с полимером. Например, согласно некоторым вариантам осуществления фактор костимуляции может быть прикреплен к комплементарной аффинной молекуле, которая связывается с первой аффинной молекулой для сшивания фактора костимуляции с полимером. Согласно некоторым вариантам осуществления фактор костимуляции представляет собой адъювант. Согласно альтернативным вариантам осуществления костимулирующий фактор может быть любым известным специалисту в настоящей области техники и включает в себя любую комбинацию, например, без ограничения, агонисты Toll-подобного рецептора (агонисты для TLR2, 3, 4, 5 7, 8, 9 и т.д.), агонисты NOD или агонисты инфламмасомы.
Другой аспект настоящего изобретения относится к применению раскрытой в настоящем документе иммуногенной композиции, подлежащей введению субъекту для активации иммунного ответа у субъекта. Согласно некоторым вариантам осуществления иммунный ответ представляет собой ответ антител/В клеток, CD4+ Т-клеточный ответ (включая в себя клетки Th1, Th2 и Th17) и/или CD8+ Т-клеточный ответ. Согласно некоторым вариантам осуществления по меньшей мере один адъювант вводят совместно с иммуногенной композицией.
Другой аспект настоящего изобретения относится к способу индукции иммунного ответа у субъекта по меньшей мере к одному антигену, включающему введение субъекту раскрытой в настоящем документе иммуногенной композиции.
Другой аспект настоящего изобретения относится к способу вакцинации животного, например, птицы, млекопитающего или человека, портив по меньшей мере одного антигена, включающему введение вакцинной композиции, содержащей раскрытую в настоящем документе иммуногенную композицию.
Согласно всем раскрытым в настоящем документе аспектам животное или субъект может представлять собой человека. Согласно некоторым вариантам осуществления субъект может быть сельскохозяйственным или диким животным, или домашним животным. Согласно некоторым вариантам осуществления вакцинная композиция, содержащая раскрытую в настоящем документе иммуногенную композицию, может быть введена посредством подкожной, интраназальной, пероральной, сублингвальной, вагинальной, ректальной, интрадермальной, интраперитонеальной, внутримышечной инъекции или посредством кожного пластыря для чрескожной иммунизации.
Согласно всем раскрытым в настоящем документе аспектам иммунный ответ представляет собой ответ антител/В-клеток, CD4+ Т-клеточный ответ (включая в себя ответы Th1, Th2 и Th17) или CD8+ Т-клеточный ответ против белкового(ых)/пептидного(ых) антигена(ов). Согласно некоторым вариантам осуществления иммунный ответ представляет собой ответ антител/В-клеток против полимера, например, пневмококкового полисахарида. Согласно некоторым вариантам осуществления по меньшей мере один адъювант вводят совместно с иммуногенной композиции.
Другой аспект настоящего изобретения относится к применению раскрытой в настоящем документе иммуногенной композиции для применения в диагностике в отношении воздействия со стороны патогенов или иммуногенного средства.
Другой аспект настоящего изобретения относится к наборам для получения раскрытой в настоящем документе иммуногенной композиции. Например, такие наборы могут содержать любой один или несколько следующих материалов: контейнер, содержащий полимер, например, полисахарид, сшитый с множеством первых аффинных молекул; и контейнер, содержащий комплементарную аффинную молекулу, которая связана с первой аффинной молекулой, причем комплементарная аффинная молекула связывается с антигеном.
Согласно другому варианту осуществления набор может содержать контейнер, содержащий полимер, например, полисахарид; контейнер, содержащий множество первых аффинных молекул; и контейнер, содержащий сшивающую молекулу для сшивания первых аффинных молекул с полимером. Согласно некоторым вариантам осуществления набор может содержать по меньшей мере один фактор костимуляции, который может быть добавлен к полимеру. Согласно некоторым вариантам осуществления набор содержит сшивающий реагент, например, без ограничения CDAP(тетрафторборат 1-циано-4-диметиламинопиридиния), EDC (1-этил-3-[3-диметиламинопропил]карбодиимидгидрохлорид), цианоборогидрид натрия; цианогенбромид; бикарбонат аммония/йодуксусная кислота для сшивания кофактора с полимером или полисахаридом. Согласно некоторым вариантам осуществления набор дополнительно содержит средство для прикрепления комплементарной аффинной молекулы к белковому или пептидному антигену, причем средство может быть предусмотрено с использованием сшивающего реагента или определенного промежуточного белка слияния.
Согласно некоторым вариантам осуществления набор может содержать контейнер, содержащий вектор экспрессии для экспрессии белка слияния белкового или пептидного антигена с аффинной молекулой, например, вектор экспрессии для экспрессии белкового или пептидного антигена в виде белка слияния с комплементарной аффинной молекулой. Согласно некоторым вариантам осуществления вектор может необязательно содержать последовательность для линкерного пептида, причем вектор экспрессии может экспрессировать белок слияния антигена с комплементарной аффинной молекулой, содержащий линкерный пептид, расположенный между антигеном и аффинной молекулой.
Согласно некоторым вариантам осуществления набор может необязательно содержать контейнер, содержащий комплементарную аффинную молекулу, которая связывается с первой аффинной молекулой, причем комплементарная аффинная молекула связывается с пептидным/белковым антигеном. Согласно некоторым вариантам осуществления набор может кроме того дополнительно содержать средство для прикрепления комплементарной аффинной молекулы к антигену, например, с использованием раскрытого в настоящем документе сшивающего реагента или другого промежуточного белка, такого как двухвалентное антитело или фрагмент антитела.
Также в настоящем документе предусматривается способ вакцинации субъекта, например, млекопитающего, например, человека с помощью раскрытых в настоящем документе иммуногенных композиций, включающий введение раскрытой в настоящем документе вакцинной композиции субъекту.
Краткое описание чертежей
На фиг.1 представлено схематическое изображение системы презентации множественных антигенов (MAPS). MAPS представляет новую платформу сложной иммуногенной композиции, которая получена путем прикрепления ряда белковых антигенов к полисахариду или полисахаридному антигену посредством стабильного взаимодействия аффинной пары, такой как пара авидин-биотин. Согласно одному варианту осуществления комплекса MAPS белковые антигены из одного или различных патогенов рекомбинантно слиты с авидиноподобным белком и экспрессированы в Е. coli. Полисахаридный остов, который может быть выбран из множества патогенов, является биотинилированным и/или сшитым с факторами костимуляции или без них с использованием тетрафторбората 1-циано-4-диметиламинопиридиния (CDAP) или 1-этил-3-[3-диметиламинопропил]карбодиимидгидрохлорида (EDC) в качестве активирующего реагента. Комплекс MAPS может быть без труда собран путем простого перемешивания и инкубации очищенных антигенов слияния, одного или множественных, в необходимом соотношении, с биотинилированным полисахаридом. Собранный комплекс MAPS может быть очищен/разделен в соответствии с размером с помощью гель-фильтрационной хроматографии.
На фиг.2 показаны иллюстративные примеры биотинилирования полисахарида: структуры производного биотина, амин-PEG3-биотина (также известного как (+)-биотинил-3-6,9-триоксаундекандиамин); структура CDAP; и структура EDC. На фигуре также показано схематическое изображение способа биотинилирования полисахаридов в использованием CDAP в качестве активирующего реагента, способ (1) или с использованием EDC в качестве активирующего реагента, способ (2). Другие процедуры биотинилирования включены в способы настоящего изобретения.
На фиг.3А-3С показан вариант осуществления рекомбинантного ризавидина и белка слияния ризавидина с антигеном. На фиг.3А показано схематическое изображение конструкции модифицированного ризавидина (вверху) и белка слияния ризавидина с антигеном (внизу). Все конструкты клонировали в вектор PET21b и трансформировали в штамм BL21 (DE3) Е. coli для экспрессии. На фиг.3B показан SDS-PAGE (электрофорез в полиакриламидном геле с использованием додецилсульфата натрия) очищенного рекомбинантного ризавидина (rRhavi). На фиг.3С показан SDS-PAGE очищенных белков слияния ризавидина (rhavi) с антигеном. Дорожка 1, rhavi-Pdt; дорожка 2, rhavi-PsaA; дорожка 3, rhavi-sp1733; дорожка 4, rhavi-sp1534; дорожка 5, rhavi-sp0435; дорожка 6, rhavi-sp1458; дорожка 7, rhavi-ESAT-6/Cfp10; дорожка 8, rhavi-TB9.8/TB10.4; дорожка 9, rhavi-MPT64; м 10, rhavi-MPT83.
На фиг.4А-4С показан профиль элюции собранной иллюстративной MAPS. На фиг.4А MAPS собирали путем инкубации 0,5 мг очищенного rRhavi с 1 мг биотинилированного декстрана 90 (BD90, средний MB 60-90 кДа) при 4°С в течение ночи и затем наносили на колонку superdex-200. Пик А и пик В указывали на элюированные фракции, содержащие комплекс MAPS, пик С указывал на элюированные фракции, содержащие свободный rRhavi. На фиг.4B показан SDS-PAGE пиковых фракций. Все образцы кипятили в SDS буфере для образцов с 10 мМ DTT. На фиг.4С показана стабильность комплекса MAPS. Обрабатывали равные количества образца и затем наносили на SDS-PAGE. Комплекс MAPS оставался интактным даже после обработки SDS буфером для образцов, содержащим восстановитель (дорожка 1) и может быть разрушен только после кипячения, что является доказательством стабильности ассоциации. Дорожка 1, MAPS, обработанный SDS буфером для образцов, содержащим 10 мМ DTT, при комнатной температуре в течение 10 мин; дорожка 2, MAPS, обработанный SDS буфером для образцов без DTT, подвергнутая кипячению в течение 10 мин; дорожка 3, MAPS, обработанный SDS буфером для образцов, содержащим 10 мМ DTT, подвергнутая кипячению в течение 10 мин.
На фиг.5 показана сборка комплекса MAPS при различной температуре и при различной концентрации PS и белкового антигена. Комплекс MAPS может быть эффективно собран в широком диапазоне концентраций полисахарида (PS) или белкового антигена (до 0,1 мг/мл). Сборка может осуществляться в помощью инкубации в течение ночи при 4°С (фиг.5А) или при 25°С (фиг.5B) в зависимости от стабильности антигенов. Эффективность сборки комплекса MAPS может быть оценена путем пропускания смеси для сборки через SDS-PAGE, с предварительным кипячением образца или без него. Без обработки кипячением белковые антигены, которые были включены в комплекс MAPS, остаются на PS и, таким образом, проявляются как полосы очень большой молекулярной массы на геле (MAPS/PS); только несвязанные белки будут опускаться ниже на геле и обнаруживаться при предполагаемой молекулярной массе антигена (положение мономера или димера). Путем сравнения полосы белкового антигена перед и после кипячения можно оценить процентное отношение антигенов, собранных в комплекс MAPS. В общем, эффективность сборки при 4°С составляет более чем 85% и при 25°С она близка к 95%-99%.
На фиг.6 показаны профили элюции MAPS, собранной с различными соотношениями белка к полисахариду. 0,5 мг очищенного rRhavi инкубировали в течение ночи или с 1 мг, 0,5 мг, или с 0,1 мг BD90, соответственно, и затем наносили на систему для гель-фильтрационной хроматографии с использованием колонки superdex 200. Оказалось, что комплекс MAPS, собранный при высоком соотношении белка к полисахариду, имел более высокую молекулярную массу, чем собранный при низком соотношении комплекс. Собирали пиковые фракции, содержащие комплекс MAPS для каждого образца (обозначены стрелками). Измеряли соотношение белка к полисахариду в очищенном комплексу MAPS и показали хорошую корреляцию с исходным соотношением.
На фиг.7 показаны профили элюции MAPS, собранного с различными размерами полисахарида. 0,5 мг антигена слияния инкубировали с 0,25 мг биотинилированного декстрана со средней молекулярной массой 425-500 кДа (BD500), 150 кДа (BD150) или 60-90 кДа (BD90). Комплекс MAPS разделяли с использованием колонки Superpose 6; хроматографический профиль показал, что собранный с большим полисахаридом комплекс имел больший размер.
На фиг.8A-8D показана сборка MAPS с множественными антигенами. На фиг.8А показана сборка MAPS с двумя антигенами при различных соотношениях. Двухвалентный комплекс MAPS получали путем инкубации биотинилированного капсульного полисахарида серотипа 14 S. pneumoniae (SP) с двумя различными пневмококковыми антигенами слияния rhavi-1652 и rhavi-0757, смешанными в молярном соотношении 1:4, 1:2, 1:1, 2:1 или 4:1. Проведение SDS-PAGE показало, что количества каждого включенного в комплекс MAPS антигена хорошо коррелировали с исходными соотношениями. На фиг.8B-8D показан многовалентный комплекс MAPS, который был получен с биотинилированным полисахаридом (декстраном, или пневмококковым капсульным полисахаридом серотипа 3), соединяющим два (2V, фиг.8B), три (3V, фиг.8С) или пять (5V, фиг.8D) различных пневмококковых и/или туберкулезных антигенов. Проведение SDS-PAGE показало антигены, включенные в комплекс MAPS. Все образцы кипятили в SDS буфере для образцов с 10 мМ DTT.
На фиг.9 показано, что иммунизация с помощью комплекса MAPS индуцировала сильный ответ антител против полисахаридных антигенов. Мыши, которых иммунизировали комплексом MAPS, полученным из биотинилированного декстрана (9А), Vi полисахарида (9B) или пневмококкового полисахарида клеточной стенки (CWPS) (9C), производили значительно более высокое количество антиполисахаридных антител по сравнению с группами животных, которые получали только адъювант (без Ag) или смесь несвязанного полисахарида и белков (смесь). На фиг.9D-9F показано, что комплекс MAPS выгодно отличается от традиционной конъюгированной вакцины в производстве антитела к PS. Комплексы MAPS получали из капсульного полисахарида (CPS) серотипа 1, 5, 14 SP, нагруженного пятью белковыми антигенами. Мышей подкожно иммунизировали с помощью MAPS или Prevnar 13® (пневмококковая 13-валентная конъюгированная вакцина [дифтерийный белок CRM197]; Wyeth/Pfizer) (PCV13) дважды с интервалом 2 недели и сывороточное IgG антитело к вакцинированному CPS серотипа анализировали через 2 недели после второй иммунизации с помощью ELISA. Титр к IgG CPS у иммунизированных PCV13 мышей произвольно устанавливали на 1200 единицах для сравнения. Для всех исследуемых серотипов иммунизация комплексом MAPS производила либо аналогичный уровень (серотип 5), либо намного больший уровень IgG антитела к CPS (серотип 1 и серотип 14), чем вырабатывалось путем вакцинации с помощью PCV13. Серотип 1 (фиг.9D); Серотип 5 (фиг.9Е); Серотип 14 (фиг.9F).
На фиг.10 сравнивают антитело к PS, индуцированное MAPS при различных дозировках иммунизации. Комплекс MAPS получали из CPS серотипа 5 SP, нагруженного пятью белковыми антигенами. Мыши получали комплекс MAPS с содержанием 1 мкг - 16 мкг PS на дозу для двух иммунизации с интервалом в две недели. Сывороточное антитело против CPS серотипа 5 измеряли и сравнивали между различными группами иммунизации через две недели после второй иммунизации. При всех дозировках иммунизация с помощью MAPS индуцировала устойчивое IgG антитело к CPS серотипа 5. Прием 2 мкг PS на дозу производил самый высокий титр антител и повышение дозировки PS до 16 мкг снижало титр антител приблизительно в 4 раза.
На фиг.11 показано, что антитела к PS, произведенные путем иммунизации с помощью комплекса MAPS, облегчают лизис целевых патогенов in vitro. На фиг.11А показан опосредованный антителами лизис экспрессирующей Vi бактерии. Сыворотка из животных, иммунизированных комплексом MAPS (с использованием Vi в качестве остова), но не из двух других групп, показала сильный лизис экспрессирующего Vi штамма (более чем 90% лизис) в пределах 1 часа инкубации. Сыворотка из мышей, иммунизированных Alum (пунктирная линия; Смесью (черная линия); или MAPS (серая линия). На фиг.11B-11D показано, что опсонофагоцитирующая лизирующая активность сыворотки из иммунизированных MAPS мышей выгодно отличается от лизирующей активности сыворотки из мышей, иммунизированных разрешенной к применению вакциной PCV13. Способность сыворотки из иммунизированных PCV13 или MAPS мышей к опосредованию in vitro опсонофагоцитирующего лизиса пневмококка нейтрофилами анализировали и сравнивали. Нейтрофилы человека дифференцировали из клеток в клеточной линии HL-60. Опсонофагоцитирующий лизис проводили путем инкубации сыворотки в различных разведениях с серотипом 1 (фиг.11B), серотипом 5 (фиг.11C) или серотипом 13 (фиг.11D), пневмококком и дифференцированными клетками HL-60 при 37°С в течение 1 часа (в присутствии комплемента крольчонка). Ал