Антисмысловые нуклеиновые кислоты
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан антисмысловой олигомер, который вызывает пропуск 50-го экзона в гене дистрофина человека, состоящий из нуклеотидной последовательности, комплементарной любой из нуклеотидных последовательностей, состоящих из 106-го - 126-го, 107-го - 127-го, 108-го - 127-го, 108-го - 128-го или 109-го - 129-го нуклеотидов, считая от 5'-конца 50-го экзона гена дистрофина человека. Также описана фармацевтическая композиция для лечения мышечной дистрофии, включающая в качестве действующего ингредиента антисмысловой олигомер или его фармацевтически приемлемую соль или гидрат. Изобретение расширяет арсенал средств для лечения мышечной дистрофии. 2 н. и 10 з.п. ф-лы, 31 ил., 15 табл., 54 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к антисмысловому олигомеру, который вызывает пропуск экзона 55, 45, 50 или 44 в гене дистрофина человека, а также к фармацевтической композиции, включающей этот олигомер.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Мышечная дистрофия Дюшена (DMD) представляет собой наиболее распространенную форму наследственной прогрессирующей мышечной дистрофии, которая поражает примерно одного из 3500 новорожденных мальчиков. Хотя двигательные функции в младенчестве и детстве редко отличаются от здоровых людей, мышечная слабость у детей наблюдается, начиная примерно с 4-5-летнего возраста. Затем мышечная слабость прогрессирует вплоть до потери способности к передвижению в возрасте примерно 12 лет от роду и смерти из-за сердечной или дыхательной недостаточности в возрасте от 20 до 30 лет. Таким образом, DMD является тяжелым расстройством. В настоящее время не существует эффективных способов лечения DMD, и очень желательна разработка новых терапевтических агентов.
Известно, что причиной DMD является мутация в гене дистрофина. Ген дистрофина локализован на X хромосоме, представляя собой ген огромного размера, состоящий из 2,2 миллионов пар нуклеотидов. ДНК претерпевает транскрипцию в предшественников мРНК, после чего в результате сплайсинга происходит удаление интронов с образованием мРНК, в которой объединено 79 экзонов. Затем осуществляется трансляция этой мРНК с образованием аминокислотной последовательности из 3685 остатков, в результате чего формируется белок дистрофин. Дистрофин связан с поддержанием стабильности мембран мышечных клеток и необходим для того, чтобы сделать мышечные клетки менее хрупкими. Ген дистрофина у пациентов с DMD содержит мутацию, вследствие чего дистрофин, который функционирует в мышечных клетках, экспрессируется в недостаточной степени. Таким образом, в организме пациентов с DMD не поддерживается нормальная структура мышечных клеток, что приводит к значительному поступлению ионов кальция в мышечные клетки. Затем в качестве реакции на этот процесс появляется воспаление, которое способствует фиброзу, из-за которого затрудняется регенерация мышечных клеток.
Мышечная дистрофия Беккера (BMD) также вызвана мутацией в гене дистрофина. Симптомы этого заболевания включают мышечную слабость, сопровождающуюся атрофией мышц, но, как правило, мышечная слабость является умеренной и прогрессирует медленно по сравнению с DMD. Во многих случаях BMD начинается в зрелом возрасте. Считается, что причина различия клинических симптомов DMD и BMD заключается в том, прерывается ли мутацией рамка считывания, кодирующая аминокислоты, при трансляции мРНК дистрофина в соответствующий белок (непатентный документ 1). Более конкретно, при DMD имеются мутационные сдвиги рамки считывания аминокислот, вследствие чего прекращается экспрессия функционального дистрофина, тогда как при BMD вырабатывается дистрофин, который является функциональным, хотя и не полностью, поскольку сохраняется рамка считывания аминокислот, хотя часть экзонов пропущена из-за мутации.
Ожидается, что пропуск экзонов может являться способом лечения DMD. Этот способ включает модификацию сплайсинга для восстановления рамки считывания аминокислот мРНК дистрофина и стимулирование экспрессии дистрофина с частично восстановленными функциональными свойствами (непатентный документ 2). При этом часть аминокислотной последовательности, которая соответствует пропущенному экзону, будет потеряна. По этой причине дистрофин, который экспрессируется при описанном способе лечения, становится короче нормального, но, поскольку рамка считывания аминокислот сохраняется, у полученного белка частично остается способность стабилизировать мышечные клетки. Таким образом ожидается, что пропуск экзона приведет к DMD, с симптомами, аналогичными более мягким симптомам BMD. Подход, связанный с пропуском экзона, прошел тестирование на животных, в котором использовались мыши или собаки, и в настоящее время проходит клинические испытания на пациентах из числа людей с DMD.
Пропуск экзона можно вызвать нацеленным связыванием антисмысловых нуклеиновых кислот по любому 5ʹ или 3ʹ сайту сплайсинга, по обоим указанным сайтам, либо по внутренним участкам экзона. Экзон будет включен в мРНК, только если оба его сайта сплайсинга распознаны комплексом сплайсингосомы. Таким образом, пропуск экзона может быть вызван направленным взаимодействием сайтов сплайсинга с антисмысловыми нуклеиновыми кислотами. Кроме того, связывание SR белка с экзонным энхансером сплайсинга (ESE) считается необходимым для того, чтобы экзон был распознан механизмом сплайсинга. Соответственно, пропуск экзона можно вызвать направленным взаимодействием с ESE.
Поскольку мутации гена дистрофина могут быть различными у разных пациентов с DMD, необходимо разрабатывать антисмысловые нуклеиновые кислоты, исходя из участка или типа соответствующей мутации гена. В прошлом, антисмысловые нуклеиновые кислоты, которые вызывают пропуск экзона, для всех 79 экзонов производились Steve Wilton, et al., University of Western Australia (непатентный документ 3), и антисмысловые нуклеиновые кислоты, которые вызывают пропуск экзона для 39 экзонов, производились Annemieke Aartsma-Rus et al., Netherlands (непатентный документ 4).
Считается, что примерно 20% всех пациентов с DMD можно лечить посредством пропуска 55-го, 45-го, 50-го и 44-го экзонов (далее по тексту именуемых экзон 55, экзон 45, экзон 50 и экзон 44, соответственно). В последние годы несколько исследовательских организаций сообщали об исследованиях, в которых мишенями для пропуска являлись экзоны 55, 45, 50 или 44 гена дистрофина (патентные документы 1-8). Однако до сих пор не разработана достаточно эффективная методика пропуска экзонов 55, 45, 50 или 44.
Патентный документ 1: Международная публикация WO 2006/000057
Патентный документ 2: Международная публикация WO 2004/048570.
Патентный документ 3: Опубликованная нерассмотренная патентная заявка США US 2010/0168212.
Патентный документ 4: Международная публикация WO 2010/048586.
Патентный документ 5: Международная публикация WO 2004/083446.
Патентный документ 6: Международная публикация WO 2010/050801.
Патентный документ 7: Международная публикация WO 2009/139630.
Непатентный документ 1: Monaco A.P. et al., Genomics 1988; 2: p. 90-95.
Непатентный документ 2: Matsuo M., Brain Dev 1996; 18: p. 167-172.
Непатентный документ 3: Wilton S.D., et al., Molecular Therapy 2997: 15: p. 1288-96.
Непатентный документ 4: Annemieke Aartsma-Rus et al. (2002) Neuromuscular Disorders 12: S71-S77.
Непатентный документ 5: Linda J. Popplewell et al., (2010) Neuromuscular Disorders, vol. 20, no. 2, p. 102-10.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В описанных выше обстоятельствах, желательно разработать антисмысловые олигомеры, которые эффективно вызывают пропуск экзона 55, экзона 45, экзона 50 или экзона 44 в гене дистрофина, а также средства для лечения мышечной дистрофии, включающие эти олигомеры.
В результате подробных исследований структуры гена дистрофина, авторы настоящего изобретения обнаружили, что пропуск экзона 55 в гене дистрофина можно с высокой эффективностью вызвать действием антисмысловых олигомеров, которые нацелены на последовательность, состоящую из примерно 1-го - 21-го, 11-го - 31-го и 14-го - 34-го нуклеотидов, считая от 5ʹ-конца экзона 55 в предшественнике мРНК (далее по тексту именуемого "пре-мРНК").
Кроме того, авторы настоящего изобретения обнаружили, что пропуск экзона 45 в гене дистрофина можно с высокой эффективностью вызвать действием антисмысловых олигомеров, которые нацелены на последовательность, состоящую из примерно 1-го - 25-го и 6-го - 30-го нуклеотидов, считая от 5ʹ-конца экзона 45 в пре-мРНК.
Далее, авторы настоящего изобретения обнаружили, что пропуск экзона 50 в гене дистрофина можно с высокой эффективностью вызвать действием антисмысловых олигомеров, которые нацелены на последовательность, состоящую из примерно 107-го - 127-го нуклеотидов, считая от 5ʹ-конца экзона 50 в пре-мРНК.
Наконец, авторы настоящего изобретения установили, что пропуск экзона 44 в гене дистрофина можно с высокой эффективностью вызвать действием антисмысловых олигомеров, которые нацелены на последовательность, состоящую из примерно 11-го - 32-го и 26-го - 47-го нуклеотидов, считая от 5ʹ-конца экзона 44 в пре-мРНК.
Исходя из этих данных, авторы завершили работу над настоящим изобретением.
Таким образом, в настоящем изобретении разработаны:
1. Антисмысловой олигомер, который вызывает пропуск 55-го экзона в гене дистрофина человека, состоящий из нуклеотидной последовательности, комплементарной любой из нуклеотидных последовательностей, состоящих из -2-го - 19-го, -2-го - 20-го, -2-го - 21-го, -2-го - 22-го, -2-го - 23-го, -1-го - 19-го, -1-го - 20-го, -1-го - 21-го, -1-го - 22-го, -1-го - 23-го, 1-го - 19-го, 1-го - 20-го, 1-го - 21-го, 1-го - 22-го, 1-го - 23-го, 2-го - 19-го, 2-го - 20-го, 2-го - 21-го, 2-го - 22-го, 2-го -23-го, 3-го - 19-го, 3-го - 20-го, 3-го - 21-го, 3-го - 22-го, 3-го - 23-го, 9-го - 29-го, 9-го - 30-го, 9-го - 31-го, 9-го - 32-го, 9-го - 33-го, 10-го - 29-го, 10-го - 30-го, 10-го - 31-го, 10-го - 32-го, 10-го - 33-го, 11-го - 29-го, 11-го - 30-го, 11-го - 31-го, 11-го - 32-го, 11-го - 33-го, 12-го - 29-го, 12-го - 30-го, 12-го - 31-го, 12-го - 32-го, 12-го - 33-го, 13-го - 29-го, 13-го - 30-го, 13-го - 31-го, 13-го - 32-го, 13-го - 33-го, 12-го - 34-го, 12-го - 35-го, 12-го - 36-го, 13-го - 34-го, 13-го - 35-го, 13-го - 36-го, 14-го - 32-го, 14-го - 33-го, 14-го - 34-го, 14-го - 35-го, 14-го - 36-го, 15-го - 32-го, 15-го - 33-го, 15-го - 34-го, 15-го - 35-го, 15-го - 36-го, 16-го - 32-го, 16-го - 33-го, 16-го - 34-го, 16-го - 35-го или 16-го - 36-го нуклеотидов, считая от 5'-конца 55-го экзона гена дистрофина человека.
2. Антисмысловой олигомер, который вызывает пропуск 45-го экзона в гене дистрофина человека, состоящий из нуклеотидной последовательности, комплементарной любой из нуклеотидных последовательностей, состоящих из -3-го - 19-го, -3-го - 20-го, -3-го - 21-го, -3-го - 22-го, -3-го - 23-го, -2-го - 19-го, -2-го - 20-го, -2-го - 21-го, -2-го - 22-го, -2-го - 23-го, -1-го - 19-го, -1-го - 20-го, -1-го - 21-го, -1-го - 22-го, -1-го - 23-го, 1-го - 19-го, 1-го - 20-го, 1-го - 21-го, 1-го - 22-го, 1-го - 23-го, 2-го - 19-го, 2-го - 20-го, 2-го - 21-го, 2-го - 22-го, 2-го - 23-го, -2-го - 24-го, -2-го - 25-го, -2-го - 26-го, -2-го - 27-го, -1-го - 24-го, -1-го - 25-го, -1-го - 26-го, -1-го - 27-го, 1-го - 24-го, 1-го - 25-го, 1-го - 26-го, 1-го - 27-го, 2-го - 24-го, 2-го - 25-го, 2-го - 26-го, 2-го - 27-го, 3-го - 23-го, 3-го - 24-го, 3-го - 25-го, 3-го - 26-го, 3-го - 27-го, 4-го - 28-го, 4-го - 29-го, 4-го - 30-го, 4-го - 31-го, 4-го - 32-го, 5-го - 28-го, 5-го - 29-го, 5-го - 30-го, 5-го - 31-го, 5-го - 32-го, 6-го - 28-го, 6-го - 29-го, 6-го - 30-го, 6-го - 31-го, 6-го - 32-го, 7-го - 28-го, 7-го - 29-го, 7-го - 30-го, 7-го - 31-го, 7-го - 32-го, 8-го - 28-го, 8-го - 29-го, 8-го - 30-го, 8-го - 31-го или 8-го - 32-го нуклеотидов, считая от 5'-конца 45-го экзона гена дистрофина человека.
3. Антисмысловой олигомер, который вызывает пропуск 50-го экзона в гене дистрофина человека, состоящий из нуклеотидной последовательности, комплементарной любой из нуклеотидных последовательностей, состоящих из 105-го - 125-го, 105-го - 126-го, 105-го - 127-го, 105-го - 128-го, 105-го - 129-го, 106-го - 125-го, 106-го - 126-го, 106-го - 127-го, 106-го - 128-го, 106-го - 129-го, 107-го - 125-го, 107-го - 126-го, 107-го - 127-го, 107-го - 128-го, 107-го - 129-го, 108-го - 125-го, 108-го - 126-го, 108-го - 127-го, 108-го - 128-го, 108-го - 129-го, 109-го - 125-го, 109-го - 126-го, 109-го - 127-го, 109-го - 128-го или 109-го - 129-го нуклеотидов, считая от 5ʹ-конца 50-го экзона гена дистрофина человека.
4. Антисмысловой олигомер, который вызывает пропуск 44-го экзона в гене дистрофина человека, состоящий из нуклеотидной последовательности, комплементарной любой из нуклеотидных последовательностей, состоящих из 9-го - 30-го, 9-го - 31-го, 9-го - 32-го, 9-го - 33-го, 9-го - 34-го, 10-го - 30-го, 10-го - 31-го, 10-го - 32-го, 10-го - 33-го, 10-го - 34-го, 11-го - 30-го, 11-го - 31-го, 11-го - 32-го, 11-го - 33-го, 11-го - 34-го, 12-го - 30-го, 12-го - 31-го, 12-го - 32-го, 12-го - 33-го, 12-го - 34-го, 13-го - 30-го, 13-го - 31-го, 13-го - 32-го, 13-го - 33-го, 13-го - 34-го, 24-го - 45-го, 24-го - 46-го, 24-го - 47-го, 24-го - 48-го, 24-го - 49-го, 25-го - 45-го, 25-го - 46-го, 25-го - 47-го, 25-го - 48-го, 25-го - 49-го, 26-го - 45-го, 26-го - 46-го, 26-го - 47-го, 26-го - 48-го, 26-го - 49-го, 27-го - 45-го, 27-го - 46-го, 27-го - 47-го, 27-го - 48-го, 27-го - 49-го, 28-го - 45-го, 28-го - 46-го, 28-го - 47-го, 28-го - 48-го, 28-го - 49-го, 29-го - 45-го, 29-го - 46-го, 29-го - 47-го, 29-го - 48-го или 29-го - 49-го нуклеотидов, считая от 5ʹ-конца 44-го экзона гена дистрофина человека.
5. Антисмысловой олигомер по п.1, который состоит из последовательности, комплементарной нуклеотидной последовательности, состоящей из 1-го - 21-го, 11-го - 31-го или 14-го - 34-го нуклеотидов, считая от 5ʹ-конца 55-го экзона гена дистрофина человека.
6. Антисмысловой олигомер по п.1, состоящий из нуклеотидной последовательности, представленной любой последовательностью, выбранной из группы, состоящей из 170-го - 190-го, 160-го - 180-го и 157-го - 177-го нуклеотидов последовательности SEQ ID NO:5.
7. Антисмысловой олигомер по п.2, который состоит из последовательности, комплементарной нуклеотидной последовательности, состоящей из -2-го - 19-го, 1-го - 21-го, 1-го - 25-го или 6-го - 30-го нуклеотидов, считая от 5ʹ-конца 45-го экзона гена дистрофина человека.
8. Антисмысловой олигомер по п.2, состоящий из нуклеотидной последовательности, представленной любой последовательностью, выбранной из группы, состоящей из 158-го - 178-го, 156-го - 176-го, 152-го - 176-го и 147-го - 171-го нуклеотидов последовательности SEQ ID NO:6.
9. Антисмысловой олигомер по п.3, который состоит из последовательности, комплементарной нуклеотидной последовательности, состоящей из 106-го - 126-го или 107-го - 127-го нуклеотидов, считая от 5ʹ-конца 50-го экзона гена дистрофина человека.
10. Антисмысловой олигомер по п.3, состоящий из нуклеотидной последовательности, представленной любой последовательностью, выбранной из группы, состоящей из 4-го - 24-го и 3-го - 23-го нуклеотидов последовательности SEQ ID NO:7.
11. Антисмысловой олигомер по п.4, который состоит из последовательности, комплементарной нуклеотидной последовательности, состоящей из 11-го - 32-го, 25-го - 45-го, 26-го - 46-го, 26-го - 47-го или 27-го - 47-го нуклеотидов, считая от 5ʹ-конца 44-го экзона гена дистрофина человека.
12. Антисмысловой олигомер по п.4, состоящий из нуклеотидной последовательности, представленной любой последовательностью, выбранной из группы, состоящей из 117-го - 138-го, 104-го - 124-го, 103-го - 123-го, 102-го - 123-го и 102-го - 122-го нуклеотидов последовательности SEQ ID NO:8.
13. Антисмысловой олигомер по любому из пп.1-12, который представляет собой олигонуклеотид.
14. Антисмысловой олигомер по п.13, где остаток сахара и/или область связывания с остатком фосфорной кислоты по меньшей мере одного нуклеотида, входящего в олигонуклеотид, подверглись модификации.
15. Антисмысловой олигомер по п.14, где остаток сахара по меньшей мере одного нуклеотида, входящего в олигонуклеотид, представляет собой рибозу, в которой группа 2ʹ-OH замещена любым фрагментом, выбранным из группы, состоящей из OR, R, R'OR, SH, SR, NH2, NHR, NR2, N3, CN, F, Cl, Br и I (где R представляет собой алкил или арил, и Rʹ представляет собой алкилен).
16. Антисмысловой олигомер по п.14 или 15, где область связывания с остатком фосфорной кислоты по меньшей мере одного нуклеотида, входящего в олигонуклеотид, представляет собой любой фрагмент, выбранный из группы, состоящей из фосфортиоатной связи, фосфордитиоатной связи, алкилфосфонатной связи, фосфорамидатной связи и боранфосфатной связи.
17. Антисмысловой олигомер по любому из пп.1-12, который представляет собой морфолино-олигомер.
18. Антисмысловой олигомер по п.17, который представляет собой фосфордиамидатный морфолино-олигомер.
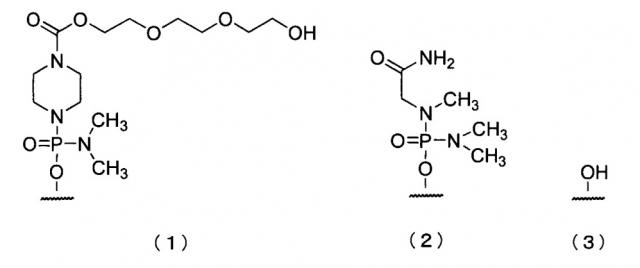
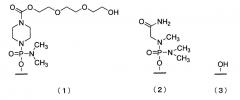
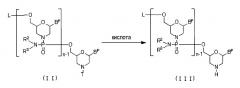
19. Антисмысловой олигомер по п.17 или 18, где 5ʹ-конец представляет собой любую из групп приведенных ниже химических формул (1)-(3):
20. Фармацевтическая композиция для лечения мышечной дистрофии, включающая в качестве действующего ингредиента антисмысловой олигомер по любому из пп. 1-19 или его фармацевтически приемлемую соль или гидрат.
Антисмысловой олигомер по настоящему изобретению может с высокой эффективностью вызывать пропуск экзона 55, экзона 45, экзона 50 или экзона 44 в гене дистрофина человека. Кроме того, путем введения фармацевтической композиции по настоящему изобретению можно эффективно облегчать синдромы мышечной дистрофии Дюшена. Далее, поскольку антисмысловой олигомер по настоящему изобретению нацелен только на экзонные последовательности пациентов, эти целевые последовательности остаются неизменными у различных индивидуумов, по сравнению со случаями, когда целевые последовательности расположены в интронах. Таким образом, антисмысловой олигомер по настоящему изобретению позволяет добиваться отличной эффективности пропуска экзонов независимо от индивидуальной изменчивости (различий между пациентами). Более того, антисмысловой олигомер по настоящему изобретению имеет небольшую длину, равную 20 парам оснований или около того, и для него существует меньшая вероятность наличия мутаций, возникающих из-за индивидуальных различий (различий между пациентами), например SNP (однонуклеотидного полиморфизма), в целевых последовательностях, по сравнению с известными антисмысловыми олигомерами для лечения DMD, длина которых составляет 25 пар оснований или около того. Эта особенность также помогает антисмысловому олигомеру по настоящему изобретению достигать отличной эффективности пропуска экзонов, независимо от индивидуальной изменчивости (различий между пациентами). Кроме того, антисмысловой олигомер по настоящему изобретению вызывает меньше побочных эффектов, которые появляются из-за индукции цитокинов и т.п., поскольку антисмысловые олигомеры с более короткими цепями в целом имеют меньшую склонность вызывать реакцию иммунной системы.
Наконец, поскольку антисмысловой олигомер по настоящему изобретению является довольно коротким, стоимость его производства является относительно невысокой.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
На фиг. 1 показана эффективность пропуска экзона 45 в гене дистрофина человека под действием 2ʹ-OMe-S-РНК олигомера в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 2 показана эффективность пропуска экзона 45 в гене дистрофина человека под действием 2ʹ-OMe-S-РНК олигомера в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 3 показана эффективность пропуска экзона 45 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 4 показана эффективность пропуска экзона 45 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 5 показана эффективность пропуска экзона 45 в гене дистрофина человека под действием PMO в клетках, в которых ген MyoD человека индуцирован в фибробласты, взятые у человека, больного DMD (клетки GM05017), чтобы вызвать их дифференцировку с образованием мышечных клеток.
На фиг. 6 показана эффективность пропуска экзона 55 в гене дистрофина человека под действием 2ʹ-OMe-S-РНК олигомера в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 7 показана эффективность пропуска экзона 55 в гене дистрофина человека под действием 2ʹ-OMe-S-РНК олигомера в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 8 показана эффективность пропуска экзона 55 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 9 показана эффективность пропуска экзона 44 в гене дистрофина человека под действием 2ʹ-OMe-S-РНК олигомера в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 10 показана эффективность пропуска экзона 44 в гене дистрофина человека под действием 2ʹ-OMe-S-РНК олигомера в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 11 показана эффективность пропуска экзона 44 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 12 показана эффективность пропуска экзона 44 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 13 показана эффективность пропуска экзона 50 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 14 показана эффективность пропуска экзона 45 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 15 показана эффективность пропуска экзона 45 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 16 показана эффективность пропуска экзона 55 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 17 показана эффективность пропуска экзона 55 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 18 показана эффективность пропуска экзона 44 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 19 показана эффективность пропуска экзона 50 в гене дистрофина человека под действием PMO в клетках линии рабдомиосаркомы человека (клетках RD).
На фиг. 20 показана эффективность пропуска экзона 44 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с делецией экзона 45 (клетки GM05112).
На фиг. 21 показан эффект (Вестерн Блоттинг) пропуска экзона 44 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с делецией экзона 45 (клетки GM05112).
На фиг. 22 показан эффект (RT-PCR) пропуска экзона 50 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с делецией экзона 45 (клетки GM05112).
На фиг. 23 показана эффективность пропуска экзона 50 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с делецией экзона 45 (клетки GM05112).
На фиг. 24 показан эффект (RT-PCR) пропуска экзона 55 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с делецией экзона 45 (клетки GM05112).
На фиг. 25 показана эффективность пропуска экзона 55 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с делецией экзона 45 (клетки GM05112).
На фиг. 26 показан эффект (RT-PCR) пропуска экзона 50 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с дупликацией экзонов 8-9 (клетки 11-0627).
На фиг. 27 показана эффективность пропуска экзона 50 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с дупликацией экзонов 8-9 (клетки 11-0627).
На фиг. 28 показан эффект (RT-PCR) пропуска экзона 50 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с делецией экзонов 51-55 (клетки GM04364).
На фиг. 29 показана эффективность пропуска экзона 50 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с делецией экзонов 51-55 (клетки GM04364).
На фиг. 30 показан эффект (RT-PCR) пропуска экзона 55 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с делецией экзона 54 (клетки 04-035).
На фиг. 31 показана эффективность пропуска экзона 55 в гене дистрофина человека под действием PMO в фибробластах человека, больного DMD, с делецией экзона 54 (клетки 04-035).
НАИЛУЧШИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее по тексту приведено подробное описание настоящего изобретения. Имеется в виду, что описанные ниже варианты осуществления представлены только в качестве примеров для описания изобретения, но изобретение не ограничено только приведенными ниже вариантами. Настоящее изобретение можно реализовать различными путями, не отступая от сути изобретения.
Все упомянутые в настоящем описании публикации, опубликованные патентные заявки, патенты и другие патентные документы включены в описание в полном объеме посредством ссылок. В настоящее описание посредством ссылки включено содержание описания и иллюстративного материала патентной заявки Японии № 2011-288040, поданной 28 декабря 2011 года, и патентной заявки Японии № 2012-043092, поданной 29 февраля 2012 года, на основании которых осуществляется притязание на приоритет.
Далее по тексту приведено подробное описание настоящего изобретения. Имеется в виду, что описанные ниже варианты осуществления представлены только в качестве примеров для описания изобретения, но изобретение не ограничено только приведенными ниже вариантами. Настоящее изобретение можно реализовать различными путями, не отступая от сути изобретения.
Не вдаваясь в конкретные детали, амино-конец аминокислотной последовательности отображается с левой стороны, а карбокси-конец - с правой, и 5ʹ-конец нуклеотидной последовательности отображается с левой стороны, а 3ʹ-конец - с правой.
1. Антисмысловой олигомер
Настоящее изобретение относится к антисмысловому олигомеру (далее по тексту именуемому "олигомер, способствующий пропуску экзона 55 по настоящему изобретению"), который вызывает пропуск экзона 55 в гене дистрофина человека, состоящему из нуклеотидной последовательности, комплементарной любой из нуклеотидных последовательностей (далее по тексту также именуемых "целевыми последовательностями экзона 55"), состоящих из -2-го - 19-го, -2-го - 20-го, -2-го - 21-го, -2-го - 22-го, -2-го - 23-го, -1-го - 19-го, -1-го - 20-го, -1-го - 21-го, -1-го - 22-го, -1-го - 23-го, 1-го - 19-го, 1-го - 20-го, 1-го - 21-го, 1-го - 22-го, 1-го - 23-го, 2-го - 19-го, 2-го - 20-го, 2-го - 21-го, 2-го - 22-го, 2-го - 23-го, 3-го - 19-го, 3-го - 20-го, 3-го - 21-го, 3-го - 22-го, 3-го - 23-го, 9-го - 29-го, 9-го - 30-го, 9-го - 31-го, 9-го - 32-го, 9-го - 33-го, 10-го - 29-го, 10-го - 30-го, 10-го - 31-го, 10-го - 32-го, 10-го - 33-го, 11-го - 29-го, 11-го - 30-го, 11-го - 31-го, 11-го - 32-го, 11-го - 33-го, 12-го - 29-го, 12-го - 30-го, 12-го - 31-го, 12-го - 32-го, 12-го - 33-го, 13-го - 29-го, 13-го - 30-го, 13-го - 31-го, 13-го - 32-го, 13-го - 33-го, 12-го - 34-го, 12-го - 35-го, 12-го - 36-го, 13-го - 34-го, 13-го - 35-го, 13-го - 36-го, 14-го - 32-го, 14-го - 33-го, 14-го - 34-го, 14-го - 35-го, 14-го - 36-го, 15-го - 32-го, 15-го - 33-го, 15-го - 34-го, 15-го - 35-го, 15-го - 36-го, 16-го - 32-го, 16-го - 33-го, 16-го - 34-го, 16-го - 35-го или 16-го - 36-го нуклеотидов, считая от 5ʹ-конца 55-го экзона гена дистрофина человека.
Кроме того, настоящее изобретение относится к антисмысловому олигомеру (далее по тексту именуемому "олигомер, способствующий пропуску экзона 45 по настоящему изобретению"), который вызывает пропуск экзона 45 в гене дистрофина человека, состоящему из нуклеотидной последовательности, комплементарной любой из нуклеотидных последовательностей (далее по тексту также именуемых "целевыми последовательностями экзона 45"), состоящих из -3-го - 19-го, -3-го - 20-го, -3-го - 21-го, -3-го - 22-го, -3-го - 23-го, -2-го - 19-го, -2-го - 20-го, -2-го - 21-го, -2-го - 22-го, -2-го - 23-го, -1-го - 19-го, -1-го - 20-го, -1-го - 21-го, -1-го - 22-го, -1-го - 23-го, 1-го - 19-го, 1-го - 20-го, 1-го - 21-го, 1-го - 22-го, 1-го - 23-го, 2-го - 19-го, 2-го - 20-го, 2-го - 21-го, 2-го - 22-го, 2-го - 23-го, -2-го - 24-го, -2-го - 25-го, -2-го - 26-го, -2-го - 27-го, -1-го - 24-го, -1-го - 25-го, -1-го - 26-го, -1-го - 27-го, 1-го - 24-го, 1-го - 25-го, 1-го - 26-го, 1-го - 27-го, 2-го - 24-го, 2-го - 25-го, 2-го - 26-го, 2-го - 27-го, 3-го - 23-го, 3-го - 24-го, 3-го - 25-го, 3-го - 26-го, 3-го - 27-го, 4-го - 28-го, 4-го - 29-го, 4-го - 30-го, 4-го - 31-го, 4-го - 32-го, 5-го - 28-го, 5-го - 29-го, 5-го - 30-го, 5-го - 31-го, 5-го - 32-го, 6-го - 28-го, 6-го - 29-го, 6-го - 30-го, 6-го - 31-го, 6-го - 32-го, 7-го - 28-го, 7-го - 29-го, 7-го - 30-го, 7-го - 31-го, 7-го - 32-го, 8-го - 28-го, 8-го - 29-го, 8-го - 30-го, 8-го - 31-го или 8-го - 32-го нуклеотидов, считая от 5ʹ-конца 45-го экзона гена дистрофина человека.
Далее, настоящее изобретение относится к антисмысловому олигомеру (далее по тексту именуемому "олигомер, способствующий пропуску экзона 50 по настоящему изобретению"), который вызывает пропуск экзона 50 в гене дистрофина человека, состоящему из нуклеотидной последовательности, комплементарной любой из нуклеотидных последовательностей (далее по тексту также именуемых "целевыми последовательностями экзона 50"), состоящих из 105-го - 125-го, 105-го - 126-го, 105-го - 127-го, 105-го - 128-го, 105-го - 129-го, 106-го - 125-го, 106-го - 126-го, 106-го - 127-го, 106-го - 128-го, 106-го - 129-го, 107-го - 125-го, 107-го - 126-го, 107-го - 127-го, 107-го - 128-го, 107-го - 129-го, 108-го - 125-го, 108-го - 126-го, 108-го - 127-го, 108-го - 128-го, 108-го - 129-го, 109-го - 125-го, 109-го - 126-го, 109-го - 127-го, 109-го - 128-го или 109-го - 129-го нуклеотидов, считая от 5ʹ-конца 50-го экзона гена дистрофина человека.
Помимо этого, настоящее изобретение относится к антисмысловому олигомеру (далее по тексту именуемому "олигомер, способствующий пропуску экзона 44 по настоящему изобретению"), который вызывает пропуск экзона 44 в гене дистрофина человека, состоящему из нуклеотидной последовательности, комплементарной любой из нуклеотидных последовательностей (далее по тексту также именуемых "целевыми последовательностями экзона 44"), состоящих из 9-го - 30-го, 9-го - 31-го, 9-го - 32-го, 9-го - 33-го, 9-го - 34-го, 10-го - 30-го, 10-го - 31-го, 10-го - 32-го, 10-го - 33-го, 10-го - 34-го, 11-го - 30-го, 11-го - 31-го, 11-го - 32-го, 11-го - 33-го, 11-го - 34-го, 12-го - 30-го, 12-го - 31-го, 12-го - 32-го, 12-го - 33-го, 12-го - 34-го, 13-го - 30-го, 13-го - 31-го, 13-го - 32-го, 13-го - 33-го, 13-го - 34-го, 24-го - 45-го, 24-го - 46-го, 24-го - 47-го, 24-го - 48-го, 24-го - 49-го, 25-го - 45-го, 25-го - 46-го, 25-го - 47-го, 25-го - 48-го, 25-го - 49-го, 26-го - 45-го, 26-го - 46-го, 26-го - 47-го, 26-го - 48-го, 26-го - 49-го, 27-го - 45-го, 27-го - 46-го, 27-го - 47-го, 27-го - 48-го, 27-го - 49-го, 28-го - 45-го, 28-го - 46-го, 28-го - 47-го, 28-го - 48-го, 28-го - 49-го, 29-го - 45-го, 29-го - 46-го, 29-го - 47-го, 29-го - 48-го или 29-го - 49-го нуклеотидов, считая от 5ʹ-конца 44-го экзона гена дистрофина человека.
Далее по тексту олигомеры, способствующие пропуску экзонов 55, 45, 50 и 44, могут совместно именоваться "олигомерами по настоящему изобретению".
Экзоны 55, 45, 50 и 44 в гене дистрофина человека
Имеется в виду, что в настоящем изобретении термин "ген" означает геномный хромосомный ген, а также включает кДНК, предшественника мРНК и РНК. Предпочтительно "ген" означает предшественника мРНК, т.е. пре-мРНК.
В геноме человека ген дистрофина человека локализован в локусе Xp21.2. Ген дистрофина человека имеет размер 3,0 Mbp и является самым крупным геном среди известных человеческих генов. Однако размер кодирующих областей гена дистрофина человека составляет только 14 Kb, разделенных на 79 экзонов, находящихся в гене дистрофина человека (Roberts, RG, et al., Genomics, 16: 536-538 (1993)). Пре-мРНК, которая является транскриптом гена дистрофина человека, подвергается сплайсингу с образованием зрелой мРНК размером 14 Kb. Известна нуклеотидная последовательность гена дистрофина человека дикого типа (учетный номер GeneBank NM_004006).
Нуклеотидная последовательность, состоящая из -2-го - 190-го нуклеотидов, считая от 5ʹ-конца экзона 55 в гене дистрофина человека, дикого типа представлена последовательностью SEQ ID NO:1. Нуклеотидная последовательность, состоящая из -3-го - 176-го нуклеотидов, считая от 5ʹ-конца экзона 45 в гене дистрофина человека, дикого типа представлена последовательностью SEQ ID NO:2. Нуклеотидная последовательность, состоящая из 1-го - 109-го нуклеотидов, считая от 5ʹ-конца экзона 50, и 1-го - 20-го нуклеотидов, считая от 5ʹ-конца интрона 50, в гене дистрофина человека, дикого типа представлена последовательностью SEQ ID NO:3.
Нуклеотидная последовательность, состоящая из 1-го - 148-го нуклеотидов, считая от 5ʹ-конца экзона 44 в гене дистрофина человека, дикого типа представлена последовательностью SEQ ID NO:4.
Олигомер по настоящему изобретению предназначен для того, чтобы вызывать пропуск экзона 55, 45, 50 или 44 в гене дистрофина человека, тем самым превращая белок, закодированный геном дистрофина DMD-типа, в дистрофин BMD-типа. Соответственно, экзоны 55, 45, 50 и 44 в гене дистрофина, которые являются мишенями пропуска экзонов под действием олигомера по настоящему изобретению, включают как последовательности дикого типа, так и мутантные последовательности.
Конкретно, мутанты экзонов 55, 45, 50 и 44 гена дистрофина человека представляют собой полинуклеотиды, определенные ниже по тексту в пунктах (a) или (b):
(a) полинуклеотид, который в жестких условиях гибридизуется с полинуклеотидом, состоящим из последовательности нуклеотидов, комплементарной последовательности SEQ ID NO:1 (или последовательности, состоящей из 3-го - 192-го нуклеотидов последовательности SEQ ID NO:1), SEQ ID NO:2 (или последовательности, состоящей из 4-го - 179-го нуклеотидов последовательности SEQ ID NO:2), SEQ ID NO:3 (или последовательности, состоящей из 1-го - 109-го нуклеотидов последовательности SEQ ID NO:3) или SEQ ID NO:4;
(b) полинуклеотид, состоящий из последовательности нуклеотидов, обладающей по меньшей мере 90% гомологией с последовательностью SEQ ID NO:1 (или последовательностью, состоящей из 3-го - 192-го нуклеотидов последовательности SEQ ID NO:1), SEQ ID NO:2 (или последовательностью, состоящей из 4-го - 179-го нуклеотидов последовательности SEQ ID NO:2), SEQ ID NO:3 (или последовательностью, состоящей из 1-го - 109-го нуклеотидов последовательности SEQ ID NO:3) или SEQ ID NO:4.
В настоящей заявке термин "полинуклеотид" предназначен для обозначения ДНК или РНК.
В настоящей заявке термин "полинуклеотид, который гибридизуется в жестких условиях" относится, например, к полинуклеотиду, полученному гибридизацией колоний, гибридизацией бляшек, Саузерн-гибридизацией или подобными способами, с использованием в качестве зонда части полинуклеотида или целого полинуклеотида, состоящего из последовательности нуклеотидов, комплементарной последовательности SEQ ID NO:1 (или последовательности, состоящей из 3-го - 192-го нуклеотидов последовательности SEQ ID NO:1), SEQ ID NO:2 (или последовательности, состоящей из 4-го - 179-го нуклеотидов последовательности SEQ ID NO:2), SEQ ID NO:3 (или последовательности, состоящей из 1-го - 109-го нуклеотидов последовательности SEQ ID NO:3) или SEQ ID NO:4. Подходящие методики гибридизации включают методики, описанные, например, в "Sambrook & Russell, Molecular Cloning: A Laboratory Manual Vol.3, Cold Spring Harbor, Laboratory Press 2001", "Ausubel, Current Protocols in Molecular Biology, John Wiley & Sons 1987-1997" и т.д.
В настоящей заявке термин "комплементарная нуклеотидная последовательность" не ограничен только нуклеотидными последовательностями, которые образуют пары Уотсона-Крика с целевыми нуклеотидными последовательностями, но предназначен также для указания на нуклеотидные последовательности, которые образуют неоднозначные пары оснований. В настоящей заявке термин "пара Уотсона-Крика" относится к паре нуклеиновых оснований, в которой водородные связи образованы между аденином-тимином, аденином-урацилом или гуанином-цитозином, и термин "неоднозначные пары оснований" относится к парам нуклеиновых оснований, в которых водородные связи образуются между гуанином-урацилом, инозином-урацилом, инозином-аденином или инозином-цитозином. В настоящей заявке термин "комплементарная нуклеотидная последовательность" относится не только к нуклеотидной последовательности, которая на 100% комплементарна целевой нуклеотидной последовательности, но и к комплементарной нуклеотидной последовательности, которая может содержать, например, от 1 до 3 или от 1 до 2, или один нуклеотид, не комплементарный целевой нуклеотидной последовательности.
В настоящей заявке термин "жесткие условия" может относится к любому уровню жесткости, т.е. условиям низкой жесткости, условиям умеренной жесткости или условиям высокой жесткости. Термин "условия низкой жесткости" относится, например, к следующим условиям 5×SSC, 5× раствор Денхардта, 0,5% SDS, 50% формамид при 32°C. Термин "условия умеренной жесткости" относится, например, к следующим условиям 5×SSC, 5× раствор Денхардта, 0,5% SDS, 50% формамид при 42°C или 5×SSC, 1% SDS, 50 мМ Tris-HCl (pH 7,5), 50% формамид при 42°C. Термин "условия высокой жесткости" относится, например, к следующим условиям 5×SSC, 5× раствор Денхардта, 0,5% SDS, 50% формамид при 50°C или 0,2×SSC, 0,1% SDS при 65°C. Ожидается, что в этих условиях полинуклеотиды с более высокой степенью гомологичности будут более эффективно взаимодействовать при более высоких температурах, хотя жесткость условий гибридизации определяется многими факторами, в том числе температурой, концентрацией зонда, длиной зонда, ионной силой, временем, концентрацией солей и прочими, и специалист в данной области техники может приблизительно подобрать перечисленные факторы для достижения аналогичной жесткости условий.
Если для гибридизации применяются коммерчески доступные наборы, можно использовать, например, Alkphos Direct Labelling and Detection System (GE Healthcare). В этом случае, согласно приложенному к набору протоколу, после культивирования с меченым зондом в течение ночи, мембрану промывают первичным буфером для промывания, содержащим 0,1% (масса/объем) SDS при 55°C, выявляя гибридизованные полинуклеотиды. В качестве альтернативы, если зонд мечен дигоксигенином (DIG) с использованием коммерчески доступного реагента (например, PCR Labelling Mix (Roche Diagnostics) и т.д.) при получении зонда на основе всей или части последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1 (или последовательности, состоящей из 3-го - 192-го нуклеотидов последовательности SEQ ID NO: 1), SEQ ID NO: 2 (или последовательности, состоящей из 4-го - 179-го нуклеотидов последовательности SEQ ID NO: 2), SEQ ID NO: 3 (или последовательности, состоящей из 1-го - 109-го нуклеотидов последовательности SEQ ID NO: 3) или SEQ ID NO: 4, гибридизацию можно обнаружить с помощью набора DIG Nucleic Acid Detection Kit (Roche Diagnostics).
Помимо описанных выше полинуклеотидов, другие полинуклеотиды, которые могут участвовать в гибридизации, включают полинуклеотиды, имеющие степень идентичности 90% или более, 91% или более, 92% или бол